Способны ли CAR-Т-клетки уничтожить опухоль?
20 ноября 2019
Способны ли CAR-Т-клетки уничтожить опухоль?
- 9234
- 1
- 16
Т-клетки атакуют опухолевую клетку. Т-клеточная терапия химерным рецептором антигена — это новая форма лечения рака, одобренная FDA. Терапия разработана на собственных Т-клетках пациента для поиска и уничтожения раковых клеток.
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Способность использовать иммунные клетки, направленно изменять их и обучать нацеливаться на опухолевые клетки изменила парадигму лечения многих гематологических опухолевых заболеваний, в том числе неходжкинской лимфомы и острого лимфобластного лейкоза. Т-клеточная терапия химерным рецептором антигена (CAR) показала замечательную противоопухолевую активность против В-клеточных опухолей. В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов (FDA) одобрило две терапии CAR-T, что дало шанс на ремиссию и увеличение продолжительности жизни множеству пациентов. Наш обзор посвящен эволюции CAR-T-клеток, способам их производства, а также будущим перспективам использования.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Способность иммунной системы выявлять и уничтожать возникающие опухоли известна давно. Иммунная система играет три основные роли в профилактике опухолей.
Во-первых, она защищает хозяина от вирусных опухолей, устраняя и подавляя вирусные инфекции.
Во-вторых, своевременная ликвидация патогенных микроорганизмов и быстрое устранение воспаления может предотвратить создание воспалительной среды, способствующей онкогенезу.
В-третьих, иммунная система может специфически распознавать и устранять опухолевые клетки на основе присутствия на их поверхности специфических антигенов или молекул, индуцированных клеточным стрессом.
Третий процесс называется иммунным надзором, при котором иммунная система способна выявлять раковые и предраковые клетки и уничтожать их до того, как они начнут причинять вред организму. Несмотря на иммунный надзор, опухоли развиваются в присутствии функционирующей иммунной системы. Этот процесс делится на три стадии, или фазы: устранения, или элиминации (elimination), равновесия (equilibrium) и избегания (escape) (рис. 1) [1–4].
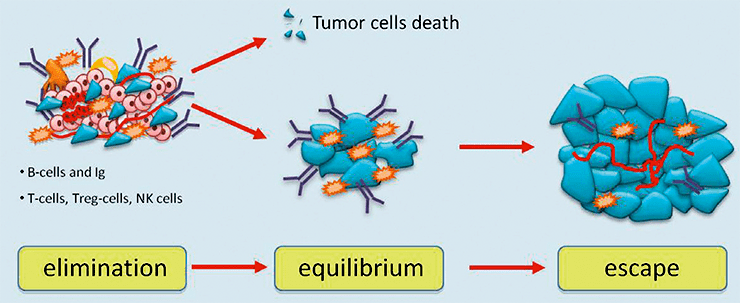
Рисунок 1. Три фазы иммуноредактирования рака. Различные иммунные реакции уничтожают опухоль. Однако некоторые опухолевые клетки могут вступить в фазу равновесия с иммунными клетками. Опухоль не увеличивается, но и не исчезает. Со временем опухолевые клетки могут выйти из-под иммунного надзора и расти, вызывая увеличение массы опухоли.
Фаза элиминации — это процесс обнаружения и уничтожения опухолевых клеток иммунной системой. Фаза элиминации завершается либо уничтожением всех опухолевых клеток, либо только их части. В случае частичной элиминации между иммунной системой и опухолью может развиться временное состояние равновесия.
В течение фазы равновесия опухолевые клетки могут оставаться в состоянии покоя или продолжать развиваться и накапливать мутации. Во время этой фазы иммунная система способна контролировать прогрессирование опухоли, но иммунный ответ все еще не может полностью уничтожить ее. При этом происходит отбор опухолевых клеток, которые способны подавлять иммунный ответ, приводящий к фазе избегания.
Во время фазы избегания иммунная система больше не может сдерживать прогрессирование опухоли. Противоопухолевый иммунный ответ существует в организме, но, к сожалению, он не настолько эффективен, чтобы полностью сдерживать мишень, в результате чего опухоль подавляет его.
Тем не менее данная концепция стала основой современной иммуноонкологии, включая клеточную адоптивную терапию, которая заключается в использовании иммунных клеток для лечения рака [5]. Клеточная терапия CAR-T является формой адоптивной терапии. Она привлекла к себе особое внимание благодаря успехам в клинических испытаниях уже двух одобренных FDA таких стратегий лечения опухолевых заболеваний [5].
Как и другие методы лечения опухолей, это не решает полностью проблему эффективности лечения, но предоставляет клиницистам еще один ресурс в их арсенал, который сегодня включает хирургические, химиотерапевтические, радиационные и иммунотерапевтические методы, в том числе использование антител, цитокинов, онколитических вирусов, биспецифических молекул [6].
Что такое CAR-T-клетки?
Т-клетки, несущие химерный антигенный рецептор, или CAR-T-клетки, — это генно-инженерные Т-клетки, выставляющие CAR на своей поверхности (рис. 2) [5]. CAR является модифицированным поверхностным рецептором, который прибавляет специфичность Т-клеткам к предварительно определенному антигену-мишени, выставленному на опухолевых клетках [5], [7]. Например, CD19 CAR-T-клетки несут на своей поверхности химерный рецептор, нацеленный против CD19 — трансмембранного белка, который синтезируется во всех лимфоцитах линии В, в том числе при В-клеточных лейкозах и лимфомах [5], [7], [8].
О CAR-T-клетках уже писали на «Биомолекуле»: «Т-клетки — марионетки, или Как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [9]. — Ред.
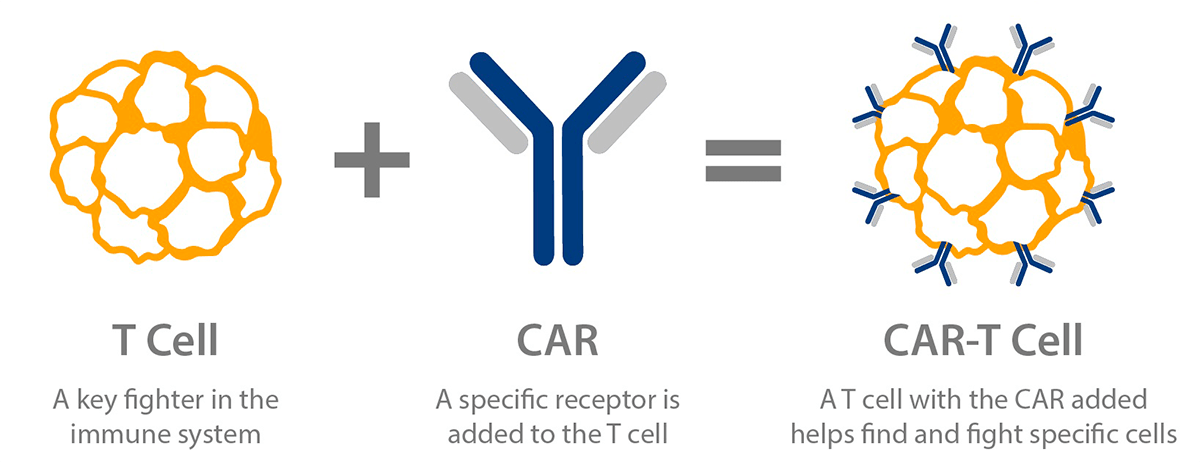
Рисунок 2. Схема CAR-T-клеток. Т-клетка несет на своей поверхности специфический рецептор, называемый химерным антигенным рецептором, который помогает находить определенные виды клеток и уничтожать их.
Структура и механизм действия CAR-T-клеток
Все Т-клетки берут свое начало в красном костном мозге, дифференцируясь из гемопоэтических стволовых клеток. Затем они мигрируют в тимус, который создает среду, необходимую для дальнейшей дифференцировки. Стадии дифференциации тимоцитов зависят от выставления на поверхность различных маркеров. На ранней стадии они не синтезируют корецепторы (CD4 и CD8), поэтому называются двойными негативными. На следующей стадии производятся оба рецептора. Такие тимоциты носят название двойных позитивных. В конце концов, клетки начинают выставлять на поверхность только один из корецепторов. При выставлении CD8 Т-клетка связывается с МНС (главным комплексом гистосовместимости) I класса и в дальнейшем становится эффекторной клеткой, то есть цитотоксическим Т-лимфоцитом; а при выставлении CD4 — с МНС II класса, и становится Т-хелпером, то есть помощником [10–14].
В итоге образуются наивные Т-клетки, которые успешно прошли селекцию, но не контактировали с антигеном. После распознавания антигена, Т-клетки активируются и начинают выполнять свои функции в организме [11].

Рисунок 3. Т-клеточный рецепторный комплекс
Т-клеточный рецептор (TCR) выставляется на поверхность зрелых Т-клеток. Он состоит из двух цепей и принадлежит суперсемейству иммуноглобулинов. Цепи имеют сходное строение и могут принадлежать двум классам: альфа и бета, гамма и дельта. Более 95% зрелых Т-клеток имеют рецептор с альфа- и бета-цепями. Однако только один Т-клеточный рецептор не способен активировать Т-клетку. Он является частью рецепторного комплекса, который в сочетании с несколькими структурами обеспечивает возникновение сигнала (рис. 3). К этим структурам относятся: CD3-комплекс (CD3γ-, CD3δ-, CD3ε-цепи) и ζ-цепи, которые содержат ITAMs (immunoreceptor tyrosine-based activation motifs). После распознавания антигена происходит фосфорилирование тирозиновых остатков ITAMs, в результате чего запускается весь сигнальный каскад. Такой сигналинг называется сигналом 1, он необходим, но не достаточен для активации Т-клеток. Для активации необходимо сочетание сигнала 1 и сигнала 2. Сигнал 2 — это взаимодействие корецептора с соответствующим лигандом на той же антигенпрезентирующей клетке [10–13].
Костимулирующие рецепторы стабилизируют взаимодействие антигенного рецептора и комплекса «пептид—МНС», которое может быть непрочным и недостаточно продолжительным для активации рецептора [11], [12]. Также наличие двух сигналов необходимо для того, чтобы активация клеток происходила только тогда, когда она нужна. Активированный Т-лимфоцит убивает зараженную клетку или выделяет цитокины, привлекающие другие иммунные клетки [11].
Таким образом, Т-клеточный рецептор состоит из антиген-специфических α- и β-цепей, связанных с комплексом CD3, который определяет целевой антиген, представленный в контексте главного комплекса гистосовместимости (МНС) [4], [5].
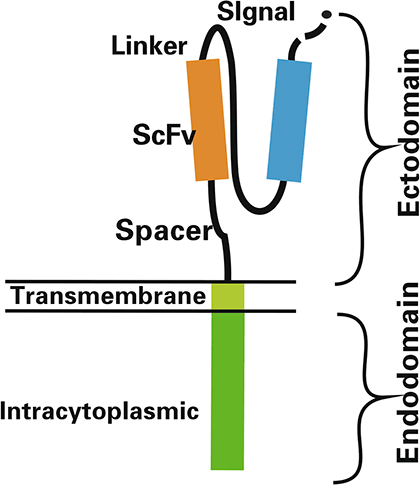
Рисунок 4. Структура химерного антигенного рецептора (CAR)
Основной задачей химерных рецепторов является использование цитотоксического потенциала Т-лимфоцитов путем замены собой TCR. Химерными они называются потому, что «собраны» в единый рецептор из комплексов различного происхождения [13].
CAR включает эктодомен, трансмембранный домен и эндодомен (рис. 4).
- Эктодомен, или внеклеточный домен, (распознающая часть) представляет собой одноцепочечный изменяемый фрагмент моноклонального антитела (scFv). Он отвечает за распознавание опухоль-специфического антигена и образует антигенсвязывающий участок [15].
- Гибкая шарнирная область (чаще всего используется шарнир иммуноглобулина G1). Необходима для отклонения антигенраспознающего фрагмента в стороны для облегчения его связывания с антигеном [15].
- Трансмембранный домен, или спейсер, (связывающая часть) соединяет эктодомен и эндодомен, придает рецептору гибкость, повышает доступность. Обычно является частью внутриклеточного домена [15].
- Эндодомен, или внутриклеточный домен, (костимулирующий домен) берется из T-рецепторного комплекса — это одна из частей димера ζ-цепи. Его функция — активация Т-клеток [15].
Все эти домены методами генной инженерии собраны в одну аминокислотную последовательность, то есть кодируются одним геном. Такая структура позволяет целенаправленно активировать Т-лимфоциты при контакте с клетками-мишенями и не зависеть от МНС, то есть появляется возможность распознавать любые антигены, а не только пептидные [12], [16].
Эволюция CAR-T-клеток
Начала CAR
Иммунологи годами боролись за то, чтобы перепрограммировать иммунную систему для борьбы с раком. Достижения в области ретровирусных систем, используемых для генетической инженерии иммунных клеток, впервые продемонстрировали многообещающие результаты с рецепторами Т-клеток, предназначенными для нацеливания на опухолевые пептиды [17], [18]. Положительные результаты были замечены, в частности, при синовиальной саркоме и меланоме, но методы лечения на основе TCR ограничены вариантами главного комплекса гистосовместимости, которые уменьшают количество потенциальных пациентов: многообразие этих белков настолько велико, что каждый человек обладает индивидуальным набором [8].
Учитывая все ограничения, Зелиг Эшхар первым выработал концепцию и получил первую Т-клетку с химерным рецептором, который впоследствии стал известен как рецептор химерного антигена (CAR) [19].
Т-клеточный рецептор включал ζ-сигнальный домен CD3, подобно TCR, но заменял субъединицы α и β одноцепочечным вариабельным фрагментом (scFv) из антитела (рис. 5). Этот единственный маневр после более чем десяти лет исследований и улучшений превратился в первую чрезвычайно успешную целевую иммунотерапию при рецидивах и рефрактных злокачественных новообразованиях В-клеток [8].
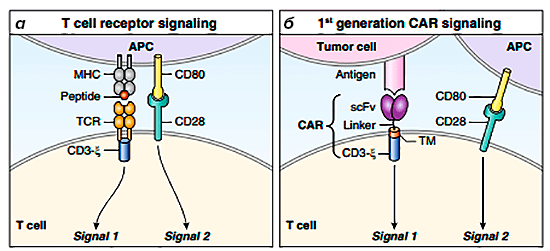
Рисунок 5. Схема строения TCR и CAR первого поколения. а — Эндогенный TCR при обнаружении комплекса пептид—МНС на антигенпрезентирующей клетке обеспечивает сигнал 1 через домен CD3-дзета. Полная активация не достигается, пока не будет обеспечен сигнал 2 (например, взаимодействие CD80—CD28). б — CAR-клетки 1 поколения основаны на МНС-независимом взаимодействии для обеспечения сигнала 1, однако не происходит полной активации вследствие отсутствия дополнительной стадии костимуляции.
CAR первого поколения проявляли активность в доклинических исследованиях, однако ранние испытания на людях показали минимальную активность из-за неполной активации Т-клеток [5], [8].
Второе и третье поколения
Наблюдения Мартина Пуля за пациентами, получившими CAR-T-клетки первого поколения, показали ограничения такого вида терапии [20]. После инфузии CAR-T-клеток только у 5 из 11 пациентов были обнаружены циркулирующие CAR-T-клетки. Это говорит о том, что у некоторых пациентов CAR-T-клетки взаимодействовали с антигенами опухоли (сигнал 1). То есть они были способны успешно нацеливаться и взаимодействовать с злокачественными клетками, но не способны их уничтожить, так как им не удавалось полностью активироваться (отсутствовал сигнал 2). У остальных пациентов не были обнаружены CAR-T-клетки, так как активация не происходила. Одной из причин отсутствия активации являлось то, что многие раковые клетки, особенно при остром лимфоцитарном лейкозе, подавляют действие иммунных клеток, вмешиваясь в костимуляторный сигналинг [8], [21].
Этот барьер был преодолен в ходе разработки CAR второго и третьего поколений (рис. 6). CAR второго поколения пытались обойти это ограничение путем включения костимуляторного домена непосредственно в рецептор [3], [5]. Костимулирующие молекулы работают в тандеме с CD3: CD3, обеспечивая активацию Т-клеток, усиливают пролиферацию и выживаемость клеток, а также обеспечивают выработку цитокинов [8]. Существует несколько доменов-кандидатов, но чаще всего используются CD28 и 4-1BB (CD137).
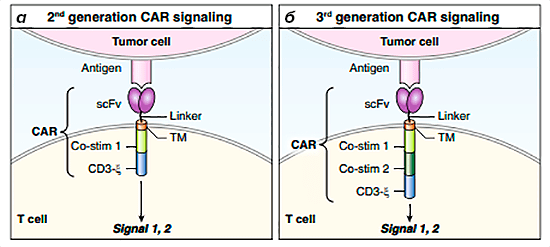
Рисунок 6. Схема строения CAR-T-клеток второго и третьего поколений. а — Интеграция CD3-ζ и костимуляторного домена в одном и том же рецепторе дает CAR 2 поколения способность полностью активировать Т-клетки за один этап. б — CAR 3 поколения включают два костимулирующих домена с CD3-ζ.
Таким образом, добавление костимулирующей молекулы к ζ-домену CD3 значительно усиливает функцию CAR-T-клеток. Важно, что это достигается за счет одного взаимодействия с антигеном-мишенью, а не с помощью многоэтапного процесса, зависящего от активированных антигенпрезентирующих клеток. Кроме того, отрицательные иммуномодуляторы, такие как регуляторные Т-клетки или другие иммуносупрессивные сигналы от опухолей или микроокружения, не влияют на костимуляцию CAR, по крайней мере, в течение начального периода действия [8].
К сожалению, CAR третьего поколения, содержащие CD3-ζ и два костимуляторных домена, не были более успешными, чем их аналоги второго поколения [22]. Несмотря на эффективное уничтожение опухолевых клеток в кратковременных анализах цитотоксичности in vitro, тестирование in vivo не было настолько эффективным. Во-первых, это могло быть связано с чрезмерной активаций CAR-T-клеток, что приводило к потере аутотолерантности и последующему апоптозу. Во-вторых, у ряда пациентов наблюдалось ингибирование активности CAR-T-клеток [23].
Четвертое и последующие поколения
В дополнение к CAR второго и третьего поколений были созданы «бронированные» CAR, или CAR четвертого поколения (рис. 7) [5]. Они были получены путем добавления доменов, кодирующих иммуностимулирующие цитокины (IL-2, IL-12, IL-8, IL-15, IL-18). Их добавление к основанию конструкций второго поколения позволяет увеличить экспансию CAR-T-клеток, в то же время делая их устойчивыми к иммуносупрессивной среде опухоли. Однако чрезмерная экспрессия иммуностимулирующих цитокинов может привести к ряду побочных эффектов, поэтому необходимо уделить особое внимание безопасности данного вида терапии [24].
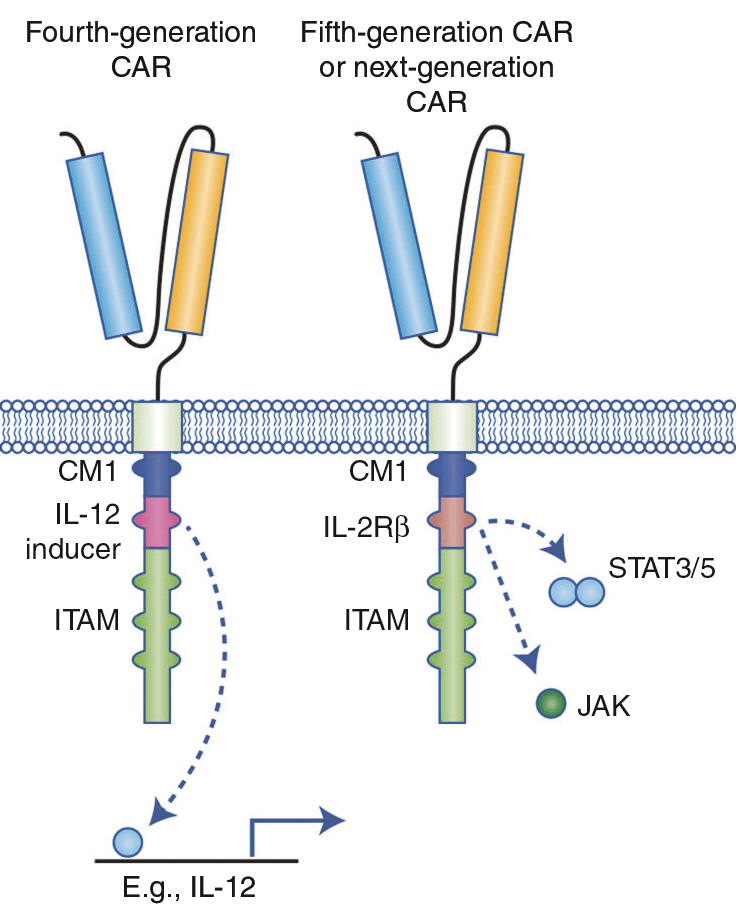
Рисунок 7. Структура CAR четвертого и последующих поколений. CAR четвертого поколения были основаны на CAR второго поколения в паре с конститутивно или индуцибельно синтезируемым хемокином (например, IL-12).
Пятое и следующие поколения также основаны на CAR 2 поколения с добавлением внутриклеточных доменов цитокиновых рецепторов [22].
Применение CAR-T-терапии
Клинические испытания CAR-T-клеток в лечении злокачественных новообразований В-клеток разворачивались быстро. В-клетки являются привлекательной мишенью, так как несут на своей поверхности специфические молекулы, такие как CD19, CD20 и CD22, которые не характерны для других типов клеток. Результаты доклинических исследований показали, что опухоли В-клеток могут быть уничтожены CAR-T-клетками. Первые клинические исследования на пациентах с хроническим лимфолейкозом, острым лимфоцитарным лейкозом и неходжкинской лимфомой показали замечательные противоопухолевые эффекты CD19-специфических CAR-T-клеток [6]. В настоящее время CAR-T-клеточная терапия одобрена FDA в качестве стандарта лечения некоторых форм агрессивной, рефрактерной неходжкинской лимфомы и пациентов с рецидивирующим или рефрактерным острым лимфобластным лейкозом в возрасте до 25 лет [8], [25], [26].
Кроме того, на стадии клинических исследований находятся CAR-T-клеточные терапии для других форм онкогематологических заболеваний, например, В-крупноклеточной лимфомы, хронического лимфолейкоза, малой лимфоцитарной лимфомы [6–8], [26].
Таким образом, в основном CAR-T-терапия используется при гематологических злокачественных новообразованиях, когда неконтролируемое размножение и рост злокачественных клеток затрагивает саму кровь, костный мозг, лимфу и ликвор [8].
Однако эти успехи еще не были воспроизведены на арене сóлидных (плотных) опухолей.
Эффективность CAR-T-клеток при гематологических злокачественных новообразованиях частично может быть объяснена наличием лучшего доступа к опухолевым клеткам в костном мозге и лимфатических узлах, где обычно перемещаются T-клетки [8]. Распознавание сóлидных опухолей требует выхода терапевтических Т-клеток из крови в опухоль, а многие злокачественные новообразования развиваются так, что их инфильтрация затруднена. В данном случае может быть эффективным региональное, а не системное введение CAR-T-клеток [8].
Также в отличие от гематологических злокачественных новообразований, терапия сóлидных опухолей встречает на своем пути множество проблем. Помимо неполной активации CAR первого поколения, одним из возможных объяснений недостаточной эффективности T-клеток CAR в сóлидных опухолях может быть микроокружение опухоли, которое часто является иммуносупрессивным, или неэффективный перенос Т-клеток CAR в опухоль [8].
Побочные эффекты CAR-T-терапии
Однако нужно быть реалистами. CAR-T-клетки — это не чудодейственное лекарство от рака. CAR-T-терапия, как и другие методы лечения онкологических заболеваний, имеют нежелательные эффекты. Несмотря на то, что эта терапия работает там, где другие методы бессильны, у нее довольно много тревожных и потенциально смертельных токсических побочных эффектов.
Существует несколько механизмов, влияющих на развитие побочных эффектов при инфузии CAR-T-клеток. Во-первых, это влияние на мишень, которое возникает в результате интенсивного высвобождения цитокинов из Т-клеток CAR. Во-вторых, это повреждения, нанесенные нормальной ткани в результате производства ею антигена-мишени либо белка, перекрестно взаимодействующего с CAR. Также в ряде исследований сообщалось об аллергических реакциях и синдроме лизиса опухоли — метаболического нарушения, вызванного гибелью большого количества клеток опухоли за короткий период времени, при котором их содержимое попадает в кровь [5], [8], [27]. В литературе наиболее часто упоминаются два специфических эффекта: синдром высвобождения цитокинов и нейротоксичность [5], [8], [28].
В рамках своих обязанностей, связанных с иммунитетом, Т-клетки высвобождают цитокины — химические мессенджеры, которые помогают стимулировать и направлять иммунный ответ. В случае цитокинового шторма происходит быстрое и массивное выделение цитокинов в кровоток, что может привести к опасно высокой температуре и резким падениям артериального давления (рис. 8) [5].
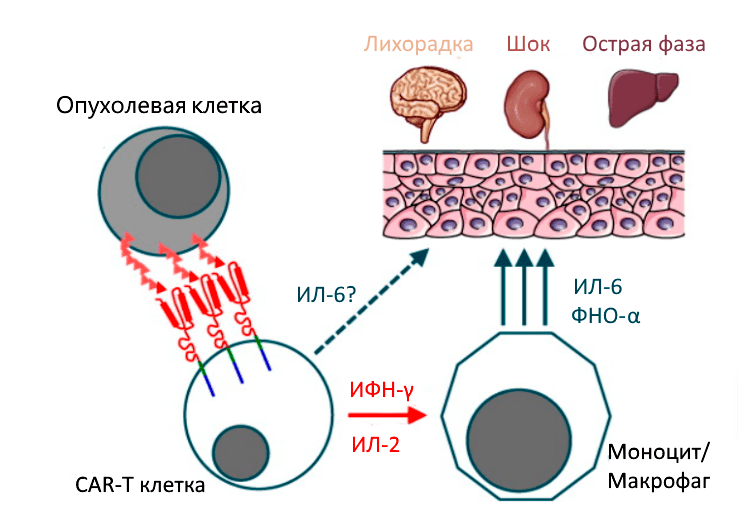
Рисунок 8. Цитокиновый шторм. У пациентов с массивной опухолью высок риск развития тяжелого цитокинового шторма. Ранними маркерами являются высокие уровни IL-6, IL-15, IL-8 INF-γ до введения или в течение одного дня после введения. Поэтому стандартом применения CAR-T-терапии является обязательная госпитализация пациента.
Синдром цитокинового шторма характеризуется высокими уровнями интерлейкина-6 (IL-6) и интерферона-γ (IFN-γ). Для его предупреждения используется тоцилизумаб — антагонист IL-6, одобренный FDA [5], [8]. Глюкокортикоиды показаны при отсутствии быстрого ответа на тоцилизумаб [5].
Нейротоксичность была отмечена множеством исследовательских групп, тестирующих CD19 CAR-T-клетки [5], [8]. Обычно сообщаемые симптомы включают головную боль, делирий, афазию, очаговый неврологический дефицит, судороги и потерю сознания. Патофизиология неврологических симптомов еще не выяснена, но обычно она полностью обратима, за исключением нескольких случаев фатального кровоизлияния в мозг или отека [5].
Как и в случае с другими методами иммуномодуляции, лечение Т-клетками CAR может предрасполагать к инфекциям. Пациенты, получающие Т-клетки CAR, часто страдают лимфопенией и нейтропенией, что делает их восприимчивыми к оппортунистическим инфекциям [5], [8].
Механизмы сопротивления опухолей
Существует несколько механизмов развития устойчивости к CAR-T-терапии: антиидиотипические антитела, утрата опухолевого антигена, мутация антигенного гена, встраивание CAR в лейкемические клетки [5], [29].
ScFv, используемые для производства CAR, могут быть получены из мышиных моноклональных антител. На данный фрагмент может выработаться иммунный ответ, который ингибирует действие CAR-T-клеток, что делает терапию неэффективной [1]. Для решения проблемы можно использовать человеческие scFv, которые устранят образование антител против мышиных последовательностей, но вероятность появления антиидиотипических антител все же сохраняется [5].
Пониженная регуляция или потеря презентации целевого антигена на лейкозных клетках является механизмом, приводящим к рецидиву опухоли [30]. Значительный объем данных в этом отношении поступает из исследований, включающих использование анти-CD19 CAR. Утрата презентации антигена и переключение опухолевой линии на синтез другого антигена являются двумя различными способами потери CD19, описанными в литературе [5]. Если после ремиссии происходит рецидив с утратой целевого антигена, то развивается фенотипически сходное заболевание. В случае CD19-клеток, переключение клонов приводит к фенотипически различному, но генетически связанному злокачественному новообразованию, например, острому миелолейкозу [5], [30]. Разработка CAR, нацеленных на более чем один антиген, может потенциально помочь в преодолении утраты антигена.
В 2018 году описан случай, когда ген CAR был случайно включен в лейкозную B-клетку во время конструирования T-клеток. Это, в свою очередь, привело к получению продукта, который связывался с эпитопом CD19 на поверхности лейкозной клетки и, следовательно, маскировал его от распознавания терапевтическими Т-клетками. У пациента отмечался рецидив. Пациент получил спасательную химиотерапию и иммунотерапию, но в конце концов скончался [5], [7].
Производство CAR-T-клеток
Несмотря на различные конструкции, процедура производства CAR-T-клеток остается неизменной. Она включает в себя сбор у пациента Т-клеток с их последующей обработкой и подготовкой: активацией Т-клеток, их генетической модификацией, крупномасштабной экспансией, формованием [8].
Далее более подробно рассмотрим каждый из этапов производства (рис. 9).

Рисунок 9. Схема производства CAR-T-клеток
Clinical manufacturing of CAR-T cells for adoptive immunotherapy, рисунок адаптирован
1. Источник Т-клеток. Поскольку зарегистрированные CAR-T — аутологичная клеточная терапия, процесс производства CAR-T-клеток начинается со сбора мононуклеарных клеток периферической крови у пациента, обычно с помощью лейкафереза. Врачи выбирают подходящее время для сбора на основе схемы лечения, чтобы обеспечить достаточное количество Т-лимфоцитов. Ориентировочно необходимо 100×106 клеток, следовательно, сбор желательно проводить до курсов химиотерапии [8], [31].
2. Обработка Т-клеток. Собранные продукты лейкафереза могут быть обработаны различными способами в зависимости от дальнейших процедур. Т-клетки отбираются с помощью проточного центрифугирования. Обработанный исходный материал может быть использован непосредственно для последующей процедуры или криоконсервирован для будущего использования [8], [31].
3. Т-клеточная активация. Для дальнейшей трансдукции необходимо активировать клетки. Существует множество методов активации, но обычно используется синтетический поликлональный активатор, связывающийся с рецепторами CD3 и CD28 [20].
4. Генетическая модификация Т-клеток. Современные методы модификации Т-клеток в значительной степени основаны на стабильной экспрессии CAR при доставки вирусными и невирусными системами переноса генов. Существует три основных подхода к стабильной экспрессии генов:
- вирус-опосредованная трансдукция;
- трансфекция с мРНК;
- трансфекция с использованием системы транспозон/транспозаза.
Ретровирусы, γ-ретровирус (γ-RV) и лентивирусы (LV), остаются основным механизмом трансдукции Т-клеток [8]. Вирусные векторы обеспечивают высокую эффективность переноса генов и стабильный уровень экспрессии CAR. Однако ретровирусные векторы представляют собой сложные биологические реагенты, которые требуют постоянного и дорогостоящего тестирования биобезопасности. Также существует высокий риск возникновения в них спонтанных мутаций, которые могут привести к развитию онкологических заболеваний [5], [8], [31].
Относительно новая система экспрессии на основе плазмидной системы транспозон/транспозаза обладает рядом преимуществ: простая производственная процедура и относительно низкая стоимость. Однако интеграция конструкта является случайной и, соответственно, представляет потенциальный онкогенный риск. При этом исследования показали низкую токсичность для Т-клеток. Однако эффективность CAR-T-клеток, получаемых этим методом, еще предстоит продемонстрировать [8], [32].
Использование матричной РНК для трансфекции обеспечивает кратковременную экспрессию в цитоплазме. В этом процессе не происходит никакой геномной интеграции, и поэтому устраняются проблемы генотоксичности [8], [31].
5. Экспансия CAR-T-клеток. Этот процесс происходит в биореакторе в течение нескольких дней под действием цитокинов (IL-2, IL-7, IL-15), поддерживающих пролиферацию Т-клеток [31].
6. Промывка и концентрирование продукта [31].
7. Контроль качества клеточного продукта [31]. Согласно правилам GMP, качество продукта закладывается при его разработке и проверяется на каждом этапе производства. В связи со сложной природой клеточных продуктов необходимо тщательно продумать список тестов, чтобы обеспечить безопасность, чистоту и эффективность.
Так, безопасность CAR-T-клеток определяется по отсутствию загрязнителей: эндотоксина, микоплазмы, компетентного по репликации ретровируса. Чистота продукта зависит от соотношения количества определенных уровней активированных и неактивированных CD3+ и CAR+ Т-клеток CAR. Примеси, такие как нежелательные типы клеток, опухолевая нагрузка и др., должны быть ниже определенных установленных уровней [33]. До настоящего времени активность клеток CAR-T часто определяли анализом цитотоксических Т-лимфоцитов in vitro или секрецией интерферона-γ [33].
8. Криоконсервация для удобства транспортировки [31].
9. Инфузия пациенту готового продукта [31].
Про новые варианты технологии получения CAR-T-клеток при помощи наночастиц рассказывает статья «CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкой доступности технологии?» [34]. — Ред.
Доставка персонализированных лекарств зависит от параметров высвобождения сложных биологических молекул, входящих в их состав. Качество клеточных продуктов CAR-T изменяется от донора к донору, но также в значительной степени зависит от условий производства, качества и доступности вспомогательного сырья и материалов [31].
Производство CAR-T должно соответствовать требованиям GMP. Согласно им, чистые помещения должны быть надлежащим образом оборудованы системами обеспечения условий окружающей среды (кондиционер), оборудованием для мониторинга окружающей среды (счетчик частиц), технологическим (биореакторы) и аналитическим (автоматические счетчики клеток) оборудованием. Еще одним ключевым компонентом GMP-производства является наличие высококвалифицированного персонала, обладающего обширными знаниями в области производства [31].
Тщательное документирование и своевременный анализ производственных процессов являются важной частью GMP-производства и необходимы для успешного выполнения сложной процедуры изготовления клеток CAR-T [33].
Производство включает в себя использование различных вспомогательных компонентов (культуральной среды, цитокинов, реагентов для генетической модификации, криоконсервации и т.д.). Все материалы и сырье, используемое при производстве клеточного продукта, должны пройти тщательный контроль [33].
Будущие направления
Разработка CAR-T-клеток, которые успешно убивают свои клетки-мишени, является сложной задачей. Вероятно, может потребоваться разработка нескольких CAR для нескольких мишеней одной и той же опухоли, поскольку опухоль стремится ускользнуть от действия терапии. Так, у пациентов с лейкемией, получавших иммунотерапию, направленную на CD19, через некоторое время обнаруживаются CD19-отрицательные клоны [8]. Ориентация на несколько антигенов опухоли, конечно, добавит трудностей в и без того сложный процесс разработки успешной терапии, однако это поможет в борьбе с резистентностью опухолевых клеток.
Другим подходом к нацеливанию на опухолевые антигены может стать разработка одного универсального CAR. Например, CAR, нацеленный на биотин. В этом случае пациенту предварительно вводят биотинилированные моноклональные антитела к опухолевым антигенам — таким образом происходит маркировка опухолевых клеток. Затем уже вводят CAR-T-клетки со специфичностью к биотину (рис. 10). Такие препараты уже разрабатываются и сейчас находятся на ранних стадиях доклинических исследований [35].
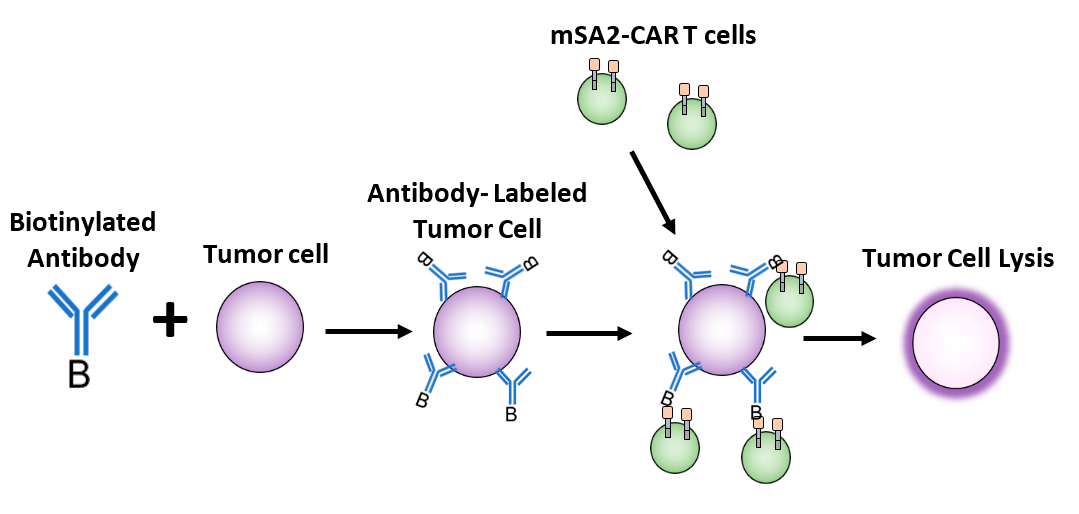
Рисунок 10. Механизм действия CAR-T-клеток, нацеленных на биотин
Разрабатываются различные методы усиления иммунотерапии и модуляции микроокружения для обеспечения более эффективного эндогенного иммунного надзора за опухолями [5], [8]. То есть вместо того, чтобы блокировать ингибирующие сигналы с помощью моноклональных антител, они заменяются на стимулирующие. Например, это может быть достигнуто добавлением второго химерного рецептора PD-1 в сигнальный домен CD28 CAR-T-клеток. Рецептор PD-1 выставляется на поверхность активированных Т- и В-клеток. Он относится к иммунологическим контрольным точкам, которые участвуют в регуляции иммунного ответа. Взаимодействие PD-1 с лигандом PD-L1 на опухолевых клетках и клетках опухолевого микроокружения способствует подавлению противоопухолевого иммунного ответа [36], [37]. Использование PD-1 в качестве второго химерного рецептора обеспечивает дополнительную стимуляцию, которая преодолевает ингибирование [8]. Таким образом, механизмы, способствующие иммунологическому избеганию опухоли, могут быть использованы для устранения злокачественных новообразований.
Один из перспективных способов нацелить Т-клетки на опухоль — использование аллогенной (или полученной от здорового донора) CAR-T-терапии, где Т-клетки от здорового донора модифицированы для использования у нескольких пациентов. Тем не менее аллогенная терапия имеет свой собственный набор проблем, которые необходимо преодолеть, а именно: опасный для жизни побочный эффект, называемый реакцией трансплантата против хозяина. Он возникает, когда донорские CAR-T-клетки распознают клетки пациента как чужеродные и атакуют их. Однако большинство разработок CAR-T-терапий, нацеленных на B-клеточные опухоли, в настоящее время направлены на использование аллогенных Т-клеток [6–8].
Несмотря на ранний успех, область CAR-T-клеточной терапии все еще находится в стадии становления, и пройдет некоторое время, прежде чем она увидит свет в качестве традиционной терапии. Время, необходимое для подготовки пациентов к инфузии, высокая цена самой терапии и значительные расходы на здравоохранение, связанные с ее назначением, являются существенными ограничивающими факторами для обеспечения доступности такой терапии широкому кругу пациентов [8].
Дальнейшие исследования в области Т-клеточной терапии должны привести к более быстрому производству, расширению использования готовых продуктов с более низкой токсичностью, что поможет сделать CAR-T-терапию более дешевой и доступной.
Литература
- Jeremy B. Swann, Mark J. Smyth. (2007). Immune surveillance of tumors. J. Clin. Invest.. 117, 1137-1146;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Gelao L., Criscitiello C., Fumagalli L., Locatelli M., Manunta S., Esposito A. et al. (2013). Tumour dormancy and clinical implications in breast cancer. Ecancermedicalscience. 7, 320;
- Wassim Mchayleh, Prabhjot Bedi, Rajesh Sehgal, Melhem Solh. (2019). Chimeric Antigen Receptor T-Cells: The Future is Now. JCM. 8, 207;
- Miguel-Angel Perales, Syed A. Abutalib, Catherine Bollard Cell and Gene Therapies — Springer International Publishing, 2019;
- Carl H. June, Michel Sadelain. (2018). Chimeric Antigen Receptor Therapy. N Engl J Med. 379, 64-73;
- Paolo A. Ascierto, David F. Stroncek, Ena Wang Developments in T Cell Based Cancer Immunotherapies — Springer International Publishing, 2015;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Томашевский Г.С., Мельников М.А., Давыдова Д.А., Долгополов М.С. Обобщенная информация о CAR-T клеточной терапии // Фундаментальные основы инновационного развития науки и образования / Г.Ю. Гуляева. Пенза: «Наука и Просвещение», 2018. С. 236–242;
- Owen J.A., Punt J., Stranford S.A. Kuby immunology. NY: WH Freeman, 2013. – 692 p.;
- Carl H. June, Roddy S. O’Connor, Omkar U. Kawalekar, Saba Ghassemi, Michael C. Milone. (2018). CAR T cell immunotherapy for human cancer. Science. 359, 1361-1365;
- Парамонов А.А., Каюмова Л.Н., Брускин С.А., Кочергин Н.Г., Олисова О.Ю., Острецова М.Н. (2015). Репертуар Т-клеточных рецепторов при некоторых иммунозависимых дерматозах. «Российский журнал кожных и венерических болезней». 4, 34–41;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Cheng Zhang, Jun Liu, Jiang F. Zhong, Xi Zhang. (2017). Engineering CAR-T cells. Biomark Res. 5;
- Michel Sadelain, Renier Brentjens, Isabelle Rivière. (2013). The Basic Principles of Chimeric Antigen Receptor Design. Cancer Discovery. 3, 388-398;
- Aniruddha Choudhury, Szilvia Mosolits, Parviz Kokhaei, Lotta Hansson, Marzia Palma, Håkan Mellstedt. (2006). Clinical Results of Vaccine Therapy for Cancer: Learning from History for Improving the Future. Advances in Cancer Research. 147-202;
- S. Mocellin, P. Pilati, D. Nitti. (2009). Peptide-Based Anticancer Vaccines: Recent Advances and Future Perspectives. CMC. 16, 4779-4796;
- Zelig Eshhar, Tova Waks, Gideon Gross. (2014). The Emergence of T-Bodies/CAR T Cells. The Cancer Journal. 20, 123-126;
- Martin A Pule, Barbara Savoldo, G Doug Myers, Claudia Rossig, Heidi V Russell, et. al.. (2008). Virus-specific T cells engineered to coexpress tumor-specific receptors: persistence and antitumor activity in individuals with neuroblastoma. Nat Med. 14, 1264-1270;
- Christian P. Pallasch, Ilya Leskov, Christian J. Braun, Daniela Vorholt, Adam Drake, et. al.. (2014). Sensitizing Protective Tumor Microenvironments to Antibody-Mediated Therapy. Cell. 156, 590-602;
- Nicholas Tokarew, Justyna Ogonek, Stefan Endres, Michael von Bergwelt-Baildon, Sebastian Kobold. (2019). Teaching an old dog new tricks: next-generation CAR T cells. Br J Cancer. 120, 26-37;
- Waleed Haso, Daniel W. Lee, Nirali N. Shah, Maryalice Stetler-Stevenson, Constance M. Yuan, et. al.. (2013). Anti-CD22–chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia. Blood. 121, 1165-1174;
- Oladapo O. Yeku, Renier J. Brentjens. (2016). Armored CAR T-cells: utilizing cytokines and pro-inflammatory ligands to enhance CAR T-cell anti-tumour efficacy. Biochemical Society Transactions. 44, 412-418;
- Bankhead C. (2017). Thumbs up to latest CAR T-cell approval. MedPage Today;
- Abutalib S.A. and Levine B.L. (2019). Update on FDA-approved CAR T-cell products. The ASCO Post;
- M. V. Maus, A. R. Haas, G. L. Beatty, S. M. Albelda, B. L. Levine, et. al.. (2013). T Cells Expressing Chimeric Antigen Receptors Can Cause Anaphylaxis in Humans. Cancer Immunology Research. 1, 26-31;
- Sattva S. Neelapu, Sudhakar Tummala, Partow Kebriaei, William Wierda, Cristina Gutierrez, et. al.. (2018). Chimeric antigen receptor T-cell therapy — assessment and management of toxicities. Nat Rev Clin Oncol. 15, 47-62;
- Marco Ruella, Jun Xu, David M. Barrett, Joseph A. Fraietta, Tyler J. Reich, et. al.. (2018). Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell. Nat Med. 24, 1499-1503;
- Robbie G. Majzner, Crystal L. Mackall. (2018). Tumor Antigen Escape from CAR T-cell Therapy. Cancer Discov. 8, 1219-1226;
- Xiuyan Wang, Isabelle Rivière. (2016). Clinical manufacturing of CAR T cells: foundation of a promising therapy. Molecular Therapy - Oncolytics. 3, 16015;
- Perry B Hackett, David A Largaespada, Laurence JN Cooper. (2010). A Transposon and Transposase System for Human Application. Molecular Therapy. 18, 674-683;
- X Wang, I Rivière. (2015). Manufacture of tumor- and virus-specific T lymphocytes for adoptive cell therapies. Cancer Gene Ther. 22, 85-94;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- K. Urbanska, E. Lanitis, M. Poussin, R. C. Lynn, B. P. Gavin, et. al.. (2012). A Universal Strategy for Adoptive Immunotherapy of Cancer through Use of a Novel T-cell Antigen Receptor. Cancer Research. 72, 1844-1852;
- John A. Craddock, An Lu, Adham Bear, Martin Pule, Malcolm K. Brenner, et. al.. (2010). Enhanced Tumor Trafficking of GD2 Chimeric Antigen Receptor T Cells by Expression of the Chemokine Receptor CCR2b. Journal of Immunotherapy. 33, 780-788;
- L. B. John, C. Devaud, C. P. M. Duong, C. S. Yong, P. A. Beavis, et. al.. (2013). Anti-PD-1 Antibody Therapy Potently Enhances the Eradication of Established Tumors By Gene-Modified T Cells. Clinical Cancer Research. 19, 5636-5646.