Спасти сердце и не потерять разум
22 ноября 2019
Спасти сердце и не потерять разум
- 9983
- 1
- 13
Этот хрупкий мозг!
рисунок автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Приходилось ли вам слышать от окружающих, чьи близкие люди перенесли кардиохирургическое вмешательство, следующее: «После операции он стал другим» или «Он больше не способен мыслить так, как до операции»? Эту статью мы посвятим феномену, когда при самом удачном исходе кардиохирургического вмешательства удается спасти человека, но есть вероятность упустить возможность сохранить его личность.
Конкурс «био/мол/текст»-2019
 Эта статья опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019 и заслужила приз зрительских симпатий.
Эта статья опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019 и заслужила приз зрительских симпатий.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В 2000 году в газете «Нью-Йорк таймс» был описан случай, произошедший в 1989 году с неким мистером Хейнеманом. Он был успешным юристом в Новом Орлеане и важной персоной в различных законодательных комитетах штата. Всё было хорошо до тех пор, пока у мистера Хейнемана не случился сердечный приступ, после которого пришлось прибегнуть к коронарному шунтированию (рис. 1).
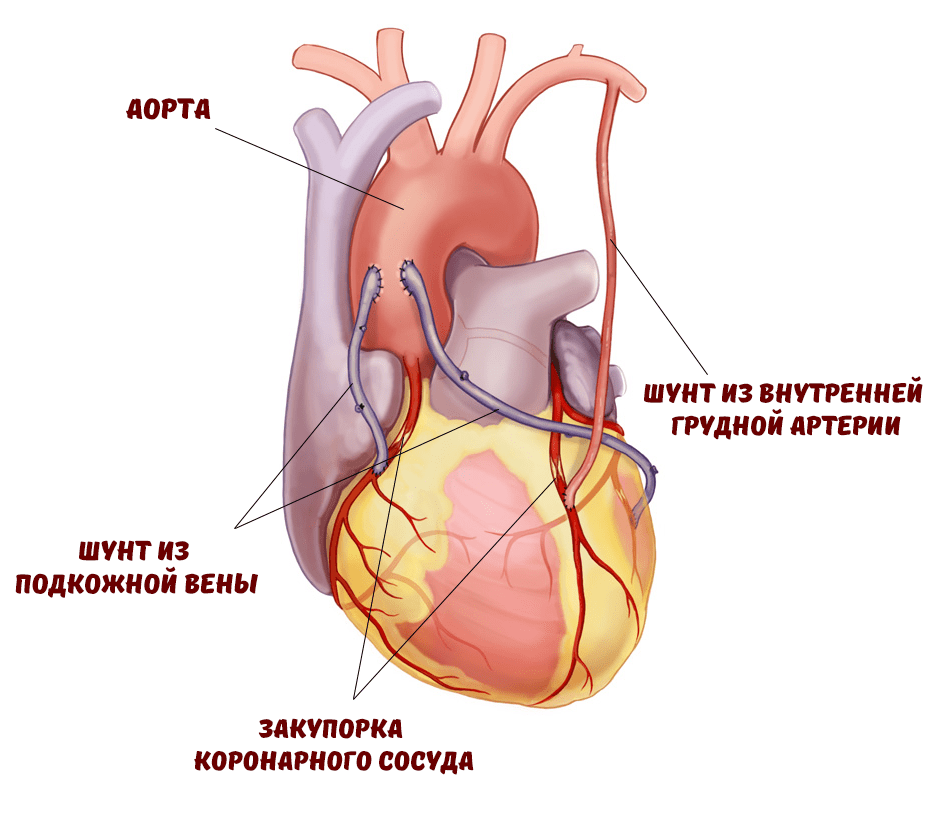
Рисунок 1. Сердце после операции коронарного шунтирования (КШ)
Хирургическое вмешательство прошло успешно, но с тех пор пациент стал замечать проблемы с памятью, и даже такие повседневные и простые задачи, как написание писем, стали вызывать у него определенные трудности. Врачи лишь пожимали плечами и говорили, что проблемы имеют временный характер, посоветовав «не принимать никаких важных решений в течение месяца». Спустя месяц Хейнеман был не способен справляться со своей работой: «Когда я изучаю какое-то новое дело из своей юридической практики, то затрудняюсь пересказать весь материал на следующий день, особенно в том порядке, в котором это должно быть представлено». Расстроенный мистер Хейнеман обратился к самолечению и методикам по улучшению памяти . Он пробовал компьютерный тренинг и чтение научной литературы.
Хотелось бы отметить, что мистер Хейнеман выбрал правильную стратегию самолечения, но какую именно программу тренингов он использовал и с какой продолжительностью — история, к сожалению, умалчивает. Регулярность и эффективность любого тренинга должна быть подтверждена практически.
Но его проблемы с памятью не исчезли, и спустя два года после случившегося он уже не вернулся к своей работе. «Если ты ничего не помнишь, ты не сможешь заниматься своей любимой работой», — сказал он.
Увы, но мистер Хейнеман не одинок в ситуации, когда после хирургического вмешательства пациенты не смогли вернуться к своей привычной жизни. Сегодня известно, что довольно значительное число обследуемых (30–80%) после операции коронарного шунтирования, проводимой с использованием искусственного кровообращения, страдают нарушениями когнитивных функций. Неужели операция, направленная на повышение продолжительности и улучшение качества жизни пациентов, проводит черту между «до» и «после»? Ведь выходит так, что сохранение работоспособности сердца влечет за собой значительный риск утратить важные функции головного мозга.
Список сокращений
В здравом уме и доброй памяти?
Когнитивные функции — это те функции, благодаря которым мы познаем окружающий мир и взаимодействуем с ним. К ним относится восприятие, которое позволяет нашему мозгу создавать целые образы от поступающей информации из органов чувств. Память способствует усвоению, сохранению и воспроизведению полученной информации, а внимание избирательно сосредоточивает нас на определенном объекте или стимуле для дальнейшего его изучения и осознания. В то же время внимание формируется из двух когнитивных процессов: гнозиса (узнавания объекта посредством органов чувств) и праксиса (способности приобретать, сохранять и воспроизводить сложные моторные навыки в повседневной деятельности). Мышление, интеллект и речь — ключевые структуры когнитивных способностей, которые формируются из вышеупомянутых «кирпичиков», менее сложных в структурно-функциональном отношении, но не менее значимых [2]. Ряд областей головного мозга считаются наиболее задействованными в когнитивной деятельности. Это префронтальная (лобная) и париетальная (задняя теменная) кора и структуры гиппокампа. Они имеют важную особенность — находятся в так называемых «зонах водораздела», то есть их кровоснабжение осуществляется концевыми ветвями соседствующих крупных мозговых артерий (рис.2) [3].
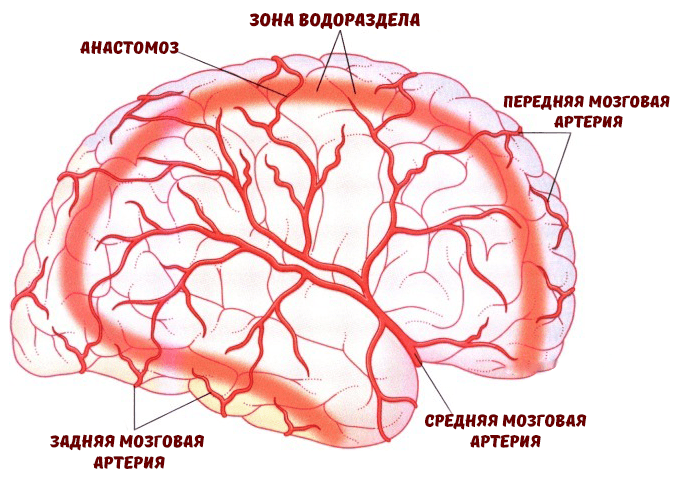
Рисунок 2. «Зоны водораздела» — конечные сосудистые регионы мозга. Это зоны смежного кровоснабжения корковых ветвей средней мозговой артерии и их анастомозов с ветвями передней и задней мозговых артерий.
Поэтому при развитии сердечно-сосудистых заболеваний (ССЗ) данные регионы мозга наиболее уязвимы для таких патологических факторов, как хроническая или острая ишемии и гипоперфузия.
Когнитивные нарушения (КН) — ухудшение деятельности высших мозговых функций, выходящее за пределы возрастной нормы. Они варьируют от легких (субъективных) и умеренных расстройств до более тяжелых, например, деменции. Для пожилых людей эти ухудшения часто считаются естественным процессом старения, если только изменения не обретают более выраженные формы. Когда человек в зрелом и пожилом возрасте замечает, что стал медленнее реагировать на происходящее или у него появилось некоторое ухудшение памяти, то не придает значения тому, что это может быть вызвано сосудистыми поражениями мозга. Однако известно, что даже «нормальное» старение сопровождается снижением мозгового кровообращения. Гипоперфузия же патологической природы (например, атеросклероз мозговых сосудов) значительно ухудшает состояние мозга дополнительно к действию факторов старения [4]. Такие связанные с атеросклерозом заболевания, как артериальная гипертензия и ишемическая болезнь сердца, рассматриваются в качестве факторов риска не только сосудистой, но и нейродегенеративной деменции.
Современная медицина обладает обширным арсеналом лечения ССЗ независимо от возраста пациента. Благодаря коронарному шунтированию или менее инвазивному методу чрескожного коронарного вмешательства (подробнее — во врезке ниже) стало возможным снизить смертность от разнообразных форм ишемической болезни сердца. Но, несмотря на все внедряемые хирургические новшества и перфузионные способы защиты головного мозга во время операции (включая и вышеупомянутые значимые области), количество когнитивных осложнений после кардиохирургических вмешательств не уменьшается. Можно ли назвать когнитивный дефицит «побочным эффектом» после кардиохирургического вмешательства?
Возможны побочные эффекты
Изучение вопроса когнитивных последствий от операций началось с работы британского хирурга П.Д. Бедфорда Adverse cerebral effects of anesthesia on old people, опубликованной в 1955 году в журнале Lancet [7]. Он изучил 1193 случая некардиохирургических вмешательств в условиях общей анестезии у пациентов старше 50 лет. Оказалось, что у 10% пациентов снизились когнитивные функции, а у 7% из них развилась тяжелая форма деменции. Бедфорд указал, что подобное состояние — следствие влияния анестезии в совокупности с низким артериальным давлением [7]. Но только в 2001 году датский хирург Ларс Расмуссен назовет этот патологический феномен послеоперационной когнитивной дисфункцией (postoperative cognitive dysfunction).
Послеоперационная когнитивная дисфункция (ПОКД) — это расстройство, характеризующееся снижением когнитивных показателей в ранний послеоперационный период (7–10 дней после вмешательства), но которое может сохраняться и усиливаться впоследствии. Ее клинические проявления заключаются в нарушении скорости реакции, памяти и внимания в различных комбинациях, а в тяжелых ее проявлениях затрагиваются более сложные корковые функции, такие как мышление, речь и интеллект. ПОКД обычно возникает после длительных высокотравматичных, многократных оперативных вмешательств, чаще у лиц пожилого возраста [8].
Возвращение к теме когнитивных нарушений произошло по большому счету лишь спустя 43 года — в 1998 году, когда было проведено первое международное исследование, касающееся проблемы ПОКД. Статус «международного исследования» подтверждался количеством его участников: медицинские учреждения восьми европейских стран и США остались небезразличны к вопросу когнитивных дисфункций. Специалисты обследовали 1218 пациентов, чтобы выявить какие факторы способствуют ухудшению послеоперационного состояния больных. А именно: влияет ли пониженное содержание кислорода в крови (гипоксемия) и пониженное кровяное давление (гипотония) на формирование ПОКД. Стало известно, что у пациентов старше 60 лет через неделю после операции ранняя ПОКД была на 22% выше в отличие от группы больных младшего возраста и оставалась в этой группе больных выше на 7% даже через три месяца после операции. В итоге, у 10% пациентов сохранялась стойкая ПОКД. К третьему месяцу после операции из всех предполагаемых факторов риска развития когнитивных дисфункций свое значение сохранил только возраст. Влияние гипоксемии и гипотонии на развитие ПОКД не подтвердилось статистическими данными ни через неделю, ни через три месяца после операции.
Показано, что ПОКД может носить временный характер, если пациент младше 45 лет, не имеет предрасположенности к нейродегенеративным расстройствам, не обладает низким образовательным и интеллектуальным уровнем, не имеет тяжелое соматическое и психическое заболевание, не подвергался продолжительному влиянию анестетиков, повторным оперативным вмешательствам и инфекционным и респираторным осложнениям после них. И совсем не важно, какой тип вмешательства перенесет пациент, факторы риска ПОКД будут одинаковыми в любом случае. Когнитивные нарушения легкой и умеренной степени наблюдаются у всех пациентов в раннем послеоперационном периоде, но на этом этапе не сразу можно обнаружить патологические изменения. Со временем симптомы начинают усиленно проявлять себя вплоть до снижения интеллектуальных способностей, дальнейших проблем с обучением, повышенной тревожности и развития депрессии. Всё вышеперечисленное не всегда доходит до уровня состояния деменции, а выявление нарушений возможно с помощью специальных нейропсихологических тестов и шкал [9].
В 2000 году крупный таблоид «Нью-Йорк таймс» обратил внимание своих читателей на проблему когнитивных нарушений в статье Saving the heart can sometimes mean losing your memory («Спасение сердца иногда может вызывать потерю памяти»), где рассказал о влиянии искусственного кровообращения на функции мозга и о возможных ухудшениях после операции на примере мистера Хейнемана. Авторы проделали колоссальную работу, ссылаясь лишь на немногочисленные к тому времени научные труды по проблеме ПОКД. Статья получила широкую огласку в медицинской среде, что подтолкнуло к более подробному изучению этого клинического феномена. За последние двадцать лет показатели частоты развития послеоперационных когнитивных дисфункций значительно выросли: от 30% до 80% — на 7‒8-е сутки после операции; от 20 до 50% — через 6 недель после операции; и от 10 до 30% — через 6 месяцев после операции [10], [11]. Исследователи столкнулись с «феноменом раннего улучшения», когда симптомы ПОКД вновь проявляли себя через пять лет после операции, поэтому был сделан вывод о том, что необходимо отслеживать состояние пациента в течение этого периода с момента выписки из клиники [12].
Удалось выделить следующие патогенетические факторы, связанные с операцией и негативно влияющие на работу головного мозга и дальнейшее развитие ПОКД.
Продолжительная общая анестезия и возможное токсическое влияние ее компонентов
Для начала разберемся: что же такое наркоз и анестезия, и в чем их различие?
Анестезия (от греческого ἀναισθησία — «без чувства») — общее определение для разных видов обезболивания и введения пациента в бессознательное сознание с потерей чувствительности на внешние раздражители. Например, болевые ощущения от хирургического скальпеля. Наркоз (от греческого «наркосис» (νάρκωσις) — «онемение/оцепенение») — это один из видов анестезии. Также наркоз принято называть — общей анестезией (ОА). Этот вид анестезии часто используют во время операций, в том числе кардиохирургических. Хотя эффект ОА описывают как «состояние сна» или «потерю сознания», воздействие наркоза нельзя назвать обычным сном. С помощью специальных медицинских средств (анестетиков) пациента вводят в обратимое состояние искусственной бессознательности и таким образом достигают угнетения работы ЦНС, блокируя передачу нервных импульсов. Действие анестезии на ЦНС неравномерно, в большей степени задействует кору головного мозга и ретикулярную формацию. В результате все реакции человека тормозятся, в том числе болевые, снижается артериальное давление и амплитуда дыхания, мышцы расслабляются, и пациент погружается в так называемый медикаментозный сон. А после пробуждения он даже не вспомнит ужасные моменты, связанные с пережитой операцией [13].
Наряду с необходимым обезболивающим эффектом продолжительная общая анестезия может иметь и токсическое действие, сопряженное с угнетением функций нейронов головного мозга и нарушением межнейронных связей. Так, например, показано, что анестезия более одного часа вызывает гиперфосфорилирование одного из основных белков внутренней мембраны нейронов — тау-протеина, что становится непосредственной причиной последующей гибели клеток головного мозга [14]. Более возрастные пациенты хуже переносят продолжительную анестезию, особенно если имеются сопутствующие ССЗ и вызванная ими ишемия головного мозга.
При продолжительной общей анестезии и сопутствующих факторах риска, таких как пожилой возраст и хроническая ишемия головного мозга, воздействие ряда анестетиков приводит к снижению доставки кислорода к нервным клеткам. Нейроны коры головного мозга обладают высокой избирательной чувствительностью к ишемии, которая обусловлена энергозатратным функционированием К+/Na+- и Ca2+-АТФаз, блокадой генерации АТФ в условиях прекращения доступа кислорода и рядом других механизмов [15]. Нарушение энергетического обмена нейронов смещает ионный баланс с нарастанием концентрации внутриклеточных ионов Са2+, что приводит к выбросу эксайтотоксичного глутамата, который гиперактивирует рецепторы NMDA и АМРА, увеличивая поступление натрия и кальция внутрь нейрона, а калия из нейронов. Внутриклеточное увеличение концентрации кальция и Са2+-зависимых повреждающих факторов (протеаз, липаз, эндонуклеаз), разрушающих цитозольные структуры, приводит к запуску апоптоза клетки [16].
Зная о таких возможных побочных эффектах продолжительной общей анестезии, специалисты стремятся достичь нейропротекторного эффекта анестетиков, которые способны угнетать патофизиологические каскады, приводящие к апоптозу, и таким образом повысить безопасность проводимой процедуры для мозга. Основным механизмом действия анестетиков, обладающих нейропротекторными свойствами, является уменьшение энергопотребления мозга, особенно коры. Но все анестетики без исключения оказывают то или иное влияние на функцию нейронов, то есть их действие на мозг — с одной стороны, нейротоксично, с другой — нейропротективно.
Таким образом, для профилактики ПОКД важна не только продолжительность анестезии, но и выбор самого анестетика и его дозировка. С учетом особенностей организма и типа проводимой операции анестезиологи комбинируют различные виды анестезии и количество анестетиков, тем самым уменьшая концентрацию тех или иных веществ во избежание токсического воздействия (табл. 1).
| Анестетик | Механизмы действия |
|---|---|
| Диприван | Не вызывает нарушений. Оказывает нейропротективный эффект. |
| Десфлуран, севофлуран | Кратковременное угнетение с полным восстановлением в течение шести часов. Отсутствует влияние. Оказывает нейропротективный эффект. |
| Бензодиазепины | Подавляют нейронную активность. |
| Барбитураты | Подавляют нейронную активность. |
| Кетамин | Увеличивает интенсивность апоптоза нейронов лобной, височной и затылочной коры. Повышает уровни астении и нервно-психических нарушений. Не влияет при уравновешенности баланса нервных процессов или их сдвиге в сторону торможения. |
| Изофлуран, галотан | Увеличивает содержание в мозге β-амилоида — вещества, связанного с развитием болезни Альцгеймера. |
Большинство используемых сегодня анестетиков являются очень разнородными, как по своим физико-химическим свойствам, так и физиологическому действию. Например, ингаляционный анестетик изофлуран — это инертный газ, анестезирующее действие которого связано с прерыванием проведения импульсов в нервной системе, в то время как внутривенный анестетик кетамин является антагонистом NDMA-рецепторов. Кетамин обладает обратным глутамату действием и блокирует эти рецепторы, разобщая межнейронные связи. Кстати, помимо анестетических свойств, кетамин оказывает еще сильное психоактивное и антидепрессивное воздействие. Производное кетамина эскетамин в настоящий момент рассматривается как антидепрессант у пациентов с резистентной к другой терапии депрессией. Однако важно учитывать такие побочные эффекты кетамина, как галлюцинации и расщепление сознания (диссоциативные расстройства). Возможно, именно поэтому и достигается известный эффект от наркоза, когда «душа отделяется от тела». Влияние NMDA-антагонистов на головной мозг неравномерно и в большей степени выражено в височных и лобных долях, которые являются одними из ключевых структур, отвечающих за когнитивную деятельность.
Другой внутривенный анестетик пропофол отличается от кетамина по нейрофизиологическим свойствам. Пропофол не имеет такого продолжительного действия, как кетамин, и хорошо комбинируется с другими анестетиками для поддержания наркоза. Предполагают, что пропофол потенциирует гамма-аминомасляную кислоту в ГАМКА-рецепторе, тем самым облегчая проведение ингибирующего импульса и замедляя время закрытия натриевых каналов. Этим можно объяснить погружение в медикаментозный сон. В ряде исследований показано, что среднетерапевтические дозы пропофола при недлительном воздействии не повреждают нейроны. Восстановление когнитивных функций до исходного уровня у прооперировавшихся больных с пропофолом в качестве анестетика происходило в течение первых 24 часов после операции.
Существуют также противоречивые мнения о безопасности некоторых ингаляционных анестетиков. Небольшие концентрации изофлурана, десфлурана и галотана могут способствовать олигомеризации β-амилоида, что является предвестником формирования нейрофибрилл, накопление которых ассоциировано с болезнью Альцгеймера. Хотя десфлуран в сочетании с севофлураном и внутривенным введением пропофола предпочтителен в профилактике ПОКД [2]. Для операций, которые длились более одного часа, севофлуран предполагает быстрое пробуждение и восстановление когнитивного статуса по сравнению с изофлураном. Но, опять же, нельзя уповать на надежность севофлурана, так как он является одним из антагонистов NMDA-рецепторов. В поиске «идеального» вида и сочетания анестетиков нужно учесть механизм действия каждого, включая их химическую структуру и физические свойства [17], [18].
Использование искусственного кровообращения, его длительность и количество связанных с его проведением эмболов
Аппарат искусственного кровообращения (АИК) представляет собой специальный насос и механически выполняет ту же работу, что и сердце (рис. 4). Во время операции аппарат ИК прогоняет кровь пациента через специальные механизмы, но их работа не всегда идеальна.
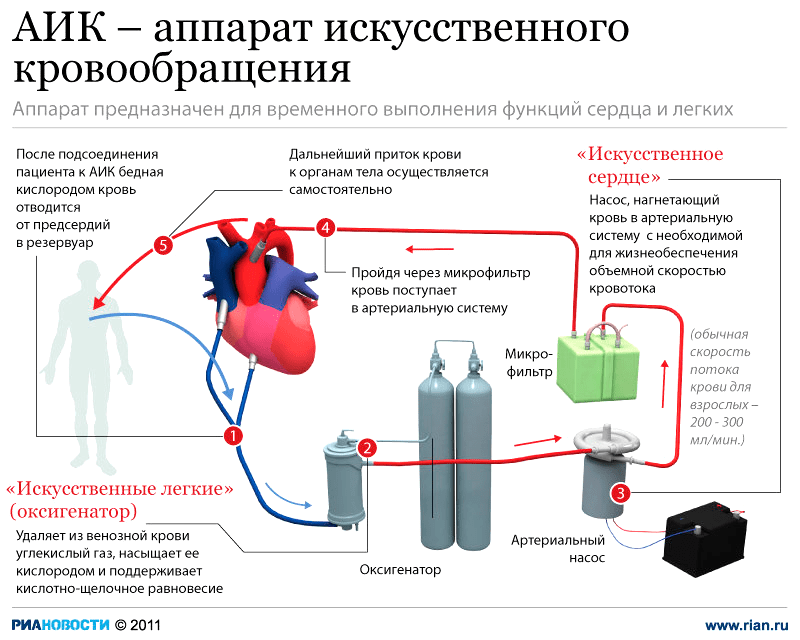
Рисунок 4. АИК — аппарат искусственного кровообращения. АИК имеет комплекс взаимосвязанных систем и блоков. Основные из них — «искусственное легкое» (оксигенатор) и «искусственное сердце» (артериальный насос). Эти части соединяются друг с другом емкостями и шлангами, тем самым образуют общий циркуляторный контур аппарата, по которому движется кровь во время искусственного кровообращения. Венозная кровь пациента переливается в оксигенатор и насыщается кислородом. Но перед тем как попасть обратно в кровяное русло, кровь проходит через теплообменник для поддержания необходимой температуры. После этого кровь попадает в микрофильтр, который очищает ее от эмболов (тромботических масс, кусочков кальция с клапанов и пузырьков газа) [19].
На протяжении 60 лет функциональные характеристики АИК постоянно совершенствуются. Улучшается работа оксигенаторов, а циркуляторные контуры изготавливаются из биосовместимых материалов. Микрофильтры нового поколения имеют гидрофильную полимерную поверхность, которая обладает высоким сродством к лейкоцитам, что обеспечивает высокую степень очистки крови от эмболов. Несмотря на все достижения, ИК все так же неоднозначно сказывается на организме больных в послеоперационный период.
Кардиохирургическое вмешательство в условиях ИК может сопровождаться развитием системного воспалительного ответа (СВО) вследствие операционной травмы, соприкосновения клеточных элементов крови с комплексом АИК и реперфузии миокарда. При этом образуются токсические субстраты, воздействие которых приводит к нарушению микроциркуляции и проницаемости биологических мембран, следовательно, нарушается и транспорт кислорода к тканям с последующей гипоксией. Также в фильтры ИК попадают пузырьки кислорода, фрагменты тканей и мембран, которые нередко служат причиной закупорки сосудов (микроэмболии) [19], [20].
Системный воспалительный ответ — активация цитокинового аппарата, формирующего воспалительную реакцию организма при поступлении в кровоток чужеродных антигенов. В случае кардиохирургического вмешательства, патологические процессы запускаются как самой хирургической травмой, так и контактом собственных клеток крови с циркуляторным контуром аппарата ИК. Происходит активация большого числа биологически активных веществ, в том числе С-реактивного белка (СРБ) и интерлейкина-1, и продемонстрировано, что у пациентов с ПОКД повышенные показатели этих веществ сохраняются достаточно долгое время после операции [21]. Интерлейкин-1 (ИЛ-1) — один из важных медиаторов воспалительного ответа в мозге. ИЛ-1 чувствителен как к инфекционному воздействию, так и к внешним повреждениям, вызванным хирургическим вмешательством. Он дает локальные эффекты на гиппокамп, ответственный за функции кратковременной и долговременной памяти. Существует два вида интерлейкина-1: альфа (ИЛ-1α) и бета (ИЛ-1β), но их биологические свойства очень похожи. ИЛ-1α активирует только Т-лимфоциты, в то время как ИЛ-1β многофункционален. ИЛ-1β модулирует и регулирует ответную реакцию организма, активирует нейтрофилы, Т- и В-лимфоциты — одни из основных компонентов иммунной системы [22]. С развитием апоптоза нейронов также образуются провоспалительные цитокины, усиливая местное воспаление и гибель нейронов [23].
Воздействие анестетиков и ИК связано с увеличением уровня нейроспецифических веществ в периферической крови. Самыми информативными в настоящий момент в диагностике ПОКД признаются S-100-белок и нейронспецифическая енолаза (НСЕ).
S-100 — целое семейство из 25 кальций-связывающих протеинов. Свое название они получили за счет свойства на 100% растворяться в растворе сульфата аммония при нейтральном pH (7,2). Присутствуют в глиальных клетках нервной системы, но большее их количество сосредоточено на мембранах астроцитов (85–90%). Астроциты чувствительны ко всем функциональным изменениям нейронов и отвечают повышением концентрации кальция в клетке, чему S-100-белки активно способствуют. Увеличение фракций S-100-белков в спинномозговой жидкости и плазме крови является признаком повреждения ЦНС по причине функционального нарушения целостности мембраны и/или повышенной проницаемости гематоэнцефалического барьера [23], [24].
Ведущее значение среди этих белков имеет S100β, так как является ранним маркером повреждения нервной ткани во время кардиохирургических операций [25]. Его наличие в плазме крови свойственно раннему послеоперационному периоду у пациентов с ПОКД [26]. Предполагается, что блокада низкими концентрациями белка S100β NMDA-рецепторов оказывает нейропротективный эффект. Однако при дальнейшем повышении его концентрации он ведет себя как цитокин, усиливающий и сохраняющий воспаление, приводящий к повреждению нейронов. Но нужно учесть, что время полураспада S100β-протеина достаточно короткое — около 25 минут. Это имеет большое значение для диагностики наличия данного маркера. Во время операции уровень S100β будет резко повышаться и быстро снижаться после нее, но медленное снижение в послеоперационный период говорит о повреждении клеток головного мозга.
Повышенная концентрация нейронспецифической енолазы в сыворотке крови также является маркером повреждения мозга в послеоперационном периоде. Нейроспецифическая енолаза — фермент, который присутствует в мембранах нейронов и нейроэндокринных клеток и участвует в процессах гликолиза клетки. Повышение уровня нейронспецифической енолазы было обнаружено при хронической ишемии и гипоксии головного мозга, эпилепсии, болезни Паркинсона, болезни Альцгеймера и опухолях головного мозга. У кардиохирургических пациентов наличие НСЕ наблюдается в первые два часа после прекращения работы аппарата ИК и постепенно снижается до показателей нормы к седьмым суткам [27].
У пожилых пациентов с диагностированной ПОКД токсическое влияние анестетиков способствует гиперфосфорилированию тау-протеина и образованию нейрофибриллярных клубков или нейрофибрилл. Тау-протеин — белок, который прикреплен к микротрубочкам аксонов и укрепляет их. Процесс фосфорилирования тау-белка осуществляется как в норме, так и в патологии. В нормальных условиях тау-протеин стимулирует рост нейронов, перемещение веществ по нервной клетке и стабилизирует микротрубочки. А вот патологический гиперфосфорилированный тау-белок, являющийся основным компонентом нейрофибриллярных клубков, ухудшает свою способность поддерживать связь с микротрубочками, что приводит к гибели нейронов [28]. Существует зависимость между концентрацией тау-протеина в плазме и размером мозговой ишемии при хирургических операциях. Как продемонстрировано исследованиями, у людей максимальный уровень этого белка выявляется через шесть часов после операции и сохраняется в течении первой недели послеоперационного периода [29].
Но если невозможно избежать всех или некоторых факторов риска, то как правильно предупредить и скорректировать возможные когнитивные нарушения после операционного вмешательства? Ведь помимо проблем со здоровьем возникают сложности с послеоперационной адаптацией в социальной сфере — на работе, в коллективе и в семье.
Как помочь?
Если в ходе обследования перед операцией пациенты жалуются на некоторое ухудшение когнитивных функций, то важно провести нейропсихологическое исследование. Обычно оно включает оценку состояния основных когнитивных доменов — процессов гнозиса и праксиса, речи, чтения и письма, ориентации в пространстве и времени, а также кратковременной памяти, внимания, исполнительных функций. Важно учитывать психоэмоциональное состояние пациента. При обследовании также учитывают и уровень образования, ведь тяжелые когнитивные расстройства характерны для лиц с низкими интеллектуальными показателями и образовательным уровнем .
Считается, что большие когнитивные резервы имеют более образованные люди. Если человек в течение жизни имеет частую когнитивную нагрузку, например, длительное обучение, интеллектуальный труд или наличие постоянного хобби, то это способствует созданию новых нейронных связей. Такие пациенты быстрее переносят послеоперационное патологическое состояние ЦНС за счет включения большего количества сложных межнейронных, ассоциативных связей и вовлечения в работу других регионов мозга [30].
В послеоперационном периоде основным методом диагностики ПОКД у пациента также является нейропсихологическое тестирование.
Но раннее обнаружение когнитивных дисфункций не всегда возможно из-за отсутствия первичной профилактики населения, осведомленности самих врачей о структуре, частоте, факторах риска, особенностях диагностики и терапии. Тем не менее простые клинико-психологические или скрининговые шкалы деменции важны и эффективны, если больной жалуется на снижение памяти и умственной работоспособности. Ниже перечислены наиболее часто используемые скрининговые инструменты для оценки когнитивного статуса пациентов.
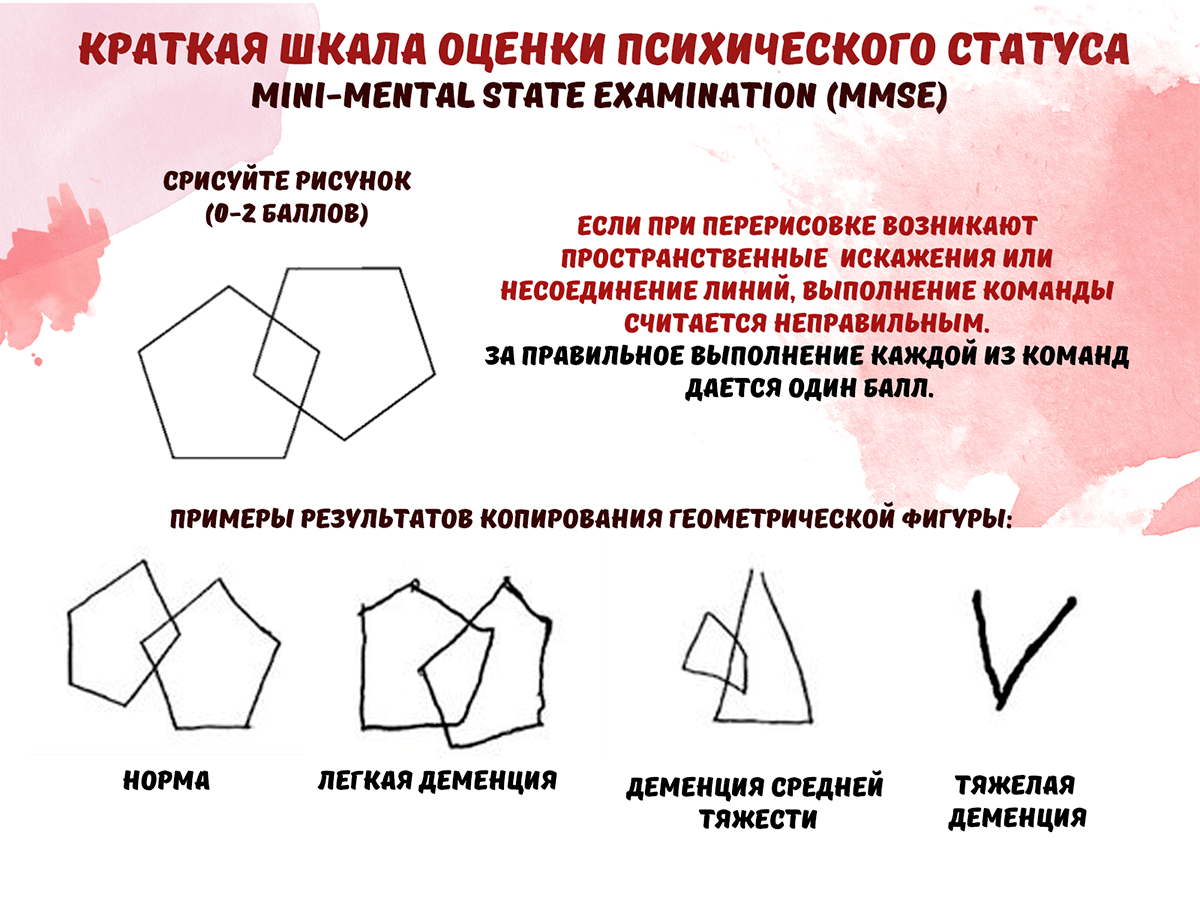
«Краткую шкалу оценки психического статуса» (КШОПС) (Mini-mental state examination, MMSE) разработал М.Ф. Фолстайн в 1975 году. Это одна из основных методик для скрининга когнитивных нарушений, которая включает в себя оценку ориентировки во времени и пространстве, возможностей кратковременной памяти, концентрации внимания, речи, восприятия, последовательных действий и логического мышления (рис. 5).
Максимальное количество баллов — 30, что является показателем высоких когнитивных способностей. Результаты теста могут иметь следующие значения:
28–30 баллов — нет нарушений когнитивных функций;
24–27 баллов — преддементные когнитивные нарушения;
20–23 балла — деменция легкой степени выраженности;
11–19 баллов — деменция умеренной степени выраженности;
0–10 баллов — тяжелая деменция.
Но нельзя сказать, что данная методика является основной для выявления когнитивных нарушений. Известны случаи, когда люди с деменцией легкой степени выраженности показывали нормальные результаты этого теста. А при деменциях с поражением подкорковых образований мозга или с поражением лобных долей тест не даст объективных результатов.
Известно, что поражение нервных клеток при когнитивных нарушениях (КН) может обнаруживаться в различных отделах головного мозга, следовательно, проявления когнитивного дефицита будет различным. К примеру, локализация поражения в префронтальных (лобных) структурах головного мозга выражается в так называемых когнитивных нарушениях по лобному типу. У людей (преимущественно пожилых) с таким видом КН сохраняется память о событиях жизни, общие знания и навыки. Но проблема возникает, когда больной оказывается не в состоянии правильно организовать свой быт, работу и досуг из-за нарушения концентрации или же из-за неустойчивой мотивации. Страдают процессы внимания и праксиса. Это состояние сочетаются с эмоциональными расстройствами. Появляется чувство апатии, больной становится более отчужденным. Все может сопровождаться немотивированной тревогой, несдержанностью, эмоциональным снижением, нарушением критики или же дурашливостью и плоским чувством юмора. Имеются двигательные расстройства в виде нарушений походки, соответствуя степени выраженности КН [31].
Когда чувствительности MMSE недостаточно, используется «Батарея лобной дисфункции» (Frontal assessment battery, FAB), разработанная Б. Дюбуа в 2000 г. Результаты теста варьируют от 0 до 18 баллов, где 18 — самый высокий показатель когнитивных функций (рис. 6).
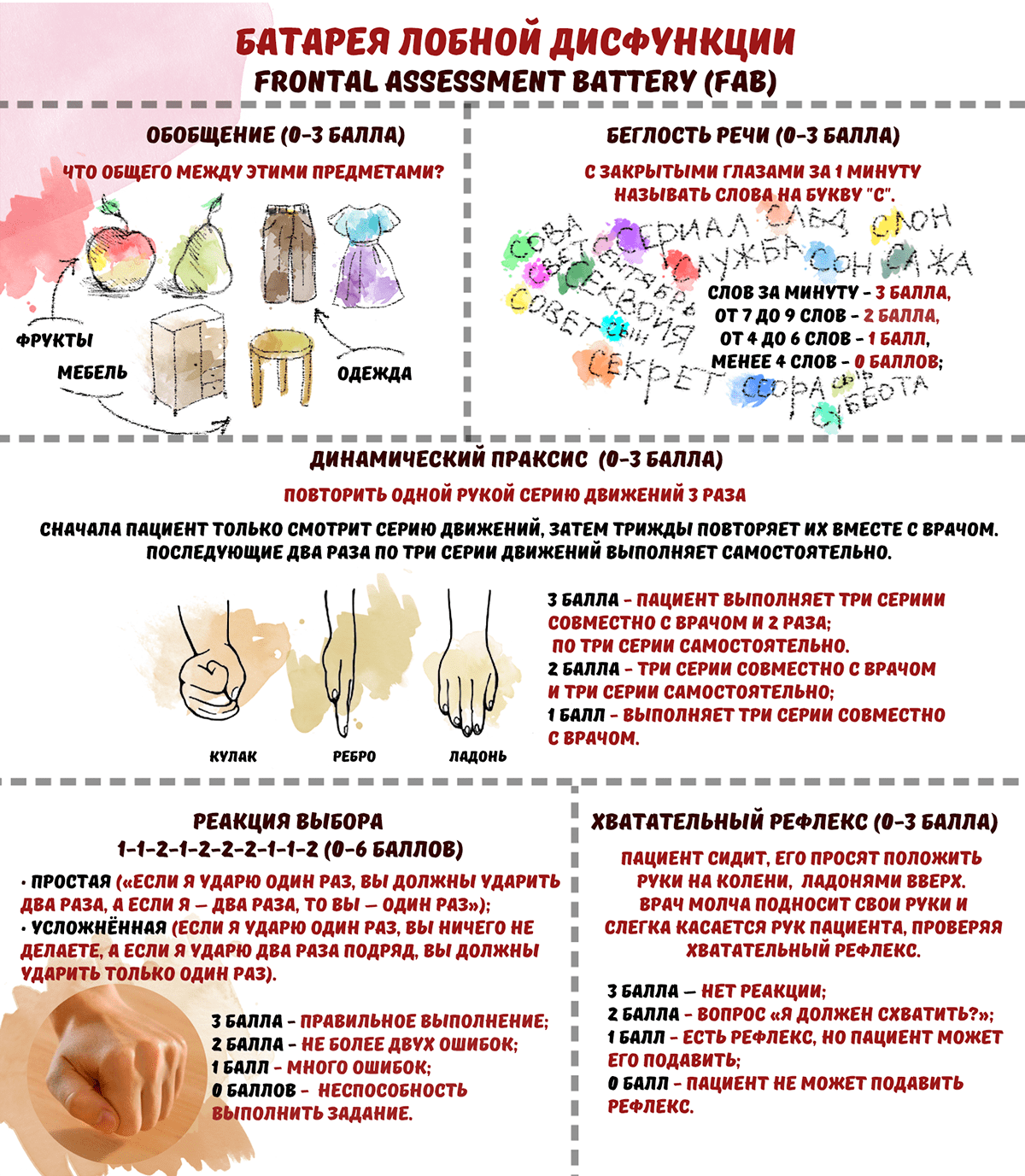
Рисунок 6. Задания теста Frontal assessment battery (FAB). Предназначен для выявления деменции с поражением лобных долей или подкорковых образований мозга, с чем тест MMSE не всегда способен объективно справиться.
рисунок автора статьи
При оценке когнитивных способностей нельзя доверять результатам только одной из шкал FAB или MMSE. Поэтому важно взаимодополняющее сопоставление их результатов. Например, деменция по лобному типу характеризуется чрезвычайно низким показателем FAB (до 11 баллов) и высоким показателем MMSE (от 24 баллов). Напротив, при легкой форме деменции при болезни Альцгеймера индекс MMSE (20–24 балла) уменьшается, в то время как индекс FAB остается на максимуме или немного уменьшается (более 11 баллов). А при умеренной или тяжелой деменции при болезни Альцгеймера, и MMSE, и FAB уменьшаются [32], [33].
Альтернативой уже существовавших MMSE и FAB стала разработанная Зиадом Насреддином в 2004 году шкала MoCA (Montreal cognitive assessment), или «Монреальская шкала оценки когнитивных функций». МоСа как раз объединяет в себе лучшие стороны шкал MMSE и FAB, что позволяет выявить ранние нейродегенеративные нарушения (рис. 7).
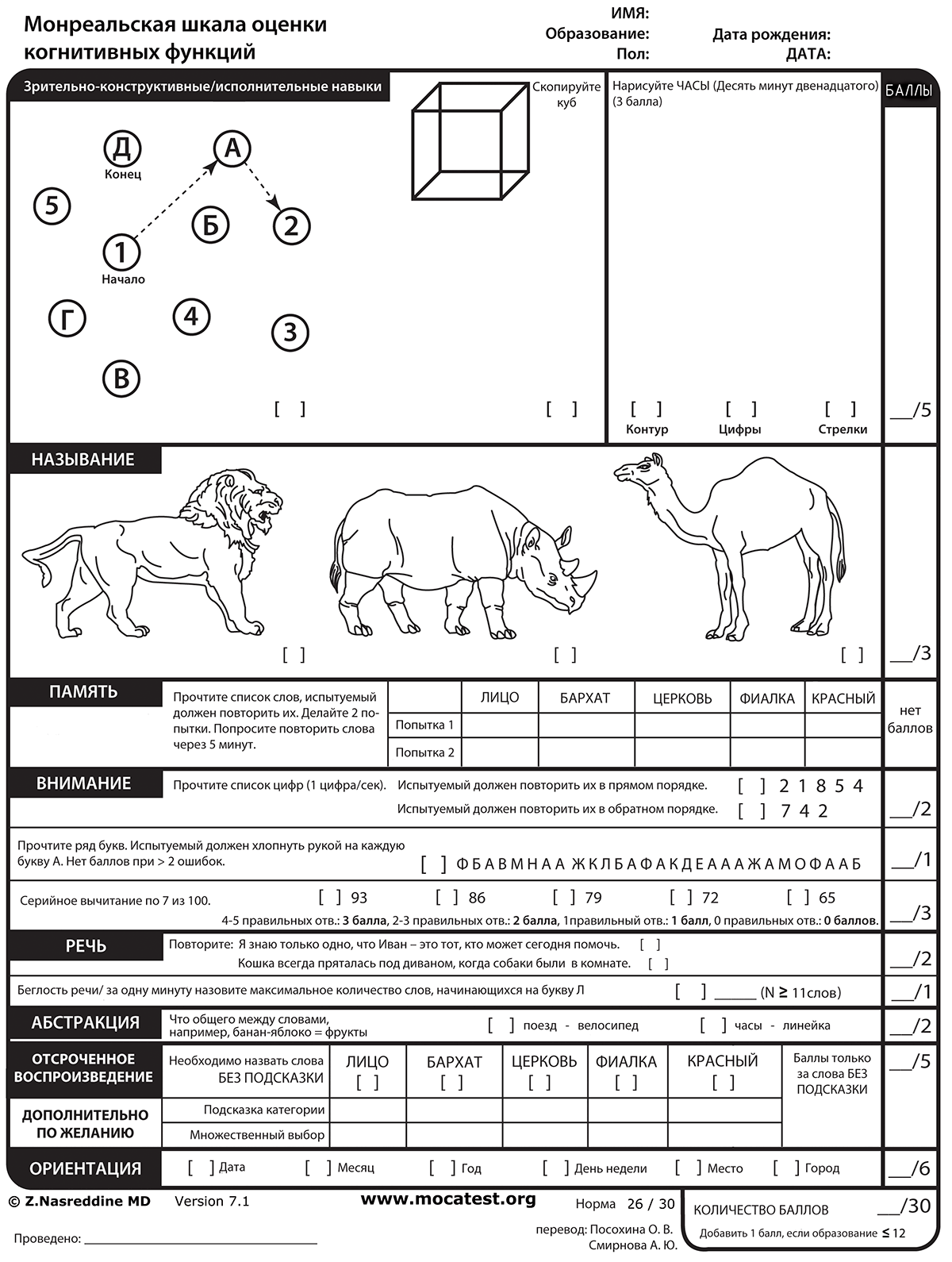
Рисунок 7. «Монреальская шкала оценки когнитивных функций» (Monreal cognitive assessment, MoCa)
МоСА делится на 7 субтестов:
- образно-пространственные/исполнительные функции (5 баллов);
- именование предметов (3 балла);
- память (5 баллов для отсроченного воспроизведения);
- внимание (6 баллов);
- языковые навыки (3 балла);
- абстрактное мышление (2 балла);
- ориентация (6 баллов).
Один балл добавляется, если обследуемый имеет ≤12 лет общей продолжительности обучения. Было показано, что шкала МоСА более чувствительна, чем MMSE для обнаружения умеренных когнитивных нарушений в общей популяции. Максимально возможное количество баллов — 30; 26 и более баллов считается нормальным [34–36].
| Шкала\тест | Преимущества | Недостатки | Чувствительность* (%) | Специфичность* (%) | Время выполнения |
|---|---|---|---|---|---|
| MMSE | Широко используется. Получено множество доказательств, связанных с его чувствительностью и валидностью. Имеются пороговые значения. Степень КН определена от легкой до тяжелой деменции | Необходимо учитывать возраст и уровень образования | 88,3 (81,3--92,9) | 86,2 (81,8–89,7) | 7–10 минут |
| FAB | Прост в использовании, есть градации по степени выраженности КН, не требует учета возраста и образования | Ограничен только определением КН по лобному типу | 77% | 87% | 5–10 минут |
| MoCA | Может идентифицировать умеренные КН | Необходимо учитывать уровень образования, большие временные затраты для проведения тестирования | Недостаточно данных для расчета этих показателей | Недостаточно данных для расчета этих показателей | 15–20 минут |
| * — Чувствительность и специфичность являются статистическими показателями эффективности диагностического теста по выявлению больных и не больных. | |||||
Если же мы диагностируем когнитивные нарушения с помощью этих шкал, то что делать дальше? Следует принять во внимание возраст обследуемого. Чем больше возраст, тем меньше когнитивно-компенсаторные резервы мозга, особенно это связано с уровнем образования пациента. Для профилактики и коррекции когнитивных нарушений пациентам следует отказаться от курения, вести активный образ жизни, придерживаться терапии по лечению ишемической болезни сердца и не пренебрегать когнитивными тренингами [38]. Нужно учитывать и информированность семейного окружения пациента о развитии ПОКД. Семья должна была заинтересована в благоприятном и полном восстановлении после операции. Наверняка вы слышали о том, что для детей важно создавать «развивающую среду», которая заключается в формировании такого игрового и воспитательного окружения, которое бы способствовало развитию интеллектуальных способностей? Это утверждение справедливо и для стареющего мозга, ведь когнитивные функции зависимы от влияния социальных и эмоциональных факторов. Доказано, что одиночество и отсутствие социальной активности негативно сказываются на послеоперационном восстановлении, в том числе и когнитивных функций.
Такие рекомендации характерны как для некардиохирургических пациентов, так и для кардиохирургических, но с некоторыми поправками. Восстановление протекает гораздо сложнее при совместном влиянии анестезии и искусственного кровообращения при кардиохирургическом вмешательстве. Длительный прием нитратсодержащих препаратов также существенно влияет на мозговое кровообращение.
В настоящее время кардиохирургических пациентов становится все больше, и, несмотря на развитие неинвазивных методов восстановления функций сердца и коронарных артерий, количество случаев ПОКД не уменьшается. Вместе с тем операция на сердце, даже с такими отягчающими факторами, как искусственное кровообращение и общая анестезия, дает последний шанс на жизнь, и не воспользоваться им никак нельзя. Однако нужно грамотно и оперативно работать над устранением ее негативных последствий. Это усердная работа как самого пациента, так и его семьи и медиков.
Литература
- Петренко Ю. (2000). Откуда берется атеросклероз. «Наука и жизнь»;
- Тарасова И.В., Трубникова О.А., Кухарева И.Н., Барбараш О.Л. (2015). Методические подходы к диагностике послеоперационной когнитивной дисфункции в кардиохирургической клинике. «Комплексные проблемы сердечно-сосудистых заболеваний». 4, 73–78;
- Михеева И.В., Кондрашова Н.М., Таратун Л.В. (2013). Особенности церебральной гемодинамики при хронических нарушениях мозгового кровообращения. «Тихоокеанский медицинский журнал». 3, 35–37;
- Труханова И.Г., Булгакова С.В., Захарова Н.О., Пыщева Л. В., Писчаскин С.Б. (2019). Когнитивные дисфункции после операции аортокоронарного шунтирования у лиц старших возрастных групп. «Современные проблемы здравоохранения и медицинской статистики». 1, 311–319;
- Robert A Byrne, Gregg W Stone, John Ormiston, Adnan Kastrati. (2017). Coronary balloon angioplasty, stents, and scaffolds. The Lancet. 390, 781-792;
- Кузнецова И.Э., Церетели Н.В., Сухоруков О.Е., Асадов Д. А. (2013). Чрескожные коронарные вмешательства с использованием лекарственных стентов: прошлое, настоящее и будущее. «Международный журнал интервенционной кардиоангиологии». 32, 45–50;
- P.D Bedford. (1955). ADVERSE CEREBRAL EFFECTS OF ANÆSTHESIA ON OLD PEOPLE. The Lancet. 266, 259-264;
- Шнайдер Н.А. (2005). Послеоперационная когнитивная дисфункция. «Неврологический журнал». 10, 37–43;
- JT Moller, P Cluitmans, LS Rasmussen, P Houx, H Rasmussen, et. al.. (1998). Long-term postoperative cognitive dysfunction in the elderly: ISPOCD1 study. The Lancet. 351, 857-861;
- Fuzhou Wang. (2014). Postoperative Cognitive Dysfunction: Current Developments in Mechanism and Prevention. Med Sci Monit. 20, 1908-1912;
- B.S. Silbert, P. Maruff, L.A. Evered, D.A. Scott, M. Kalpokas, et. al.. (2004). Detection of cognitive decline after coronary surgery: a comparison of computerized and conventional tests. British Journal of Anaesthesia. 92, 814-820;
- Patrick Meybohm, Jochen Renner, Ole Broch, Dorothee Caliebe, Martin Albrecht, et. al.. (2013). Postoperative Neurocognitive Dysfunction in Patients Undergoing Cardiac Surgery after Remote Ischemic Preconditioning: A Double-Blind Randomized Controlled Pilot Study. PLoS ONE. 8, e64743;
- Прозоровский В. (2003). Механизмы наркоза. «Наука и жизнь»;
- Соленкова А.В., Бондаренко А.А., Лубнин А.Ю., Дзюбанова Н.А. (2012). Послеоперационные когнитивные изменения у больных пожилого и старческого возраста. «Анестезиология и реаниматология». 4, 13–18;
- Emmanuel Carrera, P. Simon Jones, Rhiannon S. Morris, Josef Alawneh, Young T. Hong, et. al.. (2013). Is neural activation within the rescued penumbra impeded by selective neuronal loss?. Brain. 136, 1816-1829;
- M HYND. (2004). Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer?s disease. Neurochemistry International. 45, 583-595;
- L.V. Novitskaya-Usenko. (2017). Post-operative cognitive dysfunction in an anesthesiologist’s practice. ЕМ. 0, 9-15;
- A. M. Ovezov, M. V. Panteleeva, A. V. Knyazev, A. V. Lugovoy, M. N. Borisova. (2015). Neurotoxicity of general anesthetics: A modern view of the problem. RJTAO. 7, 78-82;
- Аверина Т.Б. (2013). Искусственное кровообращение. «Анналы хирургии». 2, 5–12;
- YU. S. POLUSHIN, Pavlov First Saint Petersburg State Medical University, А. YU. POLUSHIN, G. YU. YUKINА, M. V. KOZHEMYAKINА, et. al.. (2019). POSTOPERATIVE COGNITIVE DYSFUNCTION – WHAT WE KNOW AND WHERE WE GO. VAIR. 16, 19-28;
- Cornelia Knaak, Gerald Vorderwülbecke, Claudia Spies, Sophie K. Piper, Daniel Hadzidiakos, et. al.. (2019). C‐reactive protein for risk prediction of post‐operative delirium and post‐operative neurocognitive disorder. Acta Anaesthesiol Scand. 63, 1282-1289;
- António Rei Fidalgo, Mario Cibelli, John P.M. White, Istvan Nagy, Mervyn Maze, Daqing Ma. (2011). Systemic inflammation enhances surgery-induced cognitive dysfunction in mice. Neuroscience Letters. 498, 63-66;
- Маркеры нарушений нервной системы. «БиоХимМак»;
- Кувачева Н.В., Салмина А.Б., Комлева Ю.К., Малиновская Н.А., Моргун А.В., Пожиленкова Е.А. и др. (2013). Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации. «Журнал неврологии и психиатрии им. C.C. Корсакова». 4, 80–85;
- А. А. IVKIN, Kuzbass Cardiology Center, E. V. GRIGORIEV, D. L. SHUKEVICH, Kemerovo State Medical University, et. al.. (2018). DIAGNOSTICS OF COGNITIVE DYSFUNCTION IN PATIENTS IN THE INTENSIVE CARE WARDS. VAIR. 15, 47-55;
- Женило В.М., Акименко Т.И., Здирук С.В., Сорочинский М.А. (2017). Проблема синдрома послеоперационной когнитивной дисфункции в анестезиологической и хирургической службе. «Современные проблемы науки и образования». 4, 70;
- Жукова И.А., Алифирова В.М., Жукова Н.Г. (2011). Нейронспецифическая енолаза как неспецифический маркер нейродегенеративного процесса. «Бюллетень сибирской медицины». 2, 15–21;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Белова А.Н., Прусакова Ж.Б., Загреков В.И., Ежевская А.А. (2015). Болезнь Альцгеймера и анестезия. «Успехи современного естествознания». 8, 7–13;
- Nalini Kotekar, Anshul Shenkar, Ravishankar Nagaraj. (2018). Postoperative cognitive dysfunction – current preventive strategies. CIA. Volume 13, 2267-2273;
- J. Steinmetz, V. Siersma, L.V. Kessing, L.S. Rasmussen. (2013). Is postoperative cognitive dysfunction a risk factor for dementia? A cohort follow-up study. British Journal of Anaesthesia. 110, i92-i97;
- Jonah S. Shiroky, Hyman M. Schipper, Howard Bergman, Howard Chertkow. (2007). Can You Have Dementia With an MMSE Score of 30?. Am J Alzheimers Dis Other Demen. 22, 406-415;
- B. Dubois, A. Slachevsky, I. Litvan, B. Pillon. (2000). The FAB: A frontal assessment battery at bedside. Neurology. 55, 1621-1626;
- Robert F. Coen, Kevin McCarroll, Miriam Casey, Helene McNulty, Eamon Laird, et. al.. (2016). The Frontal Assessment Battery. J Geriatr Psychiatry Neurol. 29, 338-343;
- Ziad S. Nasreddine, Natalie A. Phillips, Valérie Bédirian, Simon Charbonneau, Victor Whitehead, et. al.. (2005). The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. Journal of the American Geriatrics Society. 53, 695-699;
- Natalia Ciesielska, Remigiusz Sokołowski, Ewelina Mazur, Marta Podhorecka, Anna Polak-Szabela, Kornelia Kędziora-Kornatowska. (2016). Is the Montreal Cognitive Assessment (MoCA) test better suited than the Mini-Mental State Examination (MMSE) in mild cognitive impairment (MCI) detection among people aged over 60? Meta-analysis. Psychiatr Pol. 50, 1039-1052;
- Miles Berger, Katie J. Schenning, Charles H. Brown, Stacie G. Deiner, Robert A. Whittington, et. al.. (2018). Best Practices for Postoperative Brain Health. Anesthesia & Analgesia. 127, 1406-1413;
- Вахнина Н.В. (2011). Современная терапия когнитивных нарушений. «Неврология, нейропсихиатрия, психосоматика». 4, 63–69;
- Спокоен как GABA;
- Формирование мембранного потенциала покоя;
- Очень нервное возбуждение.