Система CRISPR/Cas как мишень для борьбы с клостридиями
24 октября 2019
Система CRISPR/Cas как мишень для борьбы с клостридиями
- 576
- 0
- 1
Клетка Clostridium difficile со спорой
-
Автор
-
Редактор
Системы CRISPR/Cas бактерий и архей обеспечивают защиту их клеток от вирусов и другого инородного генетического материала. Активные системы CRISPR/Cas есть и у многих патогенных бактерий, в частности, Clostridium difficile, вызывающей диарею и колит. Как показало недавнее исследование ученых из Сколковского института науки и технологий и их французских коллег, собственную активную систему CRISPR/Cas клостридии можно «натравить» на геном самой же бактерии и с ее помощью произвести в нем изменения, что в перспективе может стать новым способом борьбы с этим патогеном, против которого зачастую бессильны антибиотики. Наша статья посвящена этому новому подходу для борьбы с патогенными бактериями.
Практически повсеместно распространенная устойчивость патогенных бактерий к антибиотикам заставляет исследователей активно искать альтернативные способы борьбы с болезнетворными микробами (о проблеме антибиотикорезистентности читайте в статьях «Биомолекулы» [1], [2]). Частой причиной диареи, не поддающейся лечению антибиотиками, являются бактерии вида Clostridium difficile (недавно этот вид переименовали в Clostridioides difficile [3]). Они не только не гибнут под действием антибиотиков, но и начинают еще интенсивнее колонизировать кишечник после того, как лечение уничтожает других его обитателей. Клетки C. difficile выделяют белковые токсины, которые вызывают перестройку цитоскелета клеток кишечника, приводящую к их лизису и воспалению [4].
Подробнее о клостридиях можно прочесть в наших статьях: «Чем пахнет здоровье?» [5] и «Клостридия клостридии волк: C. difficile vs C. scindens» [6].
Однако кишечник густо заселен не только бактериями, но и фагами, поэтому для самозащиты от вирусов клетки C. difficile используют активную систему CRISPR/Cas , причем количество локусов CRISPR у них необычно велико — около 8,5 на геном. Недавно ученые из Сколтеха совместно с коллегами из Франции показали, что можно искусственно заставить систему CRISPR/Cas C. difficile действовать на саму бактерию и вызывать делеции в ее геноме. В перспективе такой подход может помочь в борьбе с кишечными инфекциями, вызванными C. difficile.
О том, что такое система CRISPR/Cas и как она работает, можно прочесть в статье «Просто о сложном: CRISPR/Cas» [7].
Чтобы заставить эндогенную систему CRISPR/Cas действовать на геном той же бактериальной клетки, можно ввести в нее плазмиду, содержащую небольшой локус CRISPR со спейсерами, соответствующими какому-либо участку на хромосоме самого микроорганизма [8]. Транскрибируемая с плазмидного спейсера CRISPR-РНК (crРНК) в комплексе с эндогенными белками Cas распознает комплементарный участок (протоспейсер) в геноме бактерии, в результате чего Cas вносит в бактериальную хромосому разрыв, и клетка погибнет (рис. 1а). Для того чтобы Cas-белок сработал, он должен «увидеть» рядом с протоспейсером определенное сочетание нуклеотидов (от двух до шести), специфичное для каждого типа Cas-белков, — PAM (англ. protospacer adjacent motif). Эндогенная система CRISPR/Cas C. difficile распознает последовательность 5′-CCW (где W — это A или T) [8]. Поэтому для экспериментов подбирали такие участки в геноме бактерии, рядом с которыми есть эти PAM.
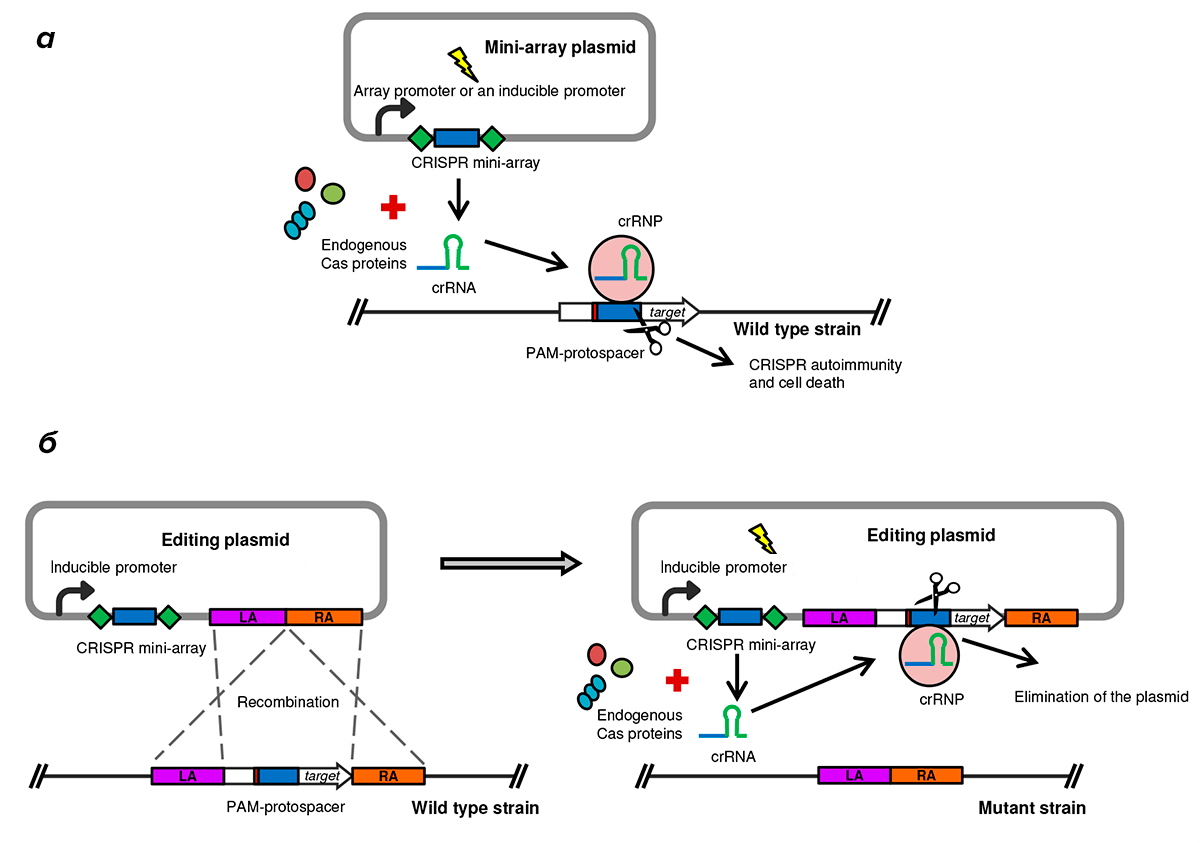
Рисунок 1. Использование эндогенной системы CRISPR/Cas для вызывания гибели бактериальных клеток дикого типа (а) и получения мутантов с делетированным участком в геноме (б). Условные обозначения: LA — левое «плечо»; RA — правое «плечо».
Однако эндогенную систему CRISPR/Cas можно использовать и для редактирования генома, если плазмида (так называемая редактирующая плазмида) будет нести не только CRISPR со спейсерами, соответствующими редактируемой последовательности в геноме бактерии, но и особый блок из двух участков (так называемых правого и левого «плеч»), гомологичных участкам, справа и слева примыкающим к сайту редактирования [9]. В этом случае произойдет гомологичная рекомбинация, в результате которой появится мутантный штамм, лишенный участка ДНК, находящегося между «плечами» (рис. 1б). Участок, удаленный из генома клетки, в ходе гомологичной рекомбинации будет встроен в редактирующую плазмиду, иными словами, бактериальная хромосома и редактирующая плазмида меняются «плечами», а заодно и всем, что между ними. Так как редактирующая плазмида теперь содержит не только спейсеры, с которых синтезируется crРНК, но и комплементарные этим crРНК участки, то эндогенные белки Cas быстро разрушат плазмиду. Отметим, что до акта гомологичной рекомбинации редактирующая плазмида сама себя «порезать» не может, потому что не содержит протоспейсеров, соответствующих crРНК, которую она сама и кодирует.
Но почему эндогенная система CRISPR/Cas не режет геном сама по себе, а нуждается для этого в редактирующей плазмиде? Дело в том, что для успешного распознавания мишени системе CRISPR/Cas необходимо сочетание специфичного для нее PAM и протоспейсера (комплементарного crРНК). В CRISPR-кассетах генома бактерии содержатся только спейсеры, соответствующие протоспейсерам врагов — в основном фагов, — и не содержатся PAM рядом с ними. То есть даже если бы CRISPR/Cas «захотела» воспринять хромосомную CRISPR-кассету, как врага, распознав спейсеры как протоспейсеры, то Cas все равно не смог бы внести разрез, не найдя там PAM. Плазмида же предоставляет клеточному Cas-белку такую crРНК, протоспейсер которой находится на бактериальной хромосоме рядом с PAM.
Кроме того, чтобы система CRISPR/Cas на плазмиде не сработала раньше времени, то есть до гомологичной рекомбинации, ее помещают под индуцибельный промотор (промотор, для активации которого в клетках должно присутствовать особое вещество-активатор, которое добавляют в культуральную среду). Таким образом, после гомологичной рекомбинации появится мутантный бактериальный штамм с делецией некоторого участка, а единственный привнесенный извне компонент системы редактирования генома — редактирующая плазмида — будет уничтожена вскоре после внесения делеции, что гарантирует невозможность обратной мутации (рис. 1б).
Описанный подход уже был успешно опробован на археях и трех других видах клостридий. Чтобы оценить возможность использования эндогенной системы CRISPR/Cas для редактирования генома у C. difficile, исследователи выбрали в качестве мишени для делеции ген hfq. Кодируемый им белок Hfq относится к числу РНК-связывающих белков и играет важную роль в метаболизме РНК. Для работы использовали два штамма C. difficile — лабораторный 630Δerm и эпидемический R20291, характеризующийся повышенной вирулентностью. Оказалось, что эндогенную систему CRISPR/Cas обоих штаммов можно не только успешно направить на ген hfq и вызвать гибель клеток из-за разрывов в геномной ДНК, но и использовать для делеции этого гена с помощью редактирующей плазмиды. Отсутствие белка Hfq и соответствующей ему мРНК в мутантных клетках обоих штаммов было подтверждено с помощью количественной ПЦР [10] и вестерн-блоттинга. Отсутствие белка Hfq проявлялось и фенотипически. Предыдущие исследования показали, что Hfq контролирует интенсивность спорообразования у штаммов C. difficile, близких к 630Δerm, — бактерии, не имеющие этого белка, образуют споры гораздо активнее, чем клетки контрольного штамма.
Разумеется, до использования эндогенной CRISPR/Cas для редактирования генома C. difficile в терапевтических целях еще далеко. Тем не менее редактирование геномов патогенов с помощью их собственных систем CRISPR/Cas может стать незаменимым в тех случаях, когда антибиотики оказываются бессильны.
Литература
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Полимеры в борьбе с антибиотикорезистентными микроорганизмами;
- Paul A. Lawson, Diane M. Citron, Kerin L. Tyrrell, Sydney M. Finegold. (2016). Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O’Toole 1935) Prévot 1938. Anaerobe. 40, 95-99;
- Orla Geoghegan, Christopher Eades, Luke S.P. Moore, Mark Gilchrist. (2017). Clostridium difficile: diagnosis and treatment update. Clinical Pharmacist;
- Чем пахнет здоровье?;
- Клостридия клостридии волк: С. difficile vs С. scindens;
- Просто о сложном: CRISPR/Cas;
- Pierre Boudry, Ekaterina Semenova, Marc Monot, Kirill A. Datsenko, Anna Lopatina, et. al.. (2015). Function of the CRISPR-Cas System of the Human Pathogen Clostridium difficile. mBio. 6;
- Anna Maikova, Victor Kreis, Anaïs Boutserin, Konstantin Severinov, Olga Soutourina. (2019). Using an Endogenous CRISPR-Cas System for Genome Editing in the Human Pathogen Clostridium difficile. Appl Environ Microbiol. 85;
- 12 методов в картинках: полимеразная цепная реакция.