
Чем пахнет здоровье?
23 октября 2017
Чем пахнет здоровье?
- 1571
- 0
- 4
сайт the-health-nut.com
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: «Кто Я?» или «Что есть Я?» — вопрос, который человек регулярно задает себе. С точки зрения современной медицины, Я — это само тело человека (организм с его генетическими и эпигенетическими особенностями) и его «микробиом». Микроорганизмы, населяющие наше тело, активно взаимодействуют с ним. Например, бактерии кишечника не только помогают нам переваривать пищу, но и влияют на наши вкусовые предпочтения. Однако, изменения в составе микробиома могут привести к тому, что наш союзник превратится в беспощадного врага, провоцируя целый ряд опасных заболеваний. Как управлять кишечной микрофлорой, можно ли пересадить «здоровый» микробиом другому человеку — на эти и ряд других вопросов я отвечу в статье.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Микробиом — это что?
Термин впервые предложили в проекте «Микробиом человека» (Human Microbiome Project) в 2001 году. Совокупность всех микроорганизмов, населяющих слизистые оболочки кишечника и других органов, а также кожу, ученые назвали «невидимым органом». Про уникальные «возможности» микробиоты кишечника написано немало научных и научно-популярных статей: установлено ее влияние (или как минимум ассоциативное взаимодействие) на формирование иммунитета [1], [2] и мозговую деятельность [3], [4], а также возможное участие в возникновении целого ряда заболеваний, на первый взгляд никак не связанных с ЖКТ (сердечно-сосудистые заболевания [5], диабет 2 типа [6], [7] ревматоидный артрит [8], [9], ожирение [10], [11], колоректальный рак [12], [13], болезнь Паркинсона [14], болезнь Альцгеймера [15] и другие).
Опубликовано более 480 тысяч статей в научных журналах, и их число постоянно растет. Ведущие журналы, такие как Nature и Science, издали специальные выпуски, посвященные изучению человеческого микробиома, его взаимодействию с внутренними органами и влиянию на здоровье человека. Сегодня известно, что кишечная микрофлора синтезирует необходимые для нормального метаболизма жирные кислоты (в основном, это ацетат, бутират и пропионат), витамины группы В и витамин К, некоторые незаменимые аминокислоты, поддерживает водно-солевой баланс, создает защитный барьер от болезнетворных микробов и т.д. [2]. Очевидно, что без микробиоты человеческий организм долго не проживет, однако ответ на главный вопрос — как, воздействуя на микробиоту, вылечить определенные заболевания либо диагностировать их на очень ранней стадии? — мы постараемся дать в этой статье.
Какие факторы влияют на состав кишечной микробиоты?
Микробиота кишечника (мы будем говорить здесь именно о ней, как о наиболее хорошо и подробно изученной части микробиома) как часть организма постоянно подвергается воздействию множества внешних и внутренних факторов — ее состав, соотношение компонентов и, возможно, функции могут изменяться. Какие же факторы можно отнести к тем, что существенно меняют наш микробиом?
- Прием антибиотиков (АБ) — широко распространенный пример внешнего воздействия. АБ уничтожают болезнетворные микробы, но, параллельно, существенно угнетают рост и развитие комменсальных (извлекающих пользу из сожительства с другим организмом, не причиняя ему вреда) бактерий кишечника. На «Биомолекуле» опубликована статья, в которой описывается воздействие длительной антибактериальной терапии на состав и разнообразие бактерий, а также рассказывается о возможности модулирования микробиоты с помощью пре- и пробиотиков [16].
- Несбалансированное питание. Как правило, это результат отсутствия контроля за своим питанием (потребление фастфуда, газированных напитков, высококалорийной пищи с избытком углеводов и жиров и т.д.). Но это может быть и продолжительная монодиета (преобладание какого-то одного типа источника энергии: белков, жиров или углеводов в потребляемой пище). В статье «Чего от нас хотят микробы?» [17] приведен пример скорости изменения состава микробиоты при монодиете.
- Стрессы, гормональный сбой, аллергические реакции, различные заболевания, отравления также могут серьезно изменять структуру микробиома.
Получается, что современный уровень жизни, особенно в крупных городах, и все вышеперечисленные факторы по отдельности или в совокупности способствуют нарушению баланса микробиоты. В статье «Зоопарк в моем животе» [16] рассказывалось о влиянии структуры питания и даже региона проживания на качественный и количественный состав микробиома.
Изменения видового состава бактерий кишечника могут быть опасны
Выше мы упоминали о тесной взаимосвязи между дисбалансом кишечной микробиоты и развитием различных заболеваний, поэтому неудивительно, что в настоящее время во всем мире происходит серьезный рост заболеваний ЖКТ (до 1,3% всего взрослого населения) [18], и особенно таких, как болезнь Крона, язвенный и некротизирующий колиты, антибиотикоассоциированная диарея и т.д. Особое внимание хотелось бы уделить антибиотикоассоциированной диарее или диарее, связанной с бактериями рода Clostridium (CDI от англ. Clostridium difficile infection). Бактерии Clostridium difficile (рис. 1) могут бессимптомно присутствовать в кишечнике 4–13% населения, подавляемые здоровой микробиотой, дожидаясь своего «звездного часа» [19], однако именно они являются главной причиной инфекционной диареи, приобретенной в больнице [20].
Рисунок 1. Бактерия Clostridium difficile.
сайт bionews-tx.com
Известны основные факторы риска развития антибиотикоассоциированной диареи: длительное нахождение на стационарном лечении, возраст старше 65 лет, проведение процедуры гемодиализа, анемия, хирургическое лечение, применение антибиотиков, ингибиторов протонной помпы и некоторых других препаратов более 5 дней [21], [22]. Поэтому, к сожалению, жертвами CDI могут стать люди любого возраста, пола и социального положения. Болезнь сопровождается учащенным стулом (до 20 раз в сутки с примесью слизи и крови) и ноющими болями в области толстой кишки и без адекватной терапии может стать причиной летального исхода (в США в год от CDI умирает до 29 тысяч человек) [23]. Лечение заключается в приеме сильнодействующих антибиотиков, типа ванкомицина, преднизолона, метронидазола и т.д., которые уничтожают Clostridium difficile, однако в 25–30% случаев происходит рецидив заболевания, после которого с вероятностью 40–60% возможен и третий эпизод, и т.д. Во-первых, это связано со способностью C. difficile образовывать споры и продолжительное время оставаться в организме в латентном состоянии [19]. Во-вторых, увеличение заболеваемости CDI ученые в значительной степени объясняют появлением устойчивого к фторхинолонам и более вирулентного штамма BI/NAP1/027, а также пластичностью генома C. difficile, несущего множество механизмов адаптации к изменениям окружающей среды, что создает реальную угрозу возникновения еще более вирулентного штамма [24].
Казнить нельзя помиловать?
Может показаться странным, что в эру антибиотиков диарея, вызванная бактериями, считается одним из наиболее распространенных и опасных заболеваний ЖКТ, ведь мы ожидали финальной борьбы и сокрушительной победы антибиотиков-защитников над армией бактерий. Но, как сказал знаменитый опоссум Пого из американского комикса: «...враг — это мы сами»! Поскольку мы продолжаем злоупотреблять антибиотиками (причем достаточно мощными) для лечения даже самых слабых инфекций верхних дыхательных путей и мочеполовой системы, постоянно мутирующие бактерии становятся устойчивыми к этим антибиотикам [23]. Именно резистентность Clostridium difficile к антибиотикам поставила под сомнение возможность излечения для 30% пациентов, у которых происходили постоянные рецидивы заболевания без надежды на облегчение состояния здоровья [19]!
И вдруг в 2003 году ученые заговорили об экспериментальном лечении CDI с помощью фекотрансплантации.
Фекотрансплантация (fecal microbiota transplantation — фекальная трансплантация микробиоты, ФТМ) — процедура восстановления нормальной микрофлоры кишечника после трансплантации кала от здорового донора реципиенту. Практика показала, что возможности искусственного модулирования состава микробиоты ограничены четырьмя способами: приемом пробиотиков, пребиотиков, симбиотиков и фекотрансплантацией (наиболее радикальным и самый действенным способом).
Методику «улучшения» микрофлоры кишечника с помощью фекалий применяли еще в IV веке в Древнем Китае. В первом китайском справочнике по неотложной медицине «Чжоу хоу бэй цзи фан» («Удобная терапия для чрезвычайных ситуаций») сообщалось о пероральном использовании даосским ученым Гэ Хуном суспензии человеческих фекалий при тяжелых отравлениях и диарее: «Это дало настолько положительные результаты, что считалось медицинским чудом, которое заставило пациентов вернуться с того света» [25]. В Европе первые упоминания о фекотрансплатации связаны с итальянским анатомом Фабрицио из Аквапенденте, который в XVII веке впервые применил ФТМ в ветеринарии [26].
Современный этап развития метода фекотрансплантации начался в 1958 году, когда Б. Айсман (B. Eiseman) с коллегами опубликовал статью об успешном лечении псевдомембранозного колита с помощью клизмы с донорским калом [27]. Значительно позже, в 2003 году, началась новая эра фекотрансплантации [28], и с тех пор провели более 5000 успешных процедур, показавших высокую эффективность метода.
Наибольшую клиническую практику метод ФТМ получил при лечении антибиотикоассоциированной диареи и воспалительных заболеваниях кишечника (ВЗК), в том числе болезни Крона, язвенном колите, синдроме раздраженного кишечника [29], [30].
В мировой клинической практике рецидивирующие CDI, когда стандартная терапия антибиотиками не приносит существенного облегчения в течение 48 часов, служат объективными показаниями к применению ФТМ.
Процедуру фекотрансплантации можно разбить на несколько этапов (рис 2):
- Подбор донора (это может быть биоматериал от близких родственников либо образцы из специального банка) и его всестороннее обследование на наличие заболеваний (ВИЧ, сифилиса, вирусных гепатитов, аллергии, диабета, метаболического синдрома и т.д.) и вредных привычек, причем татуировки должны быть сделаны не позднее, чем за 3 месяца до донорства, прием антибиотиков произведен не позднее, чем за 6 месяцев, и т.д. [31].
- Оценка состояния здоровья реципиента. В мировой клинической практике пока что нет утвержденных протоколов по скринингу реципиентов перед процедурой ФТМ. Однако в литературе описывается минимальный набор тестов, необходимых для выявления статуса здоровья реципиента (наличие сопутствующих заболеваний, общее снижение иммунитета) как фактора, способного снизить риск осложнений после процедуры ФТМ [31].
- Подготовка трансплантата к введению реципиенту (гомогенизация, фильтрование, разведение физраствором, замораживание и т.д.)
- Введение трансплантата (перорально, с использованием клизмы или эндоскопа).
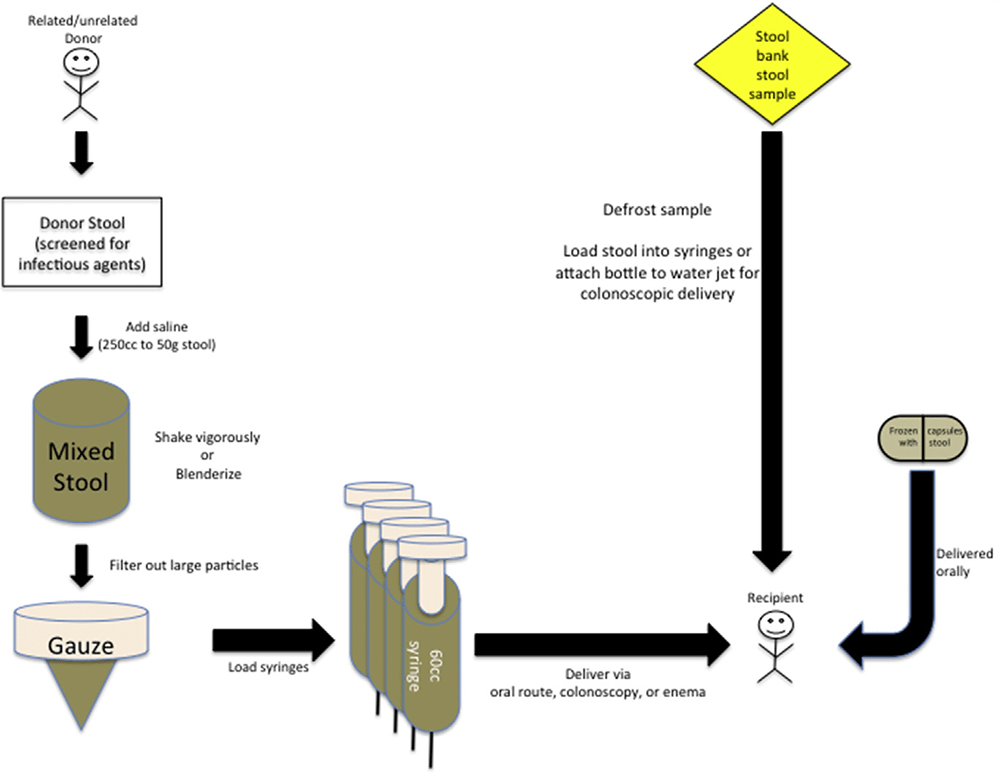
Рисунок 2. Этапы проведения фекотрансплантации.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Лучше всего (>90% излечения при CDI) зарекомендовал себя колоноскопический способ введения трансплантата, хотя и он не лишен недостатков: возможные аллергические реакции на обезболивающие препараты, перфорация толстой кишки, дискомфорт после процедуры, дороговизна [32]. Пероральный способ введения оказался успешным примерно в 75% случаев, через клизму — практически не применяется [32], [33].
Процедура ФТМ считается успешной, а пациент вылечен, если наблюдается ремиссия CDI в течение 90 дней после пересадки кала (рис. 3) [34]. Однако у 90% пациентов облегчение симптомов заболевания отмечали уже в течение первых суток после ФТМ. Наблюдение за микробиотой реципиентов в течение последующих месяцев установило увеличение разнообразия микробиома, восстановление нормальной микрофлоры кишечника, подавление развития и роста C. difficile и продуцирования ее токсинов (рис. 4) [32] и т.д. Подобную картину наблюдали и при лечении язвенного колита (70-процентное излечение с последующей ремиссией при ранее безуспешной терапии противовоспалительными и иммуносупрессивными препаратами) [35], [36], при болезни Крона [37] и некоторых других.
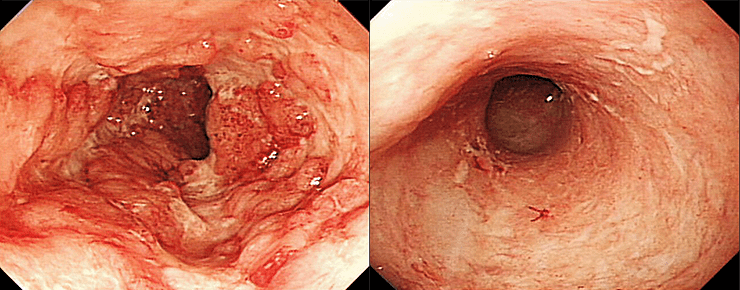
Рисунок 3. Результаты колоноскопии до и после ФТМ. Слева: до ФТМ, во время постановки диагноза. Справа: спустя 10 месяцев после ФТМ.
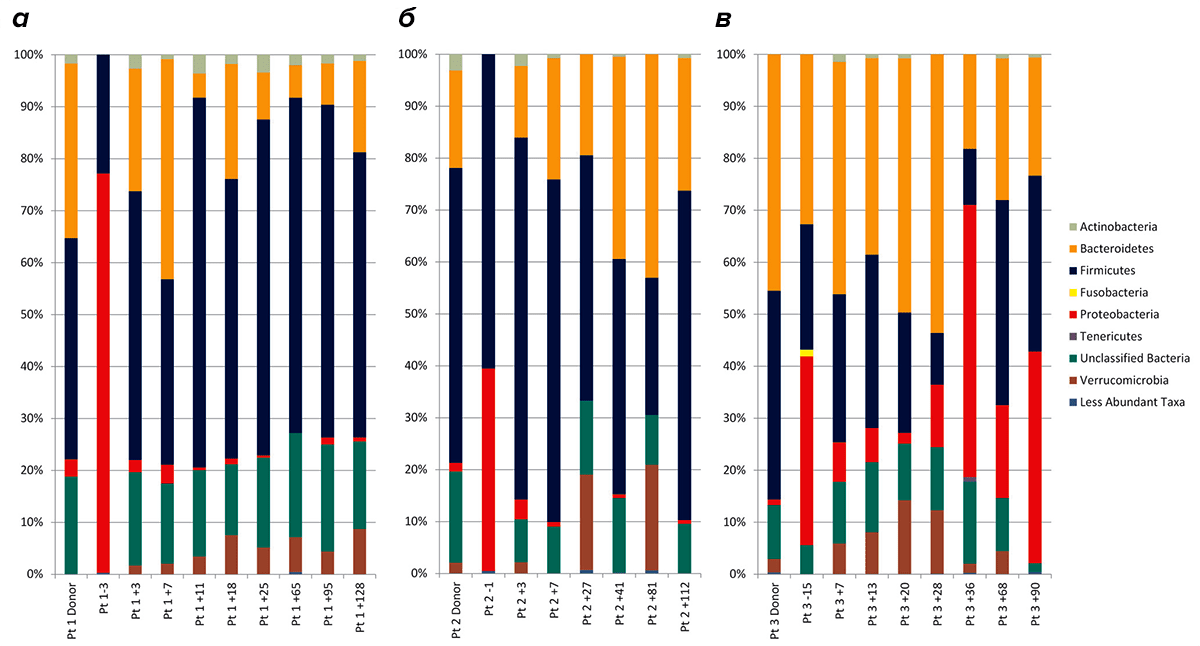
Рисунок 4. Изменение состава микробиоты 3-х реципиентов после ФТМ. а—в — Реципиенты 1–3. Первый столбец каждой диаграммы показывает состав микробиоты донора. Второй столбец — состав микробиоты реципиента до проведения процедуры (за 3, 1 и 15 дней соответственно). Остальные столбцы показывают изменение состава микробиоты реципиента в течение 4-х месяцев после проведения ФТМ. Пример: Pt2+3 — пациент 2 через три дня после ФТМ. Условные обозначения: Pt — пациент.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Диета или ФТМ?
Впечатляющими оказались и результаты по изучению влияния ФТМ на ожирение в зависимости от типа донора (нормального телосложения или с ожирением). Поскольку проблема ожирения признана одной из главных глобальных проблем XXI века, использование процедуры фекотрансплантации в качестве той самой «золотой пилюли», приняв которую можно похудеть без диет и физических упражнений, было бы идеальным вариантом. Например, исследования, проведенные на безмикробной (гнотобионтной) мышиной модели, показали, что при использовании мышей с ожирением в качестве доноров и переносе их стула к мышам без микробиоты у последних наблюдалась тенденция к ожирению по сравнению с контрольными животными [38], [39]. У небольшой выборки людей с диагнозом «ожирение» при пересадке им стула доноров нормального телосложения, улучшались показатели по чувствительности к инсулину (который часто выступает в качестве одной из причин ожирения), увеличивалось разнообразие микробиоты и количество бутират-продуцирующих бактерий (бутират — важнейший энергетический субстрат для колоноцитов, эпителиальных клеток, выстилающих толстую кишку и обеспечивающих ее гомеостаз) [40]. Эти результаты необходимо обязательно учитывать при подборе донора, чтобы не привнести реципиенту отрицательные побочные эффекты вместе с трансплантатом.
Как поделиться своим микробиомом с другими?
Вообще, потенциал применения ФТМ огромен, проводят научные и клинические исследования воздействия микробиоты на различные заболевания: описывают единичные положительные результаты при аутизме [41], болезни Паркинсона [42], рассеянном склерозе [43]. Уже достаточно широко используют в клинической практике лечения синдрома раздраженного кишечника, атопического дерматита, панкреатита, метаболического синдрома.
По примеру банков спермы созданы банки доноров фекальных образцов. Первый такой банк организован в 2012 году выпускниками Массачусетского технологического института (США) — некоммерческая организация OpenBiom, где каждый, пройдя некоторые формальности, может стать донором для ФТМ и спасти чью-то жизнь. В свою очередь организация берет на себя функции по клиническому исследованию, подготовке и отправке материала для больниц и госпиталей. В 2016 году подобный банк появился в Нидерландах при Лейденском университете [44].
Тем не менее для включения метода фекотрансплантации в официальные схемы лечения необходимо подготовить регламентированные показатели донорного материала: состав, соотношение микроорганизмов и т.д., поскольку применение «естественного продукта» связано с определенными рисками — необходимо тщательно проверять каждую порцию трансплантата на инфекции, наличие паразитов, устанавливать карантинные интервалы перед использованием, причем часто ученые и врачи вынуждены просто доверять донорам на слово. Диагностика кала является одной из самых затратных частей процедуры, которая все равно не гарантирует 100% защиту от нежелательных последствий. Поэтому создание «искусственного кала», причем желательно пациент-ориентированного, было задачей, лежащей на поверхности.
Высказывали соображения о существовании «супердоноров», трансплантаты которых обеспечивают наибольший процент положительных фекотрансплантаций. Проводили исследования по определению оптимального состава микробиоты у «супердоноров», однако никаких существенных различий в составе, соотношении или метаболоме между обычными донорами и «супердонорами» не обнаружили [45], [46]. Рассматривали также вариант составления комбинированного препарата разных доноров для создания «стандартизированного трансплантационного материала» либо «универсального донора»: с высокой степенью разнообразия кишечной микробиоты, достаточно высокими уровнями производства бутирата и сбалансированным соотношением Bacteroidetes и Firmicutes.
В 2017 году частная микробиологическая инжиниринговая компания Finch Therapeutics, основанная микробиологами OpenBiome и Takeda Pharmaceutical Company Limited анонсировали глобальное соглашение о коллаборации по совместной разработке первого синтетического биотерапевтического продукта FIN-524, состоящего из коллекции бактериальных штаммов, связанных с благоприятными клиническими исходами при ФТМ [47]. Сейчас препарат проходит клинические испытания. Все более ранние работы по использованию «искусственного кала» имели неоднозначные отзывы.
«Темная материя» микробиома
И вот вроде бы все понятно: методика работает, в качестве «волшебной пилюли» используют фекалии здоровых доноров, микробиота которых заселяет кишечник реципиента и подавляет рост и развитие патогенных бактерий (Clostirdium difficile и др.), в ближайшем будущем создадут синтетический продукт для фекотрансплантации с идеально подобранным составом и соотношением микроорганизмов... Но в 2016 году выходит публикация по опыту проведения фекотрансплантации не естественными фекалиями, а их фильтратом (стерильно отфильтрованным для удаления всех живых бактерий и мелких частиц) [48]. Выяснилось, что у пациентов с диагнозом CDI, находящихся под наблюдением за 6 месяцев до и 33 месяца после процедуры модифицированной ФТМ, полностью произошло излечение от CDI, а состав микробиоты пациентов оказался схож с донорским.
Эти результаты открыли новое направление поиска лечебного компонента, так как стало понятно, что не собственно бактерии, а что-то другое вызывает такой впечатляющий терапевтический эффект! Протеомный анализ (анализ белков и пептидов) фильтрата не выявил очевидных белков-кандидатов, связанных с терапевтической эффективностью процедуры ФТМ, а вот анализ вирусоподобных частиц обнаружил сложный комплекс из бактериофагов. Авторы сделали вывод, что не сама фекальная микробиота, а стерильные фильтраты донорского стула (бактериальные компоненты, метаболиты или бактериофаги) обладают терапевтической активностью и способны уменьшать симптомы и излечивать CDI, что особенно важно для пациентов с ослабленным иммунитетом.
В том же году возник вопрос о переносе бактериальных вирусов от донора к реципиенту в процессе ФТМ. В длительном исследовании микробиоты после ФТМ (более 42 месяцев) обнаружили достаточно крупные сообщества фагов (около 10 типов на образец), причем количество их было примерно одинаково как у доноров, так и у вылеченных пациентов [49]. Исследования виромов (вирусной составляющей микробиома кишечника, то есть совокупности бактериофагов и вирусов эукариот) кишечника здоровых людей показали их невероятное разнообразие и существенные отличия от человека к человеку [50], [51]. После проведения процедуры ФТМ оказалось, что несмотря на перенос донорского вирома реципиенту, их виромы остались существенно различными (но не полностью) [49].
О чем это может говорить? Поскольку исследования вирусной составляющей микробиома только начинаются, все заключения в достаточной степени умозрительны. Известно, что бактериофаги в кишечнике здорового человека, в основном, представлены ДНКовыми фагами Caudovirales или Microviridae [52], [53], которые латентно заражают бактерию-хозяина и в профаговом состоянии вместе с ДНК передаются дочерним клеткам. Резкое изменение бактериального баланса (прием антибиотиков, изменения в питании, стресс и т.д.) «переключает» лизогенный путь на литический с образованием огромного количества фаговых частиц, с лизисом бактерий, каскадом провоспалительных реакций и формированием воспалительного процесса [54], [55]. Фаги в большинстве своем очень специфичны и заражают обычно только один вид или штамм бактерий. Возможно, именно из-за совпадения микробиома донора и вирома реципиента первые попытки лечения болезни Крона посредством ФТМ были не совсем успешны (рис. 5) [56]. Кроме того, на модельных животных показали возможность изменения кишечной биологии и процесса воспаления вирусами эукариот [57]. Что здесь первично — бактериальные изменения микробиома при ВЗК или изменения в составе и количестве бактериофагов (поступающих с пищей, из окружающей среды, при контактах), вызывающих дисбаланс микробиома? Ясно одно, что исследования вирома и микробиома при фекотрансплантации должны проводиться параллельно для повышения специфичности процедуры ФТМ и расширения знаний о ее механизмах действия.
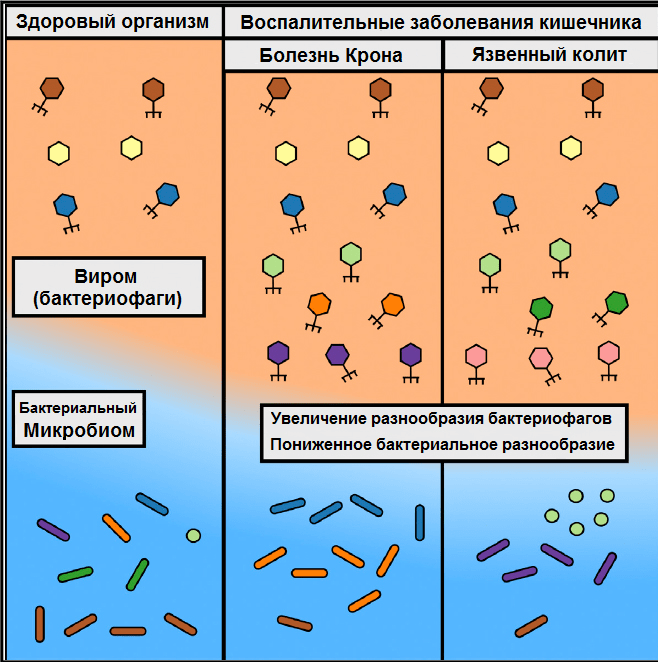
Рисунок 5. Схематическое изображение виромов здорового человека и с ВЗК.
В заключении хотелось бы сказать следующее: конечно, получилось осветить только малую часть такого масштабного вопроса, как фекальная трансплантация микробиоты. Возможно, кто-то скажет: «Ну уж нет, этим я лечиться никогда не буду, хватит увлечения уринотерапией в 90-е годы прошлого столетия!» Однако врачи, которые проводят процедуру и видят облегчение состояния пациента буквально в течение первых же суток, отвечают практически хором: «Какая разница, чем пахнет? Важно, что это лечит. А не это ли главное в нашей профессии?!»
Литература
- Naeun Lee, Wan-Uk Kim. (2017). Microbiota in T-cell homeostasis and inflammatory diseases. Exp Mol Med. 49, e340;
- Микробиом кишечника: мир внутри нас;
- Kiran V. Sandhu, Eoin Sherwin, Harriët Schellekens, Catherine Stanton, Timothy G. Dinan, John F. Cryan. (2017). Feeding the microbiota-gut-brain axis: diet, microbiome, and neuropsychiatry. Translational Research. 179, 223-244;
- Hartmut Wekerle. (2016). The gut–brain connection: triggering of brain autoimmune disease by commensal gut bacteria. Rheumatology. 55, ii68-ii75;
- W.H. Wilson Tang, Takeshi Kitai, Stanley L. Hazen. (2017). Gut Microbiota in Cardiovascular Health and Disease. Circ Res. 120, 1183-1196;
- Herbert Tilg, Alexander R Moschen. (2014). Microbiota and diabetes: an evolving relationship. Gut. 63, 1513-1521;
- Lan Lin, Jianqiong Zhang. (2017). Role of intestinal microbiota and metabolites on gut homeostasis and human diseases. BMC Immunol. 18;
- Y. Kang, Y. Cai, X. Zhang, X. Kong, J. Su. (2017). Altered gut microbiota in RA: implications for treatment. Z Rheumatol. 76, 451-457;
- Andrea Picchianti Diamanti, M. Manuela Rosado, Bruno Laganà, Raffaele D’Amelio. (2016). Microbiota and chronic inflammatory arthritis: an interwoven link. J Transl Med. 14;
- Stephan C. Bischoff, Yves Boirie, Tommy Cederholm, Michael Chourdakis, Cristina Cuerda, et. al.. (2017). Towards a multidisciplinary approach to understand and manage obesity and related diseases. Clinical Nutrition. 36, 917-938;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Márcia H. Fukugaiti, Aline Ignacio, Miriam R. Fernandes, Ulysses Ribeiro Júnior, Viviane Nakano, Mario J. Avila-Campos. (2015). High occurrence of Fusobacterium nucleatum and Clostridium difficile in the intestinal microbiota of colorectal carcinoma patients. Braz. J. Microbiol.. 46, 1135-1140;
- Andrea Leung, Ho Tsoi, Jun Yu. (2015). FusobacteriumandEscherichia: models of colorectal cancer driven by microbiota and the utility of microbiota in colorectal cancer screening. Expert Review of Gastroenterology & Hepatology. 9, 651-657;
- Shivani Ghaisas, Joshua Maher, Anumantha Kanthasamy. (2016). Gut microbiome in health and disease: Linking the microbiome–gut–brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacology & Therapeutics. 158, 52-62;
- Timothy R. Sampson, Justine W. Debelius, Taren Thron, Stefan Janssen, Gauri G. Shastri, et. al.. (2016). Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease. Cell. 167, 1469-1480.e12;
- Зоопарк в моем животе;
- Чего от нас хотят микробы?;
- James M. Dahlhamer, Emily P. Zammitti, Brian W. Ward, Anne G. Wheaton, Janet B. Croft. (2016). Prevalence of Inflammatory Bowel Disease Among Adults Aged ≥18 Years — United States, 2015. MMWR Morb. Mortal. Wkly. Rep.. 65, 1166-1169;
- Malnick S. and Melzer E. (2015). Human microbiome: from the bathroom to the bedside. World J. Gastrointest. Pathophysiol. 6, 79–85;
- Kathleen B. To, Lena M. Napolitano. (2014). Clostridium difficileInfection: Update on Diagnosis, Epidemiology, and Treatment Strategies. Surgical Infections. 15, 490-502;
- Sahil Khanna, Laura E. Raffals. (2017). The Microbiome in Crohn's Disease. Gastroenterology Clinics of North America. 46, 481-492;
- Ярушина Я.Н., Колотова Г.Б., Руднов В.А., Багин В.А. (2017). Clostridium difficile-ассоциированная болезнь у пациентов многопрофильного стационара и факторы риска ее развития. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 27, 20–28;
- Sahil Khanna, Yoshiki Vazquez-Baeza, Antonio González, Sophie Weiss, Bradley Schmidt, et. al.. (2017). Changes in microbial ecology after fecal microbiota transplantation for recurrent C. difficile infection affected by underlying inflammatory bowel disease. Microbiome. 5;
- F. C. Lessa, C. V. Gould, L. C. McDonald. (2012). Current Status of Clostridium difficile Infection Epidemiology. Clinical Infectious Diseases. 55, S65-S70;
- Faming Zhang, Wensheng Luo, Yan Shi, Zhining Fan, Guozhong Ji. (2012). Should We Standardize the 1,700-Year-Old Fecal Microbiota Transplantation?. Am J Gastroenterol. 107, 1755-1755;
- Thomas J Borody, Eloise F Warren, Sharyn M Leis, Rosa Surace, Ori Ashman, Steven Siarakas. (2004). Bacteriotherapy Using Fecal Flora. Journal of Clinical Gastroenterology. 38, 475-483;
- Eiseman B., Silen W., Bascom G.S., Kauvar A.J. (1958). Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 44, 854–859;
- Johannes Aas, Charles E. Gessert, Johan S. Bakken. (2003). RecurrentClostridium difficileColitis: Case Series Involving 18 Patients Treated with Donor Stool Administered via a Nasogastric Tube. CLIN INFECT DIS. 36, 580-585;
- Aamer Imdad, Maribeth R Nicholson, Emily E Tanner-Smith, Joseph P Zackular, Oscar Gomez-Duarte, et. al.. (2017). Fecal transplantation for treatment of inflammatory bowel disease. Unknown journal title.;
- J. L. Anderson, R. J. Edney, K. Whelan. (2012). Systematic review: faecal microbiota transplantation in the management of inflammatory bowel disease. Aliment Pharmacol Ther. 36, 503-516;
- Stephen M. Vindigni, Christina M. Surawicz. (2017). Fecal Microbiota Transplantation. Gastroenterology Clinics of North America. 46, 171-185;
- Matthew J. Hamilton, Alexa R. Weingarden, Tatsuya Unno, Alexander Khoruts, Michael J. Sadowsky. (2013). High-throughput DNA sequence analysis reveals stable engraftment of gut microbiota following transplantation of previously frozen fecal bacteria. Gut Microbes. 4, 125-135;
- Zain Kassam, Christine H Lee, Yuhong Yuan, Richard H Hunt. (2013). Fecal Microbiota Transplantation for Clostridium difficile Infection: Systematic Review and Meta-Analysis. Am J Gastroenterol. 108, 500-508;
- Lawrence J Brandt, Olga C Aroniadis, Mark Mellow, Amy Kanatzar, Colleen Kelly, et. al.. (2012). Long-Term Follow-Up of Colonoscopic Fecal Microbiota Transplant for Recurrent Clostridium difficile Infection. Am J Gastroenterol. 107, 1079-1087;
- Ahmet Uygun, Kadir Ozturk, Hakan Demirci, Cem Oger, Ismail Yasar Avci, et. al.. (2017). Fecal microbiota transplantation is a rescue treatment modality for refractory ulcerative colitis. Medicine. 96, e6479;
- Julian Panés, Ignacio Alfaro. (2017). New treatment strategies for ulcerative colitis. Expert Review of Clinical Immunology. 13, 963-973;
- Seon Ho Bak, Hyun Ho Choi, Jinhee Lee, Mi Hee Kim, Youn Hee Lee, et. al.. (2017). Fecal microbiota transplantation for refractory Crohn's disease. Intest Res. 15, 244;
- Новые функции кишечной микрофлоры;
- Peter J. Turnbaugh, Ruth E. Ley, Michael A. Mahowald, Vincent Magrini, Elaine R. Mardis, Jeffrey I. Gordon. (2006). An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 444, 1027-131;
- Dallas R. Donohoe, Nikhil Garge, Xinxin Zhang, Wei Sun, Thomas M. O'Connell, et. al.. (2011). The Microbiome and Butyrate Regulate Energy Metabolism and Autophagy in the Mammalian Colon. Cell Metabolism. 13, 517-526;
- Stephen M. Collins, Premsyl Bercik. (2009). The Relationship Between Intestinal Microbiota and the Central Nervous System in Normal Gastrointestinal Function and Disease. Gastroenterology. 136, 2003-2014;
- Ananthaswamy A. (2011). Faecal transplant eases symptoms of Parkinson’s. New Scientist;
- Borody T., Leis S., Campbell J. et al. (2011). Fecal microbiota transplantation (FMT) in multiple sclerosis (MS). Am. J. Gastroenterol. 106, S352;
- Nederlands eerste feces-transplantatiebank geopend in het LUMC. (2016). Leiden University Medical Center;
- Danielle Barnes, K. T. Park. (2017). Donor Considerations in Fecal Microbiota Transplantation. Curr Gastroenterol Rep. 19;
- Shrish Budree, Wing Fei Wong, Emilee Tu, Sanjay Rao, Jessica R. Allegretti, et. al.. (2017). Do Specific Bacteria Drive Clinical Cure in Fecal Microbiota Transplantation for Clostridium Difficile Infection?: Clinical, Microbial and Metabolomic Characterization of Universal FMT Donors. Gastroenterology. 152, S349;
- Finch Therapeutics and Takeda announce global collaboration to develop microbiome therapeutics in inflammatory bowel disease (IBD). (2017). Takeda;
- Stephan J. Ott, Georg H. Waetzig, Ateequr Rehman, Jacqueline Moltzau-Anderson, Richa Bharti, et. al.. (2017). Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152, 799-811.e7;
- Felix Broecker, Jochen Klumpp, Karin Moelling. (2016). Long-term microbiota and virome in a Zürich patient after fecal transplantation againstClostridium difficileinfection. Ann. N.Y. Acad. Sci.. 1372, 29-41;
- S. Minot, R. Sinha, J. Chen, H. Li, S. A. Keilbaugh, et. al.. (2011). The human gut virome: Inter-individual variation and dynamic response to diet. Genome Research. 21, 1616-1625;
- Alejandro Reyes, Matthew Haynes, Nicole Hanson, Florent E. Angly, Andrew C. Heath, et. al.. (2010). Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466, 334-338;
- Alison S Waller, Takuji Yamada, David M Kristensen, Jens Roat Kultima, Shinichi Sunagawa, et. al.. (2014). Classification and quantification of bacteriophage taxa in human gut metagenomes. ISME J. 8, 1391-1402;
- S. Minot, A. Bryson, C. Chehoud, G. D. Wu, J. D. Lewis, F. D. Bushman. (2013). Rapid evolution of the human gut virome. Proceedings of the National Academy of Sciences. 110, 12450-12455;
- Markus G. Weinbauer. (2004). Ecology of prokaryotic viruses. FEMS Microbiol Rev. 28, 127-181;
- Marion Dalmasso, Colin Hill, R. Paul Ross. (2014). Exploiting gut bacteriophages for human health. Trends in Microbiology. 22, 399-405;
- Jason M. Norman, Scott A. Handley, Megan T. Baldridge, Lindsay Droit, Catherine Y. Liu, et. al.. (2015). Disease-Specific Alterations in the Enteric Virome in Inflammatory Bowel Disease. Cell. 160, 447-460;
- Marijana Basic, Lydia M. Keubler, Manuela Buettner, Marcel Achard, Gerhard Breves, et. al.. (2014). Norovirus Triggered Microbiota-driven Mucosal Inflammation in Interleukin 10-deficient Mice. Inflammatory Bowel Diseases. 20, 431-443.







