
SciNat за август 2024 #4: одинокие растения, долгоживущие ископаемые зверьки и «темная сторона» голодания
25 августа 2024
SciNat за август 2024 #4: одинокие растения, долгоживущие ископаемые зверьки и «темная сторона» голодания
- 290
- 0
- 0
Одинокие растения. На обложке нового выпуска журнала Nature изображено относительно редкое цветение травянистых растений после необычно влажной весны в засушливых районах Иудейской пустыни в 2015 году. В выпуске этой недели Николас Гросс и его коллеги исследуют разнообразие растений в засушливых ландшафтах и выявляют «синдром одиночества растений». Исследователи собрали более 130 000 измерений признаков среди 301 вида многолетних растений на шести континентах. Ученые обнаружили, что растения в засушливых зонах показывают увеличение разнообразия примерно на 88% по сравнению с видами, обитающими в менее сухой среде. Команда исследователей связывает это с синдромом одиночества — относительная изоляция и суровые условия, в которых живут растения в засушливых зонах, ограничивают возможности для взаимодействия и способствуют формированию уникальных реакций на окружающую среду. — Unforeseen plant phenotypic diversity in a dry and grazed world.
-
Автор
-
Редактор
В четвертом августовском выпуске SciNat вы узнаете о том, как восстановление метаболизма глюкозы в мозге может помочь бороться с Альцгеймером и как работает эндоцитоз в нейронах. Новые исследования проливают свет на механизмы деления клеток при мейозе. Кроме того, ученые выяснили, что маленькие млекопитающие жили и развивались гораздо дольше современных в раннем Юрском периоде. А работа по изучению пользы голодания приоткроет нам риски, которые оно за собой влечет.
Нейробиология
Восстановление метаболизма глюкозы в гиппокампе спасает когнитивные функции при патологиях болезни Альцгеймера
Болезнь Альцгеймера (БА) — нейродегенеративное возрастное заболевание, связанное с возрастом. Оно характеризуется прогрессирующей и необратимой потерей синапсов и нейронных цепей. Основные патофизиологические процессы, способствующие потере синапсов, включая нарушенный протеостаз, накопление неправильно свернутого амилоида и тау-белка, а также микроглиальная дисфункция активно изучаются для открытия новых методов лечения. Однако этим различным патологиям сопутствует устойчивое снижение церебрального метаболизма глюкозы, а недавние протеомные исследования выявили выраженное нарушение астроцитарного и микроглиального метаболизма у пациентов с БА.
В новом исследовании журнала Science была изучена роль нарушений метаболизма глюкозы в прогрессировании заболевания. В работе использовали комбинацию человеческих индуцированных плюрипотентных стволовых клеток, а также мышиные модели. Авторы показали, что активация индоламин-2,3-диоксигеназы 1 (IDO1) либо амилоидными β-, либо тау-олигомерами, двумя известными патологическими белками болезни Альцгеймера, способствует превращению триптофана в кинуренин, который затем подавляет астроцитарный гликолиз, тем самым уменьшая один из основных источников топлива для нейронов. Ингибирование фермента IDO1 спасло синаптическую пластичность in vitro и улучшило когнитивные функции на нескольких моделях грызунов. Нацеливание на метаболические дисфункции является многообещающим способом лечения нейродегенеративных расстройств. — Restoring hippocampal glucose metabolism rescues cognition across Alzheimer’s disease pathologies, «Биомолекула»: «Болезнь Альцгеймера: ген, от которого я без ума».
Актин-спектриновый субмембранный каркас ограничивает эндоцитоз вдоль проксимальных аксонов
Большая часть эндоцитоза в нейронах опосредована сборкой ямок, покрытых белком клатрином (CCP), на плазматической мембране. В нейронах CCP преобладают в теле клетки и дендритах, а также вокруг активной зоны в пресинапсе, отсюда и фокус на этих компартментах как на эндоцитозных местах. Однако существует ограниченное понимание относительно наномасштабной организации или наличия эндоцитоза, опосредованного клатрином, вдоль стержня аксона и в начальном сегменте аксона (AIS), специализированном компартменте, расположенном вдоль проксимальной части аксона. Классически предполагалось, что эндоцитоз вдоль стержня аксона минимален. Это предположение дополнительно подтверждается наличием плотного комплекса спектринов, анкиринов и закрепленных мембранных белков в AIS. Кроме того, спектрины образуют периодический каркас, связывающий актиновые кольца вдоль плазматической мембраны аксона. Недавнее предположение о том, что эндоцитоз в AIS является механизмом поляризованной сортировки белков и морфологической пластичности, зависящей от активности, послужило основанием для повторного изучения наномасштабной архитектуры CCP в AIS и их эндоцитарного поведения.
Ученые использовали комбинацию микроскопии сверхвысокого разрешения и электронной микроскопии для визуализации структурных компонентов AIS с наномасштабным разрешением. В дополнение к периодическому каркасу, спектрины AIS вместе с актином образуют четко определенные круговые зоны исключения, которые исследователи назвали «просветами», которые позволяют CCP образовываться в центре. Генетически манипулируя нейронными культурами либо обрабатывая их препаратами, нацеленными на актин- или спектриновую сетку, ученые обнаружили, что плотная спектриновая сетка ограничивает образование CCP внутри просветов. Эти CCP обладают необычной стабильностью, что приводит к ограниченному эндоцитозу в начальном сегменте аксона покоящихся нейронов. Были проведены эксперименты со сверхвысоким разрешением на живых клетках, чтобы показать: CCP преимущественно стабилизируются вдоль AIS, что согласуется с их ограниченной эндоцитарной активностью. Более того, эти застрявшие CCP могут быть разблокированы, и эндоцитоз в AIS может быть вызван стимуляцией, вызывающей пластичность, с помощью N-метил-d-аспартата (NMDA). Этот триггер эндоцитоза был опосредован полимеризацией разветвленных актиновых «гнезд» вокруг ЦКП в просветах, которые, вероятно, способствуют отделению ЦКП от плазматической мембраны.
Данное наномасштабное исследование показывает, что эндоцитоз в AIS регулируется на двух уровнях: во-первых, плотная спектриновая сетка ограничивает образование CCP внутри кольцевых просветов, где они стабилизируются и долго живут, что приводит к низкой эндоцитарной активности в устойчивом состоянии. Во-вторых, эндоцитоз из этих предварительно сформированных ямок может быть вызван физиологическими сигналами, такими как стимулы NMDA, индуцирующие пластичность. Эти два уровня регуляции объясняют, как эндоцитоз может быть организован в плотном и стабильном каркасе зрелого AIS, допуская при этом его структурную перестройку. Всё это проливает свет на процесс эндоцитоза в нейронах ЦНС. — The actin-spectrin submembrane scaffold restricts endocytosis along proximal axons.
Эмбриология
Механизмы биполяризации веретена в ооцитах человека
Ключевым событием в процессе деления клетки является организация микротрубочек в биполярное веретено. На соответствующем этапе два полюса раздвигают микротрубочки вместе с прикрепленными к ним сестринскими хроматидами, гарантируя, что каждая дочерняя клетка получит правильный набор хромосом. Механика этого процесса относительно хорошо изучена для митоза, который происходит в соматических клетках, но не для мейоза, который приводит к образованию гамет. В новом исследовании журнала Science китайские ученые использовали иммунофлуоресцентную визуализацию для мониторинга биполяризации веретена в человеческих ооцитах, а также идентифицировали некоторые ключевые белки, участвующие в этом процессе.
Исследователи описали процесс биполяризации веретена и выявили различные базовые механизмы в человеческих ооцитах. Минус-концы микротрубочек, содержащих ядро кинетохора, объединяются, образуя несколько малых полюсов. Эти малые полюса способствуют образованию многополярных промежуточных продуктов, что является типичным состоянием при биполяризации веретена. После этого можно окончательно установить биполярность веретена. Белки HAUS6, KIF11 и KIF18A играют существенную роль в физиологическом процессе биполяризации веретена, а мутации в этих генах приводят к нарушению биполяризации веретена, дефектам ооцитов и эмбрионов, а также к женскому бесплодию.
Новые результаты раскрывают подробности данного физиологического процесса в ооцитах человека и проливают свет на отдельные механизмы биполяризации веретена, опосредованной малым полюсом. Эти результаты также способствуют нашему пониманию патологических механизмов у бесплодных пациентов с аномалиями созревания ооцитов, оплодотворения и эмбрионального развития. — Mechanisms of minor pole–mediated spindle bipolarization in human oocytes.
Палеонтология
Находки ископаемых детенышей Юрского периода демонстрируют более длительное развитие у ранних млекопитающих и их более долгую жизнь
Современные группы млекопитающих демонстрируют быстрый рост молодых особей с резким прекращением роста во взрослом возрасте. Понимание того, как это происходит у самых ранних форм млекопитающих (млекопитающие и их ближайшие вымершие родственники) затруднено из-за нехватки ископаемых останков молодых особей.
В новом исследовании Nature ученые сообщают о находках полных образцов молодых и взрослых особей среднеюрского докодонта Крусатодона. Данные находки предоставляют новые анатомические данные и понимание истории жизни ранних дивергирующих форм млекопитающих. Ученые использовали синхротронную рентгеновскую микрокомпьютерную томографию приростов роста цемента в зубах, чтобы предоставить доказательства иного темпа жизни мезозойской формы млекопитающих.
Взрослая найденная особь погибла в возрасте около семи лет, а молодая особь умерла в возрасте от 7 до 24 месяцев на момент смерти и находилась на стадии замены своих молочных зубов на коренные. При анализе с набором данных параметров жизненного цикла современных млекопитающих была установлена относительная последовательность прорезывания коренных зубов у Крусатодона.
Выяснилось, что это развитие было более длительным и являлось частью значительно большей максимальной продолжительности жизни, чем у современных млекопитающих с сопоставимой взрослой массой тела (156 г или меньше). Новые результаты показывают, что ранние дивергирующие формы млекопитающих не имели тех же жизненных циклов, что и современные млекопитающие с небольшим телом. Выходит, что фундаментальный сдвиг к более быстрому росту в течение более короткого жизненного цикла мог произойти у более поздних форм млекопитающих только во время или после средней юры. — Jurassic fossil juvenile reveals prolonged life history in early mammals, «Биомолекула»: «Следствие вели палеонтологи».
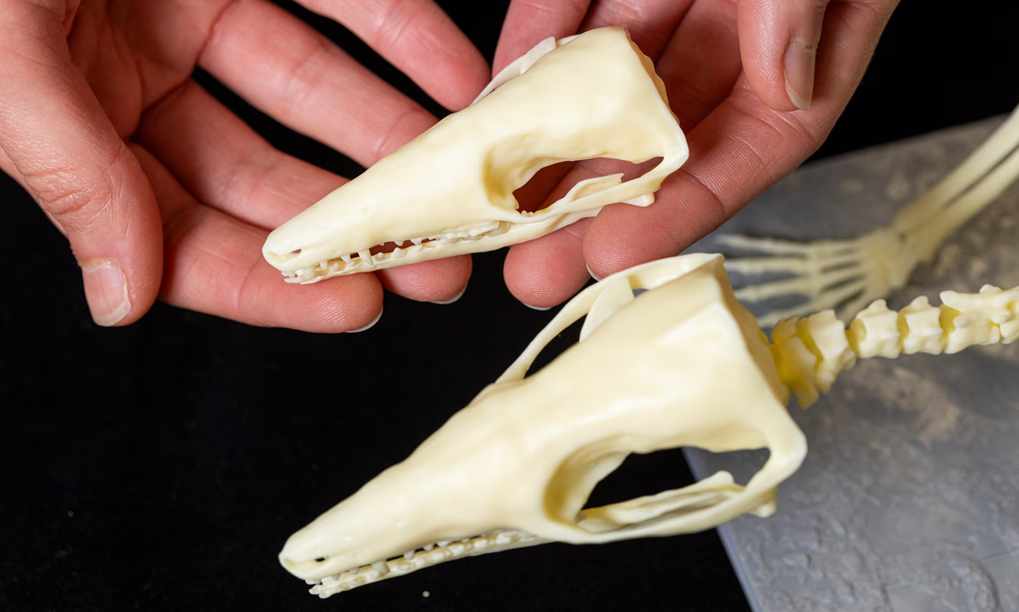
Доктор Эльза Панчироли из Национального музея Шотландии демонстрирует напечатанные на 3D-принтере модели скелетов крусатодона. Фотография: Дункан МакГлинн
Клеточная биология
Удивительная причина восстановительных свойств голодания
Новое исследование на мышах показало, что прекращение голодания приносит больше пользы для здоровья, чем само голодание. После того, как мыши длительное время воздерживались от еды, их стволовые клетки активизировались, чтобы восстановить повреждения в кишечнике, но происходило это только тогда, когда мыши снова принимались за еду, как показало исследование.
Однако такая эта активация стволовых клеток имела свою цену: у мышей была большая вероятность развития предраковых полипов в кишечнике, чем если бы они вообще не голодали. Результаты, опубликованные в журнале Nature 21 августа 2024 года, показывают, что «регенерация не бесплатна», говорит Эммануэль Пассеге, биолог стволовых клеток в Медицинском центре Колумбийского университета Ирвинга в Нью-Йорке, которая не принимала участия в данном исследовании.
Исследователи изучали потенциальную пользу голодания для здоровья на протяжении десятилетий, и есть доказательства того, что эта практика может помочь отсрочить определенные заболевания и увеличить продолжительность жизни у грызунов. Но основные биологические механизмы, лежащие в основе этой пользы, оставались загадкой.
В 2018 году Омер Йилмаз, биолог, изучающий стволовые клетки в Массачусетском технологическом институте в Кембридже, и его коллеги обнаружили, что, скорее всего, в этом деле замешаны стволовые клетки. Во время голодания стволовые клетки начинают сжигать жиры, а не углеводы в качестве источника энергии, что приводит к повышению их способности восстанавливать повреждения кишечника у мышей.
Йилмаз и его коллеги пытались понять, как и когда голодание приводит к всплеску активности и численности стволовых клеток. В своей последней работе исследователи изучали три группы мышей: животных, которые голодали в течение 24 часов, тех, которым было разрешено «возобновить питание» (возобновить прием пищи в течение 24 часов после 24-часового голодания), и тех, которые могли есть, когда захотят, во время исследования.
Кишечные стволовые клетки размножались быстрее всего у мышей, которым давали еду после голодания. Эти стволовые клетки помогают восстанавливать и регенерировать слизистую оболочку кишечника, отчасти производя большое количество молекул, называемых полиаминами, которые важны для роста и деления клеток.
«Сейчас так много внимания уделяется голоданию и тому, как долго его следует соблюдать, что мы как бы упускаем из виду другую сторону уравнения: что происходит в состоянии рефида?» — говорит Йилмаз.
Тем не менее, кишечные стволовые клетки, благодаря своей способности постоянно делиться, также могут быть источником предраковых клеток. Когда исследователи активировали ген, вызывающий рак, у мышей в период повторного кормления, у таких животных была большая вероятность развития опухолей, чем у тех, кто не голодал.
По словам Нады Калаани, специалиста по раковому метаболизму из Гарвардской медицинской школы в Бостоне, штат Массачусетс, именно эта дополнительная предрасположенность к раку, а не сам процесс рефида, способствует развитию у животных опухолей.
Исследователи всегда должны беспокоиться обо всем, что может вызвать рак, но Вальтер Лонго, биогеронтолог из Университета Южной Калифорнии в Лос-Анджелесе, говорит, что мыши с измененными генами были «практически обречены на рак» и что небольшое повышение риска, обнаруженное в этом исследовании, может не применяться в более широком смысле. Например, он указывает на исследование, опубликованное им в 2015 году, в котором было обнаружено 45%-ное снижение аномального роста клеток и тканей у мышей, которые голодали, по сравнению с животными, которые этого не делали.
Вместо этого Лонго утверждает, что результаты исследования Nature могут помочь определить способы проведения скоординированной клеточной регенерации для восстановления поврежденных тканей, например, у людей с воспалением толстой кишки или болезнью Крона.
Также неясно, применимы ли результаты исследования Nature к людям, и если да, то как. Йилмаз говорит, что он и его коллеги планируют провести клиническое испытание, чтобы выяснить это. Но результаты ясно показывают, что период повторного кормления создает «уязвимое состояние», при котором повреждения ДНК крайне нежелательны. — The surprising cause of fasting’s regenerative powers.







