С полки в лаборатории на полку в аптеке: как биспецифические антитела нашли свой эпитоп в фарминдустрии
18 февраля 2021
С полки в лаборатории на полку в аптеке: как биспецифические антитела нашли свой эпитоп в фарминдустрии
- 350
- 0
- 2
Кажется очевидным, что изобретения, имеющие биомедицинское применение, должны без промедлений попадать в клинику. Однако на практике исследователям необходимо внимательно отнестись к целому ряду формальностей, включая защиту интеллектуальной собственности и поиск индустриального партнера, — ведь это необходимо для успешного внедрения любого изобретения.
Рисунок в полном размере.
иллюстрация Святослава Федина
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Темпы разработки и внедрения новых терапевтических подходов в наше время бьют все рекорды и поражают воображение. При этом не всегда очевидно, каким образом такие изобретения попадают из университетской лаборатории в фарму, а затем — клинику. Мне лично довелось поучаствовать в работе коллектива из Университета Джонса Хопкинса, который смог пройти этот путь со своим изобретением. Работа была посвящена биспецифическим конструктам на основе антител, преодолевающим иммунную устойчивость опухолевых клеток. Сейчас эта разработка находится на второй фазе клинических испытаний против немелкоклеточного рака лёгких, всего спустя два года после публикации основной части доклинических исследований. Очевидно, что успех был во многом предопределён высоким уровнем научных результатов, опубликованных в ряде ведущих мировых научных журналов, включая Nature Communications. Не меньшую роль в этом сыграла своевременная защита интеллектуальной собственности разработки, созданной учёными, а также регистрация коммерческой компании при содействии бизнес-инкубатора университета.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Академия & бизнес» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как раковые клетки прячутся от иммунной системы
Генетическая нестабильность опухолевых клеток приводит к появлению на их поверхности фрагментов белков (неоантигенов), которые распознаются клетками иммунной системы. Однако вследствие той же самой генетической нестабильности опухолевые клетки непрерывно изменяются в направлении развития механизмов устойчивости к контролю со стороны иммунной системы [1]. Одним из таких механизмов является выделение подавляющих иммунный ответ (иммуносупрессорных) веществ-цитокинов, таких как трансформирующий ростовой фактор бета (TGF-β). Он заставляет иммунные Т-клетки синтезировать фактор транскрипции FOXP3, который, в свою очередь, наделяет эти клетки иммуносупрессорными свойствами, что самым неприятным образом ускоряет течение онкологических заболеваний [2], [3].
Преодолеть такое подавление функций иммунной системы опухолевыми клетками можно при помощи моноклональных антител к так называемым иммунным чекпоинтам — особым рецепторам на поверхности T-клеток [4–6]. Ингибирование этих рецепторов смещает равновесие между основными типами T-клеток в сторону проактивных субпопуляций, таких как Th1-клетки, цитотоксические CD8-положительные клетки и T-клетки памяти, одновременно снижая долю регуляторных Т-клеток [7]. Интересно, что за открытие этого феномена была присуждена Нобелевская премия — в 2018 году ее получили Джеймс Эллисон и Тасуку Хондзё [8]. На рынке существует целый ряд моноклональных антител, одобренных для лечения различных видов рака и связывающих различные чекпоинты: CTLA-4 (ипилимумаб), PD-1 (пембролизумаб и ниволумаб), PD-L1 (атезолизумаб, авелумаб, дурвалумаб) [9]. К сожалению, лишь небольшая доля опухолей отвечает на терапию моноклональными антителами к иммунным чекпоинтам [10].
Как биспецифические антитела помогают находить раковые клетки
Компания Insilico, в которой я работаю руководителем отдела биоинформатики, имеет давние и тесные связи с Университетом Джонса Хопкинса и более десяти совместных публикаций с разными коллективами из этого университета. Группа под руководством Атуля Беди, с которой мне довелось поработать, в течение продолжительного времени занимается созданием биспецифических конструктов на основе антител, преодолевающих иммунную устойчивость раковых клеток к терапии ингибиторами иммунных чекпоинтов [11]. Идея очень проста: вероятной причиной развития упомянутой устойчивости является уже знакомый нам TGF-β. Регуляторные Т-клетки сами же его экспрессируют, что приводит к новому витку продукции иммунных чекпоинтов, что, в свою очередь, ещё сильнее увеличивает долю регуляторных Т-клеток. Суммарно всё это ведет к снижению эффективности ингибиторов чекпоинтов: поскольку молекул чекпоинтов становится больше, то для достижения терапевтического эффекта молекул ингибитора требуется также пропорционально больше [12].
Чтобы разорвать этот порочный круг, группа Атуля предложила использовать биспецифические конструкты на основе антител, одновременно связывающие внеклеточный TGF-β и иммунный чекпоинт. Начиная с 2011 года, коллектив разработал целый набор таких «двуглавых» молекул. Роль Insilico и моей команды заключалась в том, чтобы на основе анализа генетических данных и данных генной экспрессии опухолей предсказать конкретные чекпоинты, ингибирование которых совместно со связыванием TGF-β может дать наиболее выраженный эффект. Другой задачей было обнаружение субпопуляции пациентов, для которых такой подход даст максимальный эффект. Экспрессия иммунного чекпоинта PD-L1 происходит как непосредственно в клетках опухоли, так и в Т-клетках внутри опухоли. Мы показали, что запуск дифференцировки Т-клеток в направлении иммуносупрессорного регуляторного фенотипа через иммунный чекпоинт PD-L1 и через продукцию TGF-β — это два независимых, хоть и связанных механизма (рис. 1). Таким образом, мы предположили, что совместное ингибирование PD-L1 и TGF-β может привести к взаимному усилению эффекта, что впоследствии и было подтверждено группой Атуля в экспериментах на иммунодефицитных мышах с трансплантатами нескольких видов опухолей человека [13].
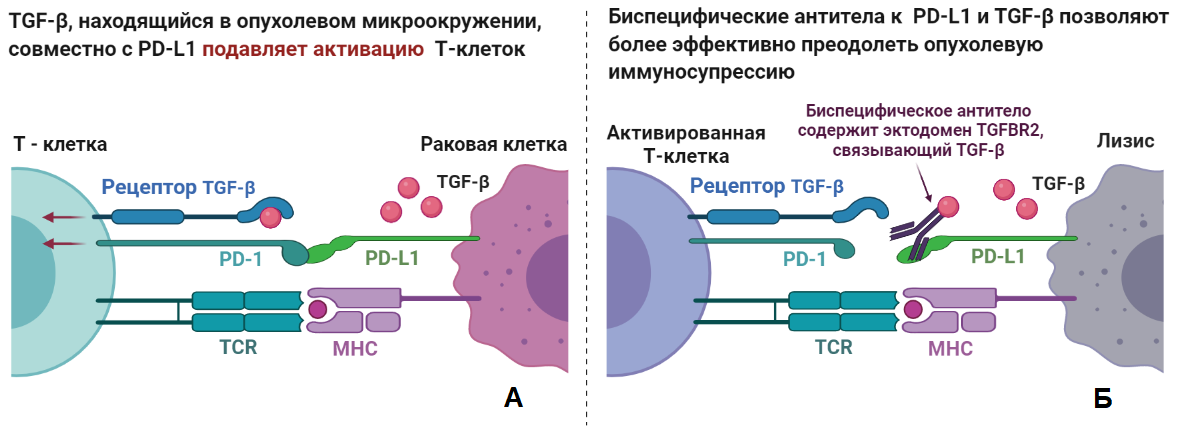
Рисунок 1. Биспецифические антитела в деле. Для активации Т-лимфоциту требуется два сигнала: от главного комплекса гистосовместимости (MHC) с антигеном, рецепцию которого осуществляют специальные Т-клеточные рецепторы (TCR), и от стимулирующих рецепторов, которые экспрессируют антиген-презентирующие клетки (АПК). В их задачи входит тонкая регуляция иммунного ответа, поэтому АПК обладают широким репертуаром как стимулирующих, так и подавляющих активацию Т-клеток рецепторов и их лигандов, в числе которых находится и PD-L1.
(А) Т-клетка узнала антиген раковой клетки, «выставленный» на MHC, однако раковая клетка с помощью PD-L1 имитирует АПК и тем самым подавляет активацию Т-клетки.
(Б) Моноклональные антитела к PD-L1, за которые дали «Нобелевку», позволяют отчасти отключить эти «тормоза», но раковые клетки обзаводятся большим количеством дополнительных способов избежать активации Т-клетки и, как следствие, собственной смерти. Один из таких способов — секреция как раковыми клетками, так и клетками в опухолевом окружении мультифункционального цитокина TGF-β, косвенно подавляющего активацию Т-клеток. Здесь и приходят на помощь разработанные при моём участии биспецифические антитела, позволяющие заблокировать сразу два важных механизма подавления иммунного ответа и существенно усилить терапевтический эффект.
рисунок Виктории Саркисовой
Хорошая публикация — это ещё не всё!
Результаты описанной выше работы были получены в 2017 году и опубликованы в журнале Nature Communications [15]. Несмотря на то, что все ключевые авторы статьи указаны как сотрудники Университета Джонса Хопкинса, за несколько лет до публикации авторы организовали стартап под названием Y-trap при содействии бизнес-инкубатора университета. Такой подход имеет несколько плюсов как для группы учёных, так и для университета. Университет договаривается с основателями компании, на какую долю потенциальной прибыли в будущем он может претендовать, в том числе в случае интереса со стороны крупного бизнеса (фармкомпании) и последующей передачи прав на коммерциализацию разработки. Также учёные получают помощь с формальностями при регистрации компании, рекомендации по развитию бизнеса; часто им предоставляют помещение и — самое главное — в случае заключения каких-либо сделок с потенциальными партнёрами в будущем им не надо тратить время на длительные трёхсторонние переговоры с университетом, поскольку все договоренности с ним уже заключены в момент регистрации компании.
Даже более важным по сравнению с регистрацией компании аспектом является защита интеллектуальной собственности. Учёные из группы Атуля еще в 2011 году первыми подали заявку на патент о применении биспецифических антител для предотвращения иммунной устойчивости раковых клеток (в частности, конструкта против TGF-β/PD-L1). Патентная заявка была подана задолго до регистрации компании и даже до получения основной части результатов, которые впоследствии вошли в статьи и пакет документов о регистрации терапевтического подхода в регулирующих органах. Это очень важно, поскольку именно дата подачи патентной заявки определяет исход потенциального спора о приоритете на изобретение.
Такое внимание к формальностям сыграло нам на руку. Параллельно с командой Y-trap, немецкая компания Merck KGaA (не путать с Merck & Co, Inc — американской компанией) стала активно развивать аналогичный подход и даже намеревалась вступить в партнёрские отношения с GlaxoSmithKline из Великобритании. А в 2017 году — раньше, чем вышла статья команды Y-trap с моим участием, — коллектив из Merck опубликовал работу, в которой говорится об эффективности аналогичных биспецифических PD-L1/TGF-β антител для лечения немелкоклеточного рака легких [14]. Более того, у Merck даже имелся свой собственный патент на использование таких антител. Тем не менее, приоритет на изобретение оказался за Y-trap благодаря более ранней дате публикации патентной заявки.
Одна компания — хорошо, а две — лучше
В 2018 году коллеги из Y-trap связались с Merck и указали на свой приоритет на разработку. Поскольку патентная заявка Атуля и его группы была подана значительно раньше мерковской, в результате переговоров Merck решил выкупить у Y-trap права на её дальнейшую коммерциализацию. При этом более поздняя дата выхода научной публикации Y-trap по сравнению с публикацией Merck никакого значения не имела — всё решил патент. Безусловно, сотрудничество Y-trap и Merck KGaA выгодно обеим сторонам, потому что Merck при этом получил в качестве партнера очень сильную группу учёных из Университета Джонса Хопкинса с огромным опытом исследований, в том числе на моделях иммунодефицитных мышей с трансплантатами нескольких видов опухолей человека. Команда Y-trap же смогла заручиться поддержкой такого гиганта фарминдустрии, как Merck, с его базой для проведения клинических исследований, маркетинга и будущей дистрибуции разрабатываемых на основе биспецифических антител продуктов (рис. 2).
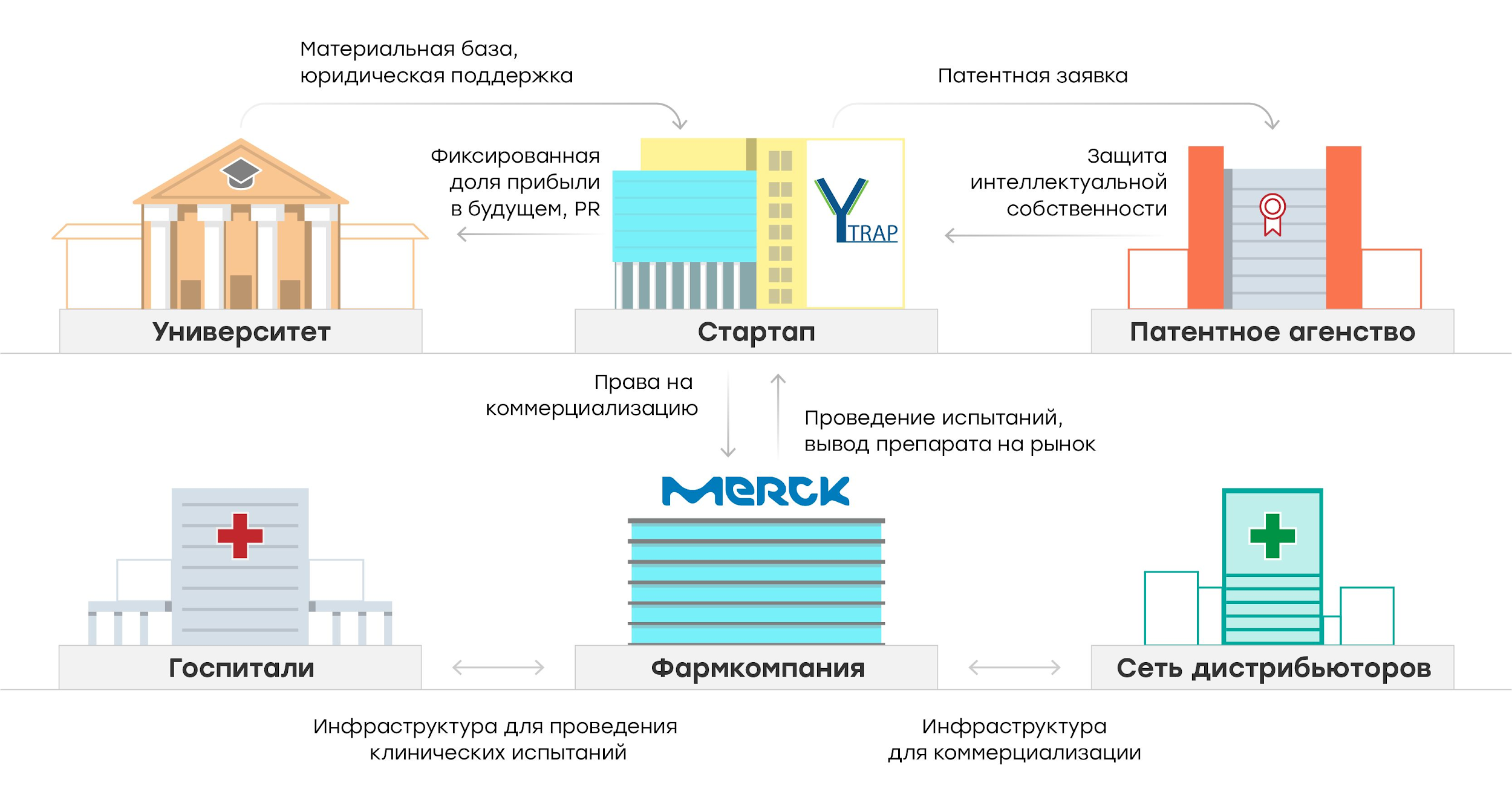
Рисунок 2. Коммерциализация биспецифических антител, разработанных группой из университета Джонса Хопкинса. Учёные провели исследования, зарегистрировали компанию Y-trap и подали заявку на патент в момент получения первых предварительных результатов. На более позднем этапе фармкомпания Merck KGaA, ведущая работу в близкой области, приобрела права на коммерциализацию разработки. Для команды Y-trap такое партнёрство в разы увеличило шансы выйти на рынок, поскольку фармкомпания обладает ресурсами и инфраструктурой как для проведения клинических исследований, так и для дальнейшей дистрибуции разработанного терапевтического подхода.
иллюстрация Елизаветы Екимовой
В 2020 году команда проекта в Merck инициировала вторую фазу клинических испытанийбиспецифических антител PD-L1/TGF-β (в виде монотерапии или комбинации с химиотерапевтическим агентом), которые продолжаются в момент написания этой статьи.
Тем не менее, можно только догадываться, насколько велик был бы соблазн Merck развивать собственную платформу, не оглядываясь на достижения команды Y-trap, если бы у последних не оказалось патента с приоритетной датой. Очень может быть, что в таком случае разработки Y-trap навсегда остались бы на полке, как это часто происходит с результатами работы многих научных коллективов. Наоборот, своевременно запатентованное изобретение, права собственности на которое заранее сознательно переданы отдельной небольшой компании при поддержке университета, позволило коллективу учёных найти партнера с большим опытом проведения клинических испытаний, маркетинга и дистрибуции лекарственных средств, который за короткое время смог запустить клинические исследования терапевтического подхода, разработанного учёными.
Литература
- R. D. Schreiber, L. J. Old, M. J. Smyth. (2011). Cancer Immunoediting: Integrating Immunity's Roles in Cancer Suppression and Promotion. Science. 331, 1565-1570;
- Jason D. Fontenot, Marc A. Gavin, Alexander Y. Rudensky. (2003). Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 4, 330-336;
- Wolf Herman Fridman, Franck Pagès, Catherine Sautès-Fridman, Jérôme Galon. (2012). The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer. 12, 298-306;
- Моноклональные антитела;
- Открытие моноклональных антител;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Drew M. Pardoll. (2012). The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 12, 252-264;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Краткая история открытия и применения антител;
- Michael A. Postow, Jason Chesney, Anna C. Pavlick, Caroline Robert, Kenneth Grossmann, et. al.. (2015). Nivolumab and Ipilimumab versus Ipilimumab in Untreated Melanoma. N Engl J Med. 372, 2006-2017;
- Три поколения лекарств;
- Liang Zhou, Mark M.W. Chong, Dan R. Littman. (2009). Plasticity of CD4+ T Cell Lineage Differentiation. Immunity. 30, 646-655;
- Rajani Ravi, Kimberly A. Noonan, Vui Pham, Rishi Bedi, Alex Zhavoronkov, et. al.. (2018). Bifunctional immune checkpoint-targeted antibody-ligand traps that simultaneously disable TGFβ enhance the efficacy of cancer immunotherapy. Nat Commun. 9;
- Justin M. David, Charli Dominguez, Kristen K. McCampbell, James L. Gulley, Jeffrey Schlom, Claudia Palena. (2017). A novel bifunctional anti-PD-L1/TGF-β Trap fusion protein (M7824) efficiently reverts mesenchymalization of human lung cancer cells. OncoImmunology. 6, e1349589.