Пособие по слежке за GPCR, или как флуоресценция поможет найти новые лекарства
11 ноября 2024
Пособие по слежке за GPCR, или как флуоресценция поможет найти новые лекарства
- 449
- 0
- 4
Краткая схема всей работы.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: G-белоксопряженные рецепторы — важнейшие мишени для фармакологии. Почти двадцать лет назад люди научились получать их пространственные структуры, и с тех пор поиск лекарственных прототипов заметно облегчился. Все становится понятно, когда внутри активного центра в структуре белка сидит заветный лиганд. Но речь в таком подходе идет только про статичные модели. А что если смотреть на работу белков в динамике, прямо в пробирке? О том, как можно это реализовать (а главное — зачем!) пойдет речь в этой статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Мембранные белки играют важную роль в жизни человека и еще большую — в фармакологии: подавляющее число лекарств (40% из всех признанных FDA [2]) взаимодействует с обширным классом рецепторов, сопряженных с G-белками (GPCR); а второе место принадлежит ионным каналам. В этом свете становится ясно, почему человечество так хочет понять принципы работы этих рецепторов и тратит на поиск новых лигандов к ним огромные ресурсы. Мешает этому более сложный процесс работы с мембранными белками (в сравнении растворимыми). Довольно длительное время отдельной и безумно сложной задачей было получить структуру GPCR. Однако в конце нулевых годов был предложен новый метод кристаллизации в липидной кубической фазе, и за структуру β2-адренорецептора Брайан Кобилка и Роберт Лефковиц получили самую престижную научную награду: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [3], [4].
За прошедшие годы наука шагнула далеко вперед, люди научились оптимизировать генетические конструкции, стали понимать больше в кристаллографии, расправила плечи криоэлектронная микроскопия (в 2017 году разработка этого метода также была отмечена Нобелевской премией [5]), что позволило получить достаточно большое количество структур важных и интересных для нас рецепторов, связанных с G-белками [6], [7]. Структуры, в свою очередь, дают понимание, какие молекулы и как могут связываться с рецепторами и вызывать изменение их активности. Именно так и появляются потенциальные лекарства. Однако не всегда есть возможность (да и необходимость) получать структуру, чтобы посмотреть на активацию рецепторов. Иногда достаточно одной флуоресцентной метки, чтобы понять, в каком состоянии рецептор, и какая молекула может вызвать его активацию.
Однако именно знание структуры рецепторов и понимание работы некоторых из них стали основой работы, о котором тут будет рассказано. Такие компетенции как раз есть у Центра Молекулярных Механизмов МФТИ, в котором была выполнена наша работа. На «Биомолекуле» уже была статья про этот Центр, много лет занимающийся структурной биологией GPCR — советуем прочитать для большего понимания [8]. В том числе в этой работе принимал участие Вадим Черезов, соавтор той самой нобелевской статьи о структуре β2-адренорецептора [9].
Рецепторами называют белки, специфически связывающие определенные молекулы (лиганды) с внешней стороны клетки и передающие сигнал вовнутрь, тем самым как бы коммутируя воздействие. GPCR — важнейший класс мембранных рецепторов, содержащие семь трансмембранных α-спиралей. Всего существует шесть подклассов GPCR, отличающихся последовательностями, связываемыми молекулами и функциями. Самый большой класс А — семейство родопсина — по филогенетическим соображениям поделен аж на 19 подклассов [10]. Выходит удивительная ситуация, что главный зрительный белок [11] со вшитым лигандом ретиналем (он же альдегид витамина А) очень похож на почти три сотни белков, разнообразие функций которых простирается от хемотаксиса и передачи болевых ощущений до регуляции кровяного давления и сна.
GPCR, как следует из их названия, передают сигнал на G-белки, которые запускают различные каскады реакций уже внутри клетки. Передача сигнала происходит, в основном, путем конформационных изменений самого рецептора. Например, при связывании лигандов у GPCR класса А зачастую происходит «отгибание» шестой трансмембранной спирали, благодаря чему G-белок может подойти и провзаимодействовать с рецептором (рис. 1). Лигандами GPCR могут быть совершенно разные вещества: светочувствительные соединения, запахи, феромоны, гормоны и нейромедиаторы, по размеру различающиеся от небольших молекул до пептидов.
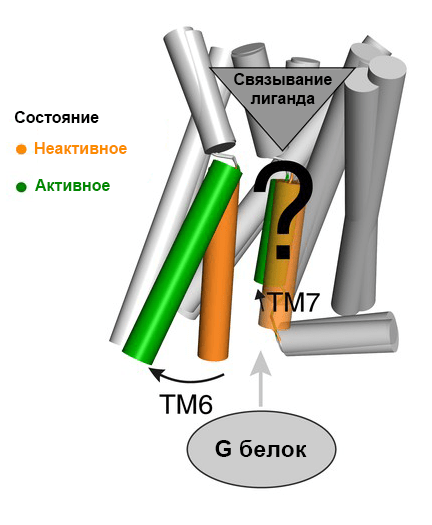
Рисунок 1. Схема активации GPCR класса А. Связывание лиганда с внеклеточной стороны вызывает конформационные изменения в белке — отгибается шестая трансмембранная спираль (TM6) и немного отклоняется TM7. Это создает полость, в которую заходит G-белок для дальнейшей передачи сигнала. Знак вопроса в центре структуры говорит, что механизмы процесса на аминокислотном уровне до конца не изучены.
[12], рисунок адаптирован
Глобально, все лиганды можно разделить на ортостерические и аллостерические [13].
-
Ортостерические лиганды присоединяются к рецептору в «основном» кармане связывания. Это место, где связывается его «основная» молекула, синтезируемая в организме. Зачастую рецепторы получают название именно в честь такого соединения: аденозин — аденозиновый рецептор, ангиотензин — ангиотензиновый, серотонин — серотониновый рецептор, и так далее. Научный термин для таких молекул — эндогенный лиганд.
-
Аллостерические лиганды присоединяются в дополнительном кармане и влияют на функцию рецептора независимо от основного лиганда. Так, у большинства представителей GPCR вышеупомянутого класса А одним из аллостерических лигандов является ион натрия [14].
Чаще всего лекарства — именно ортостерические лиганды, так как они позволяют «включать» и «выключать» рецептор наиболее четко. К слову сказать, существует много рецепторов, у которых не найден эндогенный лиганд — их называют орфанными (от англ. сирота).
Ортостерические лиганды
Однако, как бы нам не хотелось упростить для лучшего понимания модель работы GPCR, в жизни все устроено сложнее. На самом деле, многие GPCR обладают значительной активностью, не зависящей от лиганда, — базальной. На эту активность на самом деле и влияют лиганды (рис. 2).
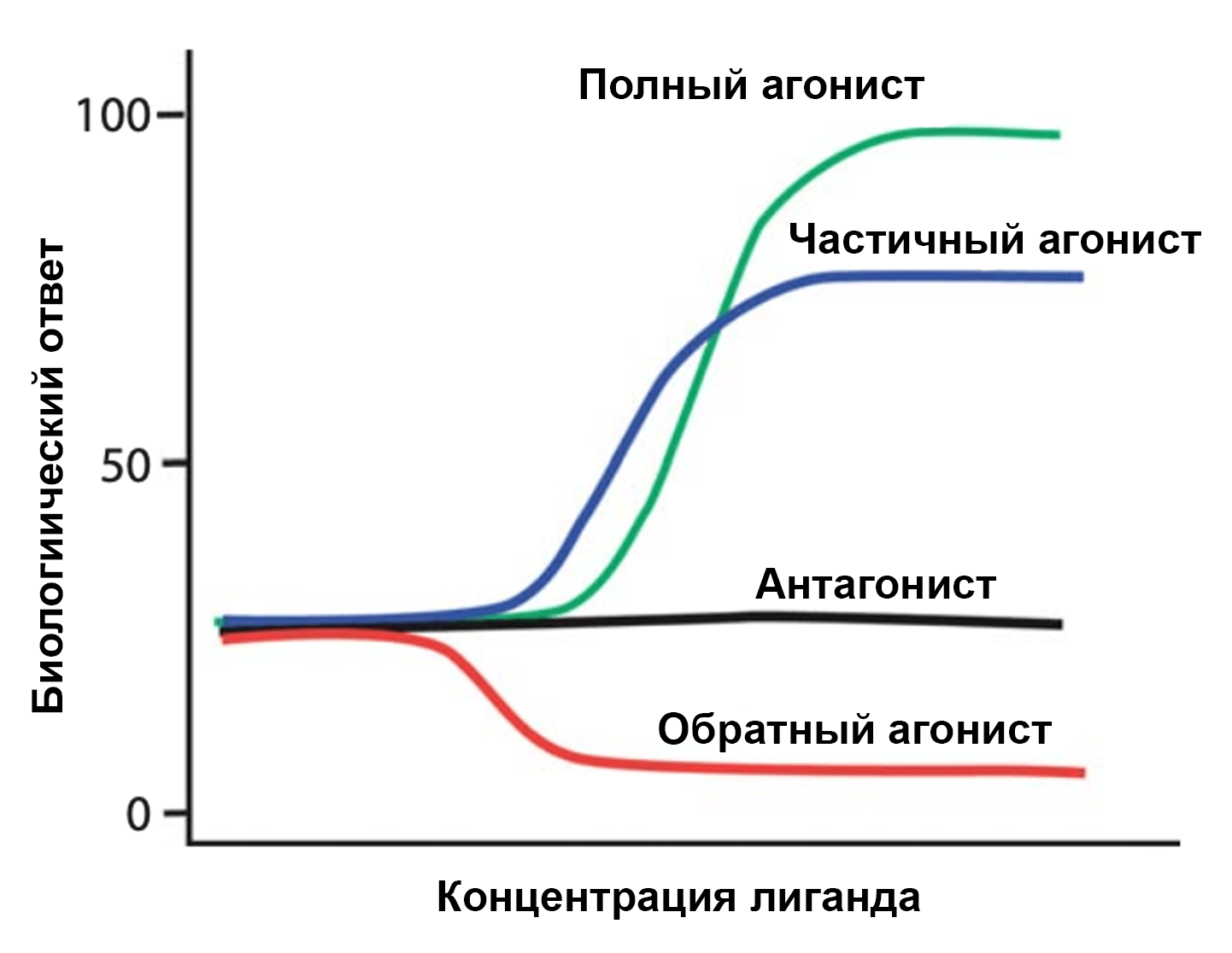
Рисунок 2. Зависимость базальной активности рецептора от концентрации лигандов различного типа.
[15], рисунок адаптирован
Активность GPCR фактически определяется эффективностью связывания G-белка, однако рецепторы действуют и через иные сигнальные пути (например, β-аррестиновый; рис. 3). К тому же G-белки могут состоять из разных субъединиц, и у одного и того же рецептора сродство к разным G-белкам может отличаться. Все это делает термин «активность» довольно запутанным и неочевидным. Поэтому ученые договорились, что полный агонист максимально активирует связывание предпочтительного G-белка, а обратный агонист максимально снижает базальную активность для любого из G-белков.
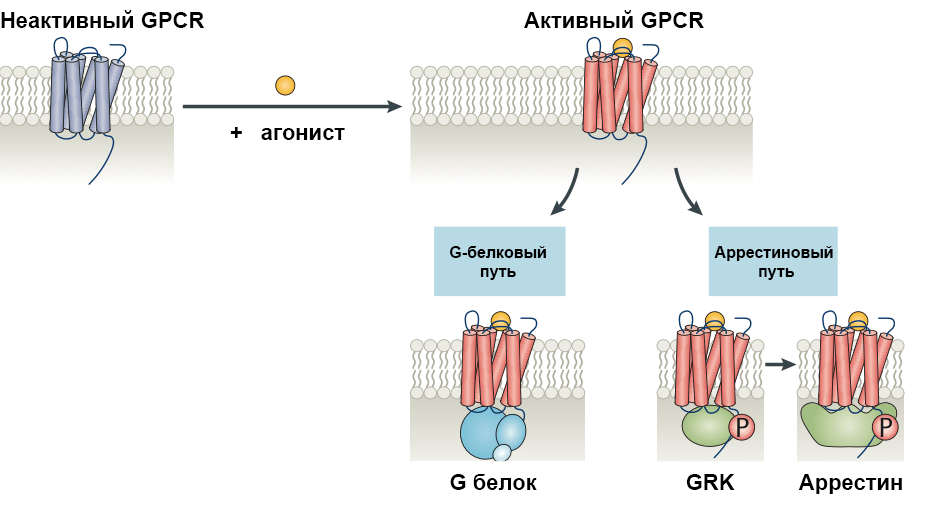
Рисунок 3. Передача сигналов от рецептора, связанного с G-белком. Активированные GPCR индуцируют передачу сигналов по независимым сигнальным путям: посредством либо G-белков, либо GPCR-киназ (GRK) и аррестинов.
[16], рисунок адаптирован
Ортостерические лиганды могут не изменять, снижать или увеличивать активность рецептора. Между собой лиганды отличаются эффективностью (англ. efficacy), которая описывает масштаб вызванных изменений [17]. Глобально, есть три типа ортостерических лигандов:
-
Антагонисты вообще не влияют на базальную активность рецептора (но мешают прочим лигандам связываться оказывать свое действие).
-
Агонисты увеличивают активность рецептора. Полные агонисты полностью активируют рецептор, а частичные агонисты, даже в высокой концентрации, могут его активировать лишь не в полную силу. Существуют также суперагонисты, которые могут активировать белок больше, чем на 100%. (Дело в том, что за 100% в фармакологии обычно принимается эффект от самого сильного эндогенного лиганда. Из-за этого могут появляться синтетические молекулы, перекрывающие величину отклика от «родного» лиганда.)
-
Обратные агонисты снижают базальную активность.
Когда-то белки представляли жесткими молекулами, где лиганды входят в карманы по принципу ключ–замок, однако это не совсем так. Такое представление появилось, потому что методы кристаллографии и крио-электронной микроскопии (два основных поставщика белковых структур на данный момент [18]) дают структуры белков в фиксированном состоянии, а работ по исследованию именно белковой динамики не так много. Однако в природе молекулярные системы подвержены флуктуациям и тепловому движению (именно те факторы, которые должны быть сведены к минимуму при получении структур с высоким разрешением).
Белки — прекрасные примеры таких молекулярных систем. Все процессы изменения конформации вероятностные и стохастические. Белок в формально неактивном состоянии какую-то часть времени все же активен, а лиганды способны смещать это равновесие. К тому же, связывание самих лигандов — такой же процесс, завязанный на флуктуациях. Даже самый высокоаффинный лиганд не проводит 100% времени в кармане белка: он бесконечно оттуда выходит и заходит вновь. А лиганды, в свою очередь, способны влиять на энергетический профиль и смещать равновесие в ту или иную сторону (рис. 4).
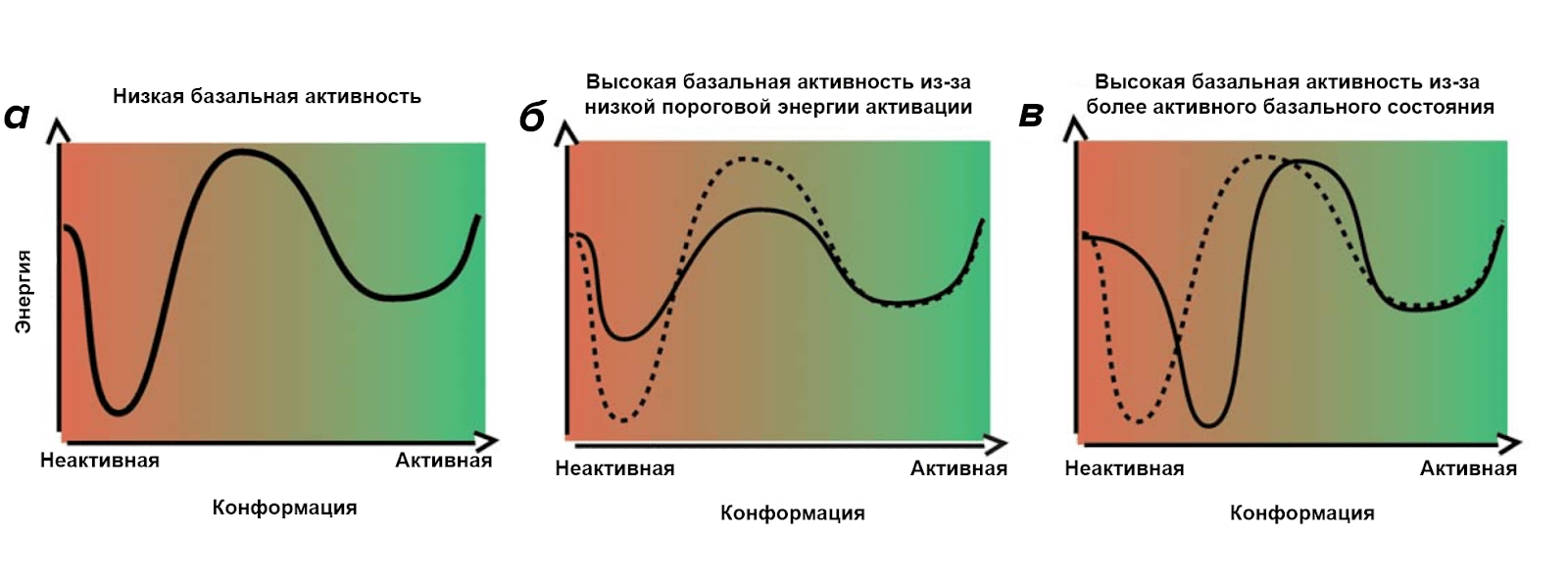
Рисунок 4. Энергетические ландшафты рецептора. а: Рецептор с низкой базальной активностью. б, в: Рецепторы с повышенной относительно А базальной активностью. Для б базальная активность повышена из-за снижения энергетического барьера, разделяющего базальное и активное конформационные состояния. Для в базальная активность выше, потому что базальное конформационное состояние обладает более высокой активностью по отношению к G-белку.
[15], рисунок адаптирован
Аллостерические модуляторы
Аллостерические модуляторы (или лиганды) сами по себе не могут изменить активность белка. Но что тогда они могут сделать? А могут делать они очень важную вещь — менять величину эффекта от ортостерического лиганда, то есть, модулировать эффект. Сами по себе аллостерические лиганды не могут запустить такую же передачу сигнала, как и ортостерические. Для этого второстепенному сайту связывания не хватает функционала, поэтому возможно лишь изменение конформации белка для управления аффинностью основного лиганда. В свою очередь, они тоже подразделяются на три типа:
-
Позитивный модулятор усиливает эффект агониста.
-
Нейтральный модулятор не меняет эффект лиганда, но мешает связываться модуляторам других типов.
-
Негативный модулятор ослабляет эффект агониста.
При этом аллостерические лиганды, как и ортостерические, влияют на энергетический профиль состояний рецептора, увеличивая или уменьшая барьеры между стабильными конформациями. Чем ниже энергия стабильного состояния, тем выгоднее молекуле белка в ней находиться (и тем выше вероятность ее там найти).
Почему я так обращаю внимание на аллостерические лиганды, хотя, казалось бы, они не могут оказать влияния на активацию/деактивацию рецептора? Все просто — аллостерическая модуляция считается одним из самых перспективных направлений в фарминдустрии. Мы можем не придумывать новые лекарства, а пускать их вместе с таким модулятором, чтобы усилить эффект от обычного лиганда; или ослабить нежелательный эффект.
Как мы смогли покрасить белок и подсмотреть за его работой
Как проверить, является ли какое-то вещество лигандом рецептора? Самый наглядный путь — получить структуру интересующего белка вместе с этим веществом. Однако, несмотря на то, что структурная биология сделала за последние несколько десятилетий огромный шаг вперед, получение структуры GPCR все еще остается сложной задачей, справиться с которой могут лишь немногие лаборатории в мире.
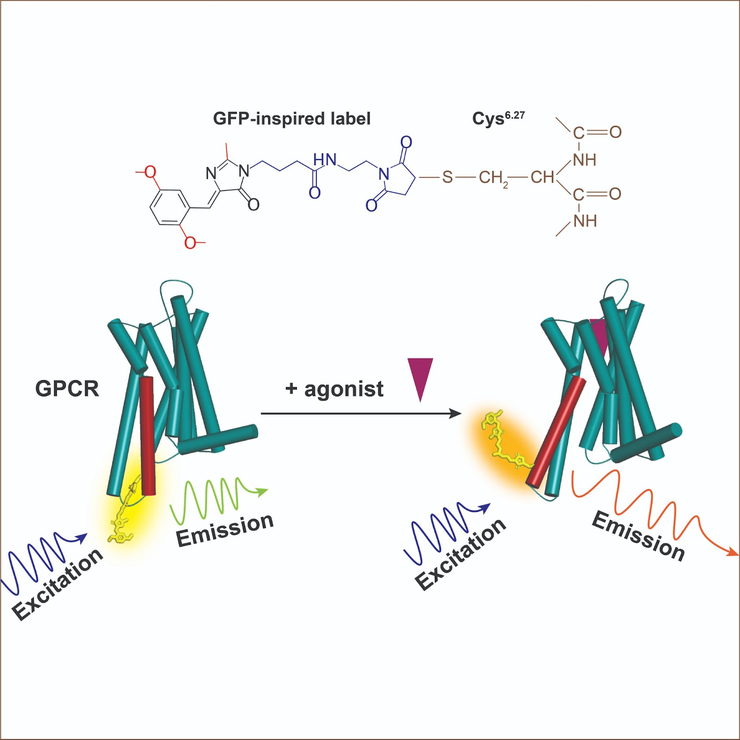
В Лаборатории структуры и динамики биомолекул Центра молекулярных механизмов (о котором я уже упоминал выше) под руководством Валентина Борщевского мы задались вопросом, как можно просто, дешево и эффективно отследить, в каком состоянии находится рецептор в данный момент. Надо понимать, что уже существуют методы, которые могут ответить на этот вопрос. Например, ЯМР- и ЭПР-спектроскопии [16], [19], одномолекулярная спектроскопия с помощью Ферстеровского резонансного переноса энергии (smFRET) [20], [21] или поверхностный плазмонный резонанс (SPR) [22]. Но эти методы требуют специального дорогого (или очень дорогого) оборудования и сложной подготовки к эксперименту. Например, smFRET требует иммобилизовать рецептор с двумя прикрепленными флуоресцентными метками — донорной и акцепторной — на специальной подложке для спектроскопии. Затем возбуждается первая метка, и энергия с нее перебрасывается на акцепторную молекулу, за флуоресценцией которой и смотрят. В нашей же работе идея заключается в том, что мы берем всего один краситель и смотрим за изменением спектров эмиссии при активации комплекса белок–краситель с помощью самого обычного планшетного ридера прямо в растворе. Особенность метода заключается именно в типе красителей, которые мы решили использовать.
Нам идеально подошли так называемые сольватохромные красители. Почти все флуорофоры представляют собой диполи. Когда такой диполь поглощает квант света, молекула красителя становится более полярной. Это влияет на ближайшие молекулы растворителя, изменяя их ориентацию. На этот процесс уходит часть поглощенной энергии, и излучение происходит на более длинной волне, чем в менее полярных растворителях. Это обеспечивает главное свойство сольватохромных красителей. Всего можно выделить пять процессов, происходящих с молекулами красителей, которыми обусловлен сольватохромный эффект (рис. 5) [23]:
-
перенос заряда;
-
перенос протона;
-
конформационные изменения (изомеризация);
-
структурная изменения;
-
агрегация.
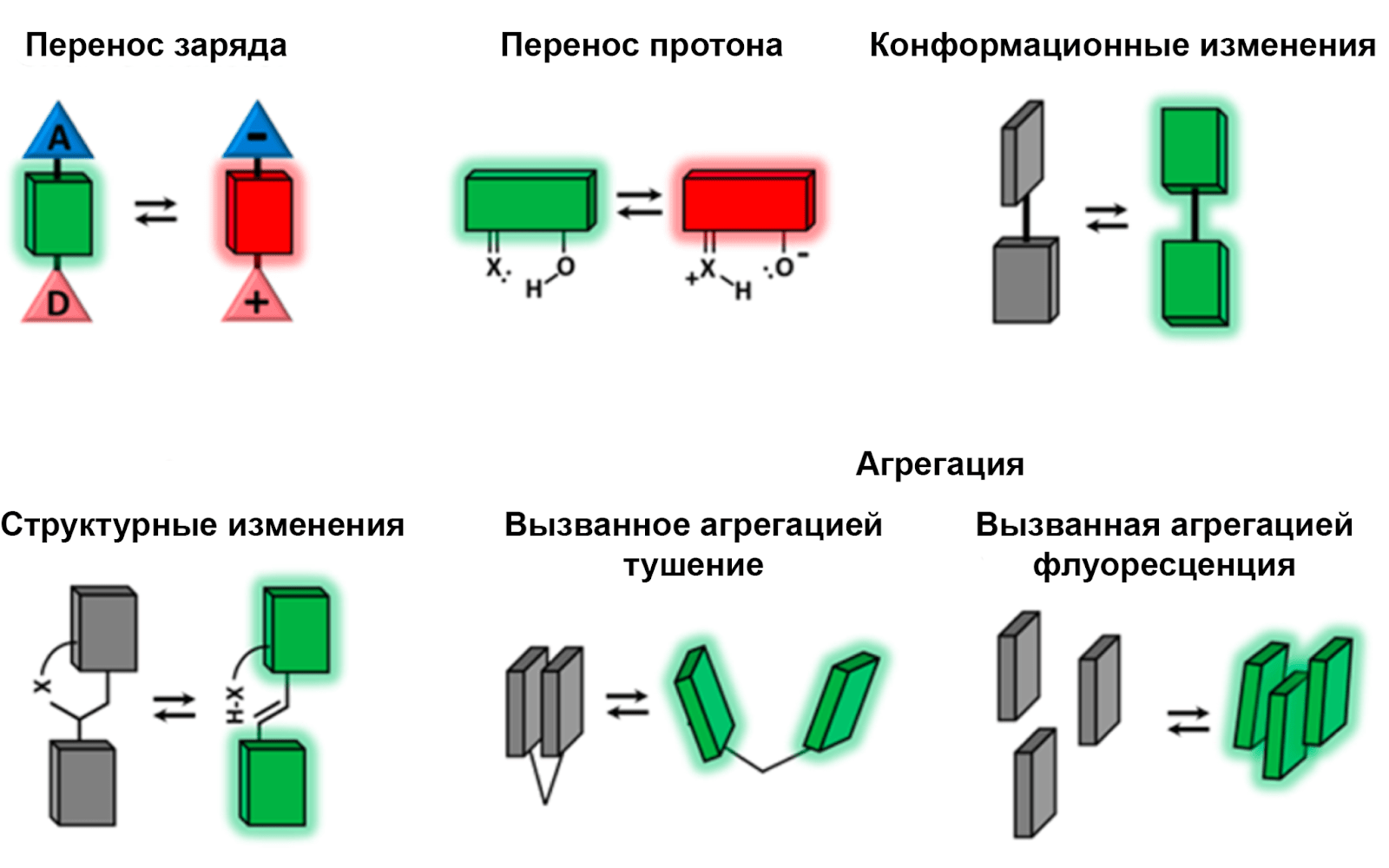
Рисунок 5. Ключевые механизмы работы чувствительных к окружению красителей.
[23], рисунок адаптирован
К третьему типу относятся «молекулярные роторы» — молекулы, у которых есть гибкая связь, вокруг которой может происходить изомеризация. Если говорить научным языком, изомеризация нарушает единую систему сопряженных π-связей и вызывает безызлучательную релаксацию. То есть, при использовании среды с большей вязкостью происходит ограничение вращения (англ. restriction in rotation, RIR), изомеризация ограничивается, и увеличивается эффективность флуоресценции. Происходит это из-за того, что энергии банально больше некуда деваться: одну из главных статей ее расходов резко урезали.
Хороший пример сольватохромного молекулярного ротора — хромофор зеленого флуоресцентного белка (GFP [24]) (рис. 6). Например, синтетические красители на основе этого хромофора способны проникать через клеточную мембрану и окрашивать органеллы. При этом они не требуют отдельного удаления несвязавшегося избытка, так как в свободном виде не флуоресцируют [25].
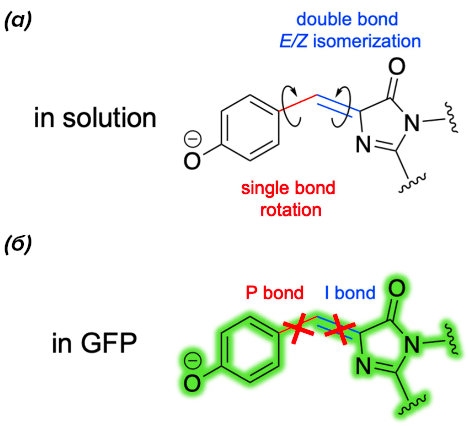
Рисунок 6. Иллюстрация принципа работы хромофора GFP. В растворе этот хромофор свободно вращается вокруг обозначенных связей, что не дает появиться флуоресценции. А вот при попадании в замкнутое пространство ꞵ-бочонка хромофор теряет возможность вращаться, что вынуждает его излучать.
Было необходимо выбрать подходящий модельный, но в то же время важный, белок. Наш выбор пал на хорошо известный рецептор, сопряженный с G-белком — аденозиновый рецептор A2A (A2AAR) [27], [28] — и на хромофор GFP как наиболее очевидный краситель. Этот хромофор просто синтезируется, но, что более важно, обладает большими возможностями для модификации. Это позволяет получить красители с практически любыми необходимыми характеристиками.
Наши коллеги из Лаборатории химии гетероциклических соединений ИБХ создали несколько вариантов красителей, которые прошли тесты и показали сольватохромность в растворах с различной полярностью (рис. 6), и мы были готовы начинать воплощать наши планы в жизнь.
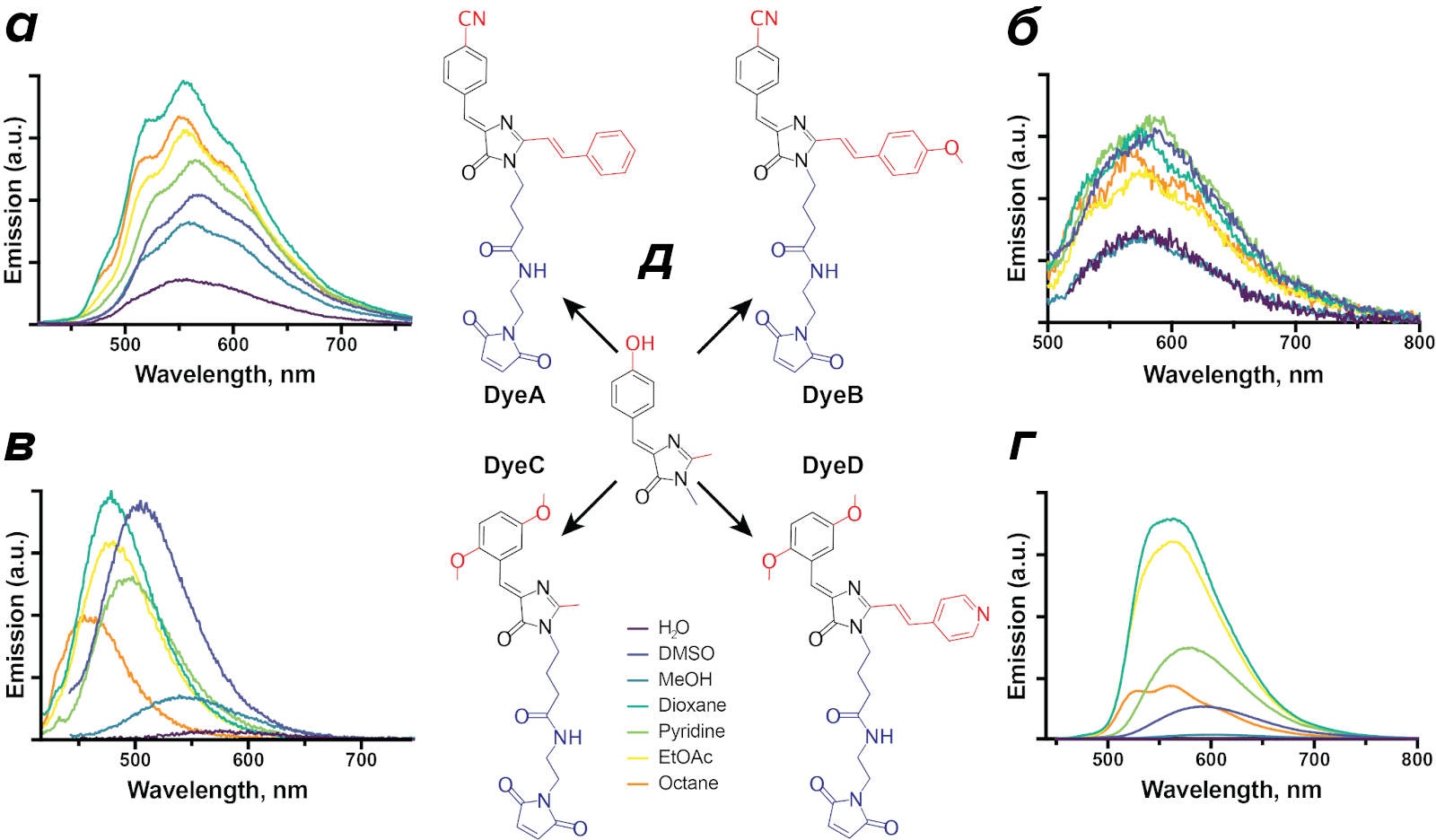
Рисунок 7. Красители, использованные в работе, и их сольватохромные свойства. По центру (д) изображен сам хромофор GFP (4-гидроксибензилиден-диметилимидазолинон) и четыре его производных. Синим выделены малеимидные группы, которые образуют ковалентную связь с цистеинами; красным — модификации, влияющие на положение, форму спектра и сольватохромные свойства красителей. На а–г показаны спектры красителей в растворах с различными полярностью и вязкостью. По изменению интенсивности флуоресценции и положения спектров был сделан вывод, что красители на самом деле чувствуют изменения в локальном окружении (то есть, являются сольватохромными). Можно заметить, что некоторые графики очень шумные — это влияние плохой растворимости красителей, которая в водных растворах может быть практически нулевой. Это важный параметр, внимание на который мы обратили только на финальной стадии исследования — молекулярной динамике.
Стоит отдельно отметить, как происходит покраска белков. Есть несколько способов, но самый распространенный — ковалентно сшивать цистеины в белке с молекулой красителя. У красителя должна иметься для этого специальная малеимидная группа (рис. 7д, синие части красителей), которая обладает высокой селективностью к тиолам (рис. 8). Цистеин же как раз является такой подходящей серосодержащей аминокислотой. Так как цистеин довольно распространенная аминокислота, покрасить можно практически любой белок. Однако если бездумно добавлять краситель к белкам, то могут получиться неинтерпретируемые результаты (об этом я расскажу немного позже, когда пойдет речь об A2AAR).

Рисунок 8. Малеимид-тиоловая реакция, позволяющая ковалентно красить белки с высокой специфичностью.
Хотя нашей целью был рецептор A2A, мы начали с более простого белка — бычьего рековерина. Это нейрональный кальциевый сенсор, отвечающий за адаптацию глаза к изменению интенсивности падающего света — проще говоря, он не дает нам ослепнуть при выходе из подъезда на улицу.
Так как наши красители были созданы для мечения белка по свободным цистеинам (не в цистеиновых мостиках), рековерин стал для нас идеальной мишенью. У него всего один цистеин, который, к тому же, располагается около места, где происходят конформационные изменения при связывании кальция. Дополнительным плюсом была водорастворимость рековерина: его намного проще нарабатывать, и не нужно изгаляться с детергентами и мембраномоделирующими системами для обеспечения стабильности.
Результаты оказались впечатляющими: из четырех красителей половина показала ответ на кальциевую активацию белка при очень высокой специфичности покраски (рис. 9), проверенной на бесцистеиновом мутанте белка.
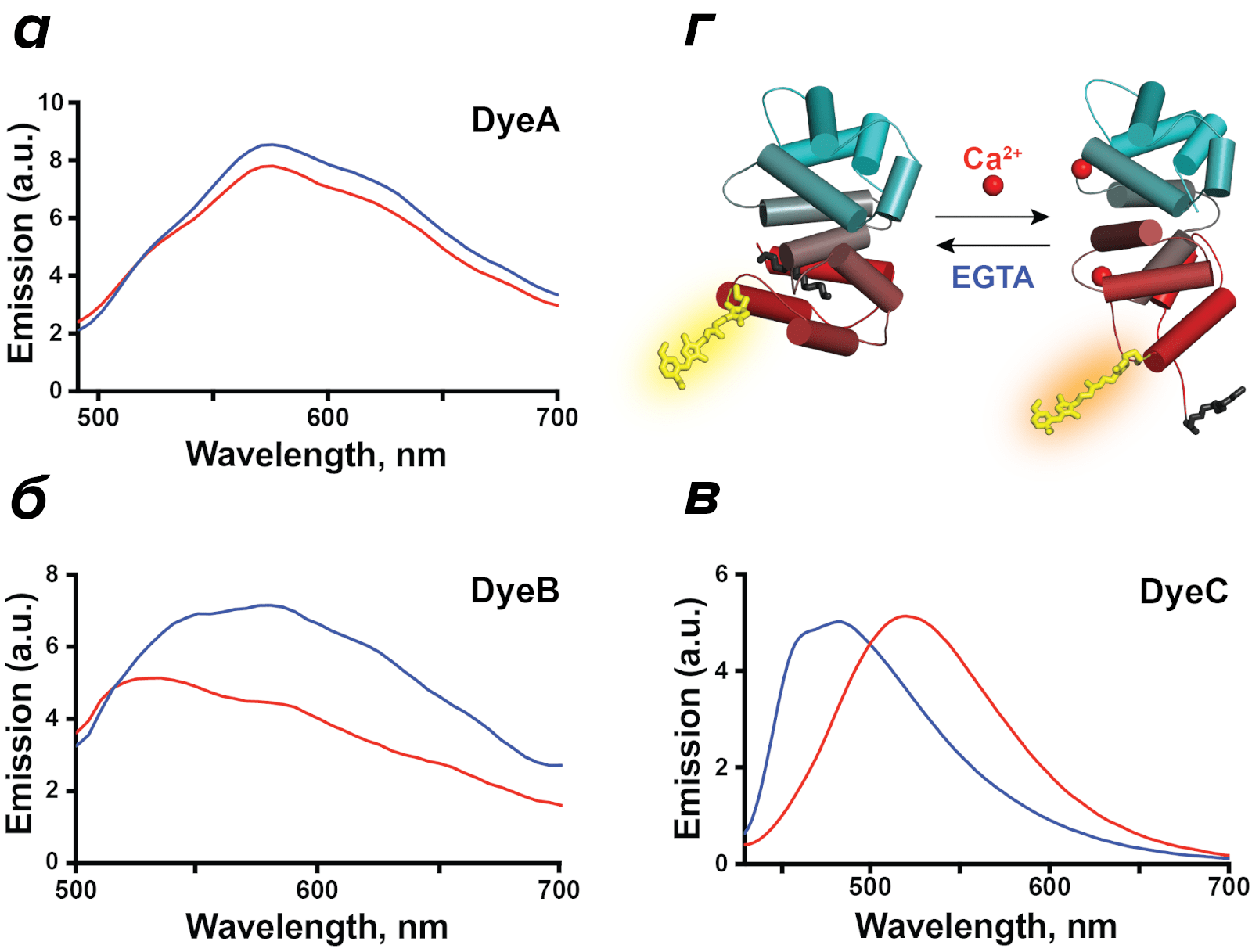
Рисунок 9. Кальций-зависимая активация рековерина (г), из которой видна глобальная перестройка всего белка. Также показано, что из трех красителей два (DyeB и DyeC) в комплексе с рековерином меняют свою флуоресценцию при активации и инактивации белка. Красным показаны спектры при добавлении кальция (рековерин активируется), а синим — при «отборе» хелатором EGTA (рековерин инактивируется).
Из сработавших красителей мы выбрали один, лучше растворявшийся в воде, и приступили к работе с аденозиновым рецептором. В случае с рековерином нам безумно повезло, что там имелся всего один цистеин в удачном месте. Однако в случае с A2AAR это совсем не так: он имеет больше 10 цистеинов, причем все не там, где нам бы хотелось (далеко от подвижных частей во время активации).
Для решения такой проблемы мы посмотрели на цистеины и поняли, что в основном они находятся в гидрофобной мембранной части белка, а внемембаранные заняты цистеиновыми мостиками. Поэтому мы внесли дополнительный цистеин на конец шестой трансмембранной спирали (конструкция стала называться A2AARL225C, так как был заменен лейцин L на цистеин C в позиции 225), и это решало сразу все наши проблемы. Мы стали способны специфично красить белок по внесенному цистеину прямо в клеточных мембранах, и это не задевало все остальные цистеины.
Но на этом особенности работы с мембранными белками не закончились. В растворе они должны находиться либо в мицелле из детергента, либо в специальной системе, которая может мимикрировать под нативную мембрану. Первый способ намного дешевле и проще, но белок получается менее стабильный, так как мицелла — динамичный объект. Из-за этого довольно быстро происходит агрегация белка и потеря его функциональности. Мы же использовали нанодиски: они состоят из каркасных белков и специальных липидов, которые могут собираться вместе вокруг рецептора и обеспечивать ему более нативную среду. Нанодиски довольно сложно получить, однако зачастую выигрыш в стабильности того стоит. К тому же, в мицеллах может застревать свободная краска, что влияет на итоговые спектры.
После подтверждения функциональности белка мы провели несколько экспериментов с различными типами лигандов — добавляли лиганды к окрашенному белку и смотрели на спектры эмиссии флуоресценции. В результате оказалось, что мы можем статистически достоверно различать эффекты агонистов и антагонистов, но, самое главное, отличать эффект от аллостерического модулятора 5-(N,N-гексаметилен)-амилорида (HMA). Причем, если на ортостерические лиганды отклик заключается почти только в изменении интенсивности эмиссии, то для HMA виден появившийся горб, который можно количественно оценить ратиометрическим подходом. Мы выбрали в качестве такого параметра соотношение интенсивностей на длинах волн 520 и 460 нм, что позволило количественно описать отличие эффектов ортостерических и аллостерических лигандов (рис. 10).
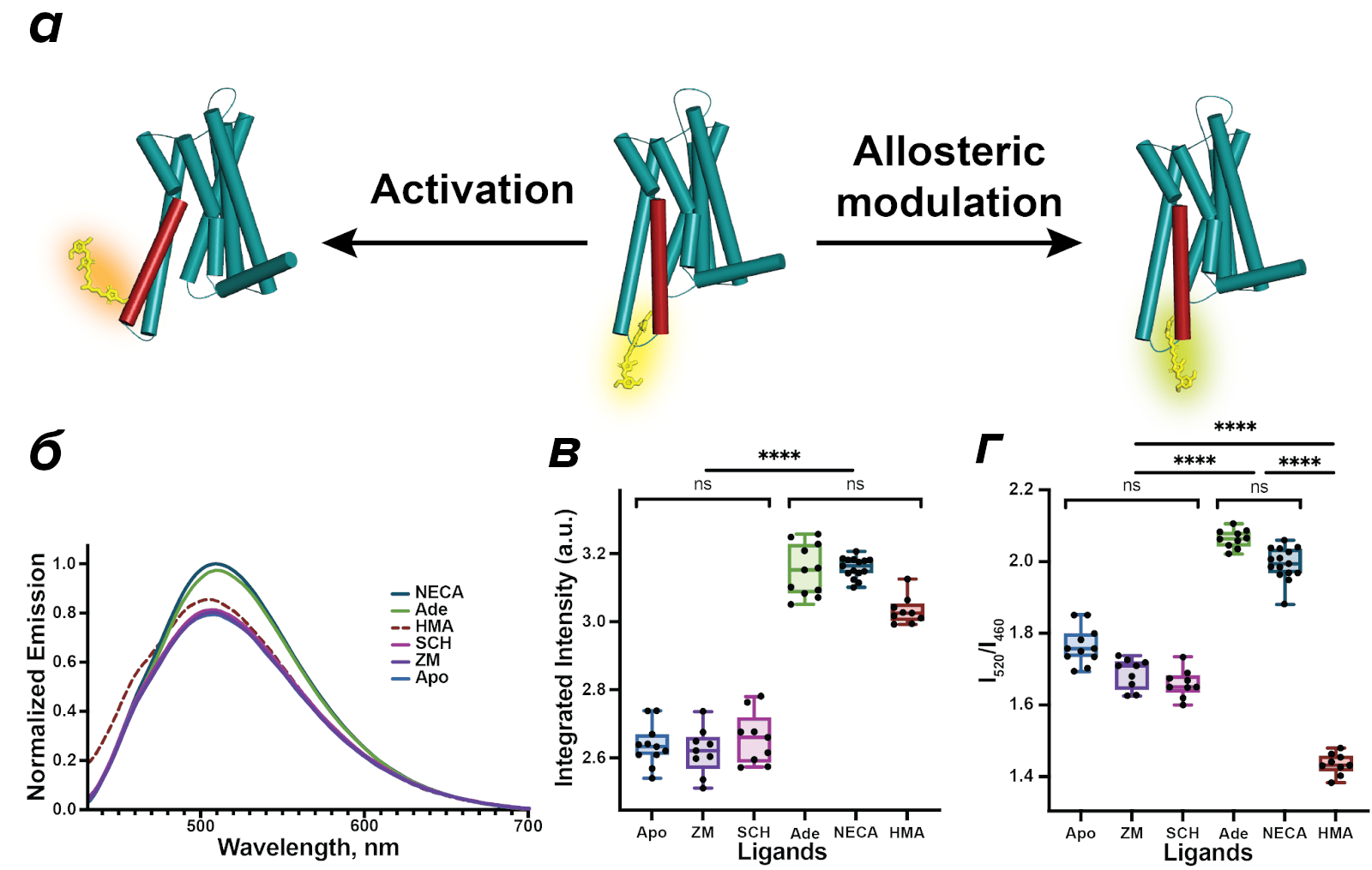
Рисунок 10. Структурные и спектральные изменения A2AARL225C–DyeC, вызванные различными лигандами. а демонстрирует активацию белка ортостерическими и аллостерическими лигандами. При активации по-разному меняются спектры флуоресценции метки — это говорит, что эти два типа лигандов по-разному меняют конформацию рецептора, однако как это делает HMA, неизвестно (поэтому центральное и правое состояние изображены одной пространственной структурой). На панели б показан общий вид спектров эмиссии покрашенного рецептора при добавлении различных лигандов к нему и без них (состояние Apo). NECA и аденозин (Ade) — полные агонисты аденозинового рецептора, а SCH и ZM — антагонисты. На центральной панели в показана полная площадь под спектрами эмиссии. На правой панели г показан ратиометрический параметр отношений интенсивностей флуоресценции на 520 и 460 нм. Можно сказать, что формы спектра достаточно, чтобы отличить все типы лигандов, которые были использованы.
Конечно, сольватохромными свойствами обладает не только хромофор GFP. Таких красителей много, и некоторые из них уже применялись для исследования конформационной активности GPCR. Очень активно проводил эксперименты уже знакомый нам Брайан Кобилка со все тем же β2-адренорецептором. В качестве флуорофора он использовал монобромбиман. Другими популярными красителями были sulfoCy5, Cy3 и TMR-5. Однако все они обладают рядом недостатков. Например, у монобромбимана слишком «синий» спектр, что неудобно для спектроскопии, а также ему нужен дополнительный агент, который бы тушил флуоресценцию. У остальных красителей был слабый отклик на активацию белка.
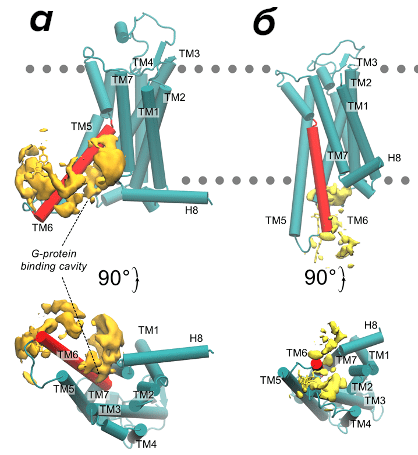
Рисунок 11. Моделирование молекулярной динамики A2AARL225C–DyeC показывает положение красителя и активации и инактивации рецептора. Были рассчитаны наиболее вероятные позиции красителя в активном (а) и неактивном (б) состоянии рецептора. Для этого мы нашли минимумы свободной энергии красителя с помощью метадинамики и сделали из них изоповерхности. Пунктирными линиями показаны границы липидного слоя нанодиска. В результате оказалось, что при активации белка краситель склонен заходить в липидную часть нанодиска, ограничивающую его движение, к тому же полярность и вязкость в липидном слое намного выше, чем в среде вокруг. При инактивации краситель больше времени проводит в растворе, свободно вращаясь и изомеризуясь.
Чтобы убедиться в эффективности нашего красителя, мы провели аналогичные эксперименты с вышеупомянутыми флуорофорами и попробовали задетектировать отклик на активацию рецептора A2AAR агонистом аденозином. Мы получили отклик только у монобромбимана, но он намного слабее, чем у красителя DyeC.
После того, как мы убедились, что наш краситель — лучший из лучших, нам стало интересно, чем обусловлено такое поведение спектров эмиссии флуоресценции. Для этого были проведены расчеты молекулярной динамики. Если не вдаваться в технические подробности, то в результате мы получили очень закономерные выводы.
При активации рецептора у него происходит «отгибание» шестой трансмембранной спирали, и краситель становится ближе к поверхности нанодиска и даже немного входит в липидный слой. Из-за этого он ограничивается во вращении и изомеризации, что приводит к усилению флуоресценции. В неактивном же состоянии краситель чувствует себя в растворе более свободно, тратя свою энергию не на флуоресценцию, а на вращение, что мы и наблюдаем в виде более слабого сигнала (рис. 11).
В таком подходе определяется положение системы в энергетическом пространстве, используя обобщенные координаты реакции. Затем к реальному энергетическому ландшафту добавляется небольшой положительный гауссов потенциал, чтобы вытолкнуть систему из локального минимума и не дать ей вернуться в прежнее состояние. В конечном итоге исследуется весь энергетический ландшафт, который затем можно восстановить как противоположность суммы всех гауссовых потенциалов. Можно посмотреть хорошее видео, которое объяснит методику.
Теперь, казалось бы, мы способны запускать высокопроизводительные скрининги лигандов для поиска новых терапевтических мишеней, однако не все так просто. Нельзя просто так взять случайный интересующий нас белок, начать его красить и искать новое лекарство. Мы использовали хорошо изученный рецептор, хорошо отработанную конструкцию с внесенным цистеином, который может гарантированно и специфично краситься. Для создания новой работающей конструкции необходимо протестировать множество разных генетических мутаций, провести тестовые экспрессии и покраски и убедиться в функциональности белка после всех манипуляций. Но, самое главное, необходимо знание структуры белка и механизма его активации (чтобы цистеин был в самом эпицентре действий, а не на отшибе) с конформационными изменениями между активным и неактивным состоянием. Помимо этого, хромофор GFP обладает высокой пластичностью в плане модификаций, что позволит нам с уже имеющимся опытом создать метки с более подходящими характеристиками.
Можно подытожить, что, несмотря на впечатляющие результаты, работы нам предстоит еще очень много, и останавливаться на достигнутом мы не собираемся!
Литература
- Anatoliy Belousov, Ivan Maslov, Philipp Orekhov, Polina Khorn, Pavel Kuzmichev, et. al. (2024). Monitoring GPCR conformation with GFP-inspired dyes. iScience. 27, 110466;
- Alexander S. Hauser, Sreenivas Chavali, Ikuo Masuho, Leonie J. Jahn, Kirill A. Martemyanov, et. al. (2018). Pharmacogenomics of GPCR Drug Targets. Cell. 172, 41-54.e19;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017;
- Aleksandra P. Luginina, Andrey. N. Khnykin, Polina A. Khorn, Olga V. Moiseeva, Nadezhda A. Safronova, et. al. (2024). Erratum to: Rational Design of Drugs Targeting G-Protein-Coupled Receptors: Ligand Search and Screening. Biochemistry Moscow. 89, 1159-1159;
- Polina A. Khorn, Aleksandra P. Luginina, Vladimir A. Pospelov, Dmitrii E. Dashevsky, Andrey N. Khnykin, et. al. (2024). Erratum to: Rational Design of Drugs Targeting G-Protein-Coupled Receptors: A Structural Biology Perspective. Biochemistry Moscow. 89, 1158-1158;
- Лаборатория перспективных исследований мембранных белков: от гена к ангстрему;
- V. Cherezov, D. M. Rosenbaum, M. A. Hanson, S. G. F. Rasmussen, F. S. Thian, et. al. (2007). High-Resolution Crystal Structure of an Engineered Human 2-Adrenergic G Protein-Coupled Receptor. Science. 318, 1258-1265;
- Patrick Joost, Axel Methner. (2002). Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands. Genome Biol. 3;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Qingtong Zhou, Dehua Yang, Meng Wu, Yu Guo, Wanjing Guo, et. al. (2019). Common activation mechanism of class A GPCRs. eLife. 8;
- Daniel Wacker, Raymond C. Stevens, Bryan L. Roth. (2017). How Ligands Illuminate GPCR Molecular Pharmacology. Cell. 170, 414-427;
- Vsevolod Katritch, Gustavo Fenalti, Enrique E. Abola, Bryan L. Roth, Vadim Cherezov, Raymond C. Stevens. (2014). Allosteric sodium in class A GPCR signaling. Trends in Biochemical Sciences. 39, 233-244;
- Xavier Deupi, Brian Kobilka. (2007). Activation of G Protein–Coupled Receptors. Advances in Protein Chemistry. 137-166;
- Ichio Shimada, Takumi Ueda, Yutaka Kofuku, Matthew T. Eddy, Kurt Wüthrich. (2019). GPCR drug discovery: integrating solution NMR data with crystal and cryo-EM structures. Nat Rev Drug Discov. 18, 59-82;
- Terry Kenakin. (2002). Efficacy at g-protein-coupled receptors. Nat Rev Drug Discov. 1, 103-110;
- 12 методов в картинках: структурная биология;
- Douglas D. Lopes, Erick F. Poletti, Renata F. F. Vieira, Guita N. Jubilut, Laerte Oliveira, et. al. (2008). A Proposed EPR Approach to Evaluating Agonist Binding Site of a Peptide Receptor. Int J Pept Res Ther. 14, 121-126;
- Рулетка для спектроскописта;
- Ivan Maslov, Oleksandr Volkov, Polina Khorn, Philipp Orekhov, Anastasiia Gusach, et. al. (2023). Sub-millisecond conformational dynamics of the A2A adenosine receptor revealed by single-molecule FRET. Commun Biol. 6;
- Iva Navratilova, Jérémy Besnard, Andrew L. Hopkins. (2011). Screening for GPCR Ligands Using Surface Plasmon Resonance. ACS Med. Chem. Lett. 2, 549-554;
- Andrey S. Klymchenko. (2017). Solvatochromic and Fluorogenic Dyes as Environment-Sensitive Probes: Design and Biological Applications. Acc. Chem. Res. 50, 366-375;
- Флуоресцирующая Нобелевская премия по химии;
- Alexander Yu. Smirnov, Maxim M. Perfilov, Elvira R. Zaitseva, Marina B. Zagudaylova, Snizhana O. Zaitseva, et. al. (2020). Design of red-shifted and environment-sensitive fluorogens based on GFP chromophore core. Dyes and Pigments. 177, 108258;
- Songtao Ye, Yuqi Tang, Xin Zhang. (2022). Principles, modulation, and applications of fluorescent protein chromophores. Chemical Physics Reviews. 3;
- Аденозиновые рецепторы: история великого обмана;
- Влияние кофеина;
- Мечение малеимидами белков и других тиолированных биомолекул. (2024). Lumiprobe.