Аденозиновые рецепторы: история великого обмана
15 ноября 2019
Аденозиновые рецепторы: история великого обмана
- 21020
- 1
- 33
Из чашки кофе хитро подмигивает молекулярная мишень, на которую действует кофеин
коллаж автора статьи, создан с помощью ru.photofacefun.com
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Почему мы устаем? Как растения нас обманывают, внушая, что мы не устали, и зачем они это делают? Как в этом обмане оказались замешаны флавоноиды и даже успокоительная валериана? И чем мы целый год занимались на нашей кафедре? Об этом читайте в нашей статье.
Конкурс «био/мол/текст»-2019
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2019.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Партнер номинации — Российский научный фонд.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
– Ты кто?
– Часть силы той, что без числа
Творит добро, всему желая зла.
И.В. Гете. Фауст
Аденозин сигнализирует об «усталости» клетки
Нуклеозид аденозин (рис. 1а) — безотказная «рабочая лошадка» многих внутриклеточных процессов. Это одна из четырех «букв» наших ДНК и РНК. Аденозин с тремя фосфорильными группами — аденозинтрифосфат (АТФ, рис. 1б) — переносит энергию в клетке, являясь универсальной «энергетической валютой». При расходовании энергии фосфорильный «хвостик» укорачивается, и получаются соединения с двумя и одной фосфорильными группами — соотстветсвенно, аденозиндифосфат (АДФ, рис. 1в) и аденозинмонофосфат (АМФ, рис. 1г). Аденозин с фосфорильной группой, замкнутой в кольцо — циклический аденозинмонофосфат (цАМФ, рис. 1д) — один из основных вторичных посредников, передающих сигнал внутри клетки.

Рисунок 1. Аденозин и его соединения. а — Аденозин — главный герой этого рассказа. б — Аденозинтрифосфат (АТФ) — главный переносчик энергии в клетках. в — Аденозиндифосфат (АДФ) образуется из АТФ, когда тот отдает энергию в каком-нибудь биохимическом процессе, теряя вместе с ней одну фосфорильную группу. г — Аденозинмонофосфат (АМФ) — это АТФ, «обобранный до нитки». Отдал всю энергию и две фосфорильные группы. д — Циклический аденозинмонофосфат (цАМФ) — один из главных внутриклеточных химических сигналов.
Помимо всего перечисленного, аденозин — медиатор межклеточной сигнализации во многих тканях. Если говорить кратко, то аденозин — это молекула усталости. В мозге он накапливается в период бодрствования, и по мере нарастания концентрации «сообщает» нейронам, что пора спать. В сердце он снижает частоту сердечных сокращений. Также аденозин тормозит воспаление, защищая клетки от вызванной им гипоксии, и повышает устойчивость к ишемии [1]. В общем, аденозин сигнализирует, что в клетках не хватает энергии и они в состоянии стресса. И им пора отдохнуть.
Функция аденозина как «сигнала усталости» напрямую следует из биохимии его образования и инактивации. Внутри клетки аденозин может образовываться несколькими путями: при расщеплении АТФ или АМФ ферментами 5′-нуклеотидазами, при разрушении цАМФ и, наконец, обычным синтезом «с нуля» (de novo). Основной способ его инактивации внутри клетки — присоединение фосфорильной группы ферментом аденозинкиназой. В этой реакции расходуется одна молекула АТФ, а «на выходе» получается по одной молекуле АДФ и АМФ (рис. 2) [2–5].
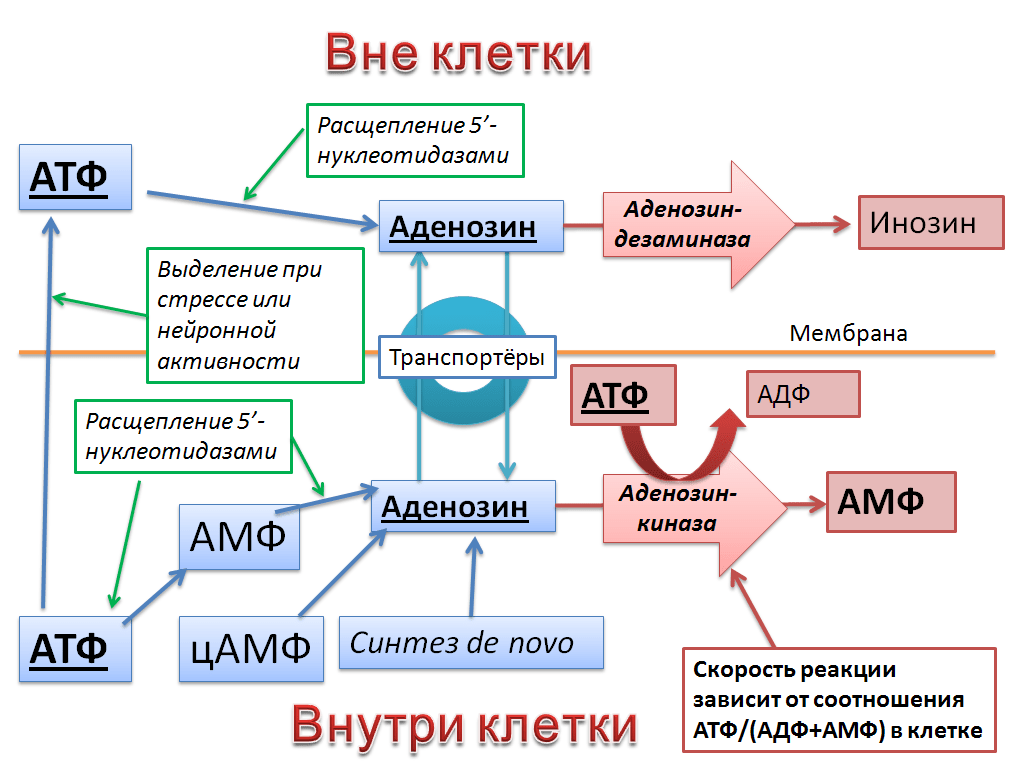
Рисунок 2. Схема метаболизма аденозина вне клетки и внутри нее. В этой довольно сложной «сети» уровень внеклеточного аденозина оказывается в конечном итоге сопряжен с уровнем энергетических «запасов» клетки в виде АТФ и со стрессовой утечкой АТФ через мембрану.
рисунок автора статьи
Фермент аденозинкиназа, как любой катализатор, исключительно ускоряет реакцию в обе стороны, но равновесие не смещает. Оно, как и в обычной школьной пробирке безо всяких ферментов, определяется концентрациями реагентов и продуктов. Поэтому катализуемая аденозинкиназой реакция зависит от количественного соотношения АТФ и АДФ/АМФ внутри клетки. А оно, в свою очередь, отражает энергетические запасы клетки.
«Лишний» аденозин выбрасывается из клетки белками-переносчиками на мембране. Поэтому в конечном итоге снижение энергетических запасов клетки приводит к тому, что она начинает выделять аденозин. А при физиологическом стрессе клетка начинает выделять АТФ целиком, который тут же расщепляется теми же нуклеозидазами до аденозина [1]. Только уже за пределами клетки. А в нервной системе нейроны задействуют этот механизм и безо всякого стресса, просто выделяя АТФ вместе с остальными нейромедиаторами [4]. В итоге — чем больше нейрон работал и передавал химических сигналов, тем больше аденозина выделил.
Поэтому в любом случае повышение концентрации аденозина во внеклеточном пространстве отражает усталость клеток. Но, чтобы их «соседи» могли это почувствовать, необходимы какие-нибудь рецепторы...
Клетки «чувствуют» аденозин посредством серпантинных рецепторов
И они есть! Это аденозиновые рецепторы. По структуре это горячо любимые нашим небольшим научным коллективом рецепторы, сопряженные с G-белком, или серпантинные рецепторы, или 7-трансмембранные рецепторы. Все эти три названия отражают их структурные особенности: это белки, пронизывающие мембрану клетки семью «стежками» (рис. 3).
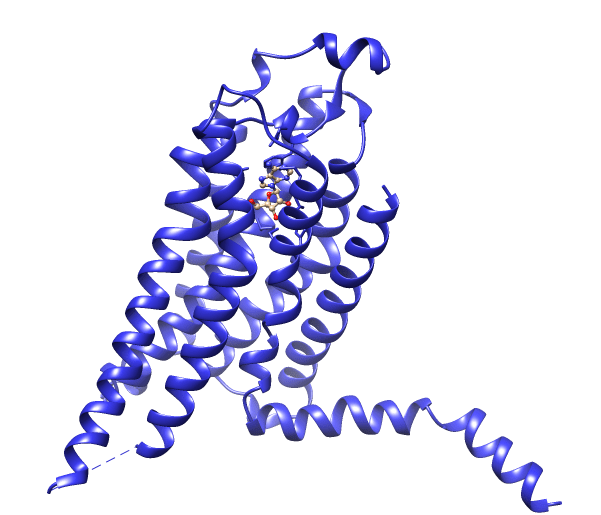
Рисунок 3. Структура GPCR на примере аденозинового рецептора — тип A2A (PDB Id: 2YDO [31]). Пунктир обозначает разрыв в структуре, возникший из-за ограничений рентгеноструктурного метода. Перед моделированием мы «заделывали» такие прорехи специальными программами. Сам рисунок сделан специально для «Биомолекулы» в программе-визуализаторе UCSF Chimera [33], как и все остальные рисунки с трехмерными структурами.
Внутри клетки они также образуют петлю, к которой прикреплен молекулярный «адаптер» — G-белок. Молекула, которая служит химическим сигналом , входит с внешней стороны в связывающий участок — щель между «стежками» рецептора, — что изменяет конформацию рецептора (в том числе и с внутренней стороны) и переключает G-белок в другое положение. А уж он запускает внутри клетки каскад биохимических изменений, в конечном итоге приводящих к тому или иному ответу.
Молекула — химический сигнал, связывающаяся с рецептором, называется лигандом. Этот термин для краткости я и буду употреблять в дальнейшем. Не пугайтесь.
Рецепторы данного класса довольно универсальны в организмах человека и животных (рис. 4): например, они обеспечивают восприятие света нашими глазами при помощи фоторецептора родопсина [6] (только там светочувствительный лиганд уже прикреплен к связывающему участку белка). Рецепторы этого же класса позволяют нам чувствовать вкус и запах [7]. Они же позволяют нормально работать нашим мозгу, сердцу и мышцам, обеспечивая клеткам возможность «чувствовать» многие гормоны и нейромедиаторы, такие как адреналин [8], серотонин, дофамин, ацетилхолин. Кстати, за изучение GPCR на примере адренорецептора в 2012 году была вручена Нобелевская премия по химии. Подробнее об истоках и триумфе открытия читайте в статье «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [9].
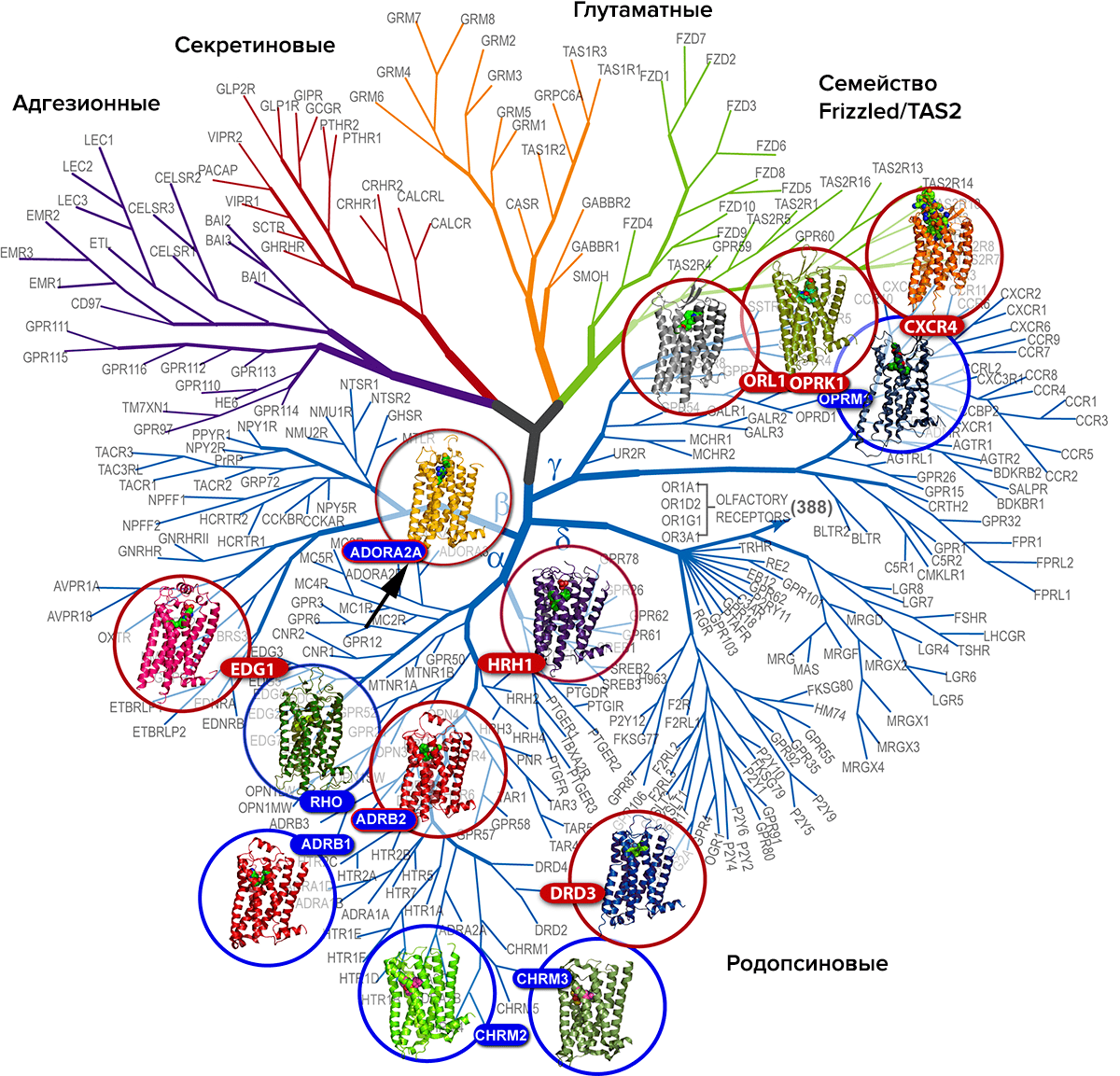
Рисунок 4. Филогенетическое дерево GPCR, отражающее их многообразие. Обозначены пять семейств, самое большое из которых — «близкие родственники» родопсина, позволяющего нам видеть. В эту группу входят рецепторы к адреналину, ацетилхолину, дофамину... и аденозину. Черной стрелкой и кодом ADORA2A обозначен наш герой — аденозиновый рецептор. В данном случае — тип A2A.
А про аденозиновые рецепторы расскажем сейчас мы. Они представлены четырьмя близкородственными белками, когда-то появившимися в результате «копирования» одного гена. Так дело обстоит со многими рецепторами, в том числе и GPCR. Каждый белок обозначаются латинской буквой A (ну раз аденозиновый!) с цифрой и — иногда — буквой в нижнем индексе: A1, A2A, A2B, A3. Это рецепторы с точно такой же структурой, как я описал выше. Они связывают аденозин и сигнализируют клетке, что пора отдохнуть [10]. Нейронам — клеткам головного мозга — что пора спать. Клеткам сердца — что пора уменьшить активность и не так энергично качать кровь, а то хозяин получит инфаркт. А еще — что пора вырастить новые сосуды для снабжения ткани кислородом, уменьшить воспаление... Словом, регулируют массу процессов.
Поэтому аденозиновые рецепторы — довольно популярная мишень у молекулярных фармакологов и биоинформатиков. Лекарственные средства, действующие на эти рецепторы, можно использовать для расширения бронхов при бронхоспазме. Аденозин и подобные ему вещества — хорошие средства для лечения аритмий (вспомните, что аденозин сигнализирует сердцу «Пора отдохнуть, хватит биться в темпе чечетки!»). А иногда на рецепторы начинают заглядываться психиатры и неврологи — из веществ, их блокирующих, могут получиться неплохие препараты для симптоматического лечения деменции (слабоумия вследствие заболевания мозга) [10]. Интересуются ими и некоторые уставшие от тирозинкиназ молекулярные онкологи — оказывается, это потенциальные мишени для противоопухолевой терапии (да, так много процессов регулируют наши рецепторы) [11]. А еще через них можно воздействовать на боль, воспаление, нарушения сна [10]...
В общем, аденозиновые рецепторы очень интересны, и к ним нужно разрабатывать лекарства. Как агонисты (средства, активирующие рецепторы), так и антагонисты (вещества, блокирующие их). Не говоря уже о том, что сама по себе химическая передача сигнала об усталости — это до крайности интересно. Поэтому мы на кафедре химии Тверского государственного медицинского университета занялись этой тематикой. Но, прежде чем заняться, надо разобраться, что уже сделано до нас. А до нашего коллектива многое сделали не только другие исследователи, но и — прежде всего — сама природа.
Кофеин и его компания. Злостные молекулярные обманщики
Самыми известными природными антагонистами данных рецепторов являются как раз кофеин (главное действующее вещество кофе, рис. 5а) и теофилин (содержится в чае, рис. 5б). Они блокируют аденозиновые рецепторы, и поэтому клетки мозга не чувствуют накопившегося аденозина, а человеку не хочется спать. На базе этих же веществ создано большое количество синтетических антагонистов аденозиновых рецепторов, проходящих сейчас «кастинг» на роли новых лекарств (рис. 5 в и г).

Рисунок 5. Антагонисты аденозиновых рецепторов: а — Кофеин — главное «действующее вещество» кофе, тонизирует нервную систему. б — Теофилин — вещество, расширяющее бронхи, используется для лечения бронхиальной астмы и хронической обструктивной болезни легких. в — 8-циклопентил-1,3-дипропилксантин (DPCPX) — мощный блокатор аденозиновых рецепторов, используется в экспериментальных исследованиях. г — Деренофиллин — возможное новое лекарство для лечения сердечной и почечной недостаточностей.
Причина такой активности кофеина и его аналогов (они называются ксантинами) кроется в их химической структуре. Кофеин, теофилин и подобные ему вещества напоминают аденозин без остатка сахара рибозы. Поэтому они могут спокойно зайти в связывающий участок рецептора, закрепиться там и имитировать все взаимодействия, кроме двух водородных связей, образуемых рибозой и необходимых для активации рецептора. Этакая молекулярная обманка: залез в связывающий участок, но рецептор не активировал. А так как место занято, настоящий аденозин тоже теперь не сможет его активировать (рис. 6а, 6б и 6в).
Примерно так же себя ведут более мощные синтетические блокаторы аденозиновых рецепторов, созданные на основе кофеина, например DPCPX (просто у него такое длинное название, что мы зовем его по аббревиатуре, рис. 6г). И вообще, так на самом деле действуют очень многие лекарства, если не сказать все — притворяются настоящим гормоном или медиатором, а его функций не выполняют. Об этом можно написать целую книгу, ну а я как-нибудь напишу еще заметки на эту тему специально для «Биомолекулы».
А кого, собственно, обманывают растения?
Кофеин довольно широко распространен в растительном мире, его умеют синтезировать около 100 видов растений из 13 различных порядков [17]. Помимо собственно кофейного дерева (рис. 7а), к ним относятся чайный куст (в чае тоже есть кофеин!), падуб парагвайский (из которого делают тонизирующий напиток мате, рис. 7б), гуарана, какао [17] и — неожиданно — лимонное дерево (рис. 7в) [18].
Кофеин — классический пример так называемых вторичных метаболитов — веществ, которые никак не используются в биохимических путях того организма, который их синтезировал, и не служат продуктами выделения (о вторичных метаболитах читайте в статье «Биомолекулы»: «О чем пахнут растения» [19]). То есть самому организму они как бы и ни зачем. Они синтезируются для защиты от микробов и травоядных, привлечения опылителей, то есть для воздействия (подчас поистине фармакологического) на другой организм. Растения синтезируют кофеин из тех же самых нуклеотидов, из которых строят ДНК и РНК, и которые используют для запасания химической энергии [17]. Параллели с нашим нуклеозидом аденозином налицо. Создается впечатление, что растения «нарочно» синтезируют для кого-то обманный аналог нуклеозида.
Но не для наших же аденозиновых рецепторов, чтобы помочь нам взбодриться? Эволюция вряд ли стала бы устраивать такое биохимическое шоу по нашу душу. Набираю это предложение и предвижу ликование сторонников теории разумного замысла... Но и здесь нестыковка: вряд ли Создатель стал бы наделять около 100 видов растений способностью синтезировать кофеин ради человека — нам было бы достаточно одного кофе... Ну плюс чай... Но лимонное дерево тут точно лишнее, лимоном мы пользуемся немного в других целях. Так что во всем виновата, похоже, эволюция.
И самый первый кандидат на роль «мишени» для кофеина — насекомые! Те, что поедают листья растений, и те, что их опыляют. Подробно об этом профессор Нортумбрийского университета Дэвид Кеннеди написал целую книгу — Plants and the human brain [17]. В ней автор научно, но увлекательно рассказывает о том, что у насекомых и людей нервная система, в принципе, устроена до ужаса сходно! Нет, конечно, строение мозга разное, но одни и те же функции у нас и у насекомых контролируются практически одними и теми же нейромедиаторами. Кроме того, белки-рецепторы для этих нейромедиаторов имеют почти такое же строение, как у нас. Поэтому растения эволюционно целились в нервную систему насекомых, а «попали» и продолжают попадать в мозг человека.
Так чего растения добиваются от насекомых, обильно «снабжая» их кофеином? Во-первых, кофеин может быть ядовит для насекомых, питающихся этими растениями. Любимое экспериментальное животное молекулярных биологов... — нет-нет, не мышь, а плодовая мушка дрозофила — при хроническом введении кофеина меньше живет и оставляет меньше потомства. Возможно, не лучшим образом дела идут и у других насекомых, отведавших «запретный плод» кофеина. Механизм этого эффекта, похоже, хотя бы отчасти связан с действием через аденозиновый рецептор. Кстати, в то время как млекопитающие накопировали его себе аж в четырех экземплярах и каждый белок затем подредактировали в ходе эволюции, насекомые вполне довольствуются всего одним рецептором. На все случаи жизни, так сказать. Блокирование данного рецептора кофеином in vivo приводит к тому, что насекомое меньше спит, больше двигается... и меньше ест. Чем-то похоже на поведение человека, употребившего большие дозы кофеина. И что еще нужно растению? Так изощренно оно влияет на поведение насекомого [17].
Но, помимо токсического эффекта, у кофеина есть и благотворный. Его стимулирующее действие не ограничивается только повышением общей активности и нежеланием спать. Кофеин блокирует аденозиновые рецепторы на нейронах гиппокампа — отдела мозга, отвечающего за память (рис. 8а). При этом нейроны гиппокампа активируются, улучшая запоминание и результаты обучения [18].
Именно поэтому неврологи и психиатры и присматриваются к антагонистам аденозиновых рецепторов как к средствам для улучшения памяти, внимания и мышления при заболеваниях мозга.
В мозге насекомых есть аналогичная структура — грибовидные тела (рис. 8б), отвечающие за память и сложные формы поведения [20]. На нейронах грибовидных тел также есть аденозиновые рецепторы, блокирование которых улучшает запоминание насекомыми значимой для них информации. В своей статье группа британских (ну не смейтесь, серьезная статья!) и американских ученых обосновывает гипотезу, что содержащиеся в нектаре лимонного дерева небольшие концентрации кофеина улучшают запоминание насекомыми запаха опыляемого цветка [18]. Растение дает насекомому лекарство для улучшения памяти, чтобы лучше ему запомниться... Ну и ну! Впрочем, стоит ли удивляться — я уже упоминал, что растения вообще часто решают свои проблемы в отношениях с другими организмами химическим путем, иной раз весьма оригинально [21]... Мы так не умеем, жалко... Ну зато мы говорить умеем и производим впечатление несколько по-другому.
Флавоноиды тоже блокируют аденозиновые рецепторы. Но как именно — до конца не известно
Как я писал выше, ученые-медики вовсю пытаются изобрести новые лекарства, блокирующие аденозиновые рецепторы. И делают их в основном «на базе» структуры кофеина и прочих ксантинов. Но есть еще один класс соединений, перспективный в плане блокирования аденозиновых рецепторов — флавоноиды, которые и так вызывают у медиков неугасающий интерес.
Флавоноиды — вообще вещества интересные. С химической точки зрения, они собраны из нескольких фенольных колец (их еще называют полифенолами). То есть химически это «пухлая» молекула из нескольких колец, из которой гидроксигруппы торчат во все стороны, как иглы из ежа. Эти соединения синтезируются почти всеми растениями и встречаются в них в значительных количествах. И тоже являются вторичными метаболитам, то есть самому растению как бы не нужны... Но функций у них куда больше, чем у кофеина [22].
Во-первых, это натуральные краски и ароматизаторы цветов (рис. 9а и 9б). Посмотрите на цветущий луг — природа рисовала эту красоту флавоноидной краской. Да и само название флавоноидов происходит от латинского слова flavus — желтый. О том, как флавоноиды формируют окраску растений, как они образуются сами и как мы можем это использовать, читайте в статье «Разноцветные “чудеса” науки» [23].
Во-вторых, это мощные антиоксиданты — это одна из причин, почему их так любят медики. Но и эту функцию растения придумали явно не ради человека, а ради себя любимых. У нас активные формы кислорода , повреждающие клетки, могут возникать только в результате утечек электронов через внутреннюю мембрану митохондрий. Не такие уж большие масштабы — как протечки воды из старого крана в ванной. «Штатных» систем антиоксидатной защиты клетки вполне достаточно. А вот у растений есть хлоропласты, которые, мало того, что оснащены системой переноса электронов, похожей на митохондриальную, так еще при этом не расходуют кислород, а производят его! Тут уже активные формы кислорода будут хлестать как кипяток из прорванной батареи [24]. Приходится растениям набивать свои клетки химическими «ловушками» для радикалов, на роль которых в силу своего химического строения отлично годятся флавоноиды. Ну, а человек этими плодами эволюции пользуется.
Недавно стало известно, что активные формы кислорода не всегда оказываются врагами, а антиоксиданты — друзьями. Подробнее об этом — в статье «Активный кислород: друг или враг, или О пользе и вреде антиоксидантов» [25].
Опять же, в силу структурных особенностей флавоноиды способны взаимодействовать со многими белками-рецепторами как в организме растений, так и в организме человека. А может ли быть иначе, если ты — круглая органическая молекула, способная за счет гидрофобных взаимодействий «прилипнуть» к любой неполярной аминокислоте, да еще усеянная гидроксигруппами (образовать водородные связи не проблема!)
В организме растений флавоноиды участвуют в ответе на стресс, в транспорте ауксина, и, самое главное, служат сигналом растения бактериям-симбионтам — химическим «разрешением» колонизировать свои корни [22]. Как я уже говорил, растения в принципе любят общаться химически, нам до этого еще расти и расти...
Флавоноиды, как и кофеин, блокируют аденозиновые рецепторы. Возможно, растения и не хотели на этот раз «попасть» в чьи-то аденозиновые рецепторы, но так случайно получилось в силу химической «универсальности» флавоноидов. Но ученые все равно уцепились за них. Флавоноиды связываются со многими рецепторами, однако пока дело ограничивается исследованиями связывания и размышлениями о перспективах. Но в случае с аденозиновым рецептором их восприняли на редкость всерьез и уже вовсю разрабатывают химически модифицированные производные, избирательно связывающиеся с одним из четырех имеющихся у человека аденозиновых рецепторов.
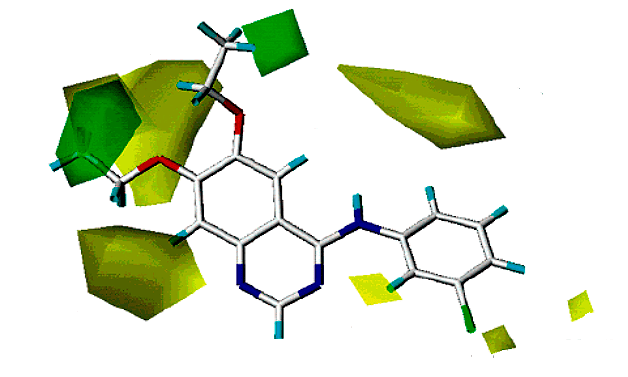
Обычно при разработке новых лекарств стараются получить молекулярную модель связывания вещества-прототипа с рецептором. Либо исследуют структуру комплекса экспериментальным путем, либо строят компьютерную модель. Сегодня много таких структур для связывания ксантинов и их производных с аденозиновыми рецепторами. А вот изыскания по флавоноидам до сих пор ведутся практически вслепую, моделей структуры комплекса для них нет. Есть разве что данные анализа связи структуры соединения и его активности, плюс еще модели CoMFA (Comparative Molecular Field Analysis, сравнительного анализа молекулярных полей) [26]. Если рецептор подобен замку, а лиганд ключу, то CoMFA — это «слепок с ключа», то есть попытка на компьютере рассчитать структуру сайта связывания по структурам многих лигандов (рис. 10а и 10б).
Но в случае флавоноидов с такими моделями есть определенная загвоздка... Как я уже говорил, флавоноид — это тот еще молекулярный ежик, не ключ в замке, а настоящая молекулярная отмычка. И при наложении CoMFA вполне может получиться «лишняя» водородная связь с рецептором. Вот исследователи из США и Италии таким образом две связи насчитали [26]... Пора бы уже иметь хоть какую-то структурную модель, чтобы проверить. Этим мы и решили заняться, однако неожиданно в литературе подвернулось еще одно интересное соединение.
Изовальтрат тоже блокирует аденозиновые рецепторы
Содержится это вещество, как ни странно, в корнях валерианы! Называется оно изовальтрат и принадлежит к валепотриатам — одному из классов соединений, вносящих вклад в седативное действие валерианы. Однако аденозиновый рецептор оно также блокирует [27]! Видимо, его возбуждающий эффект «перевешивается» действием на другие рецепторы нервной системы. К нему исследователи тоже присматриваются как к прототипу для создания новых антагонистов аденозиновых рецепторов.
В случае с кофеином хотя бы понятно, как он блокирует рецепторы: он химически похож на аденозин без рибозы. Но флавоноиды и валепотриаты химически резко отличаются как от аденозина, так и от кофеина. Они не содержат в своей структуре азотистого основания. Поэтому трудно понять, как они должны связаться с рецептором, чтобы заблокировать его.
Устраняем неясности при помощи компьютерного моделирования: флавоноиды
Мы нашим дружным коллективом из трех авторов решили прояснить этот вопрос методами компьютерного моделирования [28], [29]. Для этого мы воспользовались уже описанной выше и широко распространенной у биоинформатиков методикой докинга, но с некоторыми новшествами.
Обычно при докинге молекула рецептора жесткая — иначе вычислительных ресурсов не хватит. Это, правда, не есть хорошо, так как именно подвижность молекулы рецептора обеспечивает биологический ответ клетки, и пренебрегать ею — значить делать довольно грубое допущение. Но у флавоноидов в молекуле мало вращаемых связей, то есть гибкость лиганда тоже низкая. И обычный докинг такой молекулы в какой-нибудь рецептор становится занятием неблагодарным — рецептор не может обнять лиганд, а лиганд не может удобно улечься в рецепторе. Молекулярная динамика? Требует много ресурсов, нам она пока недоступна. А может, есть все-таки решение для докинга с гибким рецептором?
Такое решение не только есть, но еще имеет удобный веб-интерфейс. Знакомьтесь — Galaxy7TM [30]. Устанавливать ничего не надо. Да и справится даже новичок.
Моделирование GPCR и их комплексов с лигандами — огромная головная боль для биоинформатики. Кристаллические структуры GPCR исчисляются уже десятками, но по сравнению с огромным количеством таких рецепторов этого все равно недостаточно. Поэтому моделировать приходится много. Разработчики справедливо рассудили, что можно сделать сервер именно для гибкого докинга лигандов в GPCR, а не во все возможные белки, и так сэкономить вычислительные ресурсы. Благо есть модель движений любого GPCR’а. Остается только применить их к нашему белку, дальше, фактически, провести обычный докинг в полученные конформации и чуть-чуть подогнать лиганд и рецептор друг к другу, немного «расслабив» молекулы [30].
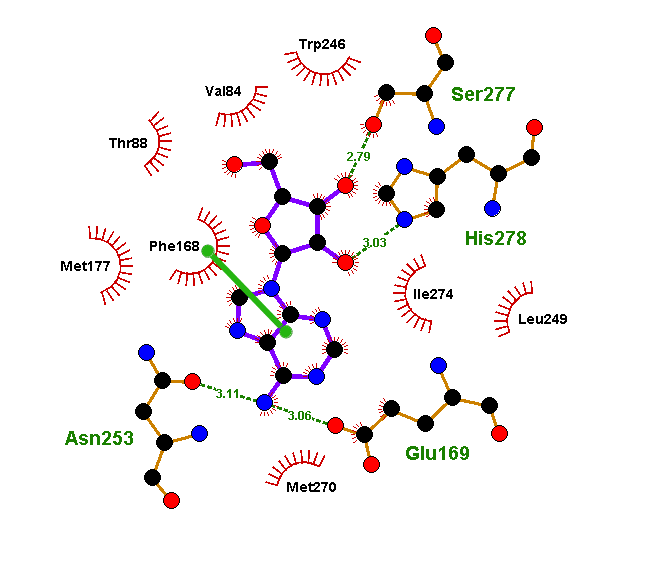
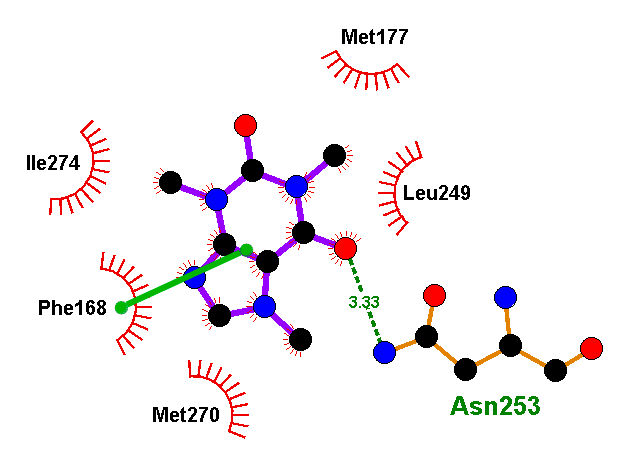
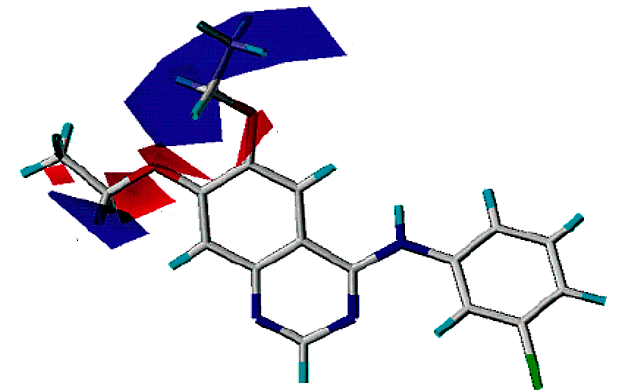
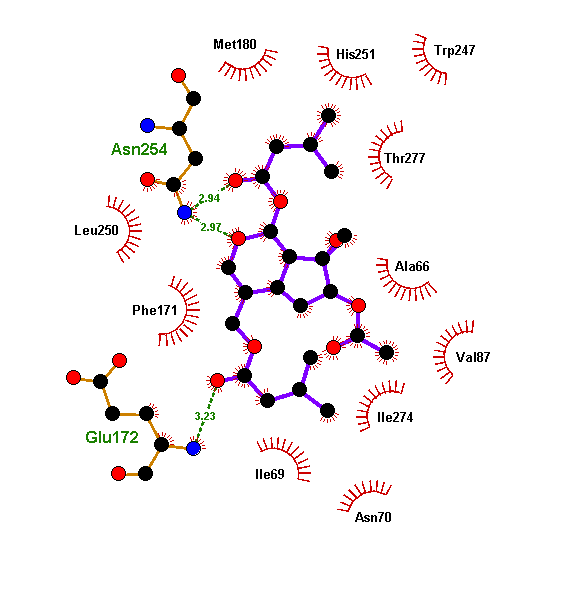
Полученные при докинге варианты связывания лиганда называются решениями докинга. И в каждом докинге у нас было решение, где флавоноид или изовальтрат образуют те же связи, что и ксантины. А связи, активирующие рецептор, он так же спокойно «игнорирует». И зачастую такое решение было даже не одно. Связи флавоноидов в таких моделях крайне похожи на связи кофеина. Просто посмотрите и сравните (рис. 11а). Да и положение молекулы подчас очень сходно (рис. 11б и 11в).
Флавоноиды оказались куда более похожими на ксантины с точки зрения рецептора, чем это могло показаться. Рецептор ведь не смотрит на формулу молекулы — у него нет глаз. Он узнает ее «наощупь». А наощупь флавоноиды очень похожи на ксантины, особенно на новые антагонисты типа DPCPX. Так же, как и кофеину, им достаточно:
- образовать водородную связь с аспарагином (при таком количестве гидроксигрупп — не проблема);
- гидрофобно «прилипнуть» к лейцину, изолейцину и фенилаланину (мощное органическое «ядро» в помощь);
- ароматически притянуться к бензольному кольцу фенилаланина (не беда, целых три бензольных кольца в молекуле, выбирай, какое ближе).
В общем, кофеин прикидывается аденозином. Но флавоноиды его перехитрили — они смогли прикинуться кофеином!
В работе мы детально описали, как флавоноиды это делают на молекулярном уровне [28]. Внесли небольшие уточнения — в предыдущих моделях, выполненных методом «слепок с ключа», одна водородная связь все-таки лишняя. Оказалось, что и одной хватит. Такие уточнения потенциально могут сделать разработку новых антагонистов аденозиновых рецепторов более легкой и продуктивной.
Чтобы убедиться, что из множества решений докинга мы взяли в работу именно те, что надо, мы попробовали предсказать энергию связывания для наших моделей. Делали мы это с помощью доступной онлайн программы KDEEP [31], в основе которой лежит нейронная сеть. Это значит, что программа в некотором роде имитирует работу мозга человека и животных и напоминает обучающегося робота — Электроника или Игрека. Только «заточенного» под узкую задачу — предсказание аффинности лиганда к рецептору.
Абсолютные значения аффинности, конечно, отличались от экспериментальных, зато с помощью программы мы смогли расставить наши несколько флавоноидов в порядке уменьшения аффинности к одному из аденозиновых рецепторов. При этом получились лишь небольшие погрешности. Такой результат — неплохое предварительное подтверждение правильности нашей модели. В наших планах — провести подобную проверку на большем наборе данных. В идеале, для окончательной валидации модели следовало бы провести эксперимент методом сайт-специфического мутагенеза: «в пробирке» заменить в структуре рецептора ключевые остатки связывающего участка «по одиночке» и измерить связывание полученных мутантных форм с флавоноидами. Однако на данный момент мы не располагаем ресурсами для проведения такого затратного и сложного эксперимента.
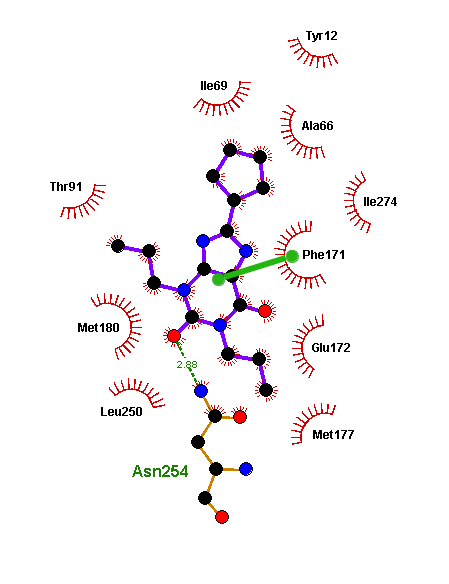
Модель приятно удивила: изовальтрат
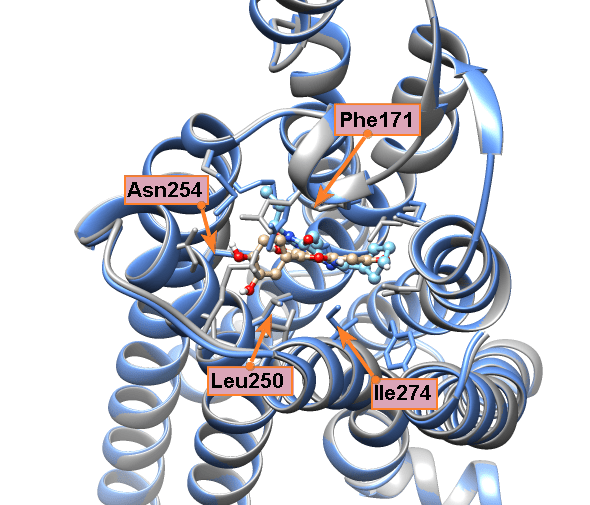
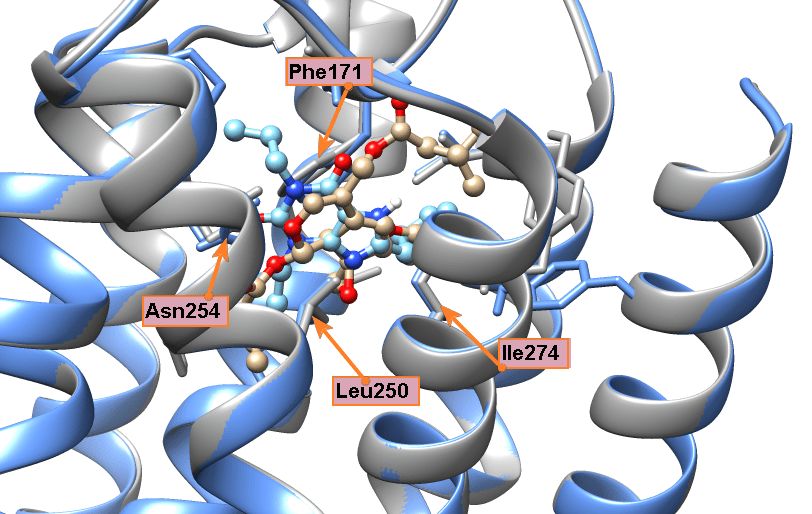
Особенно удачная модель получилась с валепотриатом изовальтратом. Он стоит немного особняком, так как для флавоноидов есть большой массив экспериментальных данных, а с изовальтратом же пришлось работать индивидуально. Для него мы также получили не одно решение, где его связи с рецептором подозрительно напоминали связи кофеина и прочих ксантинов. Когда мы выбрали из этих моделей энергетически самую выгодную (рис. 12а) и сравнили ее с моделью связывания DPCPX, то были приятно удивлены, что изовальтрат и DPCPX располагаются в рецепторе практически идентично (рис. 12б и 12в). Это происходит из-за очень сходной формы молекул.
Самое интересное, что изовальтрат неароматичен (не имеет такого же электронного облака, как флавоноиды и ксантины), и поэтому к фенилаланину должен притягиваться не так сильно. Но он настолько похож на знакомые аденозиновому рецептору кстантины, что рецептор на радостях его простил и обнял как своего... И опять заблокировался! Вы чувствуете, что изовальтрат вдохновил нас не на шутку? Настолько вдохновил, что его связывание мы описывали в отдельной статье [29].
В наших работах мы постарались немного расширить химические горизонты в разработке блокаторов аденозиновых рецепторов. Как оказалось, на роль молекулярных «обманок» для аденозинового рецептора годятся не только ксантины. Мы наметили пути, как такие молекулярные «фальшивки» сделать из соединений разной структуры. Если уж вся эта история с аденозиновыми рецепторами — один сплошной обман, то мы тоже в игре. Будем думать, как обвести вокруг пальца астму, рак и заболевания мозга.
Благодарности
Автор благодарит своих руководителей и соавторов к.х.н. Лопину Надежду Петровну и к.б.н. Бордину Галину Евгеньевну за помощь в выполнении и публикации «пересказанных» здесь научных работ, а также за любезное разрешение выступить популяризатором этих исследований.
Литература
- Holger K. Eltzschig. (2013). Extracellular adenosine signaling in molecular medicine. J Mol Med. 91, 141-146;
- Michael Lazarus, Yo Oishi, Theresa E. Bjorness, Robert W. Greene. (2019). Gating and the Need for Sleep: Dissociable Effects of Adenosine A1 and A2A Receptors. Front. Neurosci.. 13;
- Sebastian C. Holst, Hans-Peter Landolt. (2015). Sleep Homeostasis, Metabolism, and Adenosine. Curr Sleep Medicine Rep. 1, 27-37;
- Theresa Bjorness, Robert Greene. (2009). Adenosine and Sleep. CN. 7, 238-245;
- Hong Liu, Yang Xia. (2015). Beneficial and detrimental role of adenosine signaling in diseases and therapy. Journal of Applied Physiology. 119, 1173-1182;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Запах горького ветра;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Kenneth A. Jacobson, Zhan-Guo Gao. (2006). Adenosine receptors as therapeutic targets. Nat Rev Drug Discov. 5, 247-264;
- Wenying Ren, Zhenhua Qiao, Hongwei Wang, Lei Zhu, Li Zhang. (2003). Flavonoids: Promising anticancer agents. Med. Res. Rev.. 23, 519-534;
- Роль слабых взаимодействий в биополимерах;
- Физическая водобоязнь;
- 12 методов в картинках: «сухая» биология;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Kennedy D.O. Plants and the human brain. NY: Oxford University Press, 2014;
- G. A. Wright, D. D. Baker, M. J. Palmer, D. Stabler, J. A. Mustard, et. al.. (2013). Caffeine in Floral Nectar Enhances a Pollinator's Memory of Reward. Science. 339, 1202-1204;
- О чем пахнут растения?;
- Strausfeld N.J., Hansen L., Li Y., Gomez R.S., Ito K. (1998). Evolution, discovery, and interpretations of arthropod mushroom bodies. Learn. Mem. 5, 11–37;
- Жасмонаты: «слёзы феникса» из растений;
- Muhammad Khalid, Saeed-ur-Rahman, Muhammad Bilal, Dan-feng HUANG. (2019). Role of flavonoids in plant interactions with the environment and against human pathogens — A review. Journal of Integrative Agriculture. 18, 211-230;
- Разноцветные «чудеса» науки;
- Борисова-Мубаракшина М.М. и Козулева М.А. (2013). Кислородный парадокс. «Химия и жизнь». 11;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Kenneth A. Jacobson, Stefano Moro, John A. Manthey, Patrick L. West, Xiao-duo Ji. (2002). Interactions of Flavones and Other Phytochemicals with Adenosine Receptors. Flavonoids in Cell Function. 163-171;
- Svenja K. Lacher, Ralf Mayer, Kathrin Sichardt, Karen Nieber, Christa E. Müller. (2007). Interaction of valerian extracts of different polarity with adenosine receptors: Identification of isovaltrate as an inverse agonist at A1 receptors. Biochemical Pharmacology. 73, 248-258;
- G.F. Kurakin, N.P. Lopina, G.E. Bordina. (2019). COMPUTATIONAL MODELLING OF INTERACTION BETWEEN FLAVONOIDS AND ADENOSINE RECEPTORS. PBMPC. 22;
- G.F. Kurakin, N.P. Lopina, G.E. Bordina. (2019). COMPUTATIONAL MODELLING OF INTERACTION BETWEEN ISOVALTRATE AND ADENOSINE A1 RECEPTOR. PBMPC. 22;
- Gyu Rie Lee, Chaok Seok. (2016). Galaxy7TM: flexible GPCR–ligand docking by structure refinement. Nucleic Acids Res. 44, W502-W506;
- José Jiménez, Miha Škalič, Gerard Martínez-Rosell, Gianni De Fabritiis. (2018). KDEEP: Protein–Ligand Absolute Binding Affinity Prediction via 3D-Convolutional Neural Networks. J. Chem. Inf. Model.. 58, 287-296;
- Guillaume Lebon, Tony Warne, Patricia C. Edwards, Kirstie Bennett, Christopher J. Langmead, et. al.. (2011). Agonist-bound adenosine A2A receptor structures reveal common features of GPCR activation. Nature. 474, 521-525;
- Eric F. Pettersen, Thomas D. Goddard, Conrad C. Huang, Gregory S. Couch, Daniel M. Greenblatt, et. al.. (2004). UCSF Chimera?A visualization system for exploratory research and analysis. J. Comput. Chem.. 25, 1605-1612;
- Christopher J. Draper-Joyce, Maryam Khoshouei, David M. Thal, Yi-Lynn Liang, Anh T. N. Nguyen, et. al.. (2018). Structure of the adenosine-bound human adenosine A1 receptor–Gi complex. Nature. 558, 559-563;
- Roman A. Laskowski, Mark B. Swindells. (2011). LigPlot+: Multiple Ligand–Protein Interaction Diagrams for Drug Discovery. J. Chem. Inf. Model.. 51, 2778-2786;
- Andrew S. Doré, Nathan Robertson, James C. Errey, Irene Ng, Kaspar Hollenstein, et. al.. (2011). Structure of the Adenosine A2A Receptor in Complex with ZM241385 and the Xanthines XAC and Caffeine. Structure. 19, 1283-1293.