Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!
24 ноября 2018
Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!
- 4871
- 0
- 7
Подавление экспрессии мутантного гена TTR, вызывающего семейную амилоидную полинейропатию: РНК-индуцируемый комплекс выключения гена (RISC) совместно с интерферирующей РНК (siRNA) бесстрашно летит навстречу злобной патогенной мРНК-мишени, предвкушая расправу.
иллюстрация авторов статьи
-
Авторы
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Патисиран — первый препарат на основе РНК-интерференции, одобренный FDA, — не только спасает жизни людей, страдающих амилоидной полинейропатией. Он начинает писать новую страницу в терапии, о которой мечтали с момента открытия этого механизма подавления экспрессии генов, то есть уже более 20 лет. С какими сложностями сталкивались ученые и как их преодолели? Об этом вы можете узнать в нашей статье.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Амилоиды в первую очередь ассоциируются с болезнью Альцгеймера. Однако амилоидозы — это целая группа заболеваний, связанная с неправильным сворачиванием белка, приводящим к накоплению в тканях нерастворимых фибрилл. Подробнее об этом написано в статье «На руинах памяти: настоящее и будущее болезни Альцгеймера» [1].
Семейная амилоидная полинейропатия (FAP), или наследственный транстиретиновый амилоидоз (hATTR), связана с различными точечными мутациями в гене, кодирующем транстиретин (TTR). В норме он вырабатывается гепатоцитами и осуществляет транспорт витамина А вместе с тиреоидными гормонами к периферическим тканям. Определенные мутации способствуют тому, что мономеры этого белка неправильно сворачиваются и образуют аморфные олигомеры, которые сливаются в фибриллы (рис. 1). По некоторым данным, именно небольшие олигомеры обладают наибольшей токсичностью в клетках [2].

Рисунок 1. Синтез мутантного варианта транстиретина и влияние на этот процесс патисирана. Без лечения мРНК TTR транслируется в белок, который в норме состоит из четырех субъединиц. Мутантные мономеры белка сворачиваются неправильным образом и образуют аморфные олигомеры, кластеры нефиксированного размера, сливающиеся в фибриллы. Образование фибрилл может привести к развитию нейродегенеративных заболеваний и проблемам с сердечно-сосудистой системой.
На начальных стадиях заболевания фибриллы накапливаются в периферической нервной системе, вызывая прогрессирующую полинейропатию. Пациент чувствует мышечную слабость, онемение, боль, позднее происходит иммобилизация. На терминальных стадиях амилоиды препятствуют работе почек и сердца. Насчитывается более 120 амилоидогенных мутаций, определяющих различный характер проявлений наследственного транстиретинового амилоидоза (рис. 2). Заболевание проявляется в среднем возрасте, неумолимо прогрессирует и вызывает смерть через 5–10 лет [3]. К счастью, в мире им страдают лишь около 50 000 человек [4]. По данным Комитета по лекарственным средствам для орфанных заболеваний (COMP), в Европейском союзе частота встречаемости транстиретинового амилоидоза составляет 0,2 на 10 000 человек.

Рисунок 2. Связь генотипа с клиническими проявлениями при транстиретиновом амилоидозе (hATTR). До появления патисирана спасением для таких пациентов являлась трансплантация печени. В Европе также используют препарат тафамидис, который стабилизирует транстиретин. Он связывается с тетрамером и не дает ему диссоциировать на мономеры. Однако в США он так и не смог получить одобрение [5].
[3], рисунок адаптирован
Человечество стремится познать природу, которая порой нашептывает удивительные решения многих наших задач. Приоткрывая завесу тайны жизни организмов, мы видим изумительные механизмы, созданные эволюцией. Так, например, система CRISPR/Cas, обеспечивающая адаптивный иммунитет прокариот, уже не один год вдохновляет ученых на создание генной терапии с ее помощью. О системе можно почитать в статьях «Просто о сложном: CRISPR/ Cas» [6] и «Когда ослепшие прозреют?» [7].
А вот один из молекулярных механизмов эукариот уже подарил нам первое лекарство и надежду на лечение огромного спектра заболеваний. Попробуем разобраться в тернистом двадцатилетнем пути с момента открытия РНК-интерференции до первого официально одобренного FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) препарата.
Итак, как же эукариоты «выключают» гены и зачем?
Воздействовать на белок мы можем принципиально тремя способами. Можно придумать молекулу, которая будет связываться с уже синтезированным белком, препятствуя его работе, или, напротив, побуждая его к действию. Так работает большинство лекарств, например, известный анальгетик и жаропонижающее средство ибупрофен ингибирует фермент циклооксигеназу (ЦОГ), уменьшая выработку простагландинов — веществ, ответственных за воспаление [20].
Но ученые мечтают о новых возможностях: о выключении таргетного гена, вызывающего генетическое заболевание, на уровне ДНК (нокаут) и о выключении без затрагивания самой последовательности ДНК на уровне РНК (нокдаун).
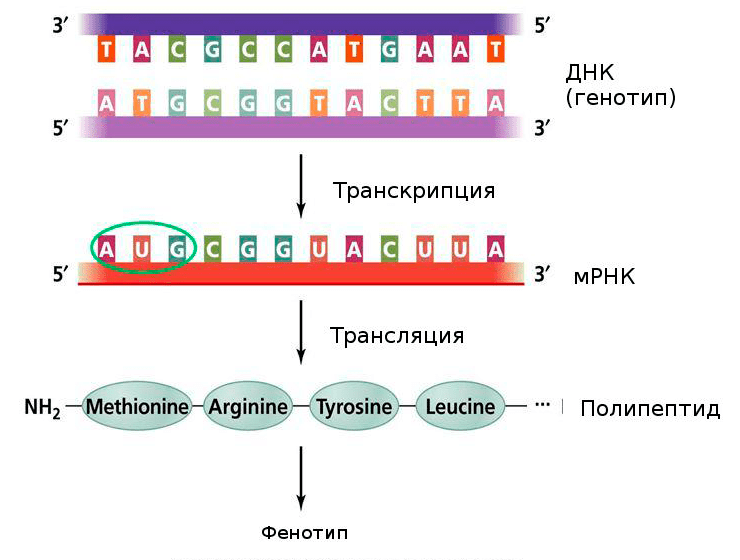
Рисунок 3. Центральная догма молекулярной биологии. Генетическая информация, закодированная в ДНК, переходит в мРНК, и уже с нее синтезируется полипептидная последовательность. Нуклеотиды одной цепочки нуклеиновой кислоты могут быть соединены с нуклеотидами другой по правилу комплементарности. В процессе транскрипции синтезируется смысловая цепь мРНК, и, зная ее последовательность, мы можем синтезировать комплементарную ей цепочку, или антисмысловую цепь.
Pearson Education, Inc., publishing as Benjamin Cummings
В своей работе 1996 года Эндрю Файр (Andrew Fire) и Крейг Мело (Craig Mello) на модельном объекте Caenorhabditis elegans (нематоде) показали, что при внесении двухцепочечной РНК можно полностью «выключить» ген. Как оказалось, происходит это от того, что антисмысловая цепь РНК, комплементарная гену-мишени, вместо ожидаемого повышения экспрессии гена (ведь мы вносим матрицу для трансляции белка) блокирует его синтез. Немногим позже, в 2006 году, за первое применение РНК-интерференции (RNAi) ученые получили Нобелевскую премию [8].
Процесс начинается с того, что поступившая в клетку экзогенная двухцепочечная РНК связывается с рибонуклеазой Dicer (да-да, как та самая овощерезка), которая нарезает ее на небольшие фрагменты длиной 20–25 пар нуклеотидов, с двумя неспаренными основаниями на каждом конце. Такая длина, видимо, оказалась оптимальной для специфического связывания с мишенью. Эти фрагменты взаимодействуют с белковым комплексом RISC, который отщепляет одну из цепей РНК, оставляя вторую на съедение нуклеазам (ферментам, расщепляющим нуклеиновые кислоты), и путешествует с ней по клетке в поисках таргетной мРНК. Обнаружив ее, белок Аргонавт из комплекса RISC разрезает свою мишень (рис. 1 и 4).
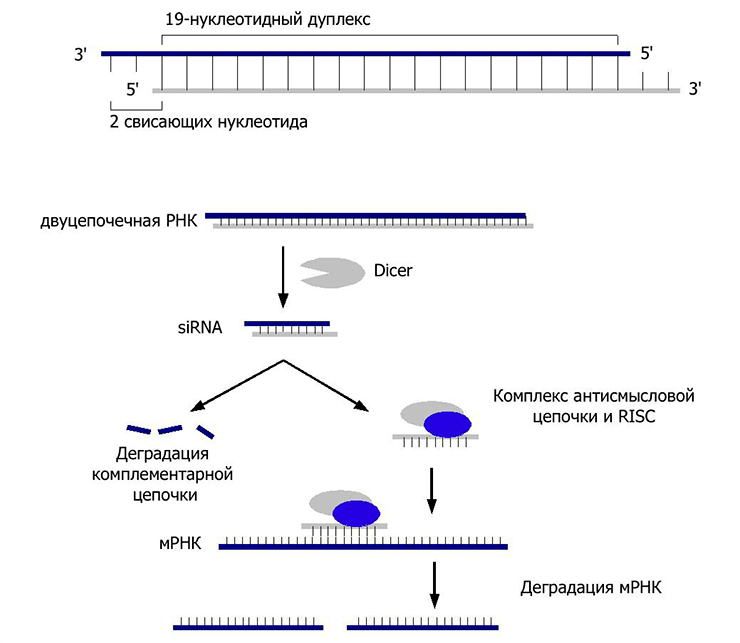
Рисунок 4. РНК-интерференция. Сверху представлена схема строения малой интерферирующей РНК (siRNA). Экзогенная двухцепочечная РНК разрезается ферментом Dicer и встраивается, расплетаясь, в белковый комплекс RISC. Готовый к работе, совместно с siRNA, он путешествует по клетке. При встрече с комплементарной мРНК комплекс индуцирует ее деградацию. Таким образом, клетка уничтожает потенциально вирусную РНК, препятствуя синтезу вирусных белков, а также борется с транспозонами.
Этот механизм выполняет защитную функцию против вирусов, которые стремятся заполучить контроль над клеткой, предоставляя ее белковой машинерии инструкции по производству вирусных агентов. Также интерферирующие РНК могут быть полезны клетке в борьбе с мобильными генетическими элементами, которые активируются при делении клетки и нарушают нормальную работу ее генетического аппарата.
Подробнее о механизмах работы РНК-интерференции можно почитать в статьях «Обо всех РНК на свете, больших и малых» [9] и «Есть ли смысл в антисенсах?» [10].
Также стоит отметить, что РНК-интерференция является не единственным механизмом регуляции экспрессии генов. Для трансляции необходимо, чтобы мРНК была одноцепочечной, поэтому при попадании одноцепочечной антисмысловой РНК в клетку блокируется процесс синтеза белка, а также активируется РНКаза H, разрушающая транскрипт.
В каких случаях мы можем использовать этот изящный механизм?
Нокаут генов активно применяется в лабораторной практике, в биоинженерии и биотехнологии. Геном можно редактировать с помощью рестриктаз с последующим сшиванием лигазами, воздействовать ретровирусами, несущими правильную копию поврежденного гена, а также использовать уже упоминавшийся метод геномного редактирования с помощью CRISPR-Cas9 — системы белков и РНК. Смотрите подробнее в статьях «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [11] и «Человек генномодифицированный / Homo genere mutatio» [12].
Проблема с применением большинства таких методов для лечения человека заключается в низкой селективности редактирования, что может вносить дополнительные мутации в геном. Клетки могут перерождаться в раковые, уходить в апоптоз. Данные побочные действия затрудняют применение описанных подходов для лечения генетических заболеваний человека.
Всего этого можно избежать, выключая гены с помощью РНК-интерференции. Очень перспективна разработка антивирусных лекарств, препятствующих связыванию вирусных белков с таргетной клеткой, а также противоопухолевых препаратов.
Так что же останавливало ученых в реализации этой простой идеи?
Все, кто работал в лаборатории с РНК, знают ее коварство: она быстро деградирует под действием РНКаз, находящихся на поверхности кожи, в слюне, и в большом количестве в кровяном русле. Получается, что препарат просто не успевает добраться до нужных клеток, гены которых необходимо выключить с помощью RNAi.
После долгих и дорогостоящих попыток фармкомпании практически потеряли надежду на терапевтическое применение этого механизма. Однако решение было найдено [13]. Сегодня у одной только компании Alnylam известно семь препаратов на основе РНК-интерференции, находящихся на разных стадиях клинических испытаний (табл. 1).
Мишенями таких лекарств являются не только заболевания, связанные с образованием амилоидных бляшек, но и широкий спектр системных дисфункций. Примеры лекарств, разрабатываемых для лечения таких заболеваний, можно найти в статье «Есть ли смысл в антисенсах?» [10].
| Лекарство | Заболевание | Стадия клинических испытаний |
|---|---|---|
| Patisiran | Наследственный АТТР амилоидоз | Одобрен |
| Givosiran | Острые печеночные порфирии | Поздняя стадия (фаза 2–3) |
| Fitusiran | Гемофилия и редкие кровотечения | Поздняя стадия (фаза 2–3) |
| Inclisiran | Гиперхолестеринемия | Поздняя стадия (фаза 2–3) |
| ALNTTRsc02 | АТТR амилоидоз | Ранняя стадия (фаза 1–2) |
| Lumasiran | Первичная гипероксалурия типа 1 | Ранняя стадия (фаза 1–2) |
| Cemdisiran | Болезни, связанные с системой комплемента | Ранняя стадия (фаза 1–2) |
| * Интересно, что некоторые препараты несут в себе название siRNA, например, Givosiran, Inclisiran; а некоторые препараты, являющиеся антисмысловыми цепочками РНК — Alicaforsen, Inotersen. | ||
Патисиран — первый олигонуклеотидный препарат на основе РНК-интерференции
Лекарственная форма патисирана (коммерческое название — Onpattro, «Онпаттро») состоит из РНК, завернутой в липидные наночастицы (LNPs). При создании действующего вещества разработчики использовали короткие, по 21 паре нуклеотидов, двухцепочечные РНК, которые предварительно модифицировали метильной группой, присоединяемой к атомам кислорода (О-метилировали) [15], и защищали с 3′ конца для увеличения стабильности молекулы (рис. 5).
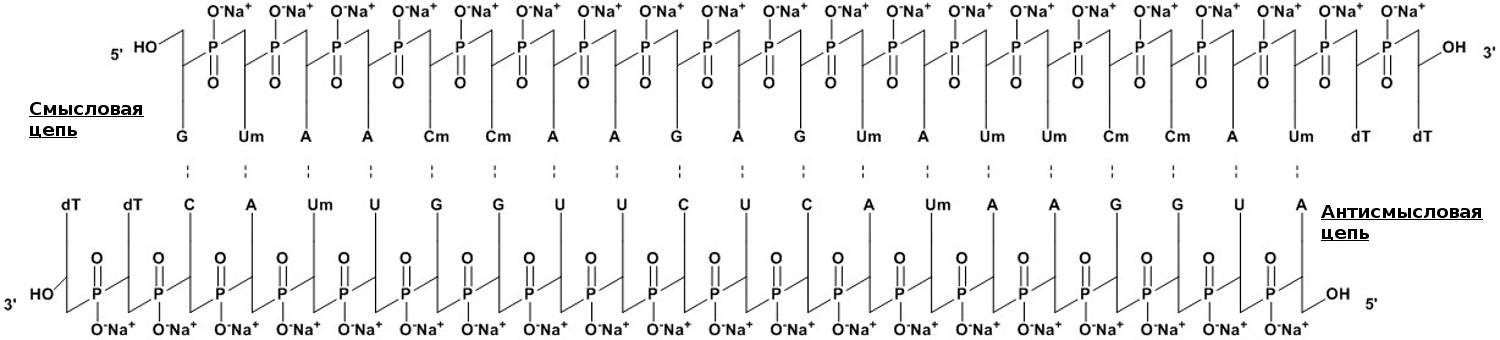
Рисунок 5. Нуклеотидная составляющая патисирана представляет собой короткую 21-буквенную двуцепочечную РНК из смысловой и антисмысловой цепей, которая комплементарна таргетному гену транстиретина (TTR). Для бóльшей устойчивости, некоторые из нуклеотидов О-метилированы (Um, Cm), а на 3′ концах пришиты два тимидина (dT). Молекулярная формула лекарства — C412H480N148Na40O290P40. Молекулярный вес составляет 14 304 Да.
Впервые система доставки малых двухцепочных РНК была предложена в 2010 году и после развивалась вплоть до первого успешного клинического испытания в 2016, которое показало возможность применения РНК-интерференции для лечения генетических заболеваний человека [13].
Липидные наночастицы, защищающие РНК, состоят из внешнего слоя, образованного липидами с полиэтиленгликолем и холестерином, и внутренней полости, заполненной буфером, в которой находятся окруженные катионными частицами интерферирующие агенты (рис. 6).
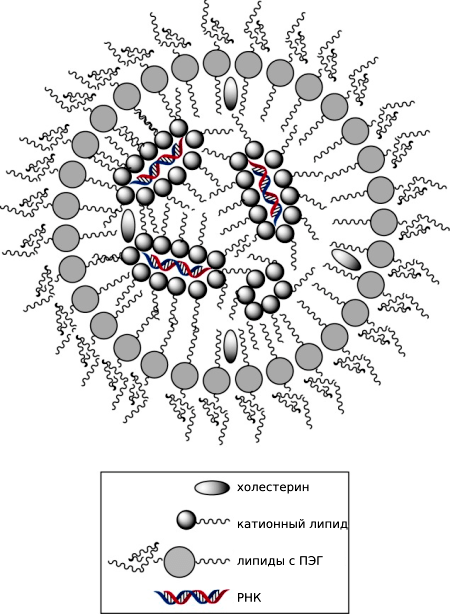
Рисунок 6. Строение липидных наночастиц. Для создания липидных наночастиц эмпирически был разработан специальный протокол, сочетающий различные буферы и типы липидов: смешиваются ионизированные катионные липиды с siRNA в буфере с низкой ионной силой, за счет чего РНК сближаются с липидами и собираются в наночастицы (разноименные заряды катионных липидов и РНК притягиваются). Далее собранные структуры покрываются вспомогательными липидами, холестерином и липидами с полиэтиленгликолем (ПЭГ).
Таким образом, препарат таргетно доставляется в гепатоциты — клетки, продуцирующие амилоидный транстиретин.
Клинические испытания
Любое лекарство проходит через несколько так называемых фаз клинических испытаний перед тем, как будет допущено к продаже и широкому клиническому применению. Узнать больше можно из статей спецпроекта «Клинические испытания».
Для патисирана все клинические испытания прошли успешно. В последней, третьей фазе участвовало 225 пациентов с наследственным транстиретиновым амилоидозом (hATTR), из которых 77 получали плацебо. Ключевым показателем оценки состояния пациентов являлась модифицированная шкала ухудшения нейропатии (mNIS+7). Также использовали тест на ходьбу на расстояние 10 м, оценку индекса массы тела и опрос о качестве жизни. Наблюдение продолжалось в течение 18 месяцев. mNIS+7 ранжируется от 0 до 304 баллов: чем больше, тем хуже состояние пациента (рис. 7). По всем показателям выявили значимое улучшение состояния пациентов по сравнению с группой, принимавшей плацебо [16].
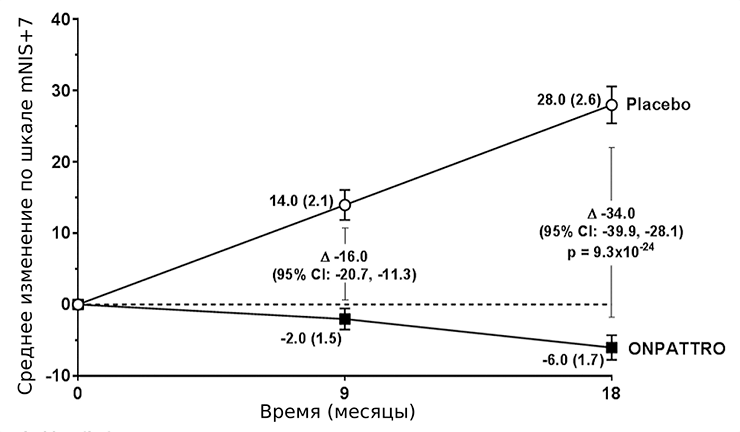
Рисунок 7. Динамика изменений средних значений модифицированной шкалы ухудшения нейропатии (mNIS+7). Разница между группами составляет 34,0 пунктов при p<0,001.
Во время клинических испытаний возникли побочные эффекты: у 10% пациентов, принимавших лекарство, и 3%, принимавших плацебо, выявили инфекции верхних дыхательных путей. У всех пациентов наблюдали падение концентрации витамина А в крови (вспомним функции транстиретина).
FDA одобрило лекарство для всех стадий заболевания 10 августа 2018 года — так, патисиран стал не только первым одобренным препаратом для лечения наследственного транстиретинового амилоидоза, но и первым одобренным средством, в механизме работы которого лежит РНК-интерференция [17].
Комитет по лекарственным средствам для человека (CHMP), входящий в Европейское агентство лекарственных средств (EMA), рекомендовал предоставить разрешение на применение патисирана для лечения наследственного транстиретин-опосредованного амилоидоза у взрослых пациентов с полинейропатией 1 или 2 стадий. Значимого улучшения состояния пациентов с 3 стадией заболевания, по результатам клинических тестов и судя по комментариям представителя компании, достичь не удалось.
Лекарство будет доступно в виде раствора для внутривенного введения с концентрацией активного компонента 2 мг/мл. Примечательна периодичность инъекций: один раз в три недели.
На данный момент стоимость годового курса составляет $450 000, в ближайшее время предполагается снижение стоимости до $350 000. Назначение патисирана, к сожалению, не покрывается всеми страховыми планами.
Компания Alnylam предоставляет несколько типов финансовых тарифов для пациентов разных категорий. Рассмотрим два из них:
- У пациента есть коммерческая страховка.Компания предоставляет программу быстрого старта, обеспечивающую до трех доз лекарства в ожидании подтверждения страхового покрытия без каких-либо затрат. После подтверждения лечение полностью оплачивается страховой фирмой.
- У пациента нет страховки или его заболевание не подпадает под страховой случай.Компания может предоставить лекарство бесплатно, если у пациента есть Medicare, Medicaid (национальные системы страхования в США) или любое другое спонсируемое правительством страхование. Также покрытие полной стоимости или ее части возможно за счет нескольких частных фондов и благотворительных организаций. В данном случае пациенту приходится ждать соблюдения всех формальностей, он не получает лечение сразу.
Нам удалось узнать подробнее о планах компании Alnylam на расширение рынка препарата. На данный момент патисиран доступен на территории США, о продаже на территории России речи пока не идет. Авторы надеются, что с течением времени терапия станет ближе для бóльшего числа больных.
Кто нас ждет теперь?
Как мы смогли убедиться, создание RNAi-препаратов сопряжено с огромными трудностями, связанными с доставкой хрупких РНК к клеткам. Сегодня остается еще много вопросов касательно дизайна и применения липидных наночастиц.
Это перспективное направление открывает, в первую очередь, невероятные возможности для лечения генетических заболеваний человека. Доказанная эффективность патисирана способствует дальнейшему исследованию РНК-интерферирующих агентов, их применению в клинической практике и еще большему накоплению багажа знаний. Возможно, когда-нибудь, мы увидим в аптеках волшебные лекарства против всего, а, может быть, приблизимся к «Дивному новому миру» Олдоса Хаксли. Время покажет.
Литература
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Willbold D. (2017). A life without dementia. Priavoid;
- hATTR guide: learn the signs of hereditary ATTR amyloidosis;
- Philip N. Hawkins, Yukio Ando, Angela Dispenzeri, Alejandra Gonzalez-Duarte, David Adams, Ole B. Suhr. (2015). Evolving landscape in the management of transthyretin amyloidosis. Annals of Medicine. 47, 625-638;
- Mathew S. Maurer, Jeffrey H. Schwartz, Balarama Gundapaneni, Perry M. Elliott, Giampaolo Merlini, et. al.. (2018). Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 379, 1007-1016;
- Просто о сложном: CRISPR/Cas;
- Когда ослепшие прозреют?;
- Michael Hopkin. (2006). RNAi scoops medical Nobel. news@nature;
- Обо всех РНК на свете, больших и малых;
- Есть ли смысл в антисенсах?;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Человек генно-модифицированный / Homo genere mutatio;
- Victor Kotelianski, Timofei Zatsepin, Yuri Kotelevtsev. (2016). Lipid nanoparticles for targeted siRNA delivery – going from bench to bedside. IJN. Volume 11, 3077-3086;
- Delivering on RNAi therapeutics: Patisiran and beyond. (2018). Alnylam;
- Беловешкин А. (2017). Метилирование и детоксикация. «Школа ресурсов здоровья»;
- David Adams, Alejandra Gonzalez-Duarte, William D. O’Riordan, Chih-Chao Yang, Mitsuharu Ueda, et. al.. (2018). Patisiran, an RNAi Therapeutic, for Hereditary Transthyretin Amyloidosis. N Engl J Med. 379, 11-21;
- Heidi Ledford. (2018). Gene-silencing technology gets first drug approval after 20-year wait. Nature. 560, 291-292;
- Ian Fyfe. (2018). Treatment success in hereditary transthyretin amyloidosis. Nat Rev Neurol. 14, 509-509;
- Ole B Suhr, Teresa Coelho, Juan Buades, Jean Pouget, Isabel Conceicao, et. al.. (2015). Efficacy and safety of patisiran for familial amyloidotic polyneuropathy: a phase II multi-dose study. Orphanet J Rare Dis. 10;
- Жасмонаты: «слёзы феникса» из растений.