Онкологические заболевания нервной системы
01 ноября 2024
Онкологические заболевания нервной системы
- 1576
- 0
- 8
Опухоли мозга – очень редкие и очень опасные новообразования; в некоторых случаях, например, при глиобластоме не помогают даже повторное хирургическое вмешательство и курсы химиотерапии. Какие бывают опухоли мозга, как их диагностируют и лечат – в нашей статье!
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Злокачественные опухоли нервной системы встречаются редко по сравнению с другими видами рака, но чаще имеют неблагоприятный прогноз. Исследования последних лет существенно продвинулись в разработке новых методов для диагностики онкологических заболеваний нервной системы, в том числе на ранних стадиях, и расширили наш терапевтический арсенал. В этой статье мы разберемся, какие бывают злокачественные опухоли мозга, как можно их диагностировать и какие терапевтические подходы уже используются либо находятся на стадии разработки или одобрения. Кроме того, мы обсудим причины, по которым терапия онкологических заболеваний нервной системы с помощью разных подходов так сложна.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
В 2022 году было диагностировано почти 20 миллионов случаев рака, и ежегодно на каждые 100 тысяч населения приходится примерно 146 смертей от различных онкологических заболеваний, что делает рак одной из главных угроз современному здравоохранению. Причиной рака служит перерождение клеток определенных органов, которые начинают неконтролируемо делиться, формируя опухоль, а затем по кровотоку достигают других органов и тканей, где закрепляются и продолжают деление, образуя «колонии» — метастазы. Опухоли, клетки которых проникают в окружающие ткани и в некоторых случаях могут давать метастазы, называют злокачественными . Если дело ограничивается первичной опухолью, которая не инвазировала другие ткани, то такие опухоли называют доброкачественными, и зачастую их хирургическое удаление приводит к полному выздоровлению.
Подробное описание биологии раковых клеток, диагностики рака и других его аспектов — в нашем спецпроекте «Онкология».
Клетки нервной системы тоже могут подвергаться злокачественному перерождению, а также давать начало доброкачественным опухолям. По сравнению с онкологическими заболеваниями других органов, рак мозга возникает достаточно редко: вероятность им заболеть в течение всей жизни всего около 0,6%. Зато он более «злой», и пятилетняя выживаемость при нем — в среднем около 33,4%.
Классификация опухолей нервной системы
На данный момент классифицируют около 13 групп опухолей центральной нервной системы, которые происходят от клеток разных видов (в это число входят как злокачественные, так и доброкачественные опухоли, а также метастазы [1]). Год от года количество случаев злокачественных заболеваний нервной системы растет [2], увеличивается точность диагностики, и Всемирная организация здравоохранения раз в несколько лет публикует их уточненную классификацию (сейчас в силе классификация, опубликованная в 2021 году). Ранее было принято классифицировать опухоли мозга только по их происхождению и гистологическим свойствам, но на данный момент в классификации учитываются и молекулярные особенности опухолевых клеток. Определение подтипа опухоли играет важнейшую роль в подборе терапии для конкретного пациента.
Итак, в последней классификации злокачественных опухолей нервной системы ВОЗ выделяет следующие группы [1] (рис. 1):
- Глиомы, глионевральные и нейрональные опухоли. К опухолям этого вида относят опухоли, происходящие из нейронов и разных видов глиальных клеток: астроцитов, олигодендроцитов, клеток эпендимы, выстилающей желудочки мозга. Именно глиомы чаще всего выявляют среди неоплазий нервной системы, причем среди них чаще всего диагностируют глиобластому — самую агрессивную среди опухолей мозга [3]. Глиобластома развивается из астроцитов, средний возраст начала заболевания — 45–70 лет, причем мужчины заболевают несколько чаще, чем женщины. Несмотря на самое интенсивное лечение, включающее в себя хирургическое удаление опухоли, облучение и химиотерапию, после непродолжительной ремиссии опухоль рецидивирует, и средняя выживаемость составляет от 10 до 15 месяцев [4]. Еще один распространенный вид глиом, по частоте встречаемости уступающий только глиобластоме, — астроцитомы. Как и при глиобластоме, в случае астроцитомы опухоль развивается из астроцитов, причем популяция астроцитов, давшая начало опухоли, во многом определяет прогноз. Так, пилоцитарная астроцитома, астроцитома, происходящая из субэпендимных клеток, и субэпендимома ведут себя как доброкачественные опухоли. В то же время, некоторые другие астроцитомы могут быть очень агрессивными, и выживаемость крайне редко достигает трех лет. Всего ВОЗ выделяет четыре градации астроцитомы, от доброкачественной (1) до самой агрессивной (4) [4].
- Опухоли сосудистого сплетения, происходящие из особых клеток выстилки желудочков, которые вырабатывают спинномозговую жидкость.
- Эмбриональные опухоли. Некоторые опухоли наиболее часто встречаются у детей [5]. К их числу относятся медуллобластомы — самые частые педиатрические (детские) опухоли мозга. Чаще всего медуллобластома располагается вблизи четвертого желудочка, между стволом мозга и мозжечком. Наибольшее количество случаев выявляется в период от 5 до 9 лет, однако медуллобластому изредка диагностируют и у взрослых людей. Считается, что медуллобластома развивается из эмбриональных клеток. В зависимости от мутаций, вследствие которых развилась опухоль, прогноз варьирует от благоприятного до плохого [6]. Еще одна эмбриональная «детская» опухоль нервной системы — нейробластома. Она, как правило, развивается вследствие мутаций, возникших в первом триместре беременности. Больше всего случаев выявляется в первый год жизни, но крайне редко нейробластома развивается и у взрослых людей. Начало нейробластоме дают нейроны симпатической нервной системы. Как и в случае с астроцитомой, поведение опухоли неоднородно: у некоторых пациентов наблюдается спонтанная регрессия, а у других опухоль становится злокачественной и агрессивной [7].
- Опухоли эпифиза неоднородны по своей природе: часть из них можно отнести к глиомам, часть — к опухолям, происходящих из клеток зародышевой линии, некоторые и вовсе морфологически представляют собой папиллому. Пик возникновения опухолей эпифиза приходится на половое созревание, что можно связать с гормональными перестройками, однако подтверждения этой гипотезе пока не получено [8].
- Опухоли черепных и параспинальных нервов. В этом случае наиболее часто перерождаются клетки Шванна, формирующие миелиновую оболочку (такие опухоли называют шванномами) нервных волокон. Помимо перерождения клеток, формирующих оболочки нервов, возможно озлокачествление клеток так называемого «конского хвоста» — пучка корешков четырех нижних поясничных, пяти крестцовых и копчиковых спинномозговых нервов вместе с концевой нитью спинного мозга (ранее такие опухоли назывались параганглиомами) [9].
- Менингиомы, происходящие из клеток мозговых оболочек.
- Опухоли ЦНС, имеющие мезотелиальное происхождение, как и менингиомы, но не относящиеся к менингиомам.
- Опухоли, происходящие из меланоцитов.
- Гематолимфатические опухоли, затрагивающие ЦНС.
- Опухоли, происходящие от клеток зародышевой линии.
- Опухоли области турецкого седла. Анатомически в области (ямке) турецкого седла находится гипофиз. Помимо гипофиза, перерождению часто подвергаются разнообразные клетки параселлярной области, в состав которой входят все структуры, окружающие ямку турецкого седла. Многие опухоли области турецкого седла доброкачественные, но некоторые, такие как краниофарингиома, могут в некоторых случаях становиться агрессивными [10].
- Метастазы других опухолей.
- Опухоли, развивающиеся в силу генетической предрасположенности.
В данной статье мы будем рассматривать только первичные опухоли, а не метастазы. Кроме того, мы сфокусируемся только на злокачественных опухолях.
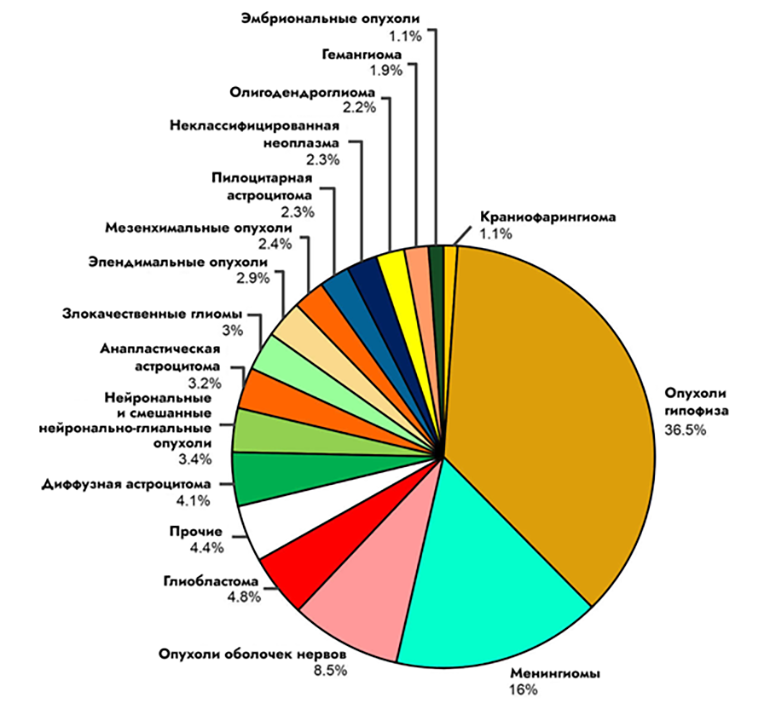
Рисунок 1. Диаграмма, иллюстрирующая распространенность разного вида опухолей мозга.
Факторы риска и симптомы
Предрасположенность к раку мозга может быть обусловлена генетическими факторами и факторами окружающей среды. Существует ряд наследственных заболеваний, которые сопровождаются повышенным риском развития злокачественных новообразований в мозге. К числу таких синдромов относят болезнь Каудена, синдром Горлина, синдром Ли—Фраумени, нейрофиброматоз 1 и 2 типов и другие. Кроме того, развитие рака мозга у одного из членов семьи означает высокую вероятность его появления и у родственников. Среди факторов внешней среды только высокая доза ионизирующего излучения является доказанным фактором риска.
Симптомы рака мозга в значительной степени неспецифичны и зависят от типа опухоли, ее размеров и скорости роста. Чаще всего пациенты, страдающие от опухолей мозга, жалуются на головную боль, тошноту и рвоту, проблемы со зрением или слухом, речью, координацией движений. Важным признаком служат судороги, особенно если они появились у пациента недавно. Если совокупность симптомов может быть вызвана злокачественным новообразованием нервной системы, то пациент направляется на диагностику, прежде всего — визуализацию возможной опухоли.
Диагностика
Для диагностики злокачественных заболеваний нервной системы используется несколько методов , которые решают разные задачи: КТ и различные виды МРТ визуализируют опухоли, а молекулярно-генетические, иммуногистохимические и гистологические исследования образца опухоли (биоптата) показывают, с какой опухолью мы имеем дело с тканевой, клеточной и молекулярной точки зрения — это важно, чтобы понять, как ее лечить.
С подробными описаниями методов диагностики рака можно ознакомиться в статье «Онкодиагностика — вызовы и решения» [11].
Визуализация опухолей мозга
Для визуализации опухолей в головном мозге преимущественно используют два основных метода: компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ) [5], а иногда также позитронно-эмиссионную томографию (ПЭТ), однофотонную эмиссионную КТ (ОФЭКТ) и магнитно-резонансную спектроскопию (МРС). В последнее время для диагностики опухолей мозга, в частности, с помощью МРТ, внедряются алгоритмы машинного обучения [12].
МРТ визуализирует анатомическое строение мозга. Методика основана на возбуждении атомов водорода, входящих в состав молекул воды в тканях мозга, с помощью специальных мощных магнитов. На основе исходящих от атомов водорода сигналов получают последовательные анатомические срезы, а на их основе создают трехмерную картину. Для увеличения качества МРТ-изображений пациенту иногда вводят контрастное вещество, чаще всего хелаты гадолиния, которые усиливают магнитное поле. МРТ с контрастом, наряду с КТ головы и шеи, применяют в тех случаях, когда стандартная МРТ не дает исчерпывающих результатов.
КТ тоже визуализирует анатомию мозга, но с более высоким разрешением. В ходе КТ мозг облучают рентгеновскими лучами под разными углами и получают снимки, из которых потом реконструируют поперечные изображения, причем метод позволяет визуализировать и костную ткань, и мягкие ткани с кровеносными сосудами, не ограничиваясь только мозгом. Для визуализации кровеносных сосудов с помощью КТ необходимо контрастное вещество, в качестве которого используют содержащие йод соединения (такая процедура известна как ангиография [13]). Подтип КТ — однофотонная эмиссионная компьютерная томография — основана на детекции сигнала от распада специальных препаратов, меченных радиоизотопами, которые предварительно вводят в организм пациента. При распаде они испускают гамма-лучи, благодаря которым определяется их расположение в теле человека и проводится восстановление изображения интересующей ткани или органа в различных плоскостях. Благодаря ОФЭКТ можно не только визуализировать мозг, но и отследить происходящие в нем биохимические и физиологические процессы.
Основная идея ПЭТ состоит в детекции клеток с чрезмерно активным метаболизмом глюкозы, поэтому с ее помощью можно визуализировать клетки, которые потребляют глюкозу активнее обычных (а это прежде всего раковые клетки и есть, потому что они нередко переходят на полное энергетическое обеспечение через гликолиз и потому потребляют гораздо больше глюкозы, чем здоровые ткани). Пациенту вводят небольшое количество радиоактивно-меченного соединения, (2-фторо-2-дезокси-D-глюкоза), и получают информацию об очагах слишком активного метаболизма глюкозы. Отметим, что мозг и в нормальных условиях потребляет существенно больше глюкозы, чем другие ткани, что может создавать трудности при диагностике опухолей мозга, как первичных, так и метастазов. Особенно много ФДГ накапливает серое вещество головного мозга, в частности, кора и базальные ганглии, причем серое вещество накапливает ФДГ в 2,5 раза больше, чем белое вещество. Поэтому при диагностике опухолей головного мозга ПЭТ используют только в комбинации с другими методами, в частности, с КТ (ПЭТ-КТ) и МРТ с контрастом [14].
МРС дает некоторые данные о метаболизме опухолевых клеток. В отличие от МРТ, где индуцируется возбуждение атомов водорода в молекулах воды, при МРС возбуждаются углерод, водород, креатинин, лактат и N-ацетиласпартат. МРС не дает изображений изучаемой ткани или органа, но позволяет исследовать их метаболизм и на основании этих данных определить степень злокачественности опухолей [15]. Ранее МРС применялась только для диагностики опухолей мозга, но сейчас этот подход используют для диагностики опухолей и в других частях тела.
Если с помощью перечисленных методов было визуализировано новообразование, оно удаляется хирургическим путем, а образец его (биоптат) отправляется на молекулярно-генетическую диагностику и иммуногистохимический анализ. Кроме того, для дальнейшего уточнения диагноза могут быть использованы онкомаркеры. Всестороннее исследование опухоли необходимо для подбора оптимальной терапии и оценки прогноза.
Важнейший этап исследования опухоли, который позволяет с наибольшей точностью подобрать подходящее лечение для опухоли и оценить прогноз — молекулярная диагностика.
Молекулярная диагностика
Для успешного лечения мало визуализировать опухоль, важно определить ее молекулярную основу — какие именно генетические изменения в ней приводят к озлокачествлению. Это дает мишени для грамотной терапии и позволяет предположить прогноз. Надо искать онкогенные точечные мутации, вариации числа копий онкогенов, в том числе вставки и делеции, слияния генов, разнообразные хромосомные перестройки, а также статус метилирования ДНК [16]. Это делают с помощью секвенирования по Сэнгеру, флуоресцентной гибридизации in situ, анализа утраты гетерозиготности и более сложных методов: таргетного секвенирования нового поколения, выявления однонуклеотидных полиморфизмов с помощью микрочипов и других . О раковом перерождении может говорить и изменение паттернов метилирования, которые можно исследовать с помощью чувствительной к метилированию ПЦР, в том числе в реальном времени, пиросеквенирования, с помощью которого можно определить положение метильных меток, и других методов [17].
Подробнее о перечисленных методах можно прочитать в статьях «12 методов в картинках: секвенирование нуклеиновых кислот» [18], «12 методов в картинках: полимеразная цепная реакция» [19], «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [20].
Исследование образца опухоли с помощью иммуногистохимических методов
Диагностику опухолей на основе иммуногистохимических (ИГХ) методов производят либо напрямую, выявляя наличие в клетках хромосомных перестроек и других мутаций с помощью цитогенетики, либо с помощью моноклональных антител, специфичных к определенным опухолевым антигенам [22]. В качестве материала для исследования берется биоптат, полученный в ходе операции по удалению опухоли. Иными словами, ИГХ — инвазивный метод исследования опухоли, в отличие от разобранных выше методов визуализации . Иммуногистохимическое окрашивание может быть использовано для выявления клеток определенного типа или быстро делящихся клеток.
Как работает иммуногистохимия (ИГХ), можно узнать в нашей статье «12 методов в картинках: иммунологические технологии» [23].
Кроме того, этот метод может быть использован для дифференциальной диагностики, особенно некоторых опухолей мозга, прежде всего диффузных глиом, которые с помощью стандартных гистологических окрашиваний неотличимы друг от друга, однако заметно отличаются при окрашивании моноклональными антителами [21].
Лечение
В этом разделе мы рассмотрим давно одобренные подходы к терапии онкологических заболеваний нервной системы, а также осветим несколько перспективных разработок, которые, возможно, в недалеком будущем пополнят ряды одобренных подходов к лечению рака мозга.
Очевидным, но не всегда осуществимым способом терапии опухоли головного мозга является ее удаление. Кроме этого, много лет в терапии злокачественных новообразований используются химиотерапия и лучевая терапия (радиотерапия), убивающие быстро делящиеся клетки. Однако в организме человека быстро делятся не только злокачественные клетки, а восстановление после облучения дается трудно не только раковым клеткам, поэтому традиционные лучевая терапия и химиотерапия сопряжены с огромным количеством побочных эффектов. Сейчас разработаны подходы таргетной терапии, действующие прицельно на злокачественные клетки, такие как иммунотерапия и клеточная терапия, и разработка новых подходов активно продолжается.
Одобренная терапия
Хирургическое вмешательство
Успех и возможность удаления злокачественных опухолей головного мозга зависят от многих факторов. Если опухоль расположена так, что ее легко отделить от окружающих тканей и удалить, то возможно полное иссечение. Иногда для удаления опухоли мозга нет нужды в трепанации черепа: например, в случае некоторых опухолей доступ к ней можно получить через нос. Бывает, что опухоль можно удалить лишь частично, чтобы не повышать риски осложнений, таких как кровотечение и повреждение прилежащих областей мозга. Зачастую для полного уничтожения злокачественных клеток, оставшихся после удаления опухоли, после операции проводят дополнительный курс лучевой терапии или химиотерапии.
В настоящее время для удаления опухолей используют флуоресцентные «ориентиры». Специфические флуорофоры используются для «подсвечивания» злокачественной опухоли, визуально отделяя ее от окружающих здоровых тканей. Например, в операциях по удалению глиомы наиболее часто используется 5-аминолевулиновая кислота, обработка которой запускает синтез протопорфирина в злокачественных клетках, и именно он «подсвечивает» клетки опухоли [24]. Некоторые флуорофоры захватываются злокачественными клетками, другие накапливаются во внеклеточной среде, где играют роль контрастного вещества, сходного с хелатами гадолиния в МРТ [25].
Отметим, что особенно опасны опухоли, которые рецидивируют уже после хирургического вмешательства. При рецидиве опухоли также лечат с помощью лучевой терапии, химиотерапии и других методов, которые применяют при терапии первичных опухолей, а также производят повторную операцию. К сожалению, в случае таких опухолей, как глиобластома, прогноз остается неблагоприятным.
Радиотерапия, или лучевая терапия
Классическая радиотерапия, или лучевая терапия, — это облучение опухоли ионизирующим излучением. Часто ее используют для замедления развития опухоли, увеличения выживаемости в случае злокачественных глиом, а также для уничтожения злокачественных клеток, оставшихся после удаления основной опухоли. Если хирургическое вмешательство невозможно, радиотерапия может стать одним из ведущих способов борьбы с новообразованием. Однако радиотерапия способствует мутагенезу, что может способствовать развитию опухоли. Иными словами, лучевая терапия — палка о двух концах, и обладает опасными побочными эффектами.
Для доставки необходимой дозы излучения используют фотоны, электроны, протоны и другие частицы. Чаще всего применяют рентгеновские и гамма-фотоны, которые генерирует линейный ускоритель. Прибор направляет пучок фотонов фокусированно под разными углами в ткань-мишень, в нашем случае — в опухоль. В тех случаях, когда критически важно доставить нужную дозу облучения в весь объем опухоли, используют 3D-конформальную радиотерапию, когда необходимые дозы облучения распределяются в соответствии с формой и объемом опухоли [26]. Разновидность 3D-конформальной радиотерапии, модулируемая интенсивностью радиотерапия, предназначена для доставки в разные части опухоли разной дозы излучения. Кроме того, разрабатывается таргетная радиотерапия, при которой к антителу или другому агенту, специфически связывающемуся с опухолью, присоединяется радионуклид. Таким образом, происходит облучение именно опухоли, что может снизить побочные эффекты и риски, связанные с обычной радиотерапией [10].
Химиотерапия
Как и в случае других видов рака, при лечении опухолей мозга назначается химиотерапия — это вещества, несущие смерть прежде всего активно делящимся клеткам. Раковые клетки убиваются химиотерапией особенно быстро, но помимо них делятся, а значит, убиваются и здоровые, нужные организму клетки, в том числе клетки волосяных фолликулов или кишечных ворсинок. Так что, по сути, химиотерапия — это яд для больного, но такой яд, который более опасен для опухоли, чем для всего остального организма, и в результате у больного есть шанс выжить и восстановиться после лечения. Неспецифические химиотерапевтические агенты подавляют процесс деления клеток, делая невозможной репликацию ДНК за счет встраивания в двойную спираль, или препятствуют сборке веретена деления, взаимодействуя с микротрубочками и белком тубулином. В частности, химиотерапевтический препарат винкристин связывается с тубулином и по этой причине останавливает клеточный цикл. К числу других химиотерапевтических агентов, блокирующих перестройки микротрубочкового цитоскелета и тем самым препятствующих делению злокачественных клеток, относят паклитаксель и доцетаксель, которые делают невозможной полимеризацию микротрубочек [27].
Еще один цитотоксический химиотерапевтический агент, иринотекан, ингибирует топоизомеразу I и препятствует устранению топологических нарушений в ДНК, тем самым блокируя ее репликацию. Этопозид ингибирует топоизомеразу II, что также подавляет удвоение ДНК. Некоторые цитотоксические препараты действуют как интеркалирующие агенты, которые, встраиваясь между азотистыми основаниями двойной спирали ДНК, блокируют ее удвоение. К числу интеркаляторов относятся, в частности, цисплатин, темозоломид, соли мочевины [28] и некоторые антрациклины [27].
Опухоли мозга разного происхождения требуют разного подхода к лечению. Например, при злокачественных астроцитомах эффективны производные мочевины, но в тех случаях, когда прогрессия астроцитомы сохраняется и на стандартном лечении, могут помочь соли платины, а темозоломид был одобрен для лечения рекуррентных анапластических астроцитом и других глиом, в том числе глиобластомы [27].
Существенным препятствием для стандартной химиотерапии в случае мозга становится гематоэнцефалический барьер (ГЭБ), через который многие препараты не могут пройти. Во многом успех химиотерапии определяется тем, сможет ли терапевтический агент пройти ГЭБ и накопиться в мозге в необходимой концентрации. Обойти ГЭБ можно несколькими способами, в том числе самыми необычными вроде доставки веществ в мозг вместе с токсоплазмой [29]. Основные методы преодоления ГЭБ подробно рассмотрены в нашей статье «Сквозь тернии к нервам: особенности доставки лекарств в нервную систему» [30], [31].
Таргетная терапия
Химиотерапия в значительной степени неспецифична, ее мишень —любые быстро делящиеся клетки. Мишень таргетной терапии — специфические белки, которые отличают раковую клетку от нормальной: или избыточно экспрессируемые, или мутантные, или аномально активированные, и так далее. С помощью малых молекул можно ингибировать такие белки, хотя проблема пересечения ГЭБ остается актуальной и в этом случае.
В роли мишеней таргетной терапии часто выступают рецепторные тирозинкиназы, взаимодействующими с различными факторами роста. На данный момент для клинического применения одобрен ряд веществ, действующих на рецепторы VEGF, тромбоцитарный фактор роста (PDGF), а также фактор роста тучных/стволовых клеток (cKIT, или SCF), фактор роста фибробластов и другие онкогенные мишени [32]. Так, ингибирование пути VEGF блокирует прорастание в опухоль кровеносных сосудов, которые необходимы для питания активно делящихся злокачественных клеток [33]. Совсем недавно получил одобрение для терапии педиатрической глиомы препарат товорафениб — ингибитор протеинкиназы RAF. Кроме того, недавно был одобрен новый препарат для лечения глиомы взрослых ворасидениб, который ингибирует изоформы изоцитратдегидрогеназы 1 и 2.
Ингибировать белки, критически важные для выживания и пролиферации злокачественных клеток, могут не только низкомолекулярные соединения, но и моноклональные антитела (подробнее читайте о них в большом спецпроекте «Терапевтические антитела». Проникновение через ГЭБ представляет собой особую сложность и для них. На мышиной модели показано, что лишь 0,1% антител, введенных в кровь, достигает мозга [34].
Моноклональные антитела могут быть направлены на разные мишени: VEGF (биспецифическое антитело анти-Ang-2/VEGF), TSPO (биспецифическое антитело анти-Ang-2/TSPO), анти-PD-1 и другие [34]. Для некоторых из этих антител механизмы проникновения через ГЭБ пока неизвестны; возможно, задачу преодоления ГЭБ иногда облегчает утрата им целостности. Для лечения нейробластомы одобрено моноклональное антитело динутуксимаб, которое связывается с опухолевым антигеном — дисиалганглиозидом (GD2). Разработка стратегий лечения рака мозга с использованием моноклональных антител ведется и сейчас.
Лечение с помощью электрических полей
Еще один метод таргетной терапии опухолей мозга, известный как TTF (от Tumor treating fields), основан на использовании электрических полей с умеренной частотой, около 200 кГц. Было показано, что такие поля останавливают деление клеток и сборку органелл. При TTF на бритую голову пациента помещают 9 изолированных электродов для создания необходимых полей [35].
Метод успешно прошел третью стадию клинических испытаний для терапии глиобластомы и увеличивает как общую выживаемость (в комбинации с терапией темозоломидом), так и выживаемость в отсутствие прогрессии опухоли [35], однако в клинической практике применяется нечасто. Одна из причин — недостаточно убедительные данные клинических исследований (в том числе недостоверная статистическая обработка данных, дающая большое количество ложноположительных результатов), не до конца изученный механизм действия, отсутствие биомаркеров, благодаря которым можно было бы выявить наиболее перспективную субпопуляцию клеток опухоли и, наконец, стоимость процедуры [36].
Отметим, что протокол лечения злокачественных опухолей, в том числе и опухолей нервной системы, использует сразу несколько терапевтических стратегий. Так, одобренный протокол лечения глиобластомы и других глиом должен включать хирургическое удаление опухоли на фоне локальной радиотерапии и химиотерапии темозоломидом, а также TTF.
Терапия в разработке
Иммунотерапия
Иммунотерапия занимает особое место в ряду терапии заболеваний нервной системы, в особенности глиобластомы. Наиболее распространена терапия ингибиторами контрольных точек. Раковые опухоли умеют «выключать» иммунные клетки, активируя специальные рецепторы контрольных точек на их поверхности (в норме рецепторы контрольных точек нужны для регулирования уровня воспаления и предотвращения аутоиммунных процессов). В результате иммунитет не реагирует на развивающийся рак. Терапия ингибиторами контрольных точек останавливает этот патологический процесс и запускает иммунный ответ на опухоль. Наиболее изучены такие рецепторы контрольных точек, как CTLA-4 и PD-1, и их ингибиторы — моноклональные антитела, настолько успешные при многих видах рака, что уже заняли первое место по продажам в мире среди всех лекарств. Кроме того, уже есть стратегии лечения, где два ингибитора используются одновременно. Ингибиторы контрольных точек показали свою эффективность в отношении разных видов опухолей, в том числе и головного мозга, несмотря на его иммунопривилегированность и вызываемую глиомами периферическую иммуносупрессию [37].
PD-1 экспрессируется T- и B-клетками, а также естественными киллерами (NK-клетками). Особенно много PD-1 экспрессируют истощенные T-клетки, которые подвергались постоянной стимуляции антигенами. Связывание PD-1 с его природными лигандами, PD-L1 или PD-L2, способствует иммунной толерантности. PD-L1 экспрессируют, в частности, клетки глиобластомы. Блокада PD-1 или его лигандов показала успех в терапии опухолей различного происхождения, а в случае глиом анти-PD-1 и анти-PD-L1 находятся на стадии клинических испытаний [37].
Иммунотерапия ингибиторами контрольных точек, несмотря на относительную безопасность, не лишена существенных недостатков. Поскольку контрольные точки сами по себе необходимы для сдерживания серьезного воспаления, одним из главных побочных действий иммунотерапии является иммунотоксичность [37].
Существуют и другие подходы иммунотерапии, которые могут быть использованы в терапии опухолей мозга. Один из таких подходов — адъювантная терапия агонистами STING и Toll-подобных рецепторов, вследствие чего дополнительно активируется врожденный иммунитет [38]. В исследовании на группе пациентов с глиобластомой было показано, что применение адъювантной терапии совместно с радиотерапией и терапией темозоломидом увеличило выживаемость по сравнению с прогнозируемой [36].
Еще одно направление иммунотерапии основано на использовании антител, конъюгированных с препаратами (ADC, от antibody—drug conjugates) [39] — антител, которые через химический линкер связаны с цитотоксическими агентами или радионуклидами. ADC зарекомендовали себя эффективными средствами при минимуме побочных эффектов. ADC разрабатываются и для терапии рака мозга [40]. Впервые FDA одобрила ADC в 2000 году, и по состоянию на 2024 год более чем 140 ADC находятся на разных стадиях клинических испытаний [41].
Терапевтические вакцины
Противораковые терапевтические вакцины направлены на усиление иммунного ответа против опухоли, и при регулярном введении можно добиться активации быстрого, реактивного ответа. Пока что терапевтические вакцины для терапии глиом находятся на разных стадиях клинических испытаний. Состав некоторых терапевтических вакцин известен. Так, вакцина GlioVac содержит смесь аутологичных, то есть взятых от самогó пациента, опухолевых клеток и трех различных аллогенных, то есть взятых от донора, клеток глиобластомы, убитых облучением. Эта вакцина активирует сразу несколько ветвей иммунной системы [42].
Таргетные терапевтические вакцины активируют иммунный ответ на опухолевые антигены — как специфичные, полученные из данной конкретной опухоли, так и общие опухолеассоциированные. Некоторые вакцины — это дендритные клетки, нацеленные на опухолевый антиген и предназначенные для активации T-клеточного иммунитета. Как правило, терапевтические вакцины совмещают с другими способами лечения. Так, иногда в место введения вакцины вводят дифтерийно-столбнячный токсоид, который усиливает действие вакцины. Есть еще пептидные вакцины на основе опухолевых пептидов вместе с дендритными клетками и адъювантом. Также существуют вакцины на основе комплексов опухолевых пептидов с белками теплового шока, экспрессия которых в злокачественных клетках повышена, а именно, с шапероном HSP96. Для вакцинации используются комплексы HSP96 с пептидом, полученные из лизата опухоли пациента [42].
К сожалению, противораковые вакцины часто не работают: опухоль умеет подавлять иммунитет или ускользать от него. Кроме того, против «холодных» опухолей, которые не инфильтрованы иммунными клетками и не создают провоспалительную среду, в отличие от «горячих опухолей», вакцины бессильны. Успех применения терапевтической вакцины может зависеть от того, какой агент использовался для химиотерапии: некоторые химиотерапевтические агенты повышают чувствительность опухоли для дальнейшей иммунотерапии. Можно сказать, что выбор химиотерапии может предопределять эффективность иммунотерапии, в том числе вакцинами [43].
Клеточная иммунотерапия
Основу клеточной иммунотерапии составляет адоптивный перенос, при котором T-клетки пациента выделяют из крови, размножают и/или модифицируют ex vivo и переливают назад донору. В некоторых случаях из сóлидных опухолей выделяют и размножают лимфоциты, инфильтровавшие опухоль (TIL), для дальнейшего переливания донору. В одном клиническом исследовании было показано, что при глиобластоме может быть эффективен адоптивный перенос T-клеток, специфичных к цитомегаловирусу [42].
После выделения из организма пациента T-клетки могут быть модифицированы посредством внедрения последовательности, кодирующей химерный антигенный рецептор (CAR). CAR-T клетки распознают антиген, который связывает рецептор, и убивают клетку, несущую антиген. Несмотря на то, что для лечения гематологических неоплазий шесть препаратов CAR-T-клеток успешно прошли клинические испытания и одобрены, в отношении сóлидных опухолей успехи CAR-T ограничены: в частности, T-клетки плохо инфильтруются в опухоль и быстро принимают истощенный (exhausted) фенотип, что резко снижает их цитотоксические свойства. Тем не менее, на пациентах с глиобластомой успешно показали себя CAR-T, распознающие в качестве антигена GD2 (того же, что и при нейробластоме [42]). Кроме того, большие перспективы в терапии злокачественных заболеваний имеют клетки, отличные от «классических» T-клеток, и экспрессирующие CAR, например, NK-клетки [44].
Онколитические вирусы
В настоящее время терапию онкололитическими вирусами, то есть модифицированными вирусами, которые реплицируются только внутри раковых клеток, нередко комбинируют с терапией цитокинами, такими как GM-CSF, облучением и другими терапевтическими подходами.
На ранних стадиях клинических испытаний исследуются возможности лечения злокачественных заболеваний нервной системы онколитическими вирусами на основе вируса простого герпеса 1 типа (HSV-1), в том числе вирусом G207 для лечения глиом и детских злокачественных опухолей мозжечка, вирус G47Δ для лечения глиобластом, а rQNestin34.5v.2 и NG34 (более «продвинутая» по части побочных эффектов версия rQNestin34.5v.2) включены в испытание, посвященное глиомам [45].
Возможно, получится применять и онколитические вирусы, полученные от вируса коровьей оспы, такие как TG6002, который показал предварительный успех в отношении глиобластомы в доклинических исследованиях. Некоторые онколитические производные аденовируса включены в клинические испытания по терапии разнообразных глиом, причем как в одиночку, так и совместно с другими методами терапии, в частности, моноклональными антителами [45].
Проблемы разработки терапии против опухолей нервной системы
Помимо сложностей, которые сопряжены с терапией многих злокачественных заболеваний, таких как сохранение раковых стволовых клеток после лечения и преодоление опухолевой микросреды, лечение рака мозга не лишено и других, более специфических проблем (рис. 2). Преодоление гематоэнцефалического барьера (ГЭБ) и барьера между кровеносной системой и опухолью, а также иммунопривилегированность мозга создают значительные трудности в доставке химиотерапевтических агентов в опухоль. Кроме того, возможно метастазирование опухолей мозга в разные органы, в частности, в легкие [46].
Еще одно важнейшее препятствие для эффективной онкотерапии — резистентность опухолевых клеток к используемым методам, особенно у опухолей, чьи «клетки-основатели» уже переживали ремиссию. Иногда раковые клетки демонстрируют множественную лекарственную устойчивость [47]. В основе резистентности могут лежать разные механизмы. Например, некоторые злокачественные клетки могут «откачивать» терапевтический агент с помощью особых белковых «насосов» — АТФ-зависимых ABC-транспортеров [6]. Среди ABC-транспортеров наиболее известны P-гликопротеин, кодируемый геном MDR1, и белок MRP, ассоциированный с множественной лекарственной устойчивостью. Многие опухоли экспрессируют MDR1 на повышенном уровне. Иногда опухолевые клетки «приручают» глутатион — один из важнейших клеточных антиоксидантов — и присоединяют к нему молекулы терапевтических агентов, чтобы понизить их токсичность [48]. Еще один механизм устойчивости к лекарственным препаратам, а именно, ингибиторам топоизомеразы II, основан на снижении уровня ее экспрессии и мутациях, которые делают фермент нечувствительным к ингибиторам за счет снижения его активности [49]. Многие опухоли, в частности, глиобластома, отличаются повышенной генетической гетерогенностью, которая может возникать в ходе клональной экспансии злокачественных клеток, что также препятствует их успешной терапии [50].
В настоящее время продолжаются поиски путей преодоления лекарственной устойчивости злокачественных клеток. В случае с глиобластомой, после хирургического удаления опухоли и химиотерапии уцелевшие злокачественные клетки в большинстве случаев дают начало новым злокачественным клонам. Очень часто глиобластома приобретает резистентность к главному «глиобластомному» химиотерапевтическому лекарству — темозоломиду [51]. Он действует как интеркалирующий агент, встраивающийся в двойную спираль ДНК. Устойчивость к темозоломиду может быть обусловлена активностью системы репарации ДНК и повышенной экспрессией рецептора эпидермального фактора роста (EGFR), галектина-1, Mdm2, p53, а также мутациями в гене PTEN. Для преодоления устойчивости клеток глиобластомы к темозоломиду были разработаны специальные препараты, некоторые из которых дошли до клинических испытаний, однако не получили одобрения [52].
Для борьбы с резистентными клетками глиобластомы может быть проведена еще одна операция и назначены дополнительные курсы химиотерапии, в частности, бевацизумабом — моноклональным антителом к рецептору VEGF [53], кроме того, может быть назначена локальная радиотерапия. К сожалению, в большинстве случаев такая усиленная терапия продлевает жизнь лишь на несколько месяцев [50].
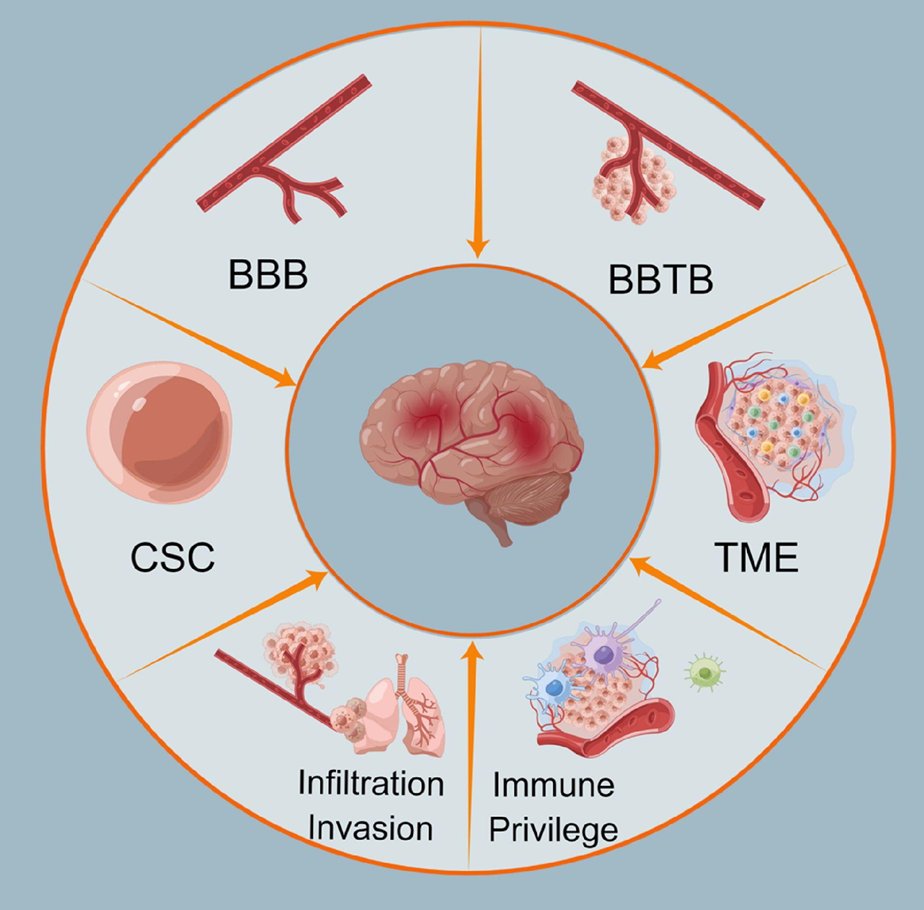
Рисунок 2. Основные сложности, с которыми сопряжено лечение опухолей мозга: раковые стволовые клетки (CSC, cancer stem cells), ГЭБ (BBB, blood brain barrier), барьер между кровеносной системой и опухолью (BBTB, blood, brain tumor barrier), опухолевая микросреда (TME, tumor microenvironment), иммунопривилегированность мозга, метастазирование опухолей мозга (в частности, в легкие).
из [46]
Важнейший недостаток традиционной противораковой терапии — очень высокая токсичность: как системная, так и проявляющаяся в отдельных органах, таких как костный мозг, печень и почки. Кроме того, многие препараты дают сильные отеки и даже вызывают судороги. Также для исследования рака мозга в целом и возможности выявить побочные эффекты, которые могут проявиться у человека, данных, полученных в доклинических исследованиях на клеточных линиях и мышах, недостаточно, даже с учетом того, что в случае с мышами используются ксенографтные модели с опухолями человека: все же эти опухоли нельзя равнять с первичными опухолями человека. Тем не менее, получены генетически модифицированные мыши, у которых часто возникают глиомы, причем высокой степени злокачественности. Эти опухоли — хорошая модель для исследования неоплазий центральной нервной системы у человека [33].
Стоит добавить, что утрата или модификация опухолевого антигена, которая часто может возникать по ходу терапии, делает невозможным продолжение терапии, основанной на выявлении этого антигена, например, посредством CAR-T. Во время терапии опухоль эволюционирует, стремясь скрыться от иммунной системы и оказываемой терапии. Наконец, стоит отметить, что опухоль неоднородна — как во времени, так и в пространстве, поэтому найти универсальную терапию для данной конкретной опухоли и некоторого типа опухолей оказывается невозможным.
Перспективы
В последние десятилетия мы успешно продвинулись как в диагностике, так и в лечении злокачественных опухолей мозга. Многочисленные фундаментальные исследования позволили нам глубже понять механизмы, лежащие в основе злокачественности и, кроме того, найти множество потенциальных мишеней для будущей терапии. Нельзя не отметить прогресс в преодолении ГЭБ.
Новые разработки повышают точность адресной доставки терапевтических агентов и снижают вероятность тяжелых побочных эффектов, которые вызывает стандартная химиотерапия. Кроме того, активно разрабатываются различные иммунотерапевтические подходы, находящиеся на разных стадиях клинических испытаний, такие как ингибирование контрольных точек или CAR-T.
И несмотря на то, что прогноз у пациентов с опухолями мозга в наше время большей частью остается неблагоприятным, вполне осязаема надежда на новые методики ранней диагностики и эффективную, но не мучительную, терапию.
Литература
- Sverre Helge Torp, Ole Solheim, Anne Jarstein Skjulsvik. (2022). The WHO 2021 Classification of Central Nervous System tumours: a practical update on what neurosurgeons need to know—a minireview. Acta Neurochir. 164, 2453-2464;
- Yang Fan, Xian Zhang, Chao Gao, Shuai Jiang, Haoze Wu, et. al.. (2022). Burden and trends of brain and central nervous system cancer from 1990 to 2019 at the global, regional, and country levels. Arch Public Health. 80;
- Jill S. Barnholtz-Sloan, Quinn T. Ostrom, David Cote. (2018). Epidemiology of Brain Tumors. Neurologic Clinics. 36, 395-419;
- David N Louis, Arie Perry, Pieter Wesseling, Daniel J Brat, Ian A Cree, et. al.. (2021). The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro-Oncology. 23, 1231-1251;
- Michael Noel Hart, Kenneth M. Earle. (1973). Primitive neuroectodermal tumors of the brain in children. Cancer. 32, 890-897;
- Juwina Wijaya, Yu Fukuda, John D. Schuetz. (2017). Obstacles to Brain Tumor Therapy: Key ABC Transporters. IJMS. 18, 2544;
- Verena Körber, Sabine A. Stainczyk, Roma Kurilov, Kai-Oliver Henrich, Barbara Hero, et. al.. (2023). Neuroblastoma arises in early fetal development and its evolutionary duration predicts outcome. Nat Genet. 55, 619-630;
- C. Mottolese, A. Szathmari, P.-A. Beuriat. (2015). Incidence of pineal tumours. A review of the literature. Neurochirurgie. 61, 65-69;
- Enzo Emanuelli, Claudia Zanotti, Sara Munari, Maria Baldovin, Gloria Schiavo, Luca Denaro. (2021). Sellar and parasellar lesions: multidisciplinary management. Acta Otorhinolaryngol Ital. 41, S30-S41;
- A H Ree, K R Redalen. (2015). Personalized radiotherapy: concepts, biomarkers and trial design. BJR. 88, 20150009;
- Онкодиагностика — вызовы и решения;
- Mahmoud Khaled Abd-Ellah, Ali Ismail Awad, Ashraf A.M. Khalaf, Hesham F.A. Hamed. (2019). A review on brain tumor diagnosis from MRI images: Practical implications, key achievements, and lessons learned. Magnetic Resonance Imaging. 61, 300-318;
- Kanako K. Kumamaru, Bernice E. Hoppel, Richard T. Mather, Frank J. Rybicki. (2010). CT Angiography: Current Technology and Clinical Use. Radiologic Clinics of North America. 48, 213-235;
- Terence Z Wong, Gert J van der Westhuizen, R.Edward Coleman. (2002). Positron emission tomography imaging of brain tumors. Neuroimaging Clinics of North America. 12, 615-626;
- Akhil Pulumati, Anika Pulumati, Bilikere S. Dwarakanath, Amit Verma, Rao V. L. Papineni. (2023). Technological advancements in cancer diagnostics: Improvements and limitations. Cancer Reports. 6;
- Ishaq N. Khan, Najeeb Ullah, Deema Hussein, Kulvinder S. Saini. (2018). Current and emerging biomarkers in tumors of the central nervous system: Possible diagnostic, prognostic and therapeutic applications. Seminars in Cancer Biology. 52, 85-102;
- Loudy P Priesterbach-Ackley, Pieter Wesseling, Tom J Snijders, Filip Y F L de Vos, Wendy W J de Leng. (2019). Molecular tools for the pathologic diagnosis of central nervous system tumors. Neuro-Oncology Practice. 6, 4-16;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: полимеразная цепная реакция;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- David M. Meredith. (2020). Advances in Diagnostic Immunohistochemistry for Primary Tumors of the Central Nervous System. Advances in Anatomic Pathology. 27, 206-219;
- Bela Bodey. (2002). The significance of immunohistochemistry in the diagnosis and therapy of neoplasms. Expert Opinion on Biological Therapy. 2, 371-393;
- 12 методов в картинках: иммунологические технологии;
- Zvi Malik. (2020). Fundamentals of 5‐aminolevulinic acid photodynamic therapy and diagnosis: An overview. Transl Biophotonics. 2;
- Alexander J. Schupper, Manasa Rao, Nicki Mohammadi, Rebecca Baron, John Y. K. Lee, et. al.. (2021). Fluorescence-Guided Surgery: A Review on Timing and Use in Brain Tumor Surgery. Front. Neurol.. 12;
- Volker W. Stieber, Minesh P. Mehta. (2007). Advances in Radiation Therapy for Brain Tumors. Neurologic Clinics. 25, 1005-1033;
- David Mathieu, David Fortin. (2007). Chemotherapy and Delivery in the Treatment of Primary Brain Tumors. CCP. 2, 197-211;
- Roberta Listro, Giacomo Rossino, Federica Piaggi, Falilat Folasade Sonekan, Daniela Rossi, et. al.. (2022). Urea-based anticancer agents. Exploring 100-years of research with an eye to the future. Front. Chem.. 10;
- Chanjin Yoon, Yu Seong Ham, Woo Jin Gil, Chul-Su Yang. (2024). Exploring the potential of Toxoplasma gondii in drug development and as a delivery system. Exp Mol Med. 56, 289-300;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Nienke A de Vries, Jos H Beijnen, Willem Boogerd, Olaf van Tellingen. (2006). Blood–brain barrier and chemotherapeutic treatment of brain tumors. Expert Review of Neurotherapeutics. 6, 1199-1209;
- Timothy P. Heffron. (2016). Small Molecule Kinase Inhibitors for the Treatment of Brain Cancer. J. Med. Chem.. 59, 10030-10066;
- Sajani S Lakka, Jasti S Rao. (2008). Antiangiogenic therapy in brain tumors. Expert Review of Neurotherapeutics. 8, 1457-1473;
- Rok Razpotnik, Neža Novak, Vladka Čurin Šerbec, Uros Rajcevic. (2017). Targeting Malignant Brain Tumors with Antibodies. Front. Immunol.. 8;
- Andreas F. Hottinger, Patricia Pacheco, Roger Stupp. (2016). Tumor treating fields: a novel treatment modality and its use in brain tumors. NEUONC. 18, 1338-1349;
- Andrew B Lassman, Adela E Joanta-Gomez, Peter C Pan, Wolfgang Wick. (2020). Current usage of tumor treating fields for glioblastoma. Neuro-Oncology Advances. 2;
- Andrew S. Luksik, Russell Maxwell, Tomas Garzon-Muvdi, Michael Lim. (2017). The Role of Immune Checkpoint Inhibition in the Treatment of Brain Tumors. Neurotherapeutics. 14, 1049-1065;
- John H. Sampson, Marcela V. Maus, Carl H. June. (2017). Immunotherapy for Brain Tumors. JCO. 35, 2450-2456;
- Что общего у боеголовок и антител? ADCs;
- Dasantha Jayamanne, Helen Wheeler, Raymond Cook, Charles Teo, David Brazier, et. al.. (2018). Survival improvements with adjuvant therapy in patients with glioblastoma. ANZ Journal of Surgery. 88, 196-201;
- Sruthi Ranganathan, Aswanth Reddy, Alessandro Russo, Umberto Malepelle, Aakash Desai. (2024). Double agents in immunotherapy: Unmasking the role of antibody drug conjugates in immune checkpoint targeting. Critical Reviews in Oncology/Hematology. 202, 104472;
- Martha R. Neagu, David A. Reardon. (2015). An Update on the Role of Immunotherapy and Vaccine Strategies for Primary Brain Tumors. Curr. Treat. Options in Oncol.. 16;
- Mansi Saxena, Sjoerd H. van der Burg, Cornelis J. M. Melief, Nina Bhardwaj. (2021). Therapeutic cancer vaccines. Nat Rev Cancer. 21, 360-378;
- Vicky Mengfei Qin, Criselle D’Souza, Paul J. Neeson, Joe Jiang Zhu. (2021). Chimeric Antigen Receptor beyond CAR-T Cells. Cancers. 13, 404;
- Kasra Mokhtarpour, Milad Akbarzadehmoallemkolaei, Nima Rezaei. (2024). A viral attack on brain tumors: the potential of oncolytic virus therapy. J. Neurovirol.. 30, 229-250;
- Yi Zhao, Ping Yue, Yao Peng, Yuanyuan Sun, Xing Chen, et. al.. (2023). Recent advances in drug delivery systems for targeting brain tumors. Drug Delivery. 30, 1-18;
- Anthony Régina, Michel Demeule, Alain Laplante, Julie Jodoin, Claude Dagenais, et. al.. (2001). . Cancer and Metastasis Reviews. 20, 13-25;
- Donald S. Backos, Christopher C. Franklin, Philip Reigan. (2012). The role of glutathione in brain tumor drug resistance. Biochemical Pharmacology. 83, 1005-1012;
- Markus Bredel. (2001). Anticancer drug resistance in primary human brain tumors. Brain Research Reviews. 35, 161-204;
- Mary Davis. (2016). Glioblastoma: Overview of Disease and Treatment. CJON. 20, S2-S8;
- Satoru Osuka, Erwin G. Van Meir. (2017). Overcoming therapeutic resistance in glioblastoma: the way forward. Journal of Clinical Investigation. 127, 415-426;
- Khaled Messaoudi, Anne Clavreul, Frédéric Lagarce. (2015). Toward an effective strategy in glioblastoma treatment. Part I: resistance mechanisms and strategies to overcome resistance of glioblastoma to temozolomide. Drug Discovery Today. 20, 899-905;
- Shenglan Li, Can Wang, Jinyi Chen, Yanjie Lan, Weichunbai Zhang, et. al.. (2023). Signaling pathways in brain tumors and therapeutic interventions. Sig Transduct Target Ther. 8.