
Онкодиагностика — вызовы и решения
05 апреля 2024
Онкодиагностика — вызовы и решения
- 1464
- 2
- 8
Важнейшую роль в диагностике рака играет визуализация злокачественного новообразования — это можно сделать, например, позитронно-эмиссионной томографией, позволяющей выявлять раковые клетки благодаря их усиленному потреблению глюкозы. А, например, рак шейки матки еще на самых ранних стадиях можно обнаружить гистологически — тестом Папаниколау.
Рисунок в оригинальном разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Иллюстратор
Залогом успешного лечения онкологических заболеваний является их ранняя и точная диагностика. К настоящему моменту разработано множество методов, позволяющих всесторонне исследовать злокачественные опухоли. Изучение молекулярных особенностей раковых клеток (им была посвящена первая статья спецпроекта «Онкология») позволило вывести диагностику онкологических заболеваний на новый уровень. Однако, к сожалению, ее возможности до сих пор не безграничны. Каковы успехи современной онкодиагностики и какие проблемы в ней остаются нерешенными и по сей день? Давайте разбираться.
Онкология

Онкология — одно из самых динамично развивающихся направлений биомедицинских исследований. С одной стороны медицинское и практическое значение этой темы обеспечивает ей интерес общества и обширное финансирование; с другой — изучение раковой клетки и эволюции опухолей проливает свет на самые фундаментальные вопросы биологии, что делает данный спецпроект интересным для биологов самых разных специальностей.
Редактор спецпроекта — Мария Кондратова, к.б.н специалист в области молекулярной биологии рака и онкоиммунологии, автор научно-популярных книг «Кривое зеркало жизни» и «Невидимый страж», которые мы горячо рекомендуем всем интересующимся молекулярной онкологией и иммунологией.
Партнер спецпроекта — компания «ПраймБиоМед», занимающаяся разработкой и изготовлением антител и реагентов для иммуногистохимии. В портфеле компании — более 30 наименований антител для диагностики социально значимых заболеваний: рака молочной железы, легкого, простаты и микросателлитной нестабильности, а также системы детекции для иммуногистохимии, вспомогательные реагенты, буферные растворы для промывки и демаскировки собственного производства.
Рак остается одной из лидирующих причин смерти по всему миру: по состоянию на 2020 год ежегодно выявляется примерно 19,3 миллионов диагностированных случаев рака, из которых около 10 миллионов приводит к смерти [1]. Своевременная диагностика злокачественных заболеваний — залог их успешного излечения. Для некоторых видов рака первые тревожные признаки может заметить сам пациент, однако в большинстве случаев диагностика требует более сложных и надежных методов.
Старейшими методами диагностирования злокачественных опухолей (помимо прямого наблюдения) являются рентгеновские исследования, позволяющие увидеть некоторые внутренние опухоли (например, рак легких), и цитологическое исследование фрагментов новообразования под микроскопом. Однако изучение особенностей биологии опухолевых клеток дало в руки врачей новые, более точные и мощные методы диагностики, применение которых ежегодно спасает миллионы жизней.
Краткий обзор этих особенностей был сделан в первой статье спецпроекта «Онкология», который вы сейчас читаете: «От медицинской онкологии к молекулярной биологии рака» [2]. Туда мы и отсылаем только что присоединившихся читателей.
В онкодиагностике можно выделить несколько основных групп методов в зависимости от задач, которые они решают:
- Визуализация новообразований позволяет «увидеть» опухоль внутри организма, оценить ее размеры и перспективы операционного вмешательства, а главное — отследить распространение злокачественной опухоли по организму (метастазирование).
- Цитологические и гистологические методы диагностики позволяют отличить злокачественную опухоль от доброкачественной. Это один из старейших методов онкодиагностики, но использование антител для «подсвечивания» специфических опухолевых антигенов сильно расширило его возможности.
- Серологические методы позволяют обнаружить следы молекулярного присутствия опухоли в плазме крови.
- Наконец, молекулярная диагностика позволяет определить молекулярный тип опухоли и назначить наиболее подходящее лечение.
Основные диагностические подходы каждой из групп методов, их возможности, достоинства и ограничения мы рассмотрим в этой статье.
Самостоятельная диагностика — первые «тревожные звоночки»
Многих людей волнует вопрос, по каким признакам можно самим обнаружить или хотя бы заподозрить начало злокачественного перерождения. Такие симптомы существуют, но, к сожалению, они в большинстве своем неспецифичны и могут указывать на наличие самых разных проблем со здоровьем. В любом случае, обнаружив у себя один или несколько из следующих признаков, стоит обязательно обратиться к врачу. Итак, пациенты с онкологическими заболеваниями, как правило, теряют вес, страдают от умеренной лихорадки, утрачивают аппетит; у них появляются высыпания на коже, выпадают волосы, а также проявляется ряд других неспецифических симптомов. Столь явные признаки нездоровья, как правило, говорят о достаточно далеко зашедшем патологическом процессе — к счастью, не обязательно злокачественном.
В некоторых случаях пациент сам может заметить развитие злокачественного процесса на достаточно ранних стадиях и обратиться к врачу. Например, выявление в ходе самостоятельного осмотра уплотнения в груди у женщин — повод для обращения к гинекологу или маммологу, а изменение внешнего вида родинок и их ускоренный рост — основание для визита к дерматологу. При подозрении на наличие злокачественных родинок этот врач проводит процедуру дерматоскопии, в ходе которой вызывающая подозрение родинка исследуется на большом увеличении [4].
Однако в целом попытки самостоятельно диагностировать у себя какое бы то ни было заболевание — дело неблагодарное. Вы не врач и легко можете переоценить одни симптомы и не заметить другие. Лучший способ позаботиться о своем здоровье — регулярно проходить рекомендованные онкоскрининги. Эти исследования позволяют выявить наиболее распространенные разновидности рака.
Методы визуализации новообразований
На сегодняшний день в клинической практике используется целый ряд методов визуализации новообразований, которые используют разные физические и физиологические особенности злокачественных опухолей. Зачастую для постановки точного диагноза используют комбинацию нескольких методов (рис. 2).
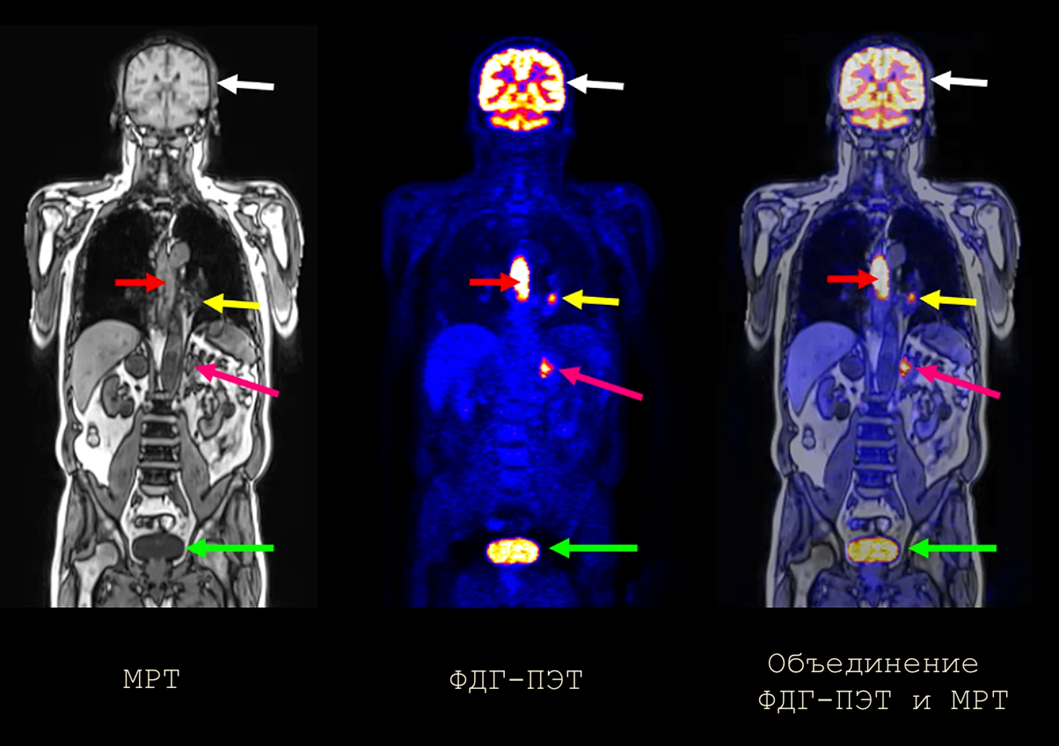
Рисунок 2. Разные методы визуализации по-разному и с разной точностью видят опухоли. Наилучший результат, как правило, дает комбинация нескольких методов. На этом рисунке видно, как по-разному визуализируют опухоли такие методы, как МРТ, ПЭТ и их сочетание. Головной мозг (белые стрелки) визуализируется всегда, поскольку его клетки активно потребляют глюкозу. Также всегда визуализируется мочевой пузырь (зеленые стрелки), так как в нем накапливается моча с меченными метаболитами окисления ФДГ. Красные стрелки указывают на первичную опухоль в пищеводе, а желтые и розовые указывают на метастазы.
Ультразвуковые исследования (УЗИ)
используются для рутинного мониторинга физиологического состояния многих органов. В онкологии УЗИ применяют для диагностики опухолей брюшной полости, сердца, молочных желез, мышц, сухожилий, а также артерий и вен. УЗИ позволяет выявить не только локализацию опухоли, но и охарактеризовать ее форму, размер и плотность. Хотя в точности УЗИ несколько уступает томографическим методам (см. далее), этот метод имеет ряд существенных преимуществ. Аппараты УЗИ есть в большинстве клиник, то есть доступны многим пациентам. В ходе ультразвукового исследования пациент не получает дозу ионизирующего излучения, и кроме того, УЗИ хорошо подходит для наблюдения за движущимися структурами в реальном времени (например, кровотоком в предположительно злокачественной ткани).
Магнитно-резонансная томография (МРТ)
основана на поляризации и возбуждении ядер атомов водорода, входящих в состав воды в тканях, с помощью мощных магнитов . Благодаря этому детектируется сигнал, позволяющий получать последовательные анатомические срезы тела (рис. 3) [7]. МРТ дает онкологам массу преимуществ: этот метод позволяет получать контрастные изображения разных тканей в разных плоскостях, а также трехмерные изображения. Кроме того, для МРТ не требуется ионизирующего излучения. В некоторых случаях МРТ проводят с контрастным веществом — хелатами гадолиния, которые сами по себе излучают сильное магнитное поле. С помощью МРТ можно выявлять опухоли в головном мозге, шее и голове, позвоночнике, печени и надпочечниках, малодоступные для других методов исследования. Кроме того, к МРТ прибегают при исследовании молочной железы в том случае, когда маммографическое исследование по тем или иным причинам невозможно (например, при уплотнении груди или наличии силиконовых имплантов) [1].
В исследовательских областях на похожем принципе работает, например, спектроскопия ядерного магнитного резонанса (ЯМР): «12 методов в картинках: структурная биология» [8].
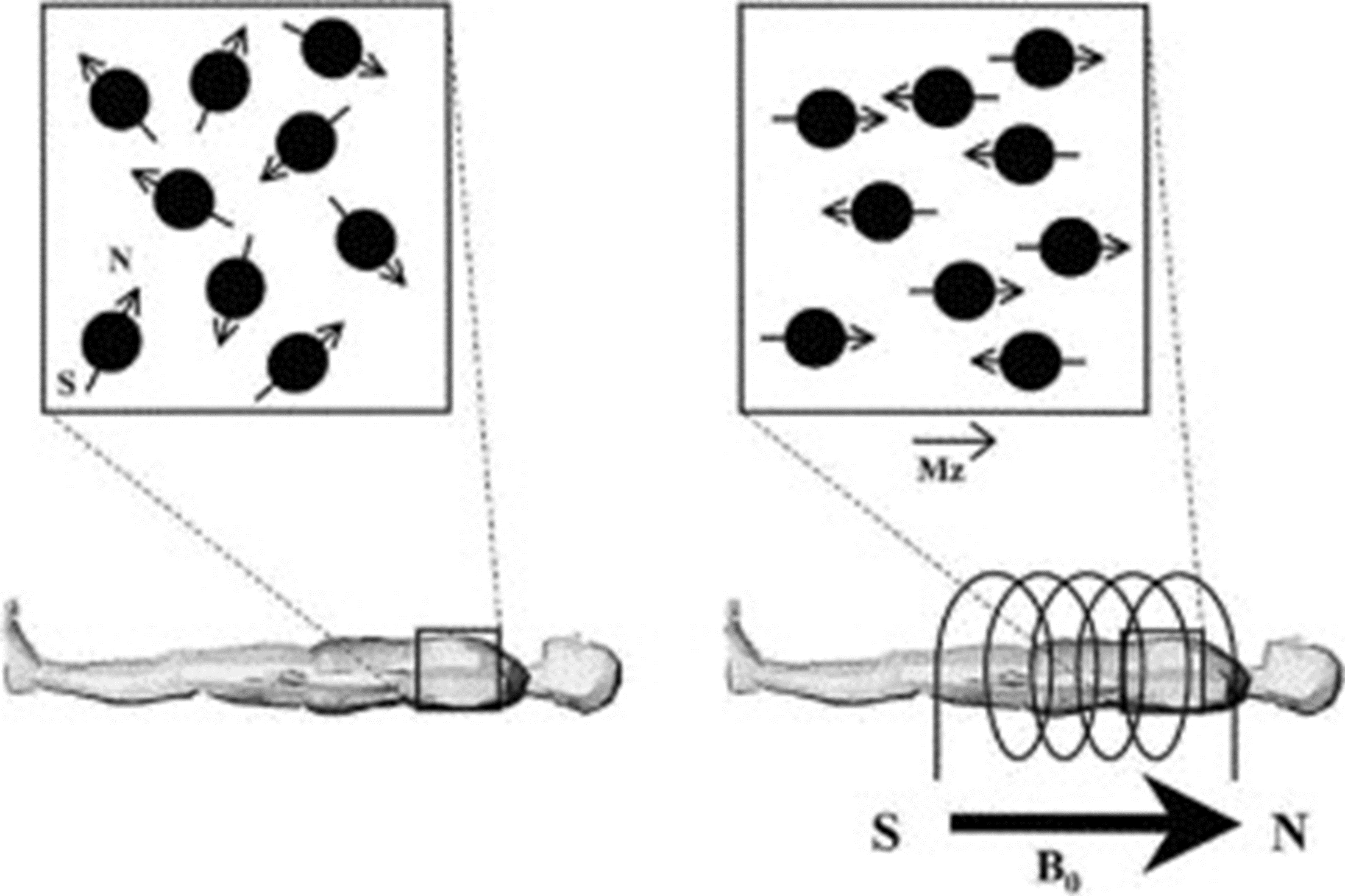
Рисунок 3. Принцип магнитно-резонансной томографии. В томографе создается сильное магнитное поле, которое возбуждает атомы водорода в составе воды в тканях пациента. Послойное облучение тела дает возможность получить на основании отдельных срезов целостное трехмерное изображение.
Позитронно-эмиссионная томография (ПЭТ)
основана на метаболических особенностях злокачественных клеток, тоже позволяющих визуализировать опухоль в пространстве. Существует несколько вариаций ПЭТ, но чаще всего при использовании этого метода пациенту перед исследованием вводят небольшое количество радиоактивно-меченного соединения, известного как 2-фторо-2-дезокси-D-глюкоза, или ФДГ. Идея принимать радиоактивное вещество может показаться пугающей, но не стоит бояться: доза облучения от ФДГ меньше, чем при обычном рентгеновском исследовании, и не представляет опасности для организма. Поскольку злокачественные клетки, в отличие от нормальных, получают энергию только за счет гликолиза (этот феномен известен как эффект Варбурга [9]), меченые молекулы глюкозы они поглощают с гораздо большей скоростью по сравнению со здоровыми клетками. Таким образом, раковые клетки излучают радиоактивный сигнал, фиксируемый прибором для последующей реконструкции изображения опухоли (рис. 4).
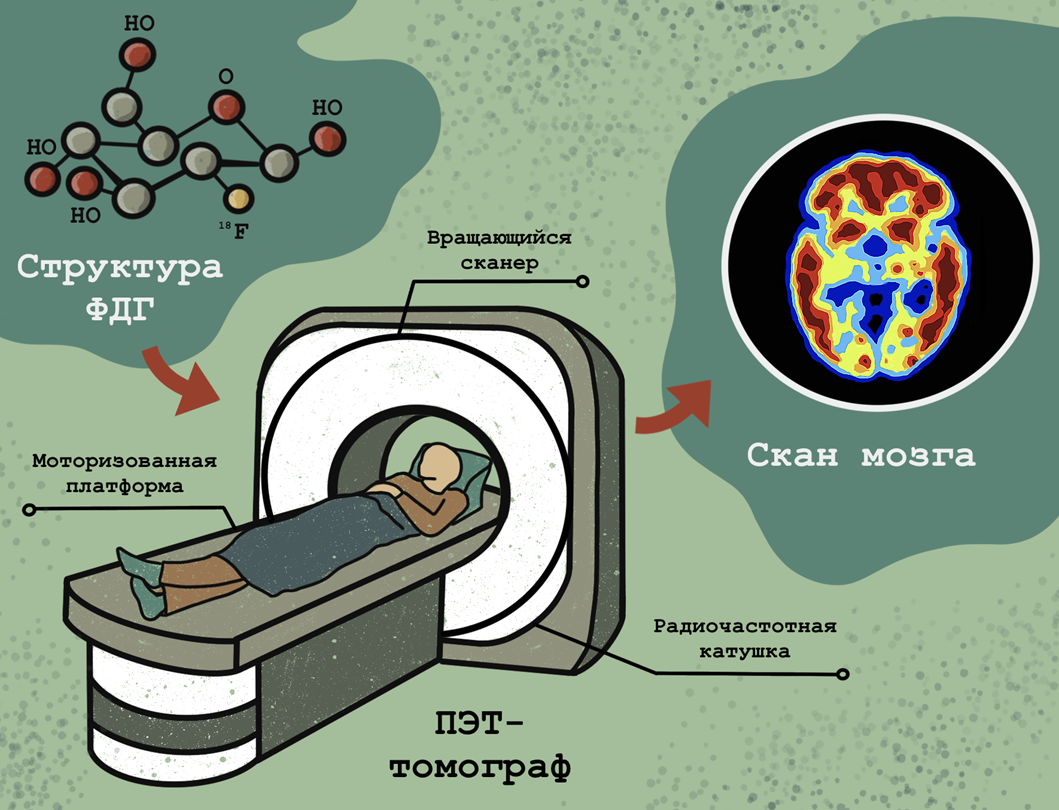
Рисунок 4. Позитронно-эмиссионная томография (ПЭТ). Пациенту вводят радиоактивно меченную (изотопом фтора 18F) 2-фторо-2-дезокси-D-глюкозу (ФДГ) и помещают его томограф, который послойно сканирует тело. При этом по образцам крови отслеживается кинетика поглощения ФДГ тканями — это излучающее вещество «подсвечивает» жадную до «сладостей» опухоль [10]. Полученные снимки подвергают специальному анализу и получают изображение тела, на котором злокачественные участки ярко светятся, поскольку поглощают глюкозу активнее, чем здоровые клетки. Однако в некоторых органах и здоровые клетки поглощают много глюкозы — например, мозг, печень, плотная ткань молочных желез.
иллюстрация Анастасии Самоукиной по схеме Cleveland clinic
Следует отметить, что некоторые ткани (мозг, печень и плотная ткань молочной железы) в норме также поглощают глюкозу в повышенном количестве, поэтому интерпретацию результатов ПЭТ этих органов надо проводить с большой осторожностью. ПЭТ наиболее эффективна для выявления рака на ранней стадии, однако в некоторых случаях, таких как рак толстой кишки, легких, меланомы и лимфомы, ПЭТ применяется и для выявления рецидивов. В ряде случаев ФДГ-ПЭТ, особенно в комбинации с КТ, используют для других специальных задач — например, для выявления стадии немелкоклеточного рака легкого, а также определения эффекта радио- и химиотерапии у пациентов с раком головы и шеи. Наконец, ФДГ-позитронно-эмиссионная маммография позволяет выявить в молочной железе опухоль размером всего лишь 1 мм. В целом, ПЭТ подходит для обнаружения широкого спектра опухолей: молочной железы, щитовидной железы, головы и шеи, предстательной железы и многих других [1].
Компьютерная томография (КТ) и ПЭТ-КТ
Компьютерная томография основывается на получении снимков под разными углами с помощью рентгеновского излучения, направленного на всё тело (рис. 5). На основании полученных снимков происходит реконструкция поперечных изображений костей, сосудов и мягких тканей. КТ успешно используется для визуализации опухолей толстой кишки, легких, головы и шеи, молочной железы и других. КТ требует невысокого уровня ионизирующего излучения и, кроме того, позволяет быстро визуализировать опухоль. Использование методов искусственного интеллекта и других мощных вычислительных методов дало возможность получать КТ-изображение в высоком разрешении при сниженном уровне излучения и избегать возможных артефактов (о возможностях применения искусственного интеллекта в анализе медицинских изображений мы писали в статьях [11], [12].
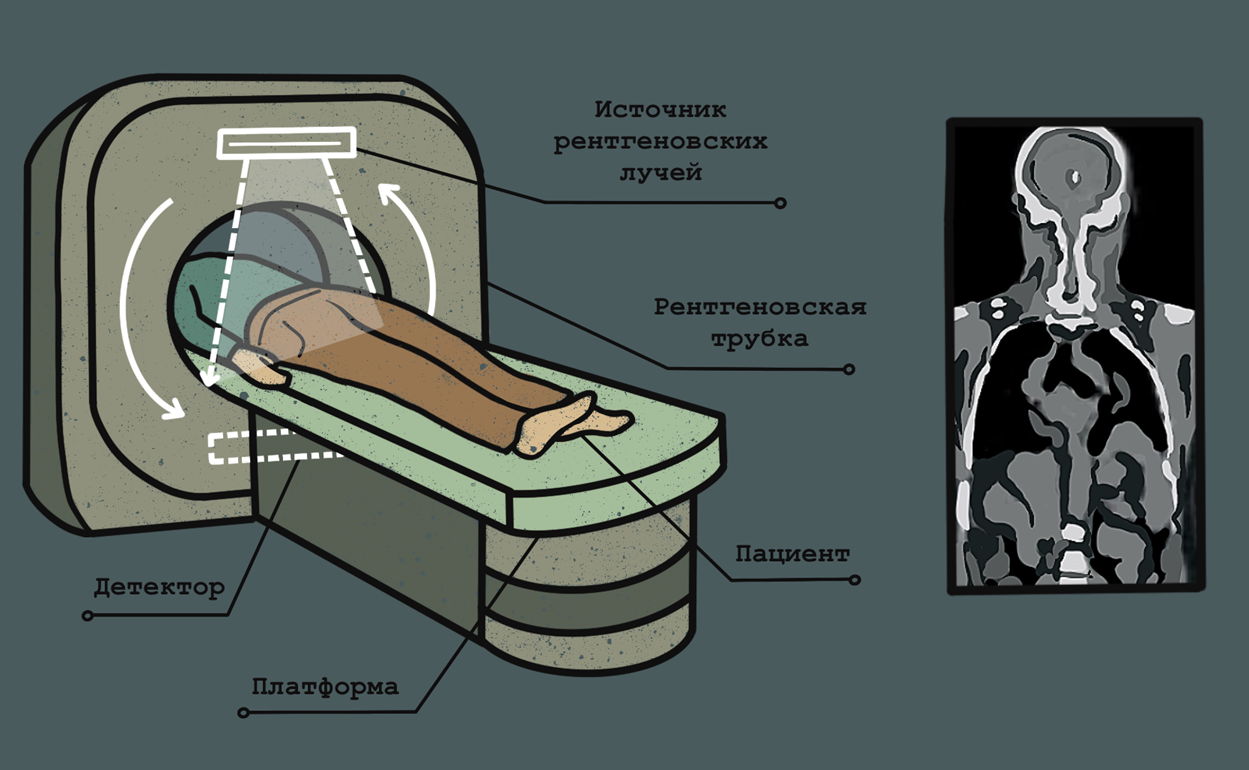
Рисунок 5. Принцип компьютерной томографии. В ходе исследования тело пациента облучается рентгеновскими лучами под разными углами, и их прохождение сквозь тело человека фиксируется. В конечном итоге полученные снимки преобразуются в единое трехмерное изображение.
иллюстрация Анастасии Самоукиной по схеме Thoracic key
Часто КТ используют в паре с ПЭТ для точного анатомического исследования нарушений, выявленных с помощью ПЭТ: последняя опирается на метаболизм клеток опухоли и выдает изображение с низким разрешением, а КТ повышает разрешение изображения и дает информацию о структуре и морфологических характеристиках опухоли. Такой двойной подход обозначается ПЭТ-КТ [1].
Магнитно-резонансная спектроскопия (МРС)
чаще всего используется для диагностики опухолей головного мозга, однако сейчас ее начинают применять и для выявления опухолей поджелудочной железы, простаты, молочной железы, шейки матки и желудочно-кишечного тракта. МРС отличается от МРТ в том, что под действием магнитного поля возбуждаются не молекулы воды (точнее, водород в их составе), а углерод, водород, креатинин, лактат и N-ацетиласпартат. МРС не дает изображений мягких тканей, но позволяет исследовать их метаболизм по содержанию различных соединений и, исходя из этого, делать вывод о злокачественности исследуемой ткани. В частности, с помощью МРС можно детектировать такие изменения в злокачественных опухолях, как повышенное содержание холина и других веществ, по которым можно определить пролиферативный потенциал раковых клеток и агрессивность опухоли [1].
Цитологические и гистологические методы диагностики
Поскольку злокачественная клетка во многих отношениях отличается от здоровой, отличить их зачастую можно, просто посмотрев в микроскоп [13]. Злокачественные клетки имеют крупное ядро неправильной формы с ярко выраженными ядрышками. Цитоплазмы в таких клетках очень мало, иногда она не имеет цвета, а иногда, наоборот, ярко окрашена. Иными словами, в злокачественных клетках ядерно-цитоплазматическое отношение значительно смещено в сторону ядра. Кроме того, злокачественные клетки часто имеют неправильную форму. Митотические деления при раке часто происходят с ошибками, и порой в опухолях образуются клетки-гиганты, содержащие несколько ядер и возникшие вследствие нерасхождения дочерних клеток при нескольких делениях (рис. 6). Тем не менее, перечисленные общие признаки, хотя и очень важны, не всегда достаточны для постановки диагноза.
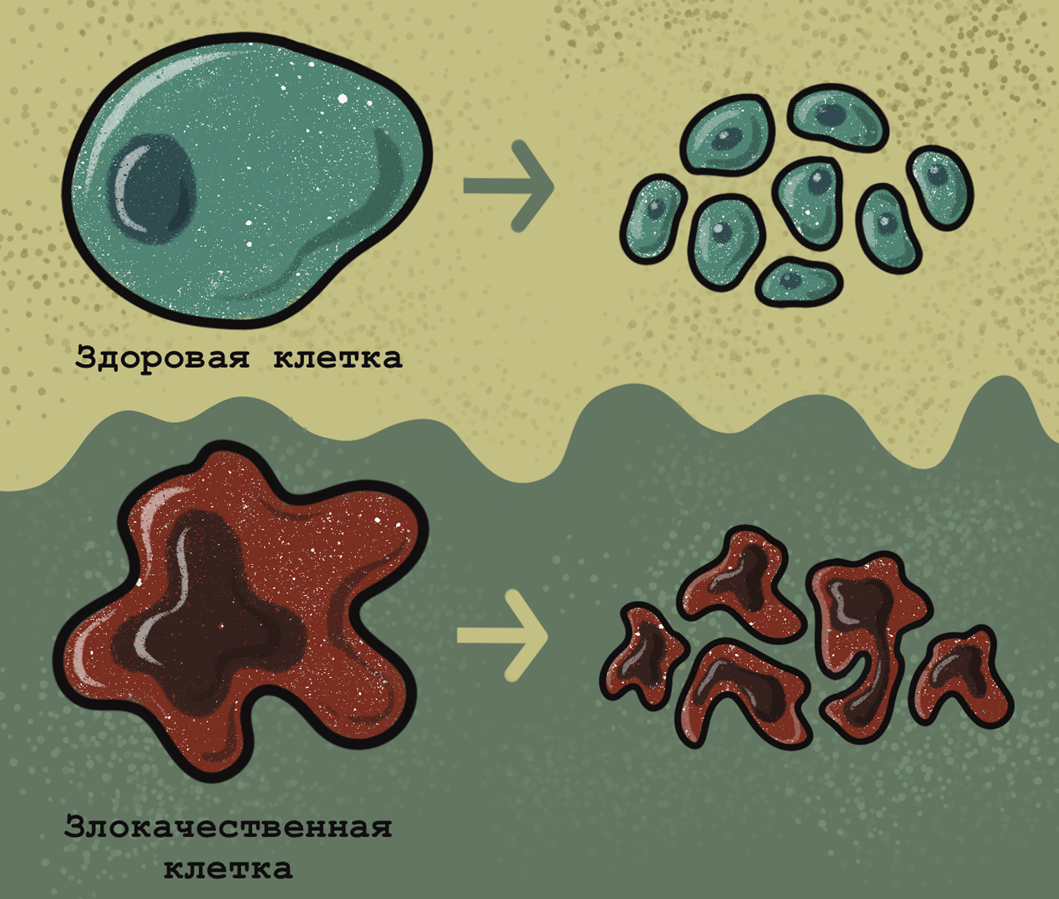
Рисунок 6. Основные отличия здоровых и злокачественных клеток. В отличие от здоровых клеток, имеющих ровные границы и небольшое ядро округлой формы, раковые клетки имеют неправильную форму и большое ядро с неровными краями. В отличие от нормальных клеток, делящихся с образованием двух дочерних клеток и образующих ткани, в раковых клетках процесс деления часто протекает не до конца, что приводит к появлению гигантских скоплений анеуплоидных или полиплоидных клеток с нарушением цитокинеза.
иллюстрация Анастасии Самоукиной по схеме Children’s Cancer and Leukaemia Group
Более специфические цитологические методы позволяют достоверно выявить злокачественный процесс. Важнейшее значение для диагностики рака шейки матки, в том числе на самых ранних стадиях, имеет тест Папаниколау, или Пап-тест, не требующий анализа на специфические опухолевые антигены (рис. 7). В рамках теста мазок клеток из шейки матки подвергают полихроматической окраске, визуализирующей разные компоненты клеток — и на таких препаратах можно выявить метапластические (злокачественные) клетки, которые могут быть окрашены синим, зеленым и розовым в разных сочетаниях. Стоит отметить, что Пап-тест можно использовать для диагностики инфекций влагалища и шейки матки, а также выявления других видов рака.
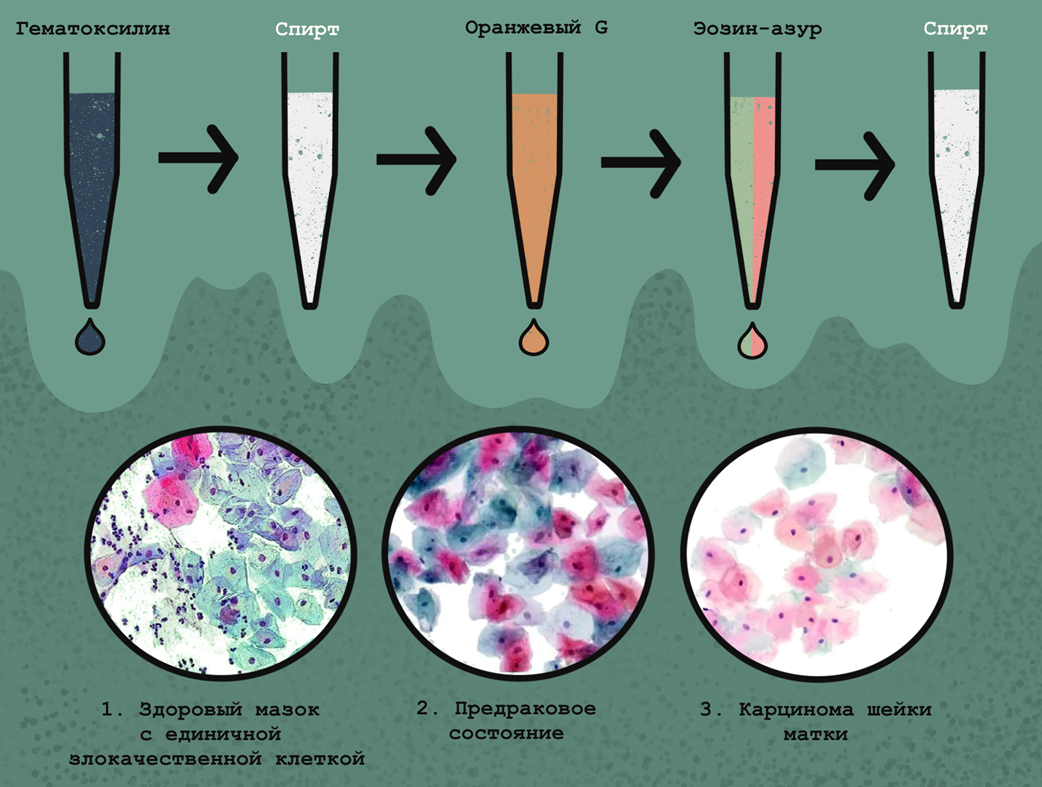
Рисунок 7. Окрашивание цервикального мазка по Папаниколау и интерпретация результатов. Окраска происходит в несколько этапов и включает: визуализацию ядер клеток путем окрашивания гематоксилином (красит ДНК); оранжевым G (подсвечивает цитоплазму взрослых кератинизированных клеток); эозин-азуром (красит цитоплазму зрелых чешуйчатых клеток, а также их ядра, эритроциты и ворсинки). В результате такого окрашивания можно различить клетки с кислой и щелочной цитоплазмой; а также поверхностные клетки. Здоровые парабазальные клетки эпителия шейки матки имеют сине-зеленую окраску, а вот метапластические окрашиваются розовым, зеленым и синим в разных комбинациях, что позволяет легко идентифицировать злокачественный процесс. Слева направо показаны разные степени развития раковой опухоли шейки матки. Благодаря способности красить даже отдельные злокачественные клетки, тест Папаниколау позволяет выявлять рак шейки матки на самых ранних стадиях.
иллюстрация Анастасии Самоукиной по схеме Lab tests guide
Однако в большинстве случаев для диагностики конкретного вида рака используются методы, основанные на выявлении специфических опухолевых антигенов. Огромную роль в рутинной диагностике рака играет иммуногистохимический анализ (ИГХ) , в основе которого лежит детекция опухолевых антигенов с помощью моноклональных антител в образцах опухоли. Иногда в ходе окрашивания определяют связывание самих моноклональных антител благодаря их флуоресценции или пероксидазной активности, в других случаях проводят выявление антител с помощью вторичного окрашивания [14].
Как работают иммуногистохимия (ИГХ) и иммуноферментный анализ (ИФА) — приглашаем прочитать в нашей статье «12 методов в картинках: иммунологические технологии» [15].
Чаще всего ИГХ применяют после обычного гистологического окрашивания опухоли гематоксилином и эозином, которое позволяет в первом приближении выявить подозрительные клетки и повысить точность результата. Клетки некоторых опухолей экспрессируют сразу несколько опухолевых антигенов [16]. Помимо определения специфических опухолевых антигенов, ИГХ может быть использован для выявления быстро делящихся клеток, клеток определенного происхождения и других характеристик, важных для дифференциальной диагностики.
При исследовании опухолевого образца с помощью ИГХ в клинике, как правило, используют панель антигенов, позволяющих оценить сразу несколько ключевых параметров опухоли. Например, при диагностике рака молочной железы одновременно исследуют маркер пролиферации Ki-67; рецепторы эстрогена и прогестерона; PD-L1, который экспрессируют клетки опухоли и/или ассоциированные с ней иммунные клетки; а также антигена HER2, причем уровень экспрессии последнего используют для подбора оптимальной терапии [17], [18]. Такой комплексный подход позволяет оценить одновременно скорость роста опухоли, эффективность иммунного ответа в ней и ее возможную чувствительность к гормональной терапии и таргетной терапии антителами к HER2. Это позволяет ускорить подбор оптимальной терапии и является своего рода гибридом гистохимических и молекулярных методов диагностики, которым посвящен следующий раздел.
Как и любой лабораторный метод, ИГХ не лишен недостатков. Часто детектируемые с его помощью белки экспрессируются не только опухолевыми, но и нормальными клетками (пусть и на другом уровне), что затрудняет интерпретацию результата, так как с помощью ИГХ очень сложно определить уровень экспрессии белка-мишени. Другая сложность состоит в интерпретации результатов: не всегда возможно определить, какой уровень экспрессии антигена присущ нормальным клеткам, а какой — злокачественным [14].
В некоторых случаях для точной интерпретации результатов ИГХ необходимо исследование опухоли с помощью других методов. Однако, несмотря на это, именно ИГХ продолжает оставаться основным методом первичной диагностики в клинической практике.
Один из гистохимических методов для уточнения результатов ИГХ в сложных случаях — флуоресцентная гибридизация in situ (FISH) [19]. Этот подход позволяет выявлять в клетках специфические молекулы ДНК или РНК путем их гибридизации с мечеными олигонуклеотидами-зондами. Если зонд образовал гибридную молекулу с мРНК, кодирующей опухолевый антиген, то в клетке появится видимый флуоресцентный сигнал. Кроме того, FISH может использоваться для выявления многочисленных геномных перестроек, характерных для злокачественных клеток. Экспрессию клетками опухоли специфического опухолевого антигена также можно выявить с помощью вестерн-блота с антителами к белковому продукту интересующего антигена [1], [3].
Существуют также тканевые чипы, основу которых представляют цилиндрические срезы 600 мкм в диаметре и 5 мкм толщиной, получаемые из фиксированных формалином опухолевых тканей; обычно такой чип содержит 500–1000 срезов (рис. 8). С помощью тканевых чипов можно in situ выявлять специфические молекулы ДНК, РНК и белков. Иммуногистохимический анализ срезов в тканевом чипе позволяет, наряду с ДНК-микрочипами, с помощью которых можно определить уровень экспрессии генов, создать более полную картину о синтезе опухолевого антигена в исследуемой ткани.
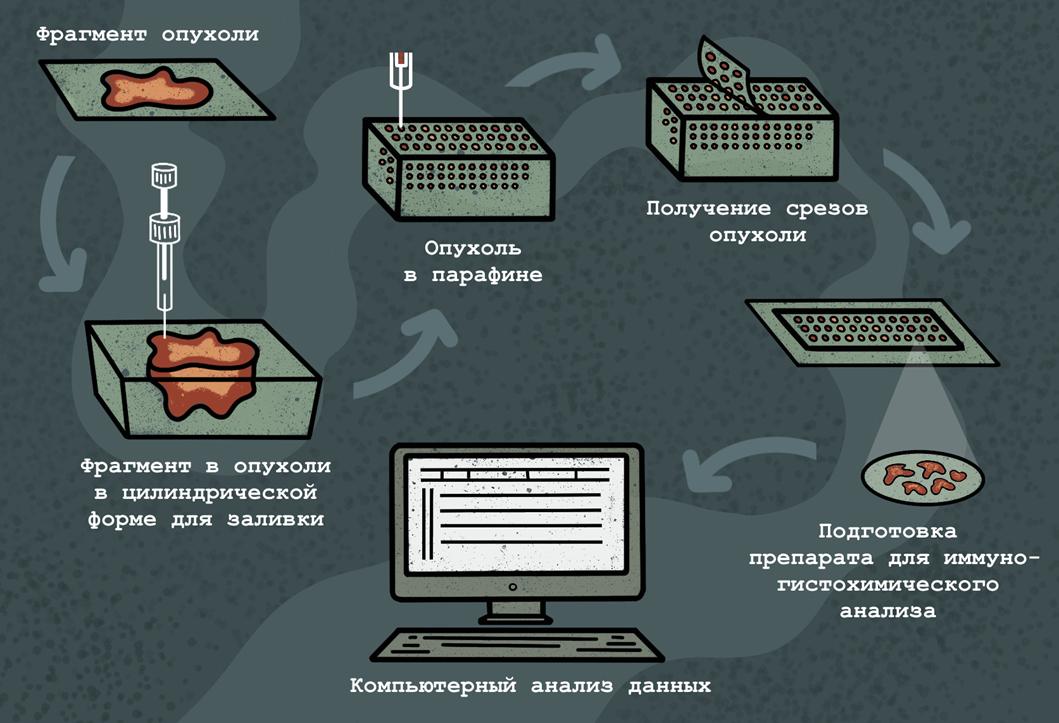
Рисунок 8. Использование тканевых микрочипов в онкодиагностике. Фрагмент опухоли фиксируют, помещают в цилиндрический желоб и заливают парафином. Далее заключенный в парафин образец опухоли нарезают на пятимикронные срезы, которые далее и анализируют (например, иммуногистохимически), причем данные по всем срезам интегрируются в общую картину с помощью вычислительных методов.
иллюстрация Анастасии Самоукиной по схеме Johns Hopkins Medical Pathology
В случае ряда гематологических злокачественных заболеваний для определения опухолевых антигенов используется проточная цитометрия [20], [21].
С помощью флуоресценто-меченных антител к нескольким поверхностным опухолевым антигенам одновременно можно не только получить информацию о возможном злокачественном перерождении клеток, но также определить размер, особенности внутренней структуры и плоидность клеток, так как злокачественные клетки часто бывают анеуплоидными или полиплоидными. Стоит отметить, что с помощью проточной цитометрии можно не только выявлять злокачественные клетки, но и определять клональность B- и T-клеток, что может быть использовано для оценки стадии заболевания [1].
Молекулярные методы диагностики
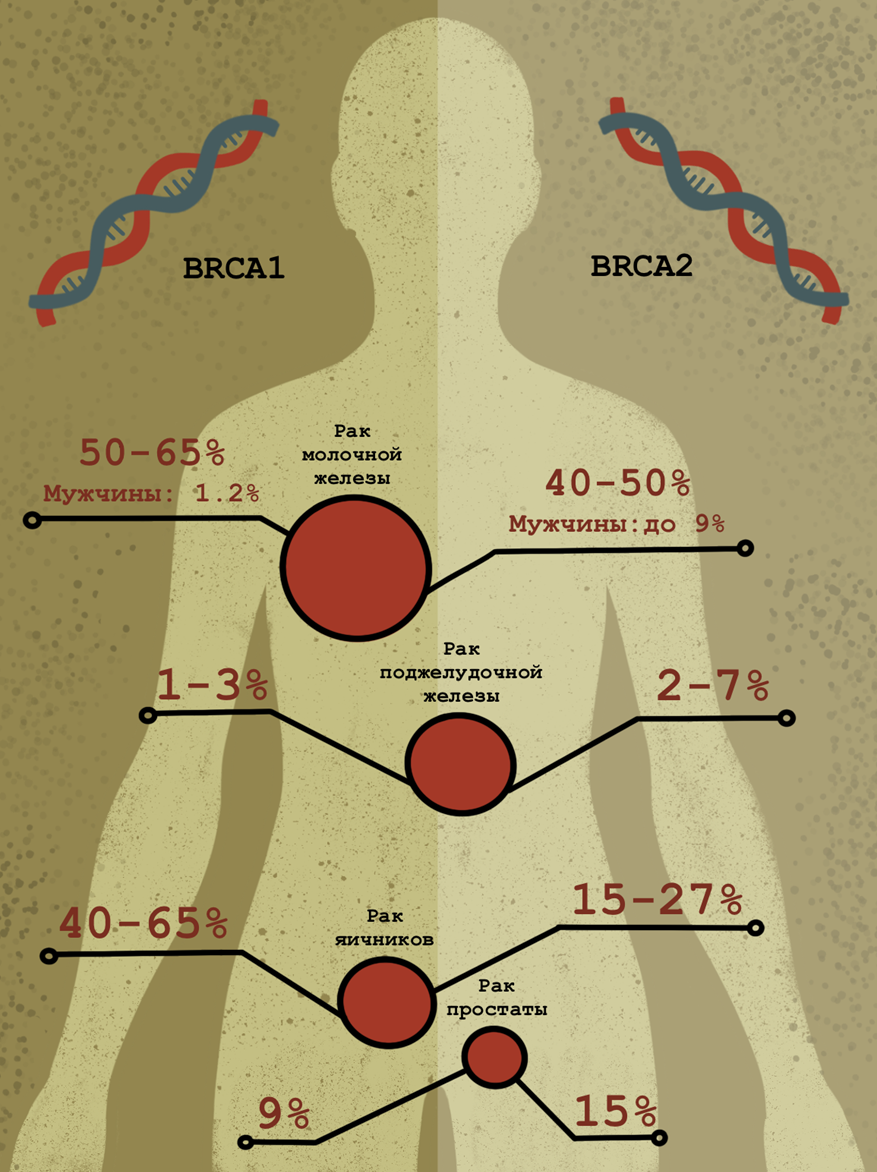
Рисунок 9. Связь мутаций в генах BRCA1 и BRCA2 с частотой рака молочной железы, яичников и других видов рака (в частности, рака поджелудочной железы). У мужчин мутации в этих генах в редких случаях связаны с раком предстательной железы.
иллюстрация Анастасии Самоукиной по схеме Wikimedia
После того, как опухоль выявлена, а ее злокачественность подтверждена иммуногистохимическими методами, для эффективного лечения необходимо определить ее молекулярный подтип — иными словами, нарисовать портрет на молекулярном уровне. Благодаря этим сведениям появляется возможность подобрать для опухоли более специфическую и, вероятно, более эффективную терапию. Например, для оценки рисков развития рака молочной железы и яичников проводят мутационный анализ генов BRCA1 и BRCA2 (рис. 9) [22], [23]. Выявление мутаций, ассоциированных с разными видами рака, позволяет начать превентивные действия для уменьшения риска. Например, при наличии мутаций в генах BRCA1 и BRCA2 врач может предложить пациентке профилактическую мастэктомию.
Ни одна злокачественная клетка не обходится без мутаций [24]. Непрерывные деления, слабость систем репарации или вовсе их отключение приводят к тому, что любая раковая клетка накапливает огромное количество мутаций разных уровней, от точечных замен до хромосомных перестроек и геномных изменений, в том числе изменяющих плоидность. Выявление мутаций, которые содержат клетки конкретных опухолей, позволяет понять, в чем их «ахиллесова пята», и, используя полученные сведения о молекулярном подтипе опухоли, подобрать эффективную специфическую терапию.
Геном злокачественных клеток нестабилен, что приводит к многочисленным перестройкам в ДНК. В случае некоторых видов рака происходят строго определенные хромосомные мутации — например, при хроническом миелоидном лейкозе злокачественные клетки несут так называемую филадельфийскую хромосому, которая образуется в результате взаимной транслокации между хромосомами 9 и 22 [25], [26]. Однако гораздо чаще перед клиницистами стоит задача по выявлению уникальных хромосомных перестроек, произошедших в клетках данной конкретной опухоли. Для решения этой задачи может быть использована полногеномная разновидность FISH [19]. Этот анализ включает гибридизацию референсной геномной последовательности и исследуемого генома с различными зондами, меченными разными флуоресцентными красителями. Различия в паттернах мечения указывают на цитогенетические изменения, которые претерпели злокачественные клетки, в том числе и хромосомные мутации [1].
Раковые клетки не всегда несут грубые хромосомные мутации, которые можно выявить цитогенетически: нередко их злокачественный фенотип ассоциирован с относительно небольшими мутациями, затрагивающими конкретные гены. Например, показана связь между мутациями в генах, кодирующих EGFR и BRAF, а также образование химерного гена EML4—ALK, возникшего в результате транслокации, и немелкоклеточного рака легкого. Наличие тех или иных мутаций зачастую играет важнейшую роль в подборе терапии для данного конкретного пациента. Стоит отметить, что в отношении разных генов могут быть использованы разные методы выявления мутаций. Например, мутации в гене BRAF чаще всего детектируются с помощью секвенирования по Сэнгеру и аллель-специфичной ПЦР в реальном времени [27], а для химерного гена EML4—ALK применяют FISH.
Мутации в конкретных генах можно выявить и с помощью микрочипов. Если опухолевый ген успел накопить мутации, то его гибридизации с нормальным геном, нанесенным на микрочип, не произойдет, что можно будет детектировать по отсутствию флуоресцентного сигнала. Кроме того, микрочипы могут подойти для картирования однонуклеотидных полиморфизмов, которые имеют место в геноме конкретной опухоли. Определение мутаций и однонуклеотидных полиморфизмов помогут в точном определении молекулярного фенотипа опухоли [3]. Однако в клинической практике этот чрезвычайно дорогостоящий метод используется редко.
Разные молекулярные подтипы опухоли нередко отличаются уровнем экспрессии определенных онкогенов. Оценить уровень экспрессии тех или иных генов можно с помощью количественной ПЦР [28]. Изменения в экспрессии разнообразных генов, которые активны в клетках данной опухоли, можно детально описать с помощью омиксных технологий, таких как транскриптомика, протеомика, метаболомика и других (см.: «Факты и легенды о мультиомиксных технологиях» [29], а также «Омикс-биомаркеры и ранняя диагностика: когда счастье возможно» [38]). Сопоставив данные этих исследований, можно получить детальную информацию о профиле экспрессии генов в конкретной опухоли, а также метаболизме ее клеток. Используя эти сведения, можно выявить «слабое место» опухоли и подобрать терапию, действующую на нее.
После определения молекулярного подтипа опухоли и предварительного выявления ее слабых мест необходимо перейти к следующему этапу — подбору терапии и предсказанию чувствительности к ней. Для предсказания ответа на терапию сóлидных опухолей разработаны специальные рекомендации, собранные в обновляемом руководстве RECIST [30], в основу которого положено измерение размеров опухоли. Согласно RECIST, существует четыре вида ответа опухоли на терапию:
- полный ответ, при котором опухоль совершенно не визуализируется;
- частичный ответ, при котором сумма самых протяженных диаметров в опухоли сокращается более чем на 30%;
- прогрессирующее заболевание, при которых сумма протяженных диаметров увеличивается более чем на 20% и/или появляются новые опухолевые очаги;
- стабильное заболевание, не удовлетворяющее трем вышеперечисленным критериям.
Как правило, традиционная химиотерапия дает хорошие результаты по критериям RECIST. Однако следует отметить, что RECIST не учитывает эффективность терапии, которая не сразу приводит к уменьшению размера опухоли — в частности, иммунотерапии [30].
Важнейший фактор, определяющий чувствительность опухоли к терапии, — ее метаболизм. Как отмечалось выше, злокачественные клетки очень интенсивно поглощают глюкозу, благодаря чему их можно выявить на ПЭТ-ФДГ. Эффективность проводимого лечения можно отслеживать, время от времени проводя ПЭТ-ФДГ по ходу лечения [30].
Для предсказания ответа опухоли на терапию нужно знать не только ее линейные параметры, но и плотность клеток в ней. Для оценки этого параметра используется диффузионный магнитный резонанс (ДМР). Поскольку действие большинства методов противораковой терапии приводит к уменьшению клеточной плотности, ДМР, подобно ПЭТ, может быть использован для наблюдения за эффективностью лечения в реальном времени. ДМР — неинвазивный метод, в котором в качестве контрастного вещества выступает вода, диффундирующая в опухоль. Остаточный сигнал ДМР у пациента, прошедшего курс терапии, свидетельствует о неполном уничтожении опухоли. Таким образом, ДМР может быть использован для предсказания успешности лучевой терапии и химиотерапии, а также оценкой их эффективности [30].
Из-за быстрого роста опухоли клетки, которые находятся внутри нее, оказываются в состоянии гипоксии, поскольку не имеют доступа к кровеносным сосудам. Если сосуды не успевают прорасти в опухоль, то в ней формируются очаги некротизированных клеток, погибших из-за гипоксии, и метаболически активных клеток, продолжающих деление. Выявить некротизированные очаги можно с помощью ряда методов визуализации, таких как МРТ, усиленная динамическим контрастом, и КТ. Благодаря этим подходам можно предсказать, как на опухоль подействует терапия, подавляющая рост кровеносных сосудов, и наблюдать за ее эффективностью, визуализируя опухоль по ходу терапии [30].
Еще один метод для подбора лечения и предсказания его эффективности на основании гипоксических изменений в опухоли — ПЭТ, в котором в качестве радиоактивной метки используется 18F-фторомизонидазол. У пациентов, страдающих раком головы и шеи, этот метод позволяет рассчитать соотношение опухолевых клеток к мышечным, из чего можно сделать вывод о числе злокачественных клеток, находящихся в состоянии гипоксии [30].
Как неоднократно отмечалось, злокачественные клетки усиленно делятся, и количественное измерение ее скорости может помочь при определении прогноза, подборе терапии и наблюдении за лечением. Для этой цели используется особая разновидность ПЭТ, в которой в качестве радиоактивной метки берут 3’-дезокси-3’-[18F]-фтортимидин [30].
Серологические методы
Еще один подход, стоящий в клинической практике несколько особняком, — это выявление опухолевых антигенов не в образцах опухолевой ткани, а в плазме крови. Методы, позволяющие детектировать опухолевые антигены в плазме крови, называют серологическими. Самые популярные среди них — иммуноферментный анализ (ИФА) и радиоиммуноанализ (РИА). ИФА используется для выявления и определения концентрации опухолевых антигенов в биологических жидкостях. РИА основан на конкуренции связывания радиоактивно-меченного и немеченного антигена с антителом, обладающим высоким сродством к антигену. Если связывание немеченного антигена с антителом преобладает, то в исследуемой биологической жидкости на детектируемом уровне присутствует опухолевый антиген. Отметим, что для получения с помощью РИА корректных результатов, необходимо рассчитать количество высокоаффинных антител, которые могут связать 60–70% меченного антитела. Для точного определения количества опухолевого антигена можно осадить полученные комплексы немеченных антигенов с антителами и подсчитать количество преципитированных комплексов.
Как работают иммуногистохимия (ИГХ) и иммуноферментный анализ (ИФА) — приглашаем прочитать в нашей статье «12 методов в картинках: иммунологические технологии» [15].
С серологическими методами связано появление понятия «онкомаркер». Это белки или вещества другой природы, которые злокачественные клетки секретируют в кровь и другие биологические жидкости, за счет чего уровень этих соединений становится существенно выше нормальных значений. Благодаря онкомаркерам стало возможным выявление ранних стадий разных видов рака еще до появления симптомов. Кроме того, онкомаркеры могут использоваться для определения прогноза, отслеживания рецидива после хирургического удаления злокачественной опухоли, предсказания ответа на терапию и отслеживания терапии при лечении поздних стадий рака [31].
Первый онкомаркер — ракоэмбриональный антиген (РЭА) — был описан еще в 1965 году [32]. Это гликопротеин, который продуцируют клетки разнообразных опухолей, однако чаще всего его используют для диагностики рака толстой кишки. С каждым годом количество онкомаркеров, в том числе специфичных для конкретных видов рака, постоянно растет, и периодический анализ на ряд онкомаркеров входит в программу онкоскринингов.
Онкомаркеры не всегда представлены опухолевыми антигенами: среди них есть цитоплазматические белки, ферменты и гормоны (см. таблицу 1). Для этих анализов, как правило, используют кровь, но иногда берут и другие физиологические жидкости (например, мочу).
Следует отметить, что, несмотря на все достоинства биомаркеров, есть у них и ограничения. Во-первых, не все онкомаркеры чувствительны к ранним стадиям рака и предопухолевой стадии. Во-вторых, некоторые онкомаркеры специфичны не только для опухолевых процессов и потому не подходят для скрининга бессимптомных пациентов [31]. В целом, наряду с исследованиями на онкомаркеры, необходимо проводить дополнительные обследования во избежание получения ложноположительных и ложноотрицательных результатов. Более подробно с биомаркерами, использующимися для диагностики разных видов рака, можно познакомиться в статье [39] (таблица 1).
| Онкомаркер | Диагностируемые опухоли |
|---|---|
| Раковоэмбриональный антиген (РЭА) | Рак толстой кишки, молочной железы, легких, поджелудочной железы, желудка, яичника |
| Альфа-фетопротеин | Гепатоцеллюлярная карцинома, опухоль клеток зародышевой линии в семенниках |
| Бета-2 микроглобулин | Множественная миелома, хронический лимфоцитарный лейкоз, некоторые лимфомы |
| Простатический специфический антиген (ПСА) | Рак простаты |
| CA 125 | Карцинома яичников |
| CA19-9 | Аденокарцинома желудочно-кишечного тракта, рак поджелудочной железы |
| CA-15.3, CA2-7.29 | Рак молочной железы |
| CA-19.9 | Рак желудка, поджелудочной железы, желчного пузыря и желчных протоков |
| CD20 | Неходжкинская лимфома |
| Кальцитонин | Опухоль медуллярной части щитовидной железы |
| Лактатдегидрогеназа | Опухоли клеток зародышевой линии |
| Бета-хорионический гонадотропин человека (ХГЧ) | Хориокарцинома, рак семенников |
| Циркулирующие опухолевые клетки | Метастатический рак молочной железы, простаты, толстой кишки |
| PCA3 мРНК | Определяется в моче при раке простаты |
Раньше в качестве онкомаркеров рассматривались только специфические белки. Однако в последние годы все большее значение в онкодиагностике приобретают кольцевые РНК и ДНК, циркулирующие в кровотоке. Эти молекулы устойчивы к нуклеазам, которые расщепляют линейные молекулы нуклеиновых кислот, поэтому могут в заметных количествах накапливаться в крови.
Вследствие транслокаций, которые часто происходят в злокачественных клетках, образуются кольцевые РНК, никогда не синтезирующиеся в здоровых тканях. Такие кольцевые РНК могут служить биомаркерами ряда злокачественных заболеваний. Так, недавно было показано, что hsa_circ_0004277 является биомаркером острого миелоидного лейкоза, а для диагностики аденокарциномы легких, в том числе на ранних стадиях, может быть использована кольцевая РНК hsa_circ_0013958 [40].
Кольцевые ДНК ковалентно замкнуты, находятся в ядре, но при этом не входят в состав хромосом, не являясь при этом плазмидами. Кольцевые ДНК широко распространены среди эукариот, однако для диагностики рака особый интерес представляют очень крупные внехромосомные кольцевые ДНК, которые содержат онкогены и часто присутствуют в злокачественных клетках в большом числе копий. Так, в клеточных линиях, происходящих из злокачественных клеток колоректального рака, а именно, COLO320-DM и COLO320-HSR, повышена копийность онкогена MYC из-за внехромосомной ДНК [41].
Выявление специфических онкогенных кольцевых ДНК ограничено их малым количеством в плазме крови. Тем не менее, удалось показать, что наличие тех или иных внехромосомных кольцевых ДНК свидетельствует о высокой злокачественности опухоли и связано с плохим прогнозом для пациента [41].
Заключение
Перечисленные выше методы — не единственные, которые могут быть использованы в диагностике злокачественных заболеваний, но лишь самые известные и распространенные. Однако даже они используются в клинической практике с неодинаковой частотой. Основу первичной онкодиагностики составляет сочетание тех или иных методов визуализации опухоли с ИГХ, остальные методы используются главным образом для уточнения диагноза.
Активное использование того или иного метода во многом определяется его ценой и трудозатратностью. Так, микрочипы практически не используются в рутинной практике, а ИГХ и серологические методы, по необходимой для лечения информативности мало уступающие более дорогим методам вроде количественной ПЦР и NGS, используются гораздо чаще [1]. Однако и более дорогие методы, показавшие свою эффективность, постепенно внедряются всё шире и становятся дешевле, как это произошло, скажем, с МРТ.
Следует отметить, что погоня за «самым современным методом диагностики» не должна быть самоцелью ни у пациента, ни тем более у врача. Не всякий диагноз нуждается в сложном многоступенчатом уточнении (на которое помимо дорогостоящего оборудования необходимо время). Во многих случаях самые простые и распространенные анализы дают достаточно информации, чтобы начать лечение. Решение о целесообразности дополнительных обследований принимает врач-онколог, по возможности объясняя пациенту, с чем связано то или иное назначение.
Онкодиагностика динамично развивается: каждый год появляются новые методы и подходы, и вскоре многие из них, вероятно, поступят в клиническую практику. Так, активно разрабатываются подходы к диагностике злокачественных заболеваний с помощью искусственного интеллекта [33], [34]. Продолжается поиск новых биомаркеров — в частности, с помощью нанотехнологий [35]. Кроме того, разрабатываются подходы к диагностике онкологических заболеваний с помощью микроРНК [36] и экзосом [37]. Будем надеяться, эти новые методы уже в ближайшие годы смогут спасти немало человеческих жизней.
Литература
- Akhil Pulumati, Anika Pulumati, Bilikere S. Dwarakanath, Amit Verma, Rao V. L. Papineni. (2023). Technological advancements in cancer diagnostics: Improvements and limitations. Cancer Reports. 6;
- От медицинской онкологии к молекулярной биологии рака;
- Kumar P., Pawaiya R. (2010). Advances in Cancer Diagnostics. Brazilian Journal of Veterinary Pathology. 3, 141–152;
- Philipp Weber, Philipp Tschandl, Christoph Sinz, Harald Kittler. (2018). Dermatoscopy of Neoplastic Skin Lesions: Recent Advances, Updates, and Revisions. Curr. Treat. Options in Oncol.. 19;
- ВПЧ: вирус, вызывающий рак;
- «Не напрасно»: Скрининг онкозаболеваний по ОМС: какие обследования можно пройти;
- Robert-Jan M. van Geuns, Piotr A. Wielopolski, Hein G. de Bruin, Benno J. Rensing, Peter M.A. van Ooijen, et. al.. (1999). Basic principles of magnetic resonance imaging☆. Progress in Cardiovascular Diseases. 42, 149-156;
- 12 методов в картинках: структурная биология;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Amol Fatangare, Aleš Svatoš. (2016). Applications of 2-deoxy-2-fluoro-D-glucose (FDG) in Plant Imaging: Past, Present, and Future. Front. Plant Sci.. 7;
- Заглянем в окошко московской кибер-поликлиники;
- Увидеть то, что неподвластно глазу: как радиомика помогает врачам в диагностике опухолей;
- Baba A.I., Câtoi C. Tumor cell morphology. In: Comparative Oncology. Bucharest (RO): The Publishing House of the Romanian Academy, 2007;
- Kabiraj A., Gupta J., Khaitan T., Bhattacharya P. (2015). Principle and techniques of immunohistochemistry. International Journal of Biological & Medical Research. 6, 5204–5210;
- 12 методов в картинках: иммунологические технологии;
- Bela Bodey. (2002). The significance of immunohistochemistry in the diagnosis and therapy of neoplasms. Expert Opinion on Biological Therapy. 2, 371-393;
- Ramona Erber, Arndt Hartmann. (2020). Understanding PD-L1 Testing in Breast Cancer: A Practical Approach. Breast Care. 15, 481-490;
- Michael Untch*, Bernd Gerber, Nadia Harbeck, Christian Jackisch, Norbert Marschner, et. al.. (2013). 13th St. Gallen International Breast Cancer Conference 2013: Primary Therapy of Early Breast Cancer Evidence, Controversies, Consensus - Opinion of a German Team of Experts (Zurich 2013). Breast Care. 8, 221-229;
- От хромосом к молекулам: молекулярная цитогенетика;
- 12 методов в картинках: проточная цитофлуориметрия;
- Проточная цитометрия: где вы были эти пять лет?;
- Nadine M. Tung, Judy E. Garber. (2018). BRCA1/2 testing: therapeutic implications for breast cancer management. Br J Cancer. 119, 141-152;
- Рак молочной железы с семейной историей;
- Геномная головоломка: открой в себе мозаика;
- Gary A. Koretzky. (2007). The legacy of the Philadelphia chromosome. J. Clin. Invest.. 117, 2030-2032;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: полимеразная цепная реакция;
- Факты и легенды о мультиомиксных технологиях;
- Milou H. Martens, Doenja M. J. Lambregts, Ewelina Kluza, Regina G. H. Beets-Tan. (2014). Tumor Response to Treatment: Prediction and Assessment. Curr Radiol Rep. 2;
- Michael J. Duffy. (2013). Tumor Markers in Clinical Practice: A Review Focusing on Common Solid Cancers. Med Princ Pract. 22, 4-11;
- Cui Hao, Guoqing Zhang, Lijuan Zhang. (2019). Serum CEA levels in 49 different types of cancer and noncancer diseases. Progress in Molecular Biology and Translational Science. 213-227;
- Andreas Kleppe, Ole-Johan Skrede, Sepp De Raedt, Knut Liestøl, David J. Kerr, Håvard E. Danielsen. (2021). Designing deep learning studies in cancer diagnostics. Nat Rev Cancer. 21, 199-211;
- Народные сказки об искусственном интеллекте в распознавании медицинских изображений;
- Fei Ye, Ying Zhao, Ramy El-Sayed, Mamoun Muhammed, Moustapha Hassan. (2018). Advances in nanotechnology for cancer biomarkers. Nano Today. 18, 103-123;
- Manuela Ferracin, Angelo Veronese, Massimo Negrini. (2010). Micromarkers: miRNAs in cancer diagnosis and prognosis. Expert Review of Molecular Diagnostics. 10, 297-308;
- Young Soung, Shane Ford, Vincent Zhang, Jun Chung. (2017). Exosomes in Cancer Diagnostics. Cancers. 9, 8;
- Омикс-биомаркеры и ранняя диагностика: когда счастье возможно;
- Virinder Kaur Sarhadi, Gemma Armengol. (2022). Molecular Biomarkers in Cancer. Biomolecules. 12, 1021;
- Duc-Hiep Bach, Sang Kook Lee, Anil K. Sood. (2019). Circular RNAs in Cancer. Molecular Therapy - Nucleic Acids. 16, 118-129;
- Julie B. Noer, Oskar K. Hørsdal, Xi Xiang, Yonglun Luo, Birgitte Regenberg. (2022). Extrachromosomal circular DNA in cancer: history, current knowledge, and methods. Trends in Genetics. 38, 766-781.







