Нейробиология спячки: гипоталамус, Q-нейроны и все-все-все
15 февраля 2023
Нейробиология спячки: гипоталамус, Q-нейроны и все-все-все
- 725
- 0
- 4
Представители семьи Старков из «Игры престолов» часто повторяли: «Зима близко», предупреждая о наступлении суровых времен. Однако героев статьи не напугать такими заявлениями: каждый из них подготовился к зимнему периоду.
Рисунок в полном размере.
составляющие заглавного изображения взяты из wallpaper.org и plaqat.ru
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Каждый год зима обрушивается на многие области земного шара и приносит с собой более низкие температуры, а также снежок. Живые организмы адаптировались к таким условиям, притом разными способами. Некоторые виды мигрируют в более теплые регионы. В то же время, другие меняют не локацию, а собственные характеристики: утепляются и покрываются шерстью белоснежного окраса, либо, как вид, к которому относится медвежонок Винни-Пух, замедляют метаболические процессы и переходят в состояние покоя — спячку. Однако одинаково ли протекает спячка у разных животных? Каковы нейробиологические механизмы спячки? Возможно ли погрузить животное в спячку искусственно, управляя этими механизмами, и для чего? Ответы современной науки на перечисленные вопросы собраны в статье.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла второе место в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла второе место в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.
Партнер номинации — компания «Сесана»: — один из ведущих поставщиков оборудования и реагентов для полного цикла научного исследования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Спячка у созданий больших и маленьких
Нелегко приходится эндотермным (т.е. теплокровным) животным, которые образуют большую часть своего тепла за счет биохимических реакций и тратят много энергии на поддержание постоянной температуры тела. Серьезным испытанием для них становится переживание зимы, когда вместе с температурой окружающей среды падает и доступность съестного. Некоторые животные, например, медведи, ежи, летучие мыши, отдельные виды приматов предпочли стратегию, которую можно описать как «в любой непонятной ситуации — гибернируй», то есть впадай в спячку. Удивительно, но такую способность обнаружили даже у птиц, которые в большинстве своем мигрируют в теплые края. Единственный гибернирующий представитель пернатых — американский белоголовый козодой Phalaenoptilus nuttallii (рис. 1) — способен погружаться в спячку до 25 дней [1].

Рисунок 1. Единственный гибернирующий пернатый собственной персоной.
Интересно отметить, что спячка может развиваться независимо от снижения доступности ресурсов, в связи с чем различают факультативных и облигатных гибернирующих животных (рис. 2) [2]. У факультативных переход в неактивное состояние происходит из-за ограничения ресурсов, похолодания и изменения суточного ритма освещения. К ним относятся мелких и средних размеров грызуны, как, например, хомяки, а также некоторые сумчатые млекопитающие и летучие мыши. В отличие от них, облигатные виды прибегают к спячке сезонно, вне зависимости от наличия ресурсов, температуры окружающей среды и продолжительности светлого времени суток. Это некоторые грызуны семейства Беличьи Sciuridae (сурки, суслики и луговые собачки), насекомоядные (европейский еж Erinaceus europaeus) и хищные млекопитающие (европейский барсук Meles meles), а также приматы из рода карликовых лемуров Cheirogaleus.

Рисунок 2. Представители животного мира, впадающие в кратковременное оцепенение (суточный торпор), спячку или способные на тот и другой процесс.
[2], c модификацией
Несмотря на русскоязычное название «спячка», физиологическое состояние, в которое переходит организм перечисленных выше животных, не тождественно сну. При спячке (гибернации) наблюдается чередование длительного, более 24 часов, оцепенения (торпора, bouts of torpor) с периодами пробуждения (interbout arousals, IBA) [2], [3]. Во время торпора, пока животное неактивно, его организм находится в режиме глубокой экономии энергии. Температура его тела снижается (гипотермия), но не ниже уровня замерзания крови (рис. 3), а также падает артериальное давление, замедляется сердцебиение, дыхание и обмен веществ в целом — развивается гипометаболизм. В таком состоянии особо не поешь и не подвигаешься — возрастает необходимость в надежном убежище, но и потери тепла сокращаются. Перечисленные физиологические процессы восстанавливаются в кратковременные периоды пробуждения (рис. 3).
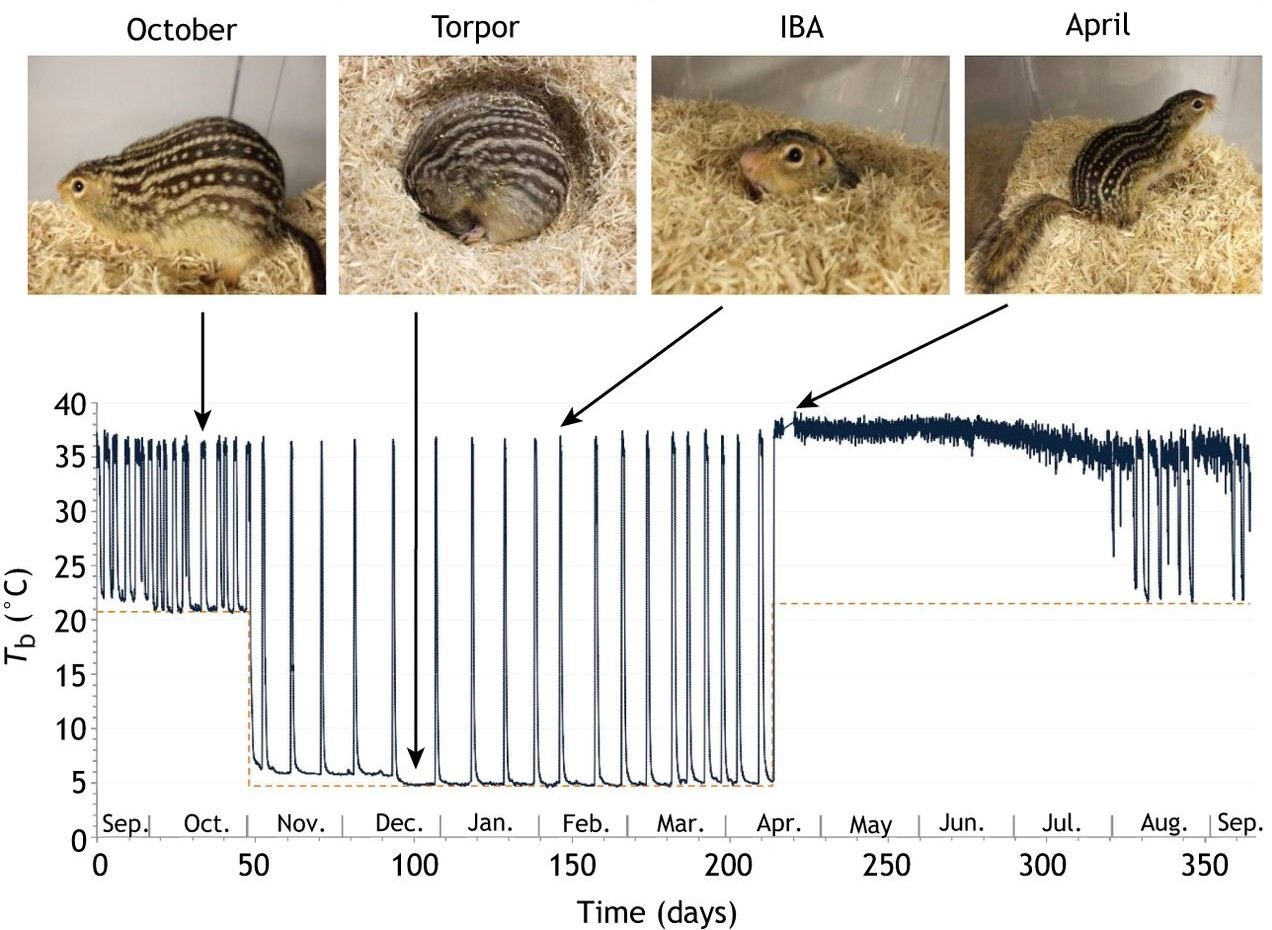
Рисунок 3. Динамика изменения температуры тела (Tb, график) и активности (фотографии) тринадцатиполосного суслика в течение года. Во время спячки резкое падение температуры (торпор, torpor) чередуется с ее непродолжительным восстановлением (пробуждение, IBA).
[3], c модификацией
Продолжительность гибернации в целом, периодов торпора и пробуждения варьирует среди животных [2], [3]. Так, тринадцатиполосные суслики Ictidomys tridecemlineatus впадают в спячку на 5–7 месяцев, в течение которых на эпизод торпора приходится 2–3 недели, эпизод пробуждения — около 24 часов. В то же время, у летучих мышей вида Hipposideros armiger terasensis спячка длится 3 месяца с чередованием недельных периодов торпора и 2-часовых периодов пробуждения.
Среди гибернирующих животных многие, например, грызуны и насекомоядные млекопитающие, обладают небольшими размерами. И это неслучайно: поверхность их тела слишком значительна по отношению к его объему, что сопряжено с возрастанием потерь тепла. Однако среди некрупных животных переход в неактивное состояние выражен в разной степени. Наряду с гибернирующими представителями, существуют виды, которые впадают в оцепенение кратковременно, менее 24 часов — суточный торпор (daily torpor) [2]. Например, так поступают многие птицы и мыши (рис. 2). У крыс, напротив, не обнаружено способности ни к гибернации, ни к отдельным эпизодам оцепенения. Однако ученым удалось ввести крыс в неактивное состояние искусственно, о чем будет рассказано далее.
«Центры спячки» в головном мозге
Изменение температуры тела, интенсивности обменных процессов и поведения в режиме гибернации или отдельных эпизодов торпора находятся под контролем центральной нервной системы (ЦНС). Важная роль, в частности, принадлежит гипоталамусу (рис. 4) — структуре промежуточного мозга, которая содержит центры голода, жажды и терморегуляции [4–7].
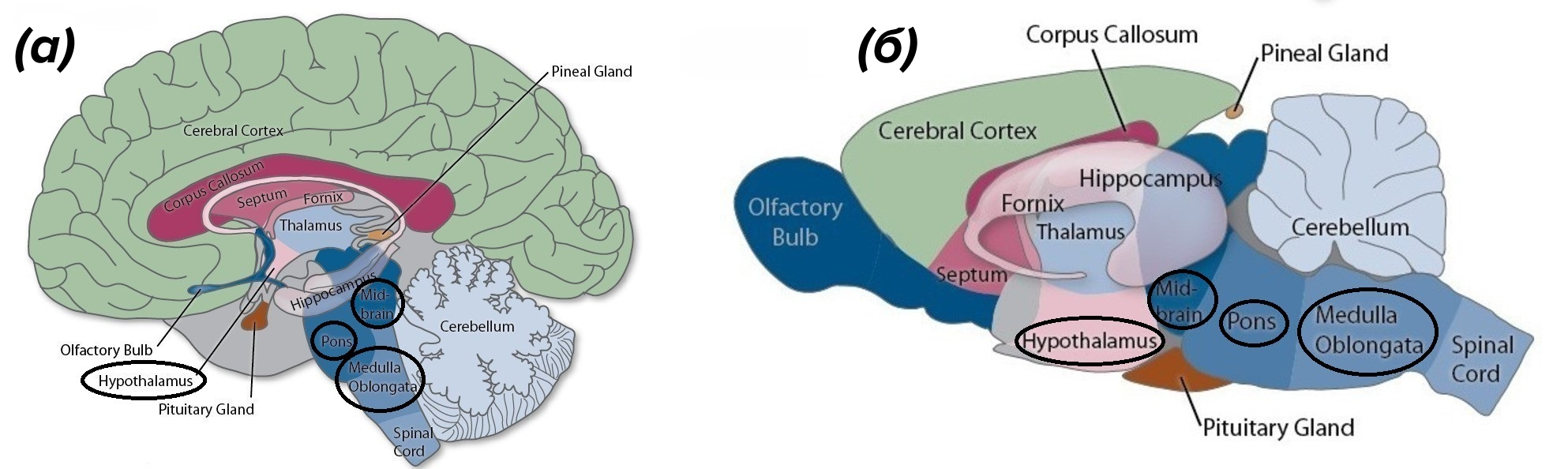
Рисунок 4. Мозг человека (а) и крысы (б). Черным выделены названия структур, которые обеспечивают погружение в спячку: гипоталамус (hypothalamus), ствол мозга — средний мозг (midbrain), варолиев мост (pons), продолговатый мозг (medulla oblongata).
из keywordbaskets.com, c модификацией
Ствол головного мозга (рис. 4) — эволюционно наиболее древняя часть головного мозга, к которой относят продолговатый и средний мозг, а также расположенный между ними варолиев мост — выполняет схожую с гипоталамусом функцию. Ядра, расположенные в нем, отвечают на сигналы от внутренних органов запуском рефлексов, которые направлены на поддержание гомеостаза: частоты дыхания, уровня кровяного давления и др. [8]. В этой статье сделан акцент на роли гипоталамуса и исследованиях активности его ядер, которые продемонстрировали потенциал практического применения.
Мозг, впадающий в спячку
Голод. Наблюдая за поведением тринадцатиполосных сусликов, ученые заметили, что грызуны сокращали потребление пищи за несколько недель до спячки и проживали период покоя без крупинки во рту [9]. Такое поведение животных кажется удивительным. Когда поступление питательных веществ в ЖКТ снижается, что происходит и при гибернации, клетки желудка и тонкого кишечника активно вырабатывают гормон голода грелин. Высокий уровень гормона в крови активирует Agrp±нейроны аркуатного ядра гипоталамуса (рис. 5), названные так за синтез агути-подобного пептида (agouti-related peptide) [5], [10]. Пептид связывается с рецепторами меланокортинов и на правах обратного агониста тормозит их сигнальные пути, что в итоге стимулирует аппетит и желание подкрепиться [10], [11]. Нужно отметить, что вместе с грелином на нейроны аркуатного ядра воздействуют инсулин и гормон насыщения лептин, которые синтезируются в клетках поджелудочной железы и жировой ткани, соответственно.

Рисунок 5. Схематичное изображение ядер гипоталамуса и ствола мозга крысы. Ядра гипоталамуса: MnPO — медиальное ядро преоптической зоны, POA — преоптическая зона, ARC — аркуатное ядро. Также обозначен субфорникальный орган (SFO).
Напрашивается вопрос: почему животное в спячке не испытывает голода, несмотря на то, что совсем не ест? Согласно одной из гипотез, во время гибернации снижается влияние грелина на Agrp±нейроны. В ее пользу можно отнести итоги работы на семействе Беличьи. В брюшную полость грызунов вводили грелин на протяжении всех сезонов года, включая время погружения в спячку [12]. Введение гормона повысило аппетит и массу тела животных даже во время спячки, однако не так ярко, как в периоды активности. Одновременно с этим, в гипоталамусе активных, но не гибернирующих, животных возросли уровни белков (раз и два), регулирующих энергетический баланс клеток. Схожий эффект грелина обнаружили и у крыс, которые не впадают в спячку совсем [13].
Возможно, грелин становится менее влиятельным во время спячки из-за сезонного изменения проницаемости таницитов — глиальных клеток, выстилающих третий желудочек и связанных с гипоталамусом [14]. Они чувствительны к гормонам и метаболитам внутренних органов, и проводят вещества из крови к клеткам гипоталамуса. Всё это, вместе с зависящей от времени года экспрессией генов, вероятно, обеспечивает биоритмы у гибернирующих видов [14], [15]. Согласно другому предположению, чувствительность нейронов аркуатного ядра определяется экспрессией рецепторов к грелину, как это было установлено для лептина. Содержание рецепторов лептина возрастало в клетках гипоталамуса перед спячкой, когда аппетит тринадцатиполосных сусликов снижался [2].
Жажда. Во время гибернации ограничено поглощение не только пищи, но и воды [16]. Как и в случае с голодом, точный механизм подавления жажды еще предстоит выяснить. Однако ученым удалось выделить физиологические адаптации у гибернирующих животных для переживания дефициты воды. Но прежде упомянем структуры, контролирующие потребление воды организмом.
Мозг и почки работают в связке и «общаются» через эндокринные сигналы (рис. 6). В ответ на низкий объем крови и сдвиг концентрации веществ (осмоляльность) особые клетки почек выделяют ренин. При его участии образуется ангиотензин II, который стимулирует надпочечники к синтезу альдостерона — гормона, регулирующего концентрацию ионов натрия в крови. В свою очередь, сразу ряд соподчиненных структур на границе третьего желудочка (его стенка примыкает к гипоталамусу) реагируют на уровень ангиотензина и осмоляльность крови и запускают соответствующий поведенческий ответ. К ним относятся терминальная пластинка, медиальная преоптическая зона гипоталамуса, а также субфорникальный орган с его нейронами жажды (рис. 5, рис. 6) [17].
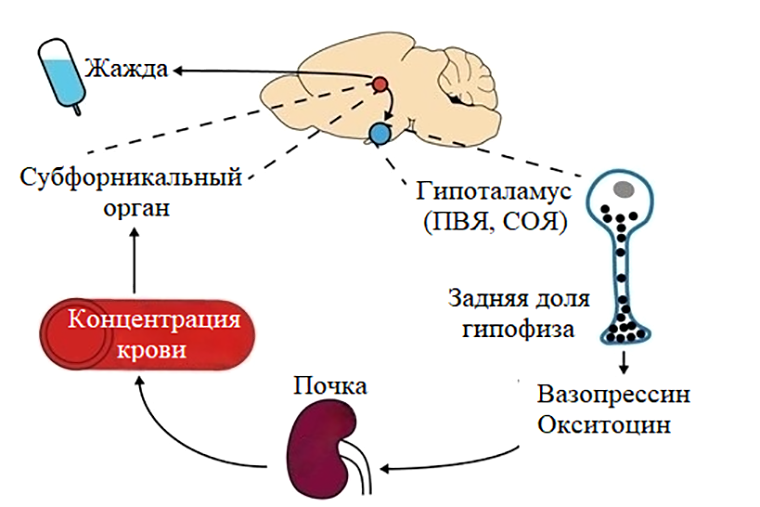
Рисунок 6. Физиологическая система, которая регулирует состояние жидких сред организма и ощущение жажды. ПВЯ — паравентрикулярное ядро, СОЯ — супраоптическое ядро гипоталамуса.
[16], с модификацией
Казалось бы, длительная нехватка воды у животного в состоянии покоя должна приводить к повышению концентрации веществ в плазме крови. Однако у тринадцатиполосных сусликов наблюдали обратное [16]. Вероятно, изменение концентрации крови позволяет «не привлекать внимание» мозга и почек, что подтвердили низкие показатели ренина, альдостерона, а также вазопрессина, секретируемого клетками гипоталамуса в ответ на активацию терминальной пластинки, в крови грызунов [16].
Во время пробуждения (IBA), которое чередуется с торпором в ходе гибернации, концентрации веществ в крови сусликов возрастали [16]. Однако даже в этом случае животные не переходили к активному поиску воды. Исследователи решили проверить, сохранен ли во время спячки физиологический контур, который обеспечивает удовлетворение жажды. Для этого пробудившимся грызунам вводили гипертонический (более концентрированный) раствор поваренной соли или маннита, предоставили поилки с водой и наблюдали за поведением животных через камеру. Жажда сусликов значительно возросла — структуры мозга и почек сохраняли функциональное состояние во время спячки [16].

Рисунок 7. Структуры, участвующие в передаче холодовых и тепловых сигналов от внутренних органов и кожи. ПО — преоптическая зона гипоталамуса, ЛПЯ — латеральное парабрахиальное ядро, СЯТН — спинномозговое ядро тройничного нерва.
[18], с модификацией
Терморегуляция. Температура тела во время спячки может сильно отличаться от таковой у активного животного. Информация о температуре внешней и внутренней сред сходится к ядрам преоптической зоны гипоталамуса (рис. 5, рис. 7). Их нейроны запускают реакции по поддержанию температуры тела и мозга: производство тепла (термогенез) через клетки бурой жировой ткани (несократительный) или мышечные волокна (сократительный, дрожь), сужение сосудов или поиск теплого местечка [18]. В свою очередь, начальным звеном в восприятии холода/тепла выступают структуры периферической нервной системы (ПНС). К ним относятся сенсорные нейроны в ганглиях задних корешков спинного мозга, чья мембрана несет холодовой TRPM8 и тепловой TRPV1 каналы. Периферическая и центральная части терморегуляторного пути связаны мостиком, а точнее, мостом — структурой ствола мозга, у которой на этот случай имеется парабрахиальное ядро [18].
На период гибернации животные снижают температуру тела и мозга и подавляют терморегуляторные реакции. Вероятно, для мозга и тела работают разные механизмы. Так, температура коры головного мозга тринадцатиполосных сусликов оставалась более высокой, чем у тела, во время спячки [19].
Устойчивость к холоду на период гибернации отчасти может определяться более низкой чувствительностью сенсорных нейронов в спинномозговых ганглиях. Так, тринадцатиполосные суслики, сирийские хомячки и их сенсорные нейроны игнорировали низкие температуры, как выяснилось впоследствии, из-за модификаций в трансмембранном домене TRPM8 [20].
Сравнение гибернирующих животных (суслики) со способными лишь на кратковременное оцепенение (мыши) раскрыло адаптации центральной нервной системы (ЦНС) [21]. Оказалось, что в преоптической зоне гипоталамуса сусликов меньше чувствительных к холоду нейронов, чем у мышей (рис. 8). Нейроны двух видов грызунов «определяли температуру» через канал CNGA3, который был менее чувствительным к холоду у сусликов. Таким образом, в ПНС и ЦНС впадающих в спячку животных развивается схожий молекулярный механизм реагирования на температурные сдвиги.
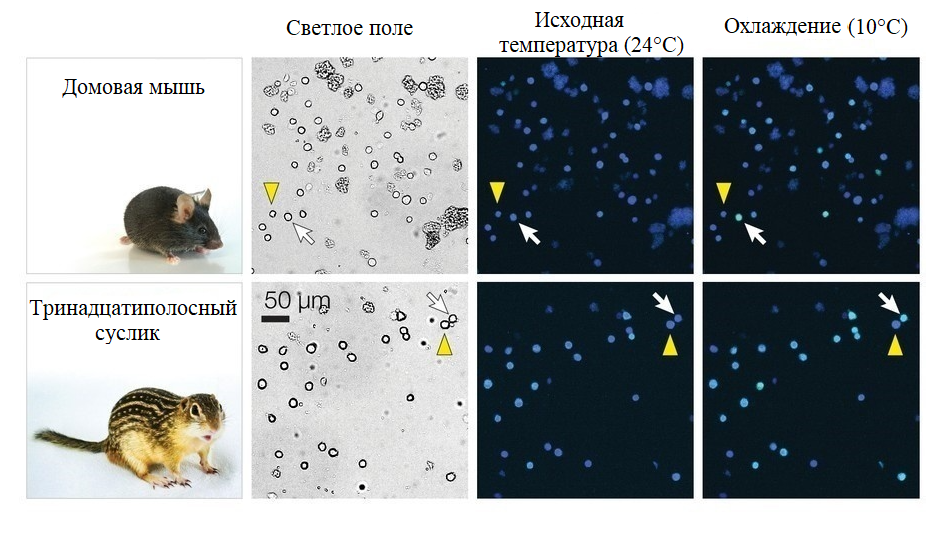
Рисунок 8. На изображениях, полученных при помощи кальциевого имиджинга (темные окошки), различимы чувствительные (белая стрелка) и нечувствительные к холоду (желтая стрелка) нейроны гипоталамуса мыши и суслика при разных температурных условиях. Слева от них показаны изображения, полученные благодаря светлопольной микроскопии.
[21], с модификацией
В условиях длительного голодания гормон голода грелин, по-видимому, включается в терморегуляцию и обеспечивает переход животного в неактивное состояние — к такому выводу пришли авторы работы 2021 года [22]. Трансгенные мыши, у которых был нарушен синтез гормона, не смогли погрузиться в торпор через 1–2 дня с момента начала голодания. В то же время, в крови мышей дикого типа концентрация грелина в плазме крови достигала максимума через 36 часов лишения еды. На фоне высокого содержания гормона температура тела грызунов снижалась, как и обменные процессы. Получается, организм обладает разными механизмами, которые обеспечивают развитие гипотермии и переход к спячке/торпору. Активация конкретного механизма зависит от условий, к которым необходимо адаптироваться.
Секреты лабораторных грызунов
Оказалось, что системы гибернации характерны для гипоталамуса даже не впадающих в спячку мышей и крыс. Это указывает на раннее эволюционное происхождение систем и сохранение их у широкого круга животных. Получается, что возможно искусственно вызвать «спячку» (synthetic torpor) у негибернирующих видов, к числу которых относится человек. Отчасти это подтверждает клинический случай 51-летнего пациента, у которого двухчасовые эпизоды гипотермии повторялись в течение недели [23]. Этому человеку выпал шанс почувствовать себя на месте хомячка: у этих грызунов снижение температуры тела регулируется биоритмами. Хотя точный механизм патологии не был установлен, врачи предположили нарушение регуляции гипоталамуса.
Ученые выявили популяции нейронов в ядрах гипоталамуса, стимуляция которых переводила мышей и крыс в неактивное состояние длительностью до двух дней [24]. Низкая двигательная активность грызунов сопровождалась падением температуры тела (гипотермией) и замедлением метаболических процессов (гипометаболизмом) — развивалось состояние, схожее с гибернацией (рис. 9).

Рисунок 9. Изменение температуры тела (сверху) и позы (снизу) мыши после активации Q-нейронов (QIH, Q-neuron-induced hypothermia and hypometabolism — вызванный активацией Q-нейронов гипометаболизм и гипотермия). Эти изображения показывают, что терморегуляция при QIH схожа с таковой при спячке, но не при суточном торпоре (FIT, fasting-induced daily torpor — суточное оцепенение, вызванное голоданием). В течение 30 минут после активации Q-нейронов температура хвостика, в противоположность телу, возросла (показано стрелкой). Также, чтобы сократить потери тепла, мышь сворачивалась клубочком при 28 градусах (Та — температура в камере) во время FIT, но не во время QIH при той же температуре.
[21], с модификацией
В одной из ранних работ сообщалось, что пептид QRFP (pyroglutamylated RFamide peptide), образуемый нейронами гипоталамуса, регулирует пищевое поведение, обменные процессы и активность у мышей и крыс [25]. Q-нейроны, как их назвали позднее, разбросаны по разным ядрам гипоталамуса. Исследователи задались целью идентифицировать те из них, что отвечали за гипотермию и гипометаболизм. Для этого использовали трансгенных мышей и крыс (рис. 12, «Подготовка к активации Q-нейронов»): их Q-нейроны содержали специальные рецепторы DREADD, которые связывались с разработанными для них лигандами, в частности, с N-оксид клозапином (CNO).
Q-нейроны активировали при помощи внутрибрюшинной инъекции CNO. Значения температуры отслеживали по датчику в брюшной полости грызунов, а уровень метаболических процессов — по интенсивности газообмена, в частности, по объему потребляемого кислорода. Активность клеток оценивали при помощи электрофизиологических методов, а их локализацию в гипоталамусе — посредством окрашивания и микроскопии тканей мозга.
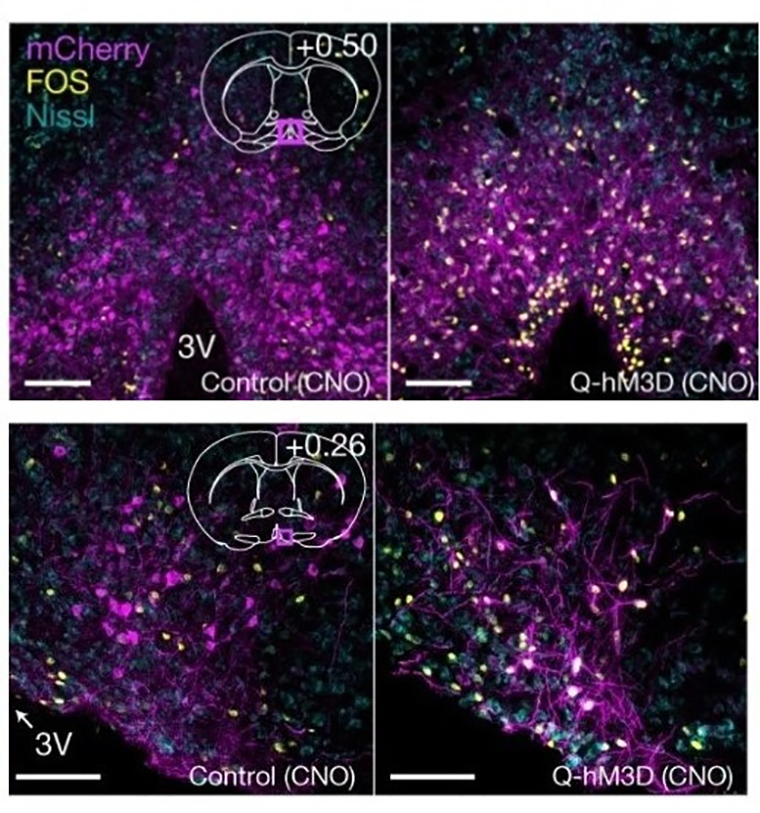
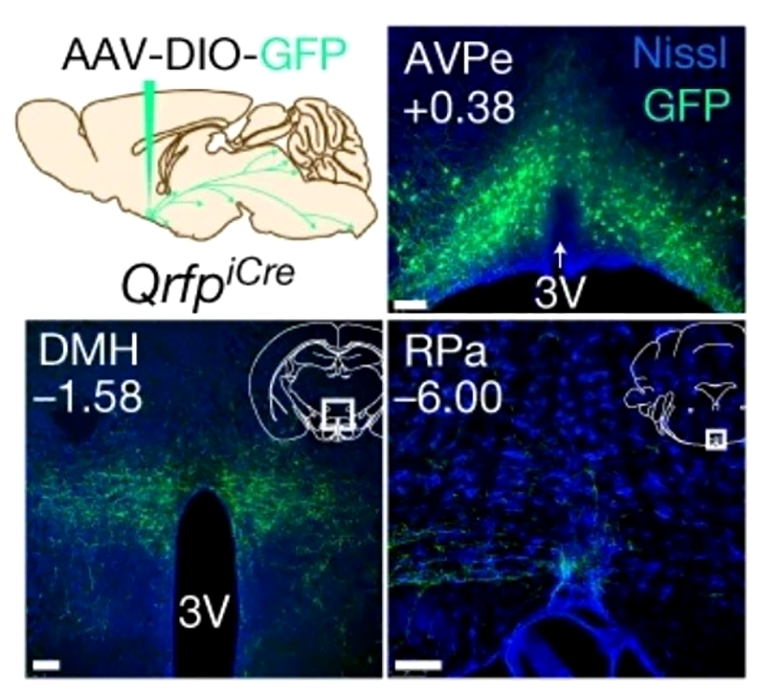
«Нейроны спячки» обнаружили в составе перивентрикулярного ядра и медиальной преоптической зоны гипоталамуса (рис. 10А). Проекции, то есть аксоны нейронов, простирались к дорсомедиальному ядру гипоталамуса (рис. 10Б) — активация этих отростков при помощи света также приводила к гипотермии грызунов. В другой работе после повреждения проекций из преоптической зоны к дорсомедиальному ядру гипоталамуса у крыс развивалась необычная реакция — на холоде температура тела животных понижалась вместо того, чтобы возрасти. Это явление авторы назвали терморегуляторной инверсией (thermoregulatory inversion) [26]. Q-нейроны различались химически: некоторые из них продуцировали возбуждающий медиатор глутамат, другие — торомозный ГАМК или оба медиатора. Важно отметить, что схожие результаты были независимо получены исследователями из другой лаборатории [27].
Замедление метаболизма, вызванное активацией Q-нейронов, не повредило ткани мозга, сердца, почек и других внутренних органов, как выяснили ученые после вскрытия животных. Кроме того, после выхода из состояния торпора грызуны продемонстрировали свое обычное поведение. По мнению авторов работы, гипометаболизм посредством избирательной стимуляции Q-нейронов может найти широкое применение в медицине. Так можно продлить сохранность донорских органов, которая обычно ограничена несколькими часами, или предотвратить травмы тканей вследствие инфарктов, инсультов и нехватки кислорода (гипоксии) [23], [24].
Нейроны гипоталамуса защитят органы во время операций
Первые свидетельства в пользу клинического применения гипометаболизма, вызванного активацией Q-нейронов, были представлены в работе 2022 года. Ученые погружали мышей в торпор перед кардиохирургической операцией с остановкой кровотока [28]. Подобные операции на сердце и сосудах распространены среди людей. Обычно перед их проведением организм сильно охлаждают и тем самым снижают потребление кислорода тканями, пока ток крови перекрыт и сохраняется дефицит кислорода (гипоксия). Однако охлаждение приводит к неприятным осложнениям в виде острого повреждения почек (ОПП), а также риску послеоперационных кровотечений из-за связи гипотермии и ухудшения свертываемости крови.
Исследователи проводили опыты с участием упомянутых ранее [24] трансгенных мышей, чьи Q-нейроны экспрессировали особые рецепторы к СNO — экспериментальная группа. У контрольных мышей нейроны не содержали рецепторы — введение CNO не сопровождалось активацией Q-нейронов. Каждую группу разделили на 2 части: в одной — поддерживали температуру тела мышей на уровне 35 oС (нормотермия), в другой — на уровне 21,5 oС (гипотермия) при помощи охлаждения (контроль) или активации Q-нейронов (экспериментальная группа) (рис. 11).
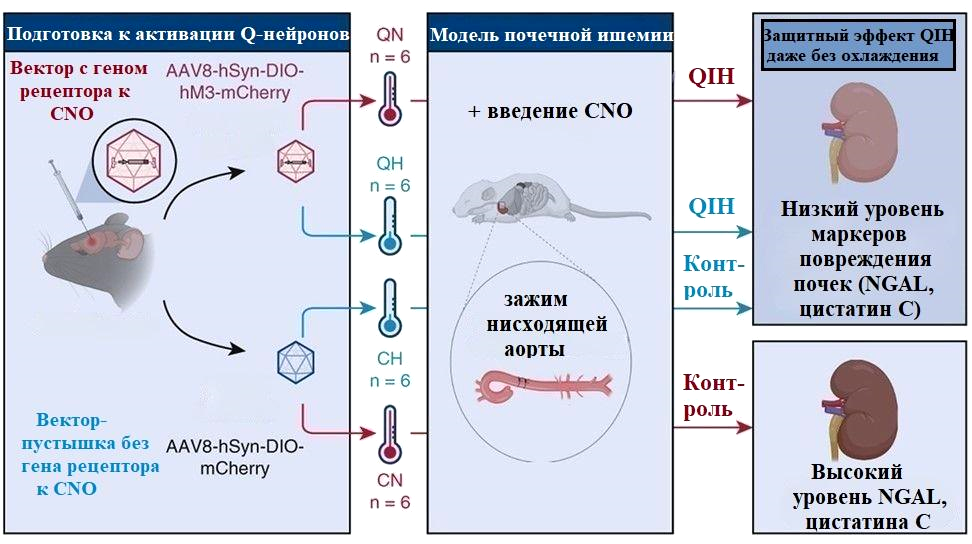
Рисунок 11. Схема дизайна эксперимента, описанного в статье [28]. QIH — вызванный активацией Q-нейронов гипометаболизм и гипотермия. QN и QH — нормотермия и гипотермия при активированных Q-нейронах, CN и СН — нормотермия и гипотермия у контрольных мышей без стимуляции Q-нейронов.
[28], с модификацией
Инъекцию CNO проводили за 3 часа до анестезии мышей. Затем пережимали нисходящую часть аорты на 15 минут (рис. 11). После операции проверили структуру почек на наличие изменений, а также измерили уровни маркеров повреждения — липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), и цистатина С — в сыворотке крови грызунов.
Первое, на что обратили внимание исследователи — активация Q-нейронов приводила к замедлению обменных процессов независимо от снижения температуры тела. Так, восстановление объемов вдыхаемого кислорода (активности метаболизма) до исходного уровня заняло больше времени после инъекции CNO, чем восстановление температуры тела. Анатомическая целостность почек определялась температурой тела: меньше повреждений в нефронах — мельчайшей почечной структуре — было зафиксировано при гипотермии у мышей как с активированными, так и молчащими Q-нейронами (рис. 12).

Рисунок 12. Ткани почек после операции на аорте. Черными стрелками показаны следы повреждения, которые сильнее выражены в почках животных из групп нормотермии (температура тела поддерживалась на уровне 35 градусов). QN и QH — нормотермия и гипотермия при активированных Q-нейронах, CN и СН — нормотермия и гипотермия у контрольных мышей без стимуляции Q-нейронов.
В то же время, стимуляция нейронов гипоталамуса позволила поддержать функцию почек. Содержание биохимических показателей патологии почек было ниже в сыворотке крови животных с активными Q-нейронами, вне зависимости от температуры тела грызунов. Получается, угнетение метаболизма, вызванное активацией Q-нейронов, даже при нормальной температуре тела снижало риск повреждения почек не менее эффективно, чем вызванное охлаждением.
Авторы работы отметили, что воссоздание гипометаболизма без дополнительного охлаждения потенциально возможно перед операциями на человеке. Однако активация Q-нейронов может представлять опасность при терапии антикоагулянтами, препятствующими свертываемости крови. Поэтому исследователи решили детально разобраться в молекулярных процессах, запускаемых после стимуляции Q-нейронов. По мнению ученых, это поможет вызвать те же процессы при помощи препаратов, без прямой активации нейронов гипоталамуса.
Следует заметить, что существует несколько фармакологических способов погружения негибернирующих животных в «искусственную спячку». Они основаны на введении биологически активных веществ, которые взаимодействуют с рецепторами нервных клеток. Например, инертные газы блокируют рецепторы к глутамату [29], [30], мусцимол активирует ГАМК-рецепторы [31], [32], циклогексиладенозин и аденозинмонофосфат — рецепторы к аденозину [33], [34] в нейронах ядер ствола мозга, которые обеспечивают поддержание температуры тела. Итог один — обменные процессы замедляются, и организм переходит в состояние, схожее со спячкой. Фармакологические методы позволяют изучить еще один практический аспект гибернации, о котором будет рассказано далее.
Комфортное путешествие по межгалактическим мирам при помощи спячки
Наряду с медицинским применением, в научном сообществе активно обсуждается вопрос искусственного введения в торпор для исследования космического пространства [35]. Такие полеты представляют существенную нагрузку для живого организма ввиду нехватки воды и питательных веществ, а также кислорода. Перенести их дефицит без существенного вреда для организма возможно в состоянии гипометаболизма, когда поглощение кислорода, воды и питательных веществ сокращается, как было рассказано ранее.
Космос таит две серьезные опасности для живого организма — микрогравитация (невесомость) и излучение. Длительное пребывание в условиях невесомости приводит к снижению минеральной плотности костей у космонавтов [36], как и у грызунов в активном состоянии, которых подвергли невесомости в земных условиях [37]. Однако у медведей во время 6- и 8-месячной спячки масса костной ткани не изменялась. Это указывает на действие во время гибернации защитных механизмов, которые препятствуют истощению минеральных веществ в костях [38]. Остается выяснить, присущи ли подобные механизмы торпору (оцепенению) и его искусственной модификации.
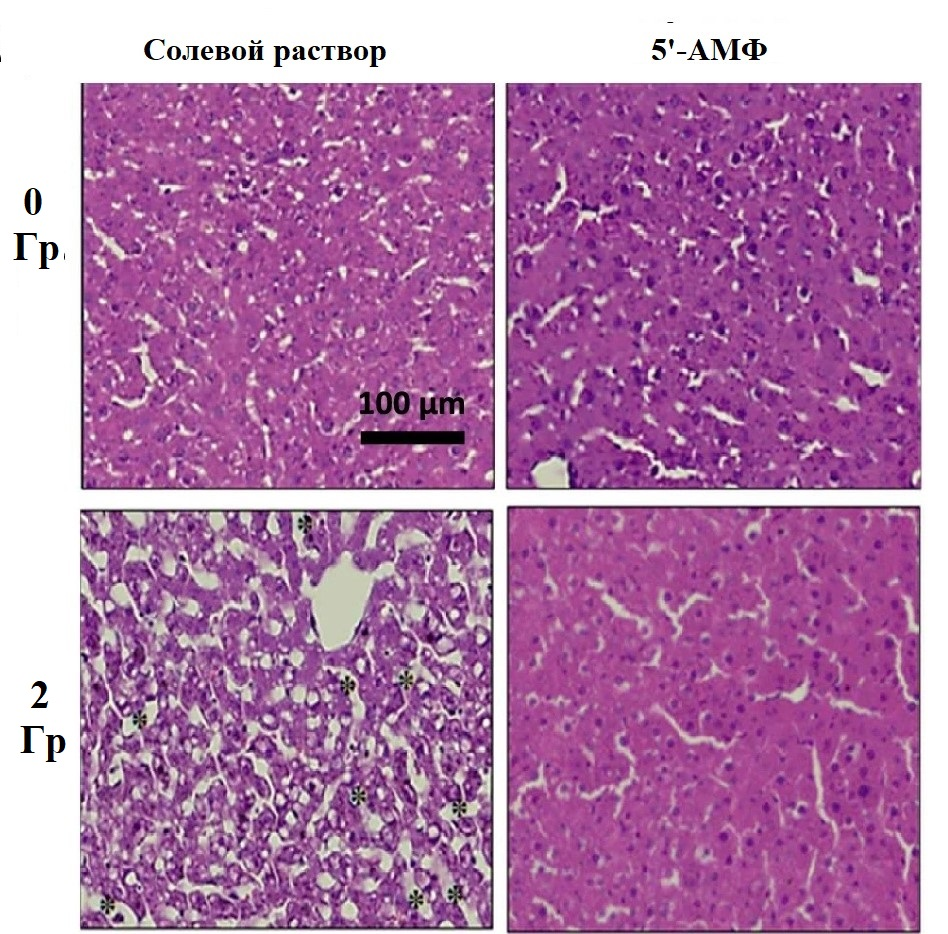
Радиация обладает мутагенным действием, повреждая ДНК и белки, и вызывает необратимые процессы в клетках. Удивительно, но замедленный естественной спячкой метаболизм защищал животных от мутагенного эффекта радиации [35]. Более того, защитить от влияния радиации удалось негибернирующих крыс (рис.13А и Б) и мышей [39], [40]. Животных сначала облучали, а затем вводили в состояние «искусственной спячки», сочетая инъекцию 5’-аденозинмонофосфата (5’-АМФ) или циклогексиладенозина и содержание при низкой температуре. В частности, из погруженных в торпор мышей спустя месяц после облучения выжило 80%, в сравнении с 20% грызунов, не введенных в состояние торпора [40].
Некоторые специалисты отмечают преимущество подхода, который заключается в непосредственной стимуляции структур ЦНС, в том числе гипоталамуса [36]. Подтверждением этой точки зрения служит работа, в которой ученые вводили N-метил-D-аспартат (NMDA) в паравентрикулярное ядро (ПВЯ) гипоталамуса крыс. Это активировало нейроны ПВЯ [41]. Их активность угнетала продукцию тепла (термогенез) бурой жировой ткани, несмотря на охлаждение грызунов.
Другой способ не предполагает введения веществ или прямой стимуляции нейронов, но сопровождается активацией гипоталамических ядер. Для этого нужно лишить грызунов еды на 1,5 дня с дальнейшем выдерживанием при низких температурах [42]. Сочетание двух факторов — голода и холода — сопровождалось высоким уровнем экспрессии генов c-fos в нейронах аркуатного, дорсомедиального и паравентрикулярного ядер, что указывало на их активацию. Кроме того, активность генов, вызванная комбинацией голода с холодом, отличалась от таковой при голоде и холоде по отдельности, что подтверждало связанную именно с торпором активацию ядер.
Большое число способов искусственного погружения в торпор активно используется учеными для изучения пределов защиты гипометаболизма и гипотермии в экстремальных условиях, включая космос. Остается надеяться, что небольшие шаги исследователей в этом направлении позволят человечеству бороздить обширные просторы Вселенной в будущем.
Заключение
Адаптации живых организмов многогранны и удивительны. И такой физиологический процесс, как гибернация (спячка) — не исключение. Перестройка метаболических процессов, которая позволяет пережить смену времен года, находится под контролем нервной системы, в частности, гипоталамуса. Большое число ядер с разнородными популяциями нейронов позволяют тонко регулировать голод, жажду и продукцию тепла, которые могут быть губительны для животного в период холодов. Расширение знаний о нейробиологии спячки, как и обнаружение систем гибернации у не впадающих в спячку животных открывает новые перспективы для спасения людских жизней, а, может быть, и поиска следов жизни на других планетах.
Самое время вспомнить о медвежонке Винни-Пухе. Один из мультфильмов о нем завершается фразой: «Ну что ж, сказке конец. То есть конец этой сказке, а есть и другие… » Она применима и к этой статье, которая стала своего рода «сказкой» об участии гипоталамуса в процессах гибернации, хоть и далеко не исчерпывающей. Учеными написаны и другие «произведения», например, о том, как ствол мозга обеспечивает гипометаболизм или как вызвать спячку, изменяя активность его структур. В завершение хотелось бы пожелать уважаемому читателю познакомиться с ними и, возможно, выступить в качестве автора новой «сказки», пополнив мировой запас научных бестселлеров.
Литература
- «Элементы»: «Птица, впадающая в спячку»;
- Sarah M. Mohr, Sviatoslav N. Bagriantsev, Elena O. Gracheva. (2020). Cellular, Molecular, and Physiological Adaptations of Hibernation: The Solution to Environmental Challenges. Annu. Rev. Cell Dev. Biol.. 36, 315-338;
- Matthew T. Andrews. (2019). Molecular interactions underpinning the phenotype of hibernation in mammals. Journal of Experimental Biology. 222;
- M. Jastroch, S. Giroud, P. Barrett, F. Geiser, G. Heldmaier, A. Herwig. (2016). Seasonal Control of Mammalian Energy Balance: Recent Advances in the Understanding of Daily Torpor and Hibernation. J Neuroendocrinol. 28;
- Vineet Augustine, Sangjun Lee, Yuki Oka. (2020). Neural Control and Modulation of Thirst, Sodium Appetite, and Hunger. Cell. 180, 25-32;
- Christopher A. Zimmerman, David E. Leib, Zachary A. Knight. (2017). Neural circuits underlying thirst and fluid homeostasis. Nat Rev Neurosci. 18, 459-469;
- Michael J. Angilletta, Jacob P. Youngblood, Lauren K. Neel, John M. VandenBrooks. (2019). The neuroscience of adaptive thermoregulation. Neuroscience Letters. 692, 127-136;
- Barbara A. Horwitz, Sat M. Chau, Jock S. Hamilton, Christine Song, Julia Gorgone, et. al.. (2013). Temporal relationships of blood pressure, heart rate, baroreflex function, and body temperature change over a hibernation bout in Syrian hamsters. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 305, R759-R768;
- C. Schwartz, M. Hampton, M. T. Andrews. (2015). Hypothalamic gene expression underlying pre-hibernation satiety. Genes, Brain and Behavior. 14, 310-318;
- Пробило на хавчик;
- Madeleine S. Junkins, Sviatoslav N. Bagriantsev, Elena O. Gracheva. (2022). Towards understanding the neural origins of hibernation. Journal of Experimental Biology. 225;
- Jessica E. Healy, Jenna L. Bateman, Cara E. Ostrom, Gregory L. Florant. (2011). Peripheral ghrelin stimulates feeding behavior and positive energy balance in a sciurid hibernator. Hormones and Behavior. 59, 512-519;
- Ricardo Lage, María J. Vázquez, Luis Varela, Asish K. Saha, Antonio Vidal‐Puig, et. al.. (2010). Ghrelin effects on neuropeptides in the rat hypothalamus depend on fatty acid metabolism actions on BSX but not on gender. FASEB j.. 24, 2670-2679;
- Matei Bolborea, Eric Pollatzek, Heather Benford, Tamara Sotelo-Hitschfeld, Nicholas Dale. (2020). Hypothalamic tanycytes generate acute hyperphagia through activation of the arcuate neuronal network. Proc. Natl. Acad. Sci. U.S.A.. 117, 14473-14481;
- Jo E. Lewis, Francis J. P. Ebling. (2017). Tanycytes As Regulators of Seasonal Cycles in Neuroendocrine Function. Front. Neurol.. 8;
- Ni Y. Feng, Madeleine S. Junkins, Dana K. Merriman, Sviatoslav N. Bagriantsev, Elena O. Gracheva. (2019). Osmolyte Depletion and Thirst Suppression Allow Hibernators to Survive for Months without Water. Current Biology. 29, 3053-3058.e3;
- Vineet Augustine, Sertan Kutal Gokce, Sangjun Lee, Bo Wang, Thomas J. Davidson, et. al.. (2018). Hierarchical neural architecture underlying thirst regulation. Nature. 555, 204-209;
- Chan Lek Tan, Zachary A. Knight. (2018). Regulation of Body Temperature by the Nervous System. Neuron. 98, 31-48;
- Willem J. Laursen, Marco Mastrotto, Dominik Pesta, Owen H. Funk, Jena B. Goodman, et. al.. (2015). Neuronal UCP1 expression suggests a mechanism for local thermogenesis during hibernation. Proc. Natl. Acad. Sci. U.S.A.. 112, 1607-1612;
- Vanessa Matos-Cruz, Eve R. Schneider, Marco Mastrotto, Dana K. Merriman, Sviatoslav N. Bagriantsev, Elena O. Gracheva. (2017). Molecular Prerequisites for Diminished Cold Sensitivity in Ground Squirrels and Hamsters. Cell Reports. 21, 3329-3337;
- Viktor V Feketa, Yury A Nikolaev, Dana K Merriman, Sviatoslav N Bagriantsev, Elena O Gracheva. (2020). CNGA3 acts as a cold sensor in hypothalamic neurons. eLife. 9;
- Takahiro Sato, Kanae Oishi, Daisuke Koga, Takanori Ida, Yusuke Sakai, et. al.. (2021). Thermoregulatory role of ghrelin in the induction of torpor under a restricted feeding condition. Sci Rep. 11;
- Matteo Cerri. (2017). The Central Control of Energy Expenditure: Exploiting Torpor for Medical Applications. Annu. Rev. Physiol.. 79, 167-186;
- Tohru M. Takahashi, Genshiro A. Sunagawa, Shingo Soya, Manabu Abe, Katsuyasu Sakurai, et. al.. (2020). A discrete neuronal circuit induces a hibernation-like state in rodents. Nature. 583, 109-114;
- Shinobu Takayasu, Takeshi Sakurai, Satoshi Iwasaki, Hitoshi Teranishi, Akihiro Yamanaka, et. al.. (2006). A neuropeptide ligand of the G protein-coupled receptor GPR103 regulates feeding, behavioral arousal, and blood pressure in mice. Proc. Natl. Acad. Sci. U.S.A.. 103, 7438-7443;
- Domenico Tupone, Georgina Cano, Shaun F. Morrison. (2017). Thermoregulatory inversion: a novel thermoregulatory paradigm. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 312, R779-R786;
- Sinisa Hrvatin, Senmiao Sun, Oren F. Wilcox, Hanqi Yao, Aurora J. Lavin-Peter, et. al.. (2020). Neurons that regulate mouse torpor. Nature. 583, 115-121;
- Shoichi Kyo, Kozue Murata, Masahide Kawatou, Kenji Minatoya, Genshiro A. Sunagawa, Hidetoshi Masumoto. (2022). Quiescence-inducing neurons-induced hypometabolism ameliorates acute kidney injury in a mouse model mimicking cardiovascular surgery requiring circulatory arrest. JTCVS Open. 12, 201-210;
- Nadezhda M. Zakharova, Yury S. Tarahovsky, Irina S. Fadeeva, Natalia P. Komelina, Maxim O. Khrenov, et. al.. (2019). A pharmacological composition for induction of a reversible torpor-like state and hypothermia in rats. Life Sciences. 219, 190-198;
- Очень нервное возбуждение;
- M. Cerri, M. Mastrotto, D. Tupone, D. Martelli, M. Luppi, et. al.. (2013). The Inhibition of Neurons in the Central Nervous Pathways for Thermoregulatory Cold Defense Induces a Suspended Animation State in the Rat. Journal of Neuroscience. 33, 2984-2993;
- Спокоен как GABA;
- D. Tupone, C. J. Madden, S. F. Morrison. (2013). Central Activation of the A1 Adenosine Receptor (A1AR) Induces a Hypothermic, Torpor-Like State in the Rat. Journal of Neuroscience. 33, 14512-14525;
- Аденозиновые рецепторы: история великого обмана;
- Yuri Griko, Matthew D. Regan. (2018). Synthetic torpor: A method for safely and practically transporting experimental animals aboard spaceflight missions to deep space. Life Sciences in Space Research. 16, 101-107;
- A. LeBlanc, T. Matsumoto, J. Jones, J. Shapiro, T. Lang, et. al.. (2013). Bisphosphonates as a supplement to exercise to protect bone during long-duration spaceflight. Osteoporos Int. 24, 2105-2114;
- J Ignacio Aguirre, Lilian I Plotkin, Scott A Stewart, Robert S Weinstein, A Michael Parfitt, et. al.. (2006). Osteocyte Apoptosis Is Induced by Weightlessness in Mice and Precedes Osteoclast Recruitment and Bone Loss. J Bone Miner Res. 21, 605-615;
- Vadim B. Fedorov, Anna V. Goropashnaya, Øivind Tøien, Nathan C. Stewart, Celia Chang, et. al.. (2012). Preservation of bone mass and structure in hibernating black bears (Ursus americanus) through elevated expression of anabolic genes. Funct Integr Genomics. 12, 357-365;
- Anggraeini Puspitasari, Fabio Squarcio, Martina Quartieri, Cristina Totis, Timna Hitrec, et. al.. (2022). Synthetic torpor protects rats from exposure to accelerated heavy ions. Sci Rep. 12;
- Subhajit Ghosh, Namita Indracanti, Jayadev Joshi, Jharna Ray, Prem Kumar Indraganti. (2017). Pharmacologically induced reversible hypometabolic state mitigates radiation induced lethality in mice. Sci Rep. 7;
- C. J. Madden, S. F. Morrison. (2009). Neurons in the paraventricular nucleus of the hypothalamus inhibit sympathetic outflow to brown adipose tissue. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 296, R831-R843;
- Timna Hitrec, Marco Luppi, Stefano Bastianini, Fabio Squarcio, Chiara Berteotti, et. al.. (2019). Neural control of fasting-induced torpor in mice. Sci Rep. 9.