
Наработка антител для доклинических и клинических испытаний
14 декабря 2018
Наработка антител для доклинических и клинических испытаний
- 2689
- 0
- 6
Производство антител в больших масштабах
иллюстрация Дарьи Боголюбовой-Кузнецовой
-
Автор
-
Редакторы
-
Иллюстратор
В прошлых статьях спецпроекта о биспецифических антителах мы говорили о том, что такое биспецифические антитела и как их разрабатывают. В этой публикации мы рассмотрим очень важный вопрос производства антител, в том числе биспецифических. Какие технологии применяются при производстве антител? Какие здесь существуют сложности и как они решаются? Насколько дорого производить такие антитела и во что обходится обеспечение качества производства?
Биспецифические антитела

Спецпроект о биспецифических антителах, особенностях их строения, свойств, получения и применения в современной медицине.
Партнер спецпроекта — компания Cytiva, занимающаяся оснащением научно-исследовательских лабораторий, фармацевтических и биотехнологических производств приборами, расходными материалами и реактивами.
Биспецифики (короткое название для биспецифических антител) способны связывать не одну мишень, как обычные моноклональные антитела, а две или более. В первой статье цикла, «Биспецифические антитела, их мишени и перспективы применения в современной медицине» [1], рассказывалось о том, какие у биспецификов преимущества по сравнению с моноспецифическими антителами, какие из них уже применяются в клинической практике и как выбирают мишени для них. Во второй статье, «Разработка биспецифических антител для применения в клинике» [2], рассказано о том, какие бывают форматы антител, какие у них преимущества и недостатки и с какими проблемами сталкиваются исследователи при их разработке. В третьей статье цикла мы расскажем, как производятся антитела и биспецифики, что такое фармацевтическая разработка и какие требования применяются к процессу производства.
Цель производства антител, как и любых других лекарств — создание эффективного, безопасного и качественного лекарственного препарата. Поскольку речь идет о здоровье людей, область разработки и производства лекарств (включая антитела) строго зарегулирована. Выпуск некачественного, а значит, неэффективного и небезопасного препарата может поставить под угрозу жизни людей. Более подробно качество рассмотрим в следующей статье цикла — «Контроль качества биотехнологических продуктов». Здесь упомянем только об основных моментах.
Обеспечение качества производства биотехнологических продуктов в целом базируется на системе менеджмента качества ISO 9001, но в приложении именно к лекарствам говорят о фармацевтическом качестве, под которым понимается пригодность действующего вещества и лекарственного препарата для своего целевого назначения. Проще говоря, у любого лекарства есть цель: улучшить состояние человека. С другой стороны, у него есть объективные характеристики, самые главные из них — подлинность, дозировка и чистота [3]. Если характеристики препарата позволяют достичь указанной цели, он называется качественным.
Вкратце рассмотрим, как регулируется качество при разработке антител и биспецификов, а затем — как оно обеспечивается в процессе производства и контроля.
Регуляторные требования к разработке антител
Основой для регуляции процесса разработки лекарств и в частности их производства является система руководств ICH , на которые опираются разработчики лекарств в США, Европе и отчасти в России. Это документы, где даны определения понятий и описание разных аспектов разработки: доклинических и клинических исследований, производства, контроля качества и всех остальных.
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к регистрации лекарственных средств для медицинского применения.
Один из главных документов ICH, касающийся производства лекарственных веществ, — это ICH Q7 good manufacturing practice («Надлежащая производственная практика», GMP), устанавливающий правила производства активных фармацевтических ингредиентов . В случае готовых препаратов (finished products) GMP находится в компетенции стран или надгосударственных образований (например, ЕС). В России GMP введен приказом Минпромторга «Об утверждении Правил надлежащей производственной практики». Правда, правовое оформление GMP в России пока недостаточно проработано: всего одна статья в Законе об обращении лекарственных средств 61-ФЗ посвящена производству лекарственных средств.
Лекарственная субстанция (активный фармацевтический ингредиент) — вещество, которое войдет в состав готового лекарственного продукта и которое производит фармакологический эффект.
Регуляции биотехнологических продуктов, к которым относятся антитела, в ICH зачастую посвящены отдельные документы. Дело в том, что антитела (и биспецифики) — это большие биологические молекулы, и, в отличие от малых молекул (таких как аспирин или пенициллин), они содержат тысячи атомов, организованных в сложную трехмерную структуру. Белковые молекулы не производят химическим синтезом, а получают чаще всего в клетках бактерий или животных. Поэтому два белковых препарата, даже произведенных в одном месте, но в разное время, будут отличаться друг от друга. Для малой молекулы, как правило, достаточно проконтролировать только конечный продукт в рамках спецификации . У малой молекулы не так много параметров, и они все хорошо известны, но для биомолекулы этого недостаточно. Помимо спецификации необходим тщательный контроль исходных материалов и процесса производства препарата. В руководствах даже приводится максима «продукт — это процесс». Для процесса производства определяют критичные параметры производства, а также проводят валидацию процесса.
Спецификацией, в соответствии с ICH Q6A, называется перечень тестов, ссылок на аналитические процедуры и критерии допустимости, включающие численные границы и диапазоны допустимых величин [3].
Валидация — это документальное доказательство того, что процесс надежно приводит к желаемому результату. В ходе валидации сначала проводят проверку помещений и оборудования на соответствие спецификациям, проверку правильности работы оборудования и, наконец, квалификацию самого процесса производства продукта в условиях, близких к реальным [4].
Именно поэтому любое изменение процесса производства биопрепаратов требует специальных исследований, чтобы доказать, что оно не сказалось негативно на профиле безопасности и эффективности препарата. По этой же причине в случае биопрепаратов не говорят о дженериках, когда идет речь о копии препарата, выпущенной другой фирмой, а используют термин «биоаналог» (biosimilar).
В соответствии с руководством ICH Q10, подход к обеспечению качества фармацевтических препаратов зависит от стадии разработки (рис. 1).
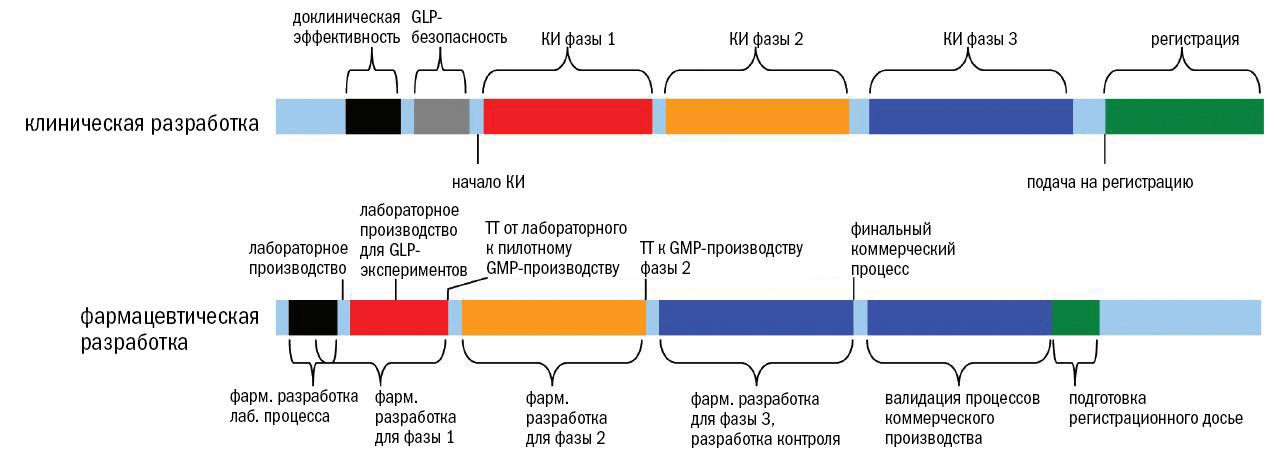
Рисунок 1. Соответствие доклинической и клинической разработок (вверху) и фармацевтической разработки (внизу). Фармацевтическая разработка, то есть разработка процесса производства лекарственной субстанции и готового продукта начинается на этапе доклинических исследований и продолжается примерно до конца фазы 2. На этапе доклинических исследований необходимо произвести качественный продукт, но в небольшом объеме, и он еще может не обладать всеми характеристиками будущего коммерческого продукта. Одновременно с началом клинических исследований (КИ) идет разработка более масштабного процесса производства . По мере приближения продукта к рынку начинается перенос технологии (technology transfer, TT), который заключается в масштабировании пилотного процесса производства до промышленного. К моменту завершения фазы 3 и началу коммерциализации препарата должен быть готов процесс промышленного производства.
Об одном из первых в России биофармацевтических производств рассказано в статье «Основоположники отечественной биофармацевтики: опытное биотехнологическое производство ИБХ» [5].
По мере перехода продукта от доклинических к клиническим исследованиям (о которых подробно рассказано в спецпроекте «Клинические исследования») правила ужесточаются, и регулирование достигает максимума для продукта, выходящего на рынок, когда риску подвергаются тысячи, а иногда и миллионы людей.
Правила GMP начинают действовать на позднем этапе доклинических исследований, когда проводятся исследования безопасности препарата на животных по правилам «Надлежащей лабораторной практики» (GLP, Good laboratory practice).
Как устроено производство антител?
Общая схема производства биотехнологических препаратов, в частности, антител, приведена на рисунке 2.
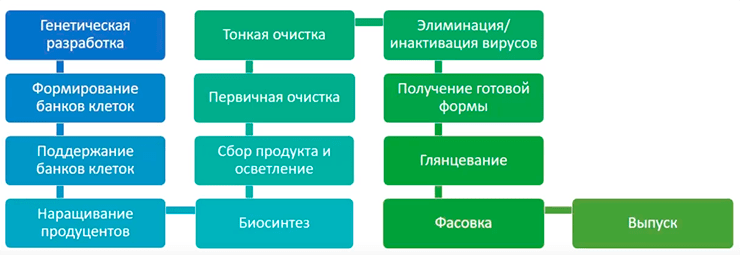
Рисунок 2. Общая схема производства антител подпись
Выбор системы экспрессии
Систему экспрессии необходимо выбрать в самом начале разработки, так как от нее будет зависеть, какую нужно создать генетическую конструкцию. Если антительный продукт не требует гликозилирования и относительно небольшой — например, Fab-фрагмент, scFv или диабоди (рис. 3; более подробно о различных форматах биспецификов рассказано в предыдущей статье цикла — «Разработка биспецифических антител для применения в клинике» [2]), — то можно экспрессировать его в бактериальных клетках. Чаще всего используют кишечную палочку Escherichia coli, как наиболее изученный организм, оптимизированный для продукции белков.
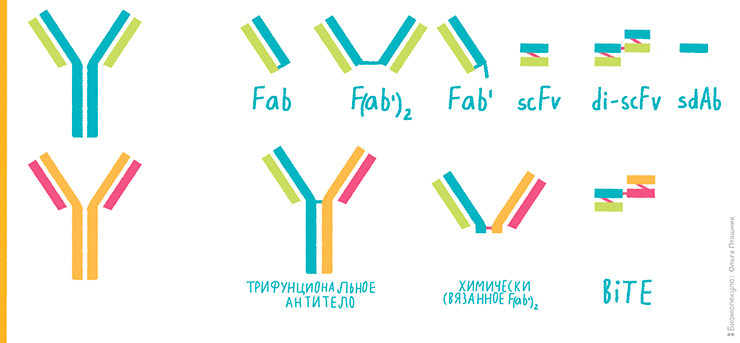
Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым.
рисунок Ольги Пташник, [31]
Для экспрессии полноразмерных антител и IgG-биспецификов лучше использовать эукариотические системы, которые обеспечивают правильное гликозилирование белков, необходимое для их функционирования.
Были попытки производить антитела и их фрагменты в клетках дрожжей, грибов, простейших и насекомых, но на нынешний момент 95% антител на рынке производится в клетках млекопитающих. Аппарат свертывания белков, посттрансляционных модификаций и секреции позволяет производить антитела, практически неотличимые от природных. Это важно для снижения риска иммуногенности, который возрастает при любых чужеродных модификациях [6].
Наиболее часто используют клетки яичников китайского хомячка (Chinese hamster ovary, CHO). Также на рынке есть антитела, получаемые в клетках мышиной миеломы NS0 и Sp2/0.
Разработка генетической конструкции
Более подробно про разработку генетической конструкции (плазмиды, или вектора) для экспрессии антител мы рассказывали в статье «Биотехнология антител» [7]. Если коротко, то сначала с помощью одного из дисплейных методов получают генетическую последовательность, кодирующую нужное антитело. Затем ее встраивают в вектор (конструкцию, которая обеспечит экспрессию гена в клетке-хозяине). В итоге получают плазмиду, то есть кольцевую ДНК, содержащую всё необходимое для экспрессии нужного гена.
В случае антител плазмида содержит гены, кодирующие легкую и тяжелую цепи антитела, высокоэффективный промотор (последовательность ДНК, служащая сигналом начала транскрипции гена), гены устойчивости к антибиотикам и другим селективным агентам (чтобы клетки не избавлялись от плазмиды) и последовательности, способствующие повышению уровня транскрипции и трансляции.
Экспрессирующую конструкцию вносят в клетку-хозяина в ходе трансфекции. Отрицательно заряженная ДНК самостоятельно в клетку проникнуть не может, поэтому используют, например, упаковку ее в липосомы, которые сливаются с клеточной мембраной, и плазмида оказывается внутри (такая трансфекция называется липофекцией). Затем плазмида попадает в ядро, как правило, в ходе клеточного деления, когда ядерная оболочка разбирается и собирается снова.
Далее конструкция интегрируется в геном для стабильной экспрессии . Встраивание может происходить как случайным образом, так и более избирательно. Случайная трансфекция проще в исполнении, но интеграция в геном — довольно редкое событие, к тому же вставка может попасть в «молчащие» (то есть не транскрибируемые) участки генома. Поэтому после трансфекции клетки высевают в селективную среду, где растут только те из них, в геноме которых содержится плазмида. При избирательном встраивании в векторе должны быть специальные последовательности, обеспечивающие направленную интеграцию ДНК в геном. Также для доставки ДНК в геном могут использоваться вирусные конструкции, например, на основе аденоассоциированных вирусов (AAV). Правильность интеграции подтверждают секвенированием участка генома, куда должна была встроиться последовательность гена. Подробнее о генетической модификации рассказано в статьях «Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал» [8] и «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [32].
Транзиентная экспрессия без встраивания плазмиды в геном тоже используется, но не в промышленных процессах производства, так как клетки быстро теряют целевой участок ДНК, и больших выходов белка добиться не удается.
Секвенирование — определение нуклеотидной последовательности ДНК или РНК. Подробнее — в статье «12 методов в картинках: секвенирование нуклеиновых кислот» [9].
Затем происходит проверка, насколько экспрессионная конструкция генетически стабильна, и не элиминируется ли она в процессе клеточных делений. Если все в порядке, то получившаяся клеточная линия с привнесенной целевой генетической конструкцией далее используется для наработки антител.
Разработка клеточной линии
Как правило, в ходе трансфекции получается много клонов . В маленьких объемах (в планшетах с 96 или 384 лунками объемом соответственно 200 или 50 мкл) каждый из них тестируется на способность производить нужный белок. 20–30 клонов с максимальной продуктивностью отбираются для культивирования в колбах объемом 1 литр.
Клон — генетически однородное потомство одной клетки. О работе с клетками более подробно рассказано в статье «12 методов в картинках: клеточные технологии» [10].
Оптимизация клеточных линий включает в себя введение делеций или точечных мутаций, которые увеличивают стабильность профиля гликозилирования, повышают продуктивность клеток в отношении целевого белка, повышают выживаемость клеток, снижают производство продуктов метаболизма — аммония и лактата, которые токсичны для клеток [11]. Во многих случаях требуется повышение ADCC (antibody-dependent cytotoxicity, антителозависимой цитотоксичности) — одного из эффекторных механизмов антител, позволяющих иммунной системе уничтожать клетки, с рецепторами которых связались антитела. Этого добиваются с помощью дефукозилирования антитела, то есть удаления остатка фукозы , либо удаляя из клетки гены, кодирующие ферменты, осуществляющие фукозилирование, либо вводя интерферирующие РНК (RNAi), которые препятствуют трансляции этих ферментов [12].
Делеция — удаление гена или его фрагмента.
Влияние дефукозилирования на ADCC было подробнее описано в статье «Биотехнология антител» [7].
Сейчас уже существуют клеточные линии, которые оптимизированы для экспрессии IgG-антител. Однако в случае биспецифических продуктов, как правило, требуется индивидуальный подход.
В конце концов выбирают финальный клон, который, уже в GMP-условиях, дает начало главному банку клеток (master cell bank, MCB). Его разделяют на сотни аликвот (идентичных частей) и хранят в жидком азоте при температуре −150 °С [13]. Также в ходе выбора клона проверяют профиль гликозилирования и его постоянство, склонность белка к агрегации и другие ключевые параметры [11].
Очень важно выбрать правильный клон как можно раньше, в идеале — до начала клинических исследований. Смена клона перед фазой 3 клинических исследований или позже потребует проведения дополнительного исследования сопоставимости продуктов, полученных на основе разных клонов [12].
По мере необходимости из главного банка отбирают очередную пробирку, размораживают, культивируют находящиеся там клетки и получают рабочий банк (working cell bank, WCB) — также сотни пробирок, которые хранятся в другом месте и являются основой для производства.
MCB и WCB тестируются на генетическую стабильность в течение как минимум 60 поколений клеток, чтобы обеспечить нужные параметры клеточной линии при производстве. Для этого клетки выращивают в культуральной среде, периодически пересевая и секвенируя кДНК целевого гена.
кДНК — комплементарная ДНК, которая синтезируется на мРНК с помощью обратной транскриптазы.
С создания банка клеток начинается собственно процесс производства белка. Он делится на две крупные стадии: процесс синтеза (upstream processing, USP) и процесс выделения и очистки (downstream processing, DSP). В USP входят все стадии от создания банка клеток до сбора продукта, то есть до начала очистки белка. В DSP входят все стадии от начала очистки до разлива по флаконам, то есть до получения готового продукта.
Процесс синтеза
Основной задачей разработки upstream processing при производстве антитела является максимизация выхода белка без ущерба для его качества.
Если в конце 1990-х годов выход 1 г/л считался довольно высоким, то сейчас обычны выходы 3–5 г/л , а некоторые компании добиваются 10–12 г/л [11]. Это стало возможным благодаря постоянному прогрессу в области экспрессии белков, главным образом, получению более совершенных клеточных линий, оптимизации состава среды и длительному процессу культивирования при высокой плотности [6].
Имеется в виду масса антитела в объеме культуральной жидкости.
Помимо состава среды, оптимизации подлежат параметры культивирования, как физические: температура, потоки газов, скорость перемешивания; так и химические: количество растворенных кислорода и углекислого газа, рН, осмотическое давление, окислительно-восстановительный потенциал (рис. 4) [14].
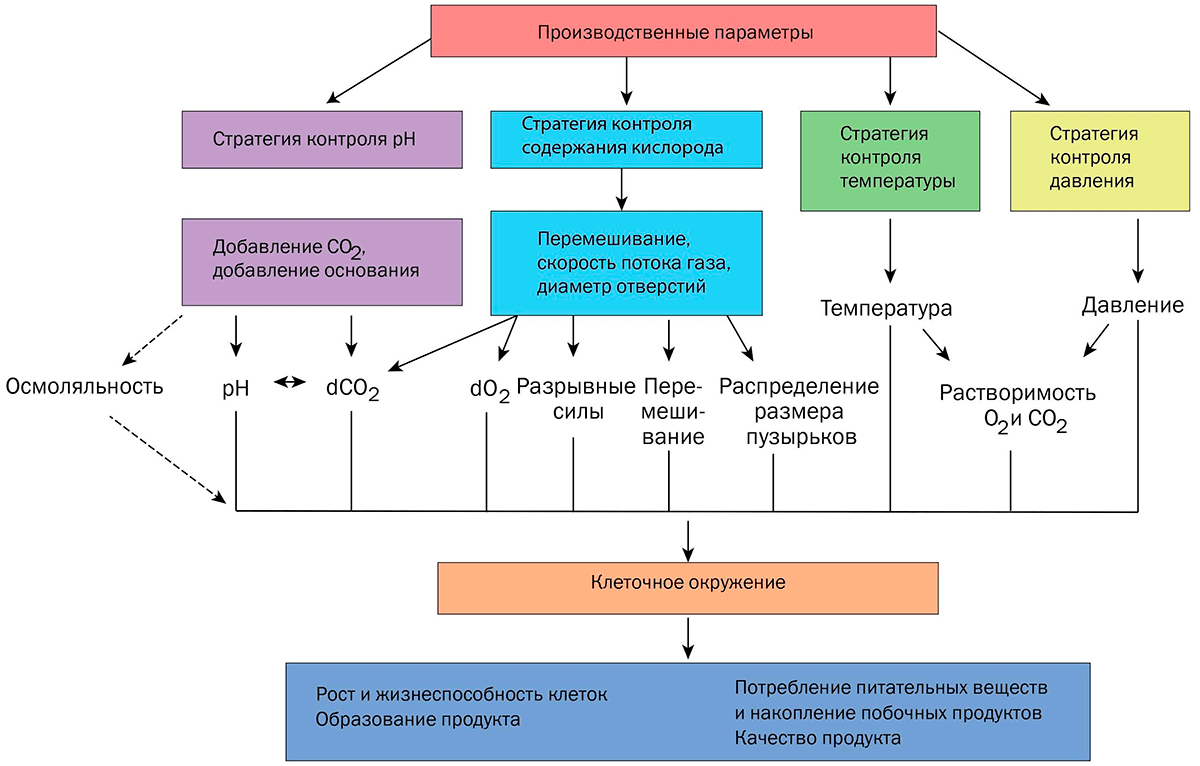
Рисунок 4. Операционные параметры процесса культивирования влияют на производительность и качество продукта
Два основных способа производства белков — в биореакторах с периодической загрузкой (fed-batch) и с непрерывной перфузией (continuous perfusion). Второй способ с использованием одноразовых (single-use) контейнеров вместо традиционных ферментёров из нержавеющей стали наиболее перспективен [14]. Использование одноразовых контейнеров более выгодно несмотря на то, что стоимость расходных материалов выше: зато снижаются затраты на стерилизацию, а особенно на валидацию и контроль стерильности.
Непрерывная перфузия свежих исходных веществ, причем с обратной связью о текущем состоянии реактора, и удаление продуктов и токсичных отходов позволяют добиться очень высокой плотности клеток. Как показало математическое моделирование, применение непрерывного процесса с одноразовыми реакторами позволяет сэкономить до 30% средств на производство [15].
Процесс выделения и очистки
Процесс выделения и очистки (DSP) в производстве антител довольно хорошо отработан, и прогресс в этой области не такой стремительный, как в USP. Однако здесь также существует тенденция к максимальному переходу от периодических процессов к непрерывным, что позволяет автоматизировать и удешевить процесс.
Поскольку сейчас для наработки белков используют клеточные линии, секретирующие белки во внешнюю среду, необходимо после культивирования удалить клетки, отделив жидкость, содержащую целевое антитело. Это делают, как правило, с помощью фильтрации или центрифугирования. Для обоих методов существуют подходы, которые позволяют интегрировать эти процессы в непрерывный производственный цикл [16].
Затем проводят аффинную хроматографию с белком А. Это белок клеточной стенки золотистого стафилококка, который сильно и селективно связывается с антителами при нормальном рН и слабо — при пониженном. На колонку с иммобилизованным белком А наносят раствор, содержащий антитело, а затем смывают раствором с рН 3,5 [14]. При такой же кислотности среды производят вирусную инактивацию: раствор выдерживают при ней 0,5–2 часа [17].
После вирусной инактивации промежуточный продукт подвергается фильтрации и проходит две стадии хроматографии — как правило, ионообменную и гидрофобную . На этих этапах удаляют различные примеси: остаточную ДНК, эндотоксины, белки клетки-хозяина, а также продукты полимеризации и деградации антитела [14].
О методах хроматографии подробнее рассказано в статье «12 методов в картинках: очистка молекул и разделение смесей» [18].
После еще одной стадии вирусной инактивации (часто используется ультрафиолет или фильтрация) промежуточный продукт концентрируют с помощью ультрафильтрации до концентрации, соответствующей конечному продукту [14].
Ультрафильтрация — фильтрация через мембрану под давлением.
Разработчики биспецификов наткнулись на множество проблем при производстве, так как в ходе USP разнообразие генерируемых форм может быть сложнее, чем для антител, поэтому требуется более тщательная очистка от примесей и тонкий контроль их наличия на этапе DSP [14]. В случае IgG-биспецификов процесс очистки облегчается благодаря наличию Fc-фрагмента, который связывается с белком А. Если же биспецифик не содержит Fc-фрагмента, то условия очистки приходится подбирать индивидуально, как для любого терапевтического белка — в этом случае на первом этапе используют ионообменную или гидрофобную хроматографию [22].
Масштабирование производства
Как мы уже говорили, фармацевтическая разработка начинается еще на этапе доклинических исследований. По мере приближения к клиническим исследованиям возрастают как регуляторные требования к качеству продукта, так и потребности в продукте. Происходит переход от небольших колб, реакторов волнового типа, лабораторных пятилитровых ферментеров к пилотным биореакторам объемом 25–100 л. Оказывается, что те хроматографические смолы и прочие расходные материалы, которые были пригодны на лабораторном этапе, не годятся для очистки продукта в больших объемах. Кроме того, многие из этих вспомогательных материалов не отвечают критериям GMP-производства. Поэтому требуются специальные усилия по масштабированию и подбору новых условий для USP и DSP.
Потребности в продукте на этапе ранних клинических исследований невелики — суммарно в них принимает участие, как правило, несколько сотен человек, поэтому нескольких десятков граммов антитела может оказаться достаточно. Другое дело — фаза 3 клинических исследований и особенно коммерческое производство. Здесь требуется производство в масштабах нескольких килограммов белка в год, а значит, объем реакторов увеличивается до 2000–20 000 литров. Требования к контролю качества здесь достигают максимума (см. видео).
В зависимости от полноты доклинических данных и степени внесенных при масштабировании изменений могут потребоваться дополнительные клинические исследования для доказательства сопоставимости версий продукта, произведенных до и после масштабирования.
Важным элементом разработки процесса производства является разработка формуляции, то есть состава готового продукта. Помимо действующего вещества (субстанции), туда входят растворитель, буферные и вспомогательные вещества, обеспечивающие длительную стабильность при хранении. Все они также должны быть произведены с выполнением требований GMP. После получения готового продукта проводят исследования стабильности для доказательства того, что продукт сохраняет надлежащее качество в течение всего срока хранения.
Стоимость производства
Сколько же стоит производство антител? Понятно, что компании не раскрывают себестоимость своих процессов, однако можно оценить ее, зная цены на сырье и расходные материалы. Так, моделирование показывает, что при небольших объемах производства для клинических исследований себестоимость 1 г антитела достигает $450–670. Однако при коммерческом производстве и больших масштабах она падает на порядок — до $30–45 за 1 г [15]. В одной из моделей себестоимость получилась еще меньше — $17 за 1 г [29].
Если остановиться на примере того же бевацизумаба, в России доза 400 мг стоит около $500, то есть около $1250 за 1 г. Следовательно, себестоимость составляет примерно 3,6% от цены препарата. В США и Европе бевацизумаб гораздо дороже. Такая наценка кажется слишком высокой, но надо понимать, что разработка нового препарата — очень рискованная деятельность, поэтому производитель закладывает в цену препарата расходы на R&D не только вышедшего на рынок, но и провалившихся препаратов, а также бюджет на дистрибуцию и маркетинг.
R&D (research and development) — исследования и разработка.
Из нашей статьи видно, что производство воспроизведенных антительных лекарств (они называются биоаналогами, или biosimilars, в отличие от дженериков для малых молекул) — непростое дело, ведь нужно выстроить и валидировать процесс, который обеспечит получение качественного препарата, не очень отличающегося по характеристикам от оригинального. Именно поэтому выходящие на рынок биоаналоги стоят не в десять раз дешевле, как дженерики, а всего на 30–40% меньше. Хотя, как мы видим, потенциал для снижения стоимости еще есть.
Проблемы и перспективы
Несмотря на стремительный прогресс в области производства белков, пространство для улучшений остается. Разработка производства — все еще длительный, дорогостоящий процесс, который зачастую ведется методом проб и ошибок. Даже обычные IgG-антитела против разных мишеней, несмотря на одинаковое строение, ведут себя по-разному в отношении экспрессии, очистки, стабильности и свойств. Что уж говорить о биспецифических антительных продуктах, для которых пока не накоплен обширный опыт масштабирования и производства. Как говорилось в статье «Разработка биспецифических антител для применения в клинике» [2], существует более 60 форматов биспецификов, и многие из них сильно отличаются друг от друга по структуре. Поэтому невозможно создать одну платформу, которая бы позволила производить биспецифики разных форматов [22]. Почти в каждом случае здесь пока требуется индивидуальный подход [30]. Однако большинство методов, изложенных в нашей статье, применимо и к биспецифическим продуктам независимо от их природы.
Понятно, что чем хуже отработан процесс, тем выше его себестоимость. Снижение себестоимости производства и ускорение его разработки — основные потребности в этой области. Помимо описанной в статье тенденции перехода к одноразовым реакторам и непрерывным процессам, одна из заметных тенденций в области разработки процесса производства — максимальная автоматизация операций. Так, выбор наиболее продуктивного клона может вестись в полуавтоматическом режиме с использованием роботов для работы с планшетами и последующим пересевом клеток в микрореакторы объемом от долей миллилитра до нескольких десятков миллилитров, имитирующие условия культивирования в ферментерах (см. видео). Расширяется использование датчиков с обратной связью, сопряженных с автоматическими устройствами дозирования, для тонкой подстройки условий культивирования по мере роста клеток.
Безусловно, дальнейшие исследования в области метаболизма клеток, состава сред, контроля процессов производства и очистки позволят сделать разработку процессов производства антител более простой, а само производство — еще более надежным и дешевым.
Литература
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Разработка биспецифических антител для применения в клинике;
- Test procedures and acceptance criteria for new drug substances and new drug products: chemical substances. Q6A. (1999). The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use;
- Kumar P. (2015). Bioprocess validation. SlideShare;
- Основоположники отечественной биофармацевтики: опытное биотехнологическое производство ИБХ;
- André Frenzel, Michael Hust, Thomas Schirrmann. (2013). Expression of Recombinant Antibodies. Front. Immunol.. 4;
- Биотехнология антител;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: клеточные технологии;
- Petra Gronemeyer, Reinhard Ditz, Jochen Strube. (2014). Trends in Upstream and Downstream Process Development for Antibody Manufacturing. Bioengineering. 1, 188-212;
- Feng Li, Natarajan Vijayasankaran, Amy (Yijuan) Shen, Robert Kiss, Ashraf Amanullah. (2010). Cell culture processes for monoclonal antibody production. mAbs. 2, 466-479;
- Pru Bird, Geoff Hale. (). Cell Banks and Stability of Antibody Production. Diagnostic and Therapeutic Antibodies. 303-307;
- Cui X. and Zhu X. (2018). Impact factors in the process development for therapeutic antibodies. International Journal of Pharmacy and Chemistry. 2, 16–22;
- Jonathan Hummel, Mark Pagkaliwangan, Xhorxhi Gjoka, Terence Davidovits, Rick Stock, et. al.. (2018). Modeling the Downstream Processing of Monoclonal Antibodies Reveals Cost Advantages for Continuous Methods for a Broad Range of Manufacturing Scales. Biotechnol. J.. 1700665;
- Veena Warikoo, Rahul Godawat, Kevin Brower, Sujit Jain, Daniel Cummings, et. al.. (2012). Integrated continuous production of recombinant therapeutic proteins. Biotechnol. Bioeng.. 109, 3018-3029;
- Xhorxhi Gjoka, Rene Gantier, Mark Schofield. (2017). Transfer of a three step mAb chromatography process from batch to continuous: Optimizing productivity to minimize consumable requirements. Journal of Biotechnology. 242, 11-18;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Balaji Somasundaram, Kristina Pleitt, Evan Shave, Kym Baker, Linda H. L. Lua. (2018). Progression of continuous downstream processing of monoclonal antibodies: Current trends and challenges. Biotechnology and Bioengineering. 115, 2893-2907;
- James Pollock, Jon Coffman, Sa V. Ho, Suzanne S. Farid. (2017). Integrated continuous bioprocessing: Economic, operational, and environmental feasibility for clinical and commercial antibody manufacture. Biotechnol Progress. 33, 854-866;
- Multidimensional scale-up of a monoclonal antibody capture step, using ÄKTATM pilot 600. (2017). Process Development Forum;
- Claire Scanlan, Elina Gousseinov, Alejandro Becerra-Artega, Ruta Waghmare. (2014). Challenges and Strategies for the Downstream Processing of BiSpecific Antibodies (BsAbs). jadc. 2;
- Avastin EPAR scientific discussion. (2005). EMA;
- Zhilan Hu, Donglin Guo, Shirley S.M. Yip, Dejin Zhan, Shahram Misaghi, et. al.. (2013). Chinese hamster ovary K1 host cell enables stable cell line development for antibody molecules which are difficult to express in DUXB11-derived dihydrofolate reductase deficient host cell. Biotechnol Progress. 29, 980-985;
- 12 методов в картинках: протеомика;
- Tomohiro Yoshikawa, Fumi Nakanishi, Seima Itami, Daisuke Kameoka, Takeshi Omasa, et. al.. (2000). . Cytotechnology. 33, 37-46;
- Yi Li, Daniel Hewitt, Yvonne K. Lentz, Junyan A. Ji, Taylor Y. Zhang, Kelly Zhang. (2014). Characterization and Stability Study of Polysorbate 20 in Therapeutic Monoclonal Antibody Formulation by Multidimensional Ultrahigh-Performance Liquid Chromatography–Charged Aerosol Detection–Mass Spectrometry. Anal. Chem.. 86, 5150-5157;
- Zdenka ŠKLUBALOVÁ. (2009). Conversion Between Osmolality and Osmolarity of Infusion Solutions. Sci. Pharm.. 77, 817-826;
- Jason Walther, Rahul Godawat, Chris Hwang, Yuki Abe, Andrew Sinclair, Konstantin Konstantinov. (2015). The business impact of an integrated continuous biomanufacturing platform for recombinant protein production. Journal of Biotechnology. 213, 3-12;
- Rios M. (2017). Process needs of antibody fragments and bispecifics: a discussion with Jonathan Royce of GE Healthcare. BioProcess International;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники.







