
Молекулярная биология боли
12 ноября 2019
Молекулярная биология боли
- 12804
- 1
- 27
Они знают, что такое боль...
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Что неизменно в вечно меняющемся мире? Отвечая на этот вопрос, обычно вспоминают любовь и смерть, иногда рождение. Но нужно помнить, что еще вечна боль. Придя в человеческую жизнь, она может разрушить ее до основания, превратить в кошмар. Страх боли иной раз может быть сильнее даже страха самой смерти. Но боль — не лавкрафтовский ужас, она лежит в пределах нашего понимания, и в последние несколько столетий человечество учится бороться с этим злейшим врагом комфортной жизни. А чтобы победить врага — нужно его узнать.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Какая бывает боль?
Ни для кого не секрет, что за ощущение боли отвечает нервная система. В общем виде работу этой системы можно представить так: рецепторы улавливают внешний сигнал и преобразуют его в нервный импульс (трансдукция), передают информацию по нерву (кондукция), а далее она обрабатывается в спинном мозге и «отсылается» в головной мозг (проекция) для генерации болезненных ощущений (восприятие) (рис. 1). Почти все помнят, что боль — это реакция на внешний раздражитель, но на самом деле это не всегда так: она может возникать и при поломке самой нервной системы.

Рисунок 1. Схема работы болевого импульса. В простейшем пути передачи сигнала участвуют три группы нейронов, чьи волокна обозначены на схеме разными цветами. За трансдукцию боли отвечает ноцицептор (обозначен на схеме фиолетовым), трансдукция происходит по нервным волокнам, обозначенным красным цветом, в спинном мозге происходит проекция боли на «зеленый» участок схемы, восприятие же боли начинается тогда, когда нейроны третьего порядка передадут нервный импульс от таламуса к коре больших полушарий.
Стоит отметить, что эволюционно боль появилась в качестве полезной адаптации, и на самом деле, до сих пор продолжает играть важную роль в нашей жизни. Задумайтесь, какой бы была жизнь без боли — мы не могли бы отдергивать руку, касаясь горячей поверхности, не замечали бы наносимых ран, а уж как осложнилась бы жизнь врачей, ставящих диагноз — сложно представить. Однако это не вся польза, которую приносит нам наша система восприятия боли. Рука об руку с ощущением боли идут ощущения давления, холода и тепла (то есть осязание) — и возможность организма в ответ на стимул из внешней среды изменить свои параметры. Существует ряд болезней (в основном генетически обусловленных), при которых восприятие боли нарушается. Их тяжесть варьирует в зависимости от того, какой именно рецептор или канал «поломан». Самые тяжелые формы (например, наследственная сенсорно-вегетативная невропатия IV типа) характеризуются полной потерей болевой чувствительности в конечностях и нарушением способности организма регулировать температуру тела. Но обо всем по порядку.
Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
- Ноцицептивная боль — самая частая: именно она является той самой реакцией на внешние раздражители. При этом виде телесных мук все необходимые компоненты нервной системы работают исправно. Именно молекулярным механизмам ноцицептивной боли будет посвящено наше дальнейшее повествование.
- Воспалительная боль по механизму на самом деле ноцицептивная, но, в отличие от «классической» вариации, возникает в ответ на стимулы, которые в норме эту боль вызывать не должны, — различные медиаторы воспаления.
- Невропатическая боль возникает при нарушениях работы периферических нервов и проявляется в виде спонтанной боли без причин.
- Функциональная же боль (или ноципластическая) возникает при нарушении обработки сигналов, поступающих от нервов — спинной мозг принимает сигнал «все нормально» за сигнал для развития болевых ощущений.
Поскольку мы решили остановиться на «нормальной» ноцицептивной боли, давайте разберемся поподробнее с каждым из этапов ее появления.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].

Рисунок 2. Связывание рецепторами TRP капсаицина и ментола приводит к активации «температурной» ноцицепции. Интересно, что при определенных условиях капсаицин может не только вызывать боль, но и ослаблять ее — он десенсибилизирует (то есть делает менее чувствительными к стимулам) другие каналы семейства TRP, кроме того, провоцирует выброс эндорфинов, а вкупе с другими лекарственными средствами может оказаться... перспективным обезболивающим.
Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.
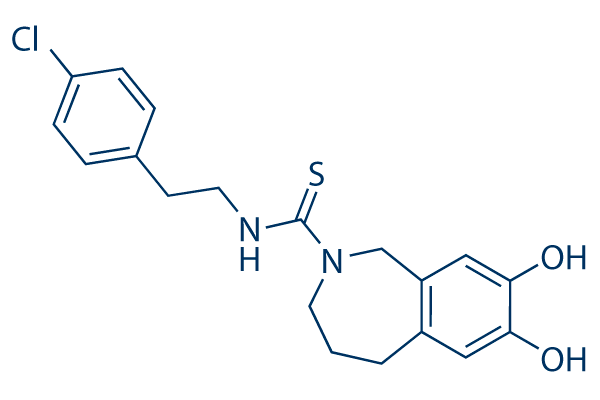
Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).
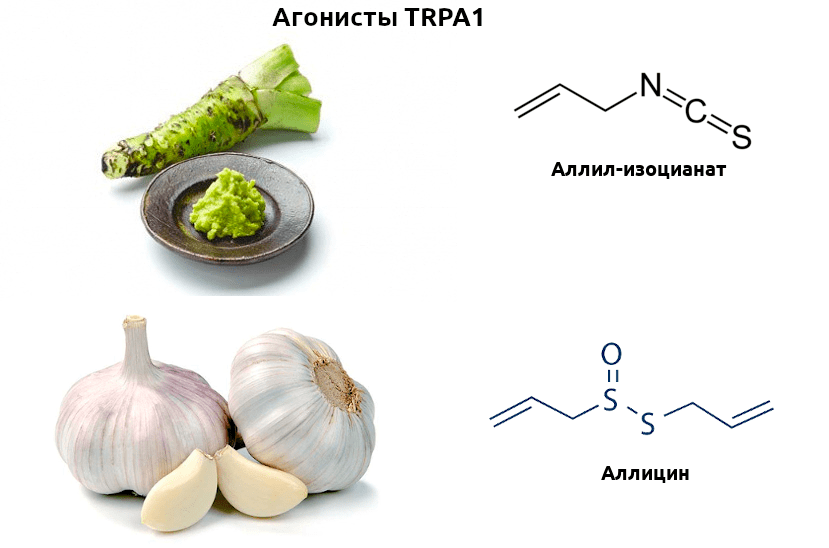
Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Как уже говорилось, рецепторы TRP — ионные каналы. Открывшись, они пропускают внутрь клетки важнейшие катионы — Na+ и Ca2+. Вход положительно заряженных ионов изменяет электрический потенциал мембраны [6], а также активирует работу ряда сигнальных белков. Всё это приводит к появлению нервного импульса, который начинает распространяться по нейрону в определенном направлении.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
На примерах мы разобрались, как работают ноцицептивные рецепторы, но ведь они расположены «на переднем крае», близко к раздражителю, а приказ о болевых ощущениях отдается из мозга. Значит, необходимо донести сигнал до верховных инстанций. Для этого только что полученный потенциал действия рецептора активирует множество потенциал-управляемых ионных каналов. Натриевые и калиевые каналы необходимы для генерации потенциалов действия, которые передают ноцицепторные сигналы синапсам в дорсальном роге спинного мозга. Они — еще одна потенциальная терапевтическая мишень для новых групп анальгетиков. Кальциевые же каналы играют ключевую роль в высвобождении нейромедиаторов из центральных или периферических ноцицепторных синапсов, вызывая боль или воспаление соответственно.
В этом месте важно отметить, что нервные волокна, по которым ноцицепторный сигнал идет до спинного мозга, бывают трех типов — Aδ (а-дельта), Aβ (а-бета) и C. Эти волокна отличаются друг от друга по толщине, наличию или отсутствию «изолирующей» миелиновой оболочки и, как следствие, по скорости проведения нервного импульса и типу импульса, который по ним проводится.
Аδ-волокна проводят импульс быстро (10–30 м/с) и «специализируются» на сигналах о сильной механической боли и изменении температуры.
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко... Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
Для снижения болевых ощущений у нас есть система внутренней анестезии. Нейроны антиноцицептивных путей выделяют короткие олигопептиды — эндорфины, которые связываются с рецепторами на нейронах задних рогов, активация которых вызывает затухание потенциала действия и замедление проведения нервного импульса. Стоит отметить, что именно с этими ингибирующими рецепторами связываются печально известные опиоидные наркотики (морфин, героин, метадон и т. д.) [10], поэтому рецепторы носят название опиоидных, да и связывающиеся с ними в норме эндорфины переводятся как «внутренние морфины». Как нетрудно догадаться, опиоидные рецепторы — самая эффективная и распространенная на данный момент мишень для лекарственного воздействия. Но широко известна и ужасающая темная сторона такого метода подавления боли — опиоидная зависимость.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Помимо «голубей», тормозящих проведение импульса, есть в спинном мозге и «ястребы», его усиливающие. Самый известный из них — глутамат [13]. В случае проведения ноцицептивного импульса, работа глутамата осуществляется через рецепторы NMDA и AMPA.
Глутамат действует хитро: связываясь с рецепторами АMPA, он вызывает в нейроне активацию уже знакомой нам протеинкиназы С, которая, в свою очередь, приводит к возрастанию уровня внутриклеточного кальция и поляризации мембраны. Помимо того, что это ускоряет проведение болевого импульса, это влияет на NMDA-рецепторы. В норме потенциал-зависимый канал закрыт магниевой «пробкой» и не открывается даже при связанном глутамате. Когда мембрана деполяризируется, магниевая пробка вылетает, и NMDA-рецептор запускает внутрь клетки катионы натрия и кальция, а наружу — калия, что способствует дальнейшей деполяризации мембраны. Самый известный антагонист NDMA-рецепторов — кетамин. Он нашел обширное применение в качестве операционного анестетика, но в последние годы из-за многочисленных нежелательных эффектов (в том числе наркотических), его применяют все реже. В ветеринарной же медицине кетамин, напротив, один из самых широко применяемых анестетиков.
Одним из очень интересных модуляторов боли является субстанция Р. Это олигопептидный нейромедиатор, связывающийся с метаботропными рецепторами нейрокинина (NKR). NK1R, являясь уже знакомым нам GPCR, вызывает каскад реакций фосфорилирования через протеинкиназу С. В результате в клетке возрастает экспрессия генов натриевого канала Nav1.8, а в нейроне-ноцицепторе увеличивается синтез и наших старых знакомых — NMDA и TRPV1. Кроме того, субстанция Р снижает активность низкопорогового калиевого канала (Kv1.4) в чувствительных к капсаицину нейронах спинального ганглия и, таким образом, сенсибилизирует ноцицепторы. Интересно, что знаменитые грызуны-долгожители — голые землекопы [14] — практически не имеют в ЦНС субстанции Р, благодаря чему становятся нечувствительными ко многим видам боли [15].
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Сначала таламус и парабрахиальное ядро получают информацию от проекционных нейронов в различных пластинах, а затем передают эту сенсорную информацию в корковые и миндалевидные области, где информация расшифровывается как «болезненный стимул».
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Аффективно-мотивационный аспект боли опосредуется медиальным болевым путем, включающим внутриламинарные ядра таламуса, которые проецируются на соматосенсорные структуры коры и лимбической системы. Пластина V же передает ноцицептивные сообщения парабрахиальному внутреннему латеральному ядру. Нервные волокна этого ядра связаны с областями коры, отвечающими за когнитивные функции (например, поведенческую реакцию на боль) и агрессивное поведение [16].
Помимо «осознания боли» ответом часто является реакция «бей или беги», связанная с активацией норадреналинергических нейронов в голубом пятне. Кроме того, после «обработки» болевого сигнала соматосенсорной корой, информация о болевом сигнале передается в гиппокамп — чтобы затем отправиться в долговременную память.
На данный момент мы не можем с точностью сказать, какие молекулярные процессы, происходящие в мозге, отвечают за «субъективное восприятие» боли, поэтому вмешиваться с помощью лекарств на этом уровне восприятия боли никто не решается — слишком опасно.
Часть VI: Возвращение к наболевшему
С помощью одних и вопреки другим нейробиохимическим механизмам, болевой импульс дошел до мозга. На некоторое время организм ждут ощущения от неприятных до ужасающих. Сейчас кажется, что человечество овладело огромным количеством фармакологических методов для остановки боли — однако это лишь иллюзия, и как только противовоспалительные средства — ингибиторы циклооксигеназы — перестают снимать боль, врачам приходится применять «тяжелую артиллерию» опиоидных анальгетиков.
Как мы уже выяснили, сейчас выявлено очень много рецепторов, которые вовлечены в процесс передачи боли, но еще большее количество факторов пока ускользает от всевидящего взгляда ученых. Другой печальный факт заключается в том, что у многих из известных нам болевых рецепторов есть и другие физиологические функции, блокировка которых приведет к значительным побочным эффектам. Разработка антагонистов TRP, а также «опиоидов нового поколения», не вызывающих зависимость, может оказаться настоящим прорывом — но может и повлечь новые невзгоды. Сегодня нам ясно одно — в борьбе за повышение качества жизни боль рано или поздно должна быть взята под контроль, а для того чтобы оседлать этого страшного зверя, его нужно узнать.
Литература
- John E. Swett, Clifford J. Woolf. (1985). The somatotopic organization of primary afferent terminals in the superficial laminae of the dorsal horn of the rat spinal cord. J. Comp. Neurol.. 231, 66-77;
- Рецепторы в активной форме;
- Жгучий перец облегчит боль;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Rafael C. Dutra, Allisson F. Bento, Daniela F.P. Leite, Marianne N. Manjavachi, Rodrigo Marcon, et. al.. (2013). The role of kinin B1 and B2 receptors in the persistent pain induced by experimental autoimmune encephalomyelitis (EAE) in mice: Evidence for the involvement of astrocytes. Neurobiology of Disease. 54, 82-93;
- Формирование мембранного потенциала покоя;
- Ilona Obara, Vsevolod Telezhkin, Ibrahim Alrashdi, Paul L. Chazot. (2019). Histamine, histamine receptors, and neuropathic pain relief. Br J Pharmacol;
- Keri E. Cannon, Julia W. Nalwalk, Rebecca Stadel, P. Ge, D. Lawson, et. al.. (2003). Activation of spinal histamine H3 receptors inhibits mechanical nociception. European Journal of Pharmacology. 470, 139-147;
- S.J. Enna, Kenneth E. McCarson. (2006). The Role of GABA in the Mediation and Perception of Pain. GABA. 1-27;
- Идеальный опиоид, или Как избавиться от Дамоклова меча;
- Спокоен как GABA;
- Глицин: часть 2. Нейромедиатор и мем;
- Очень нервное возбуждение;
- Преодолевшие старение. Часть II. Дети подземелья;
- Dudley P. (2018). Pain pathways. Teach Me Physiology;
- R.J.R. Blair. (2004). The roles of orbital frontal cortex in the modulation of antisocial behavior. Brain and Cognition. 55, 198-208;
- Allan I. Basbaum, Diana M. Bautista, Grégory Scherrer, David Julius. (2009). Cellular and Molecular Mechanisms of Pain. Cell. 139, 267-284;
- S. Brauchi. (2006). A Hot-Sensing Cold Receptor: C-Terminal Domain Determines Thermosensation in Transient Receptor Potential Channels. Journal of Neuroscience. 26, 4835-4840;
- Kartik Venkatachalam, Craig Montell. (2007). TRP Channels. Annu. Rev. Biochem.. 76, 387-417;
- Félix Viana. (2016). TRPA1 channels: molecular sentinels of cellular stress and tissue damage. J Physiol. 594, 4151-4169;
- Kartik Venkatachalam, Craig Montell. (2007). TRP Channels. Annu. Rev. Biochem.. 76, 387-417;
- Gabriel Rusanescu, Jianren Mao. (2015). Immature spinal cord neurons are dynamic regulators of adult nociceptive sensitivity. J. Cell. Mol. Med.. 19, 2352-2364;
- Lindsay B. Hough, Frank L. Rice. (2011). H3 Receptors and Pain Modulation: Peripheral, Spinal, and Brain Interactions. J Pharmacol Exp Ther. 336, 30-37;
- Chu-Ting Chang, Bo-Yang Jiang, Chih-Cheng Chen. (2019). Ion Channels Involved in Substance P-Mediated Nociception and Antinociception. IJMS. 20, 1596.







