Идеальный опиоид, или Как избавиться от Дамоклова меча
18 ноября 2016
Идеальный опиоид, или Как избавиться от Дамоклова меча
- 4514
- 2
- 6
Сейчас действие опиоидных анальгетиков можно сравнить с Дамокловым мечом. Сначала пациент получает желаемый обезболивающий эффект, но через некоторое время потенциально могут развиться (и развиваются) побочные эффекты.
картина «Дамоклов меч» Ричарда Уэстолла
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Для того чтобы избавиться от боли у современного человека есть обширный выбор лекарственных препаратов. Наверняка, вам в голову никогда не приходила идея употребить морфий для устранения головной боли. Но есть такие категории больных людей, для которых опиоидные анальгетики, хотя они и вызывают ряд побочных эффектов, являются не просто препаратами выбора, а жизненной необходимостью. Что сделали ученые для этих пациентов, перевернув историческую основу опиоидов на молекулярном уровне, обсудим в данной статье.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Какой философ
Зубную боль переносил спокойно!
А ведь они с бессмертным красноречьем
Писали против рока и страданий.
Уильям Шекспир. Много шума из ничего
Прекрасное или ужасное?
Международная ассоциация по изучению боли (IASP) определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с реальным или потенциальным повреждением тканей или описываемое в терминах такого повреждения» [1]. Независимо от степени выраженности боли, она всегда требует ответных действий, чем быстрее, тем лучше. Но боль хроническая, нетерпимая, как у онкологических больных, не реагирует на прием «стандартных» ненаркотических анальгетиков или лекарств из «бабушкиной аптечки». Такие больные вынуждены принимать более сильные по своему обезболивающему эффекту препараты, чаще всего — опиоиды.
Лекарственные препараты, уменьшающие или купирующие боль, называются анальгетики. Современная классификация анальгетиков предполагает разделение их на четыре основные группы [2]:
- наркотические (опиоидные) анальгетики;
- ненаркотические (неопиоидные) анальгетики;
- анальгетики смешанного типа действия;
- препараты других фармакологических групп, обладающие анальгетическим эффектом.
Все что-то слышали об опиоидах, но, скорее всего, у большинства людей возникают ассоциации, связанные со злоупотреблением применения данных веществ. Но нас же интересует не рекреационный эффект алкалоида Papaver somniferum, а его медицинское применение.
Пожалуй, «звезду мирового масштаба» среди группы наркотических анальгетиков знает каждый. Встречайте, морфин. Отцом его можно без зазрения совести считать аптекаря Фридриха Вильгельма Сертюрнера, двадцатилетнего на тот момент юношу (рис. 1). В лаборатории своего отца, увлекавшегося, как модно было в то время, искусством алхимии, юный Сертюрнер получил все навыки для последующего открытия. После смерти отца он начинает экспериментировать с различными веществами в придворной аптеке в Падерборне. Так как опиум был покрыт ореолом таинственности, то, конечно же, Сертюрнер не обошел и его своим вниманием. Выделенный порошок был смело опробован на всех пробегающих мимо аптеки собаках. Собаки не возражали и после угощения с примесью волшебного порошка засыпали глубоким сном, не чувствуя щипки Сертюрнера [3]. Молодой ученый сразу понял, что вещество с подобными свойствами могло приобрести для человечества огромное значение. Совершив ряд опытов на себе, Сертюрнер назвал его в честь греческого бога сна морфием. Это произошло в 1804 году. Дальнейшую историю вы знаете. От столетий использования и восторгания до законодательных актов для ограничения использования опиоидов и возникновения черных рынков.

Рисунок 1. Фридрих Вильгельм Сертюрнер — немецкий фармацевт, открывший морфин в 1804 году.
Обоюдоострый меч: положительные и отрицательные эффекты опиоидов

Рисунок 2. Димерная структура опиоидного μ-рецептора.
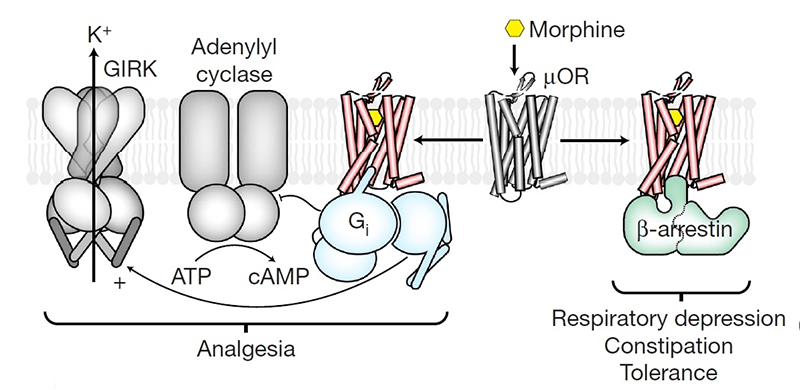
Проще всего понять механизм действия опиодов, зная, что опиоид — субстрат, возбуждающий определенные рецепторы. Опиоидных рецепторов в современной фармакологии различают пять типов, наиболее изученные из которых — μ, δ, κ. Все опиоиды в той или иной степени взаимодействуют с разными типами опиоидных рецепторов, но при этом для каждого типа опиоидных рецепторов есть наиболее типичные агонисты и антагонисты. Эффектов, реализуемых через эти рецепторы, масса, все они очень интересные и влияют на человека, если не на организменном уровне, то уж точно на полиорганном (начиная с ЦНС, заканчивая мочевыделительной системой). Ярко выраженная активность опия проявляется больше через воздействие на μ-рецепторы (рис. 2).
μ-рецепторы разделяют на подтипы. Всего их три, и через воздействие на определенный подтип реализуются разные эффекты. Воздействие лиганда на μ1-рецептор приведет к возникновению обезболивающего эффекта. В то же время через этот подтип рецептора развивается физическая толерантность к препаратам опия. При взаимодействии лиганда с подтипом μ2-рецептора возникают побочные эффекты: угнетение дыхания вплоть до апноэ, снижение перистальтики в желудочно-кишечном тракте, физическая и психическая зависимость. Кроме того, могут возникать такие эффекты, как угнетение сердечно-сосудистого центра в продолговатом мозге, олиго- или анурия, тошнота, рвота, запор и еще много всего очень нежелательного [2], [4]. Функция μ3-рецептора пока не известна.
Основной интересующий нас эффект — анальгетический — реализуется через угнетение активности структур центральной нервной системы. Эти структуры находятся на разных уровнях и выполняют контролирующую (ограничительную) функцию по отношению к болевым стимулам. Их можно разделить на 3 уровня [5]:
- подкорковые структуры — околопроводное серое вещество, ретикулярная формация, ядра шва;
- гипоталамус;
- кора больших полушарий.
Также анальгетический эффект осуществляется через снижение возбудимости эмоциональных и вегетативных центров гипоталамуса, лимбической системы и коры больших полушарий, что приводит к ослаблению отрицательной эмоциональной и психической оценки боли [2].
Эндогенные опиоиды
Что касается анальгетического эффекта, то тут опиоиды просто великолепны и превзошли многих! Всегда интересно раскрыть секреты тех, у кого что-то получается великолепно. Секрет же опиоидов был раскрыт в конце прошлого века. Сначала были открыты рецепторы в мозге, которые отвечали на воздействие опиатов. Затем произошло одно из выдающихся достижений в неврологии — открытие нейронного механизма действия опиатов [6]. Эти исследования привели к обнаружению класса химических веществ, выделяемых мозгом, которые называются энкефалины, а позже к открытию эндорфинов. Все это — морфиноподобные эндогенные субстанции (эндогенные опиоиды). У эндорфинов довольно долгий путь образования: начинается все с проопиомеланокортина (ПОМК), который вырабатывается в передней и промежуточной долях гипофиза и в некоторых других тканях (кишечнике, плаценте). После волшебных превращений ПОМК в адренокортикотропный гормон (АКТГ) и β-липотропин, в разных клетках из этих предшественников образуется разный набор пептидов, в том числе и эндорфины (рис. 3).

Рисунок 3. Эндорфины — морфиноподобные эндогенные субстанции.
сайт compoundchem.com
Представьте! У каждого из нас есть собственная отличная система защиты от любой боли, любых переживаний, любых отрицательных явлений. Ведь эндогенные опиоиды также, как и экзогенные, связываются с опиоидными рецепторами и реализуют эффект обезболивания. Все так, да не совсем.
После открытия эндорфинов действительно предпринимались попытки получить их синтетические аналоги, так как теперь стало ясно, что опиоиды не такое уж и зло, а, как обычно и бывает в отношении лекарственных препаратов, обоюдоострый меч. Предполагалось, что такие соединения будут мощными обезболивающими, свободными от неблагоприятных последствий, связанных с использованием наркотических препаратов: все же это собственный продукт человеческого организма. К сожалению, успехом поиски не увенчались. Анальгезирующее действие у полученных веществ было слабее, чем у морфина. А если ученые пытались сделать эффект сопоставимым по уровню обезболивания с экзогенными опиатами, то получали в результате серьезные побочные эффекты [7].
Почему же это происходило? Давайте вспомним, что в нашем организме есть система обеспечения гомеостаза. Все со школы помнят, что это такое. Можно даже хором: способность организма поддерживать постоянство внутренней среды. Так вот, при нормальном физиологическом состоянии отмечается баланс между синтезом, высвобождением, связыванием с рецептором и обратным захватом нейромедиатора, результатом которого является чувство внутреннего комфорта. Что важно, сам организм не вырабатывает чрезмерное количество эндогенных опиоидов, так как это может привести к ряду побочных эффектов, о которых уже упоминалось (привыкание, угнетение дыхания вплоть до апноэ, тошнота, запор и др.). Таким образом в человеческом организме осуществляется один из видов гомеостаза — так называемое состояние «опиоидной достаточности». Если в организм извне поступает вещество, способное связаться с опиоидным рецептором, то данное состояние нарушается.
От кого зависит результат
Наиболее высокая концентрация μ-рецепторов обнаружена в хвостатом ядре. В больших концентрациях эти рецепторы представлены в коре, таламусе, гипоталамусе. Также они найдены в умеренном количестве в околопроводном сером веществе, теле желудка, в двенадцатиперстной кишке, в подвздошной кишке и в меньших количествах в других местах [8], [9]. Эти рецепторы (GPCRs ) расположены на мембране клетки и взаимодействуют через G-белок с мембранным ферментом [4]. G-белок — универсальный посредник при передаче от рецептора к ферментам клеточной мембраны сигналов, катализирующих образование вторичных посредников гормонального сигнала. Когда опиоид попадает на рецептор, G-белок активируется, меняя свою конформацию, и активно взаимодействует с ферментом мембраны. Итогом является изменение скорости и активности процессов в клетке.
«Биомолекула» уже не раз писала про замечательные GPCR: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [10].
Взаимодействие опиоида с μ-рецептором приводит к конформационным изменениям не только G-белка, но также превращает сам рецептор в субстрат для протеинкиназы. Активированный лигандом рецептор фосфорилируется по остаткам серина или треонина [10]. С активированным и фосфорилированным рецептором связываются β-аррестины (рис. 4). Вот тот, кто нам нужен! Именно β-аррестины «решают», появится ли побочный эффект от приема опиоидного вещества. Доказательством вышесказанного послужили исследования на мышах. Было установлено, что если мышам, лишенным μ-рецепторов, ввести морфин, то у них не появится ни анальгетического эффекта, ни побочных эффектов, в частности угнетения дыхательного центра. Ученые на этом не остановились и исследовали, что будет у мышей без β-аррестинов 1 и 2. Выяснилось, что при введении таким мышам морфина, анальгетический эффект у них возникал, причем сильнее и дольше, чем у мышей с β-аррестинами 1 и 2. А вот, что примечательно, угнетения дыхания, запора и других отрицательных проявлений не было [11]. Вывод был очевиден. Нужно продолжать работать в направлении исследования β-аррестинов.
К семейству белков аррестинов относятся четыре белка. Аррестины 1 и 4 экспрессируются в палочках и колбочках сетчатки соответственно. Аррестины 2 и 3 (известные так же, как β-аррестины 1 и 2) представлены во всех тканях. Они управляют активностью рецепторов, сопряженных с G-белками, на трех уровнях:
- сайленсинга — отделения рецептора от его G-белка;
- интернализации — удаления рецептора с цитоплазматической мембраны, повторного возвращения на мембрану и/или деградации;
- проведения сигнала — активации или ингибирования внутриклеточных сигнальных путей независимо от G-белков.
Управленческие способности β-аррестина обеспечивают клатрин-зависимый эндоцитоз — вхождение фрагментов цитоплазматической мембраны вместе со всем содержимым в клетку в виде пузырьков, покрытых снаружи решеткой из полимеризованного клатрина. Клатрин — белок, обладающий способностью формировать структуры с упорядоченной сеткой, их еще называют клатратами. Сформированный пузырек, внутри которого рецептор, подвергается эндоцитозу, а дальнейший ход событий может складываться по-разному [12].
Начало детализированного изучения опиоидов можно отсчитывать от вышеизложенного открытия Сертюрнера в 1804 году. Многое с тех пор прояснилось, но конкретный молекулярный механизм возникновения побочных эффектов до сих пор обсуждается. Одно признается всеми учеными без исключения: возникнет или нет отрицательный эффект в виде угнетения дыхания, снижения перистальтики в желудочно-кишечном тракте, физической и психической зависимости и других эффектов зависит от β-аррестина. Существуют три основные гипотезы реализации этой зависимости [11]. Возникали они постепенно, но заменить и исключить друг друга не смогли. Поэтому постараемся разобраться во всех трех предположениях. Хочется подчеркнуть, что гипотезы и не призваны исключить друг друга. Возможно, все механизмы имеют место, ведь в человеческом организме сложноустроенные процессы встречаются повсеместно.
Гипотезы, которые работают
Первая гипотеза (наиболее молодая по происхождению) является наиболее обоснованной и понятной. В ней утверждается, что β-аррестины 1 и 2 стимулируют внутриклеточные молекулярные сигналы независимо от G-белков и связанных с G-белком дальнейших каскадов (рис. 5). β-аррестины могут активировать митоген — протеинкиназный каскад. Основа этого каскада — MAP-киназы — серин/треонин-специфичные протеинкиназы, которые в ответ на внеклеточные стимулы регулируют клеточную активность (экспрессию генов, митоз, дифференцировку, выживание клеток, апоптоз и др.).
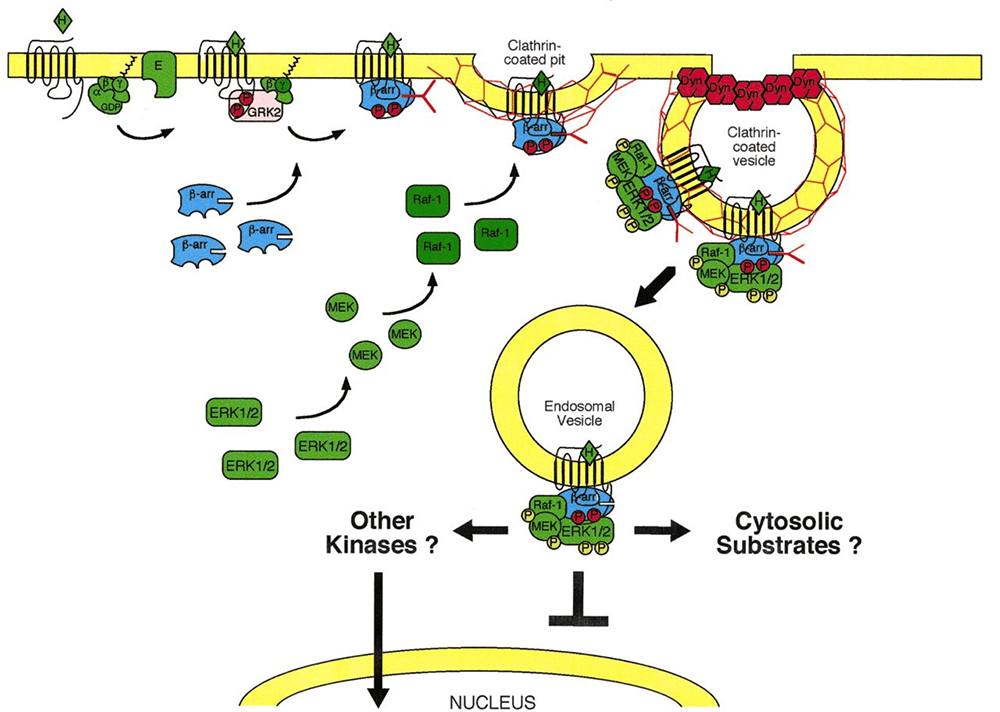
Рисунок 5. Присоединение β-аррестина стимулирует каскад внутриклеточных молекулярных сигналов независимо от G-белка и связанных с ним путей. На этапе начала формирования эндосомы с комплексом GPCR + лиганд(опиоид) + β-аррестин на мембране β-аррестин способствует активацию каскада реакций. Каскад заключается в активации ERK1/2 пути. В последующем через активацию других неизвестных киназ или через активацию неизвестных цитоплазматических субстратов происходит стимуляция внутриядерных процессов транскрипции и последующей экспрессии молекул. Через образование этих молекул реализуются эффекты на полиорганном уровне. О том, как это происходит читайте в [12].
После того как лиганд-опиоид присоединился к μ-рецептору, происходит связывание этого комплекса с β-аррестином. Одновременно начинается погружение рецепторного комплекса внутрь клетки с формированием эндосомы. Образовавшийся комплекс (GPCRs + лиганд-опиоид + β-аррестин) способен далее связаться с МАР-киназой. Есть несколько сигнальных путей, связанных с этой системой, но здесь работает один. Эта система — путь ERK (extracellular signal-regulated kinase), который включает цепь активаций и взаимодействий белков ERK1/2 с другими киназами, результатом чего является прохождение сигнала в ядро клетки. Здесь уже происходят процессы транскрипции и дальнейшей экспрессии соответствующих молекул, благодаря которым клетка так или иначе может реагировать на внешние стимулы. Функция такого механизма до конца не изучена.
Интересно, что данная сигнальная парадигма была подтверждена у некоторых GPCRs (к примеру, у ангиотензиновых GPCRs), но еще не подтверждена у μ-опиоидных рецепторов. Ученые предполагают, что если такой механизм свойственен одному виду GPCRs, то и на другие системы он распространяется [11–14]. Можно попытаться предположить, что внутриядерные процессы, реализуемые через МАР-киназный каскад, приводят к следующим изменениям: после внутриядерных процессов, опосредуемых через МАР-киназы, происходит экспрессия определенных молекул, которые регулируют ионные обменники, преимущественно затрагивая калиевые и кальциевые каналы. Так реализуются все последующие эффекты в организме, о которых упоминалось, — через активацию калиевых и ингибирование кальциевых каналов [14], [15]. Необходимо, чтобы произошел выход большого количества калия из клетки согласно концентрационным градиентам, после чего возникает гиперполяризация мембраны. Такое состояние также называют тормозным постсинаптическим потенциалом. Очевидно, что в это время клетка не способна к генерации потенциала действия и проведению импульсов. Происходит торможение тех процессов, в которых данная клетка принимает участие. Так и реализуется эффект обезболивания (клетка не способна ответить на активирующие импульсы от различных нейропептидов, отвечающих за проведение болевых импульсов), эффект угнетения дыхания, возникновение запоров из-за угнетения перистальтики в желудочно-кишечном тракте.
Кроме того, доподлинно известно, что угнетение дыхания частично реализуется через калиевые каналы внутреннего выпрямления (IRK). Опыт по исследованию эффекта от систематической инфузии опиоидов мышам с отсутствием IRK показал, что в итоге опиоид все равно привел к снижению частоты дыхания и последующему его угнетению. Это показывает, что все-таки реализация эффектов сложнее, чем все думали, и требует изучения. Возможно, эти механизмы связаны с G-протеин-независимыми сигнальными каскадами, впервые предположенными в исследованиях с β-аррестин-лишенными мышами, о которых говорилось ранее [14]. При подобном сценарии устранение β-аррестина или ослабление афинности молекулы рецептора по отношению к нему может нивелировать путь передачи сигнала и последующий биологический ответ. Собственно, преимущественно на основе этой гипотезы и была получена новая лекарственная молекула PZM21. О ней мы поговорим позже.
Вторая гипотеза связана с тем, что β-аррестин действует в разных подтипах μ-рецепторов (μ1 и μ2) по-разному. Воздействие лиганда на μ1-рецептор приведет к возникновению обезболивающего эффекта, а взаимодействие лиганда с μ2-рецептором приведет к развитию побочных эффектов. Логичным для ученых кажется, что, соответственно, μ1-рецепторы расположены в нервной системе (например, в околопроводном сером веществе, ретикулярной формации), а μ2-рецепторы расположены в тех областях, побочные эффекты в которых они вызывают. Например, угнетение дыхательного центра связано с расположением μ2-рецепторов в дыхательном центре. Эта гипотеза в настоящее время считается недостаточно достоверной и требует исследования [11], [13]. Но все же авторы статей даже в 2016 году упоминают ее (хотя эта гипотеза существует уже более 30 лет без 100-процентной доказательной базы), поэтому и мы все еще верим в ее реализацию на практике [14].
Третья гипотеза утверждает, что β-аррестин воздействует через другие рецепторы, т.е не через GPCRs. Например, на серотониновые рецепторы 5-HT4, влияя на их активность в нейронах комплекса PBC (pre-Bötzinger complex). Под этим комплексом понимается скопление нейронов в вентролатеральной области продолговатого мозга. В совокупности они отвечают за генерацию ритма дыхания. Соответственно, влиянием на данный комплекс реализуется эффект угнетения дыхания. Были проведены исследования, в которых ученые показали, что больше половины всех 5-HT4-рецепторов в PBC-комплексе взаимосвязаны с опиатными μ-рецепторами в этом же комплексе. Данные рецепторы, по пока не объясненному учеными механизму, способны выступать как антагонисты. Активируется μ-рецептор — антагонистически угнетается деятельность 5-HT4-рецепторов. Итогом каскада последующих событий является эффект угнетения дыхания. Для проверки этой гипотезы были проведены исследования агонистами 5-HT4-рецепторов. Их влияние на эти рецепторы приводило к снижению угнетения дыхания, вызванного опиоидами. Но при этом, что интересно, не было потери обезболивающего эффекта [11], [16].
Данная гипотеза объясняет лишь механизм одного побочного эффекта. При этом она, как и предыдущие гипотезы, всего лишь гипотеза, пока не имеющая 100-процентно достоверных доказательств. Следует уточнить, что ученые не сдаются и не довольствуются возникшим положением дел. Например, современные концепции утверждают, что действия ERK1/2 (о которых говорилось ранее в первой гипотезе) приводят в нейронах околопроводного серого вещества к угнетению толерантности к опиоидам [17]. Подобные исследования указывают на то, что механизм действия опиоидов не односложен. Каждый каскад сигналов, молекулярных путей, возможностей взаимодействия молекул важен и несет информацию, которая в совокупности даст нам полное понимание проблемы. Зная суть проблемы, мы сможем ее решить.
Есть ли решение?
Опиоидные анальгетики действуют так, что у больного человека, вынужденного их принимать, быстро формируются побочные эффекты. Это заставляет задуматься о целесообразности и законности применения опиоидов, что резко снижает их доступность для пациентов.
До недавнего времени опиоидные анальгетики, не имеющие пока альтернативы по своей эффективности обезболивать, были «головной болью» ученых и врачей. Предметом исследований была особая группа пациентов, для кого все возможные нежелательные проявления — лишь крупица по сравнению с болью, справиться с которой под силу только опиоидам. В мае 2016 года на второй российской конференции по поддерживающей терапии в онкологии один из докладчиков отметил, что, хотя опиоиды и являются препаратами выбора при терапии хронического болевого синдрома в интервале от средней до сильной боли, Россия все же находится на последнем месте по их медицинскому потреблению среди наркотических анальгетиков по сравнению с другими странами (Канада — 57,9%, США — 31,0%, Западная Европа — 34,2%, Восточная Европа — 4,2%, страны Балтии — 2,3%, Россия — 0,5%) [18]. Это связано как с законодательными аспектами, так и с многочисленными отрицательными факторами: частый прием (каждые 4 часа), быстрое развитие толерантности, необходимость частых визитов к врачу, трудность самостоятельного введения в домашних условиях, многократно упоминавшиеся побочные эффекты и др.
Можно надеяться, что если и не все, то большинство проблем в области применения опиоидных анальгетиков будут скоро решены. В 2016 году журнал Nature опубликовал статью «Structure-based discovery of opioid analgesics with reduced side effects», в которой описано интересное и важное исследование (рис. 6) [14]. Авторам удалось подойти ближе к решению давно неразрешимой, да и уже успевшей стать привычной, проблемы — создать наркотический анальгетик без побочных эффектов, свойственных этой группе препаратов. Путем длительных умственных и компьютерных изысканий ученые пытались найти подходящую молекулу.

Рисунок 6. Один из авторов статьи «Structure-based discovery of opioid analgesics with reduced side effects» — Аашиш Манглик. Ученый так описывает в соцсети свой круг интересов: «I am a physician-scientist with an interest in understanding human physiology from a biochemical perspective. I am particularly motivated to leverage recent advances in the understanding of G protein-coupled receptors to study and address various clinical diseases» («Я врач-ученый, стремящийся понять физиологию человека с биохимической стороны. Я особенно ориентирован на использование последних достижений в понимании сопряженных с G-белком рецепторов для изучения и лечения различных клинических заболеваний»).
Изначально было получено более трех миллионов молекул, конформационно подходящих под строение μ-рецептора. 2500 наилучших соединений затем проанализировали вручную на взаимодействие с ключевыми полярными участками активного центра рецептора. Из отобранных 23 молекул семь продемонстрировали наибольшее сродство к μ-рецептору. Самое высокоселективное соединение получило название PZM21 (запомните название — возможно, это будущая знаменитость!).
Данное вещество воздействует на опиоидный μ-рецептор следующим образом (рис. 7). Ранее говорилось о том, что β-аррестин присоединяется к активированному и фосфорилированному после последовательных реакций GPCR (μ-рецептору). Его присоединение обеспечивает дальнейший ход событий, итогом которых является возникновение побочных эффектов. Но PZM21 работает таким образом, что даже после фосфорилирования, активации и изменения конформации GPCR к рецептору не присоединяется β-аррестин. Это связано с изменением конформации самого μ-рецептора в пользу дальнейшей активации именно G-зависимого пути, через который не возникает побочных эффектов.

Рисунок 7. Синтезированное соединение PZM21 и взаимодействие его с опиоидным μ-рецептором. Сравнение конфигурации и активного взаимодействия PZM21 с TRV130 по отношению к μ-рецептору. Компьютерная модель, основанная на кристаллической структуре молекул.
Так, подтверждением вышесказанного стал опыт с присутствием сверхэкспрессируемых GRK2 (G-protein-coupled receptor kinase2). Это семейство серин/треонин-протеинкиназ, которые распознают и фосфорилируют агонист-активированные GPCRs. То есть фосфорилируют μ-рецептор после того, как к нему присоединится лиганд-опиоид [19]. Только этого момента и ждет β-аррестин, готовый «на всех парах» способствовать реализации побочных нежелательных эффектов. Но конформация μ-опиоидного рецептора изменяется так, что β-аррестин не способен с ним связаться. И в опыте было показано, что даже в условиях сверхэкспрессии GRK2 при максимальной концентрации PZM21 содержание β-аррестина по-прежнему остается низким. Вывод: при использовании PZM21 в качестве μ-опиоидного агониста происходит дальнейшее формирование цепи реакций не по пути β-аррестина, а по пути, связанному с G-белком. В итоге это приводит к позитивному терапевтическому эффекту (анальгезии), при чем нивелируются побочные эффекты в виде угнетения дыхания, снижения перистальтики в желудочно-кишечном тракте, физической и психической зависимости. Максимальный обезболивающий эффект PZM21 in vivo длился 180 минут и при этом без побочных эффектов. Интересным стало сравнение воздействий PZM21 и морфина. Так, при одинаковой дозе двух веществ PZM21 вызвал обезболивающий эффект у 87% мышей через 15 минут, морфин — у 92% мышей через 30 минут.
Авторы исследования делают все же акцент, что, возможно, некоторые столь положительные по сравнению с другими агонистами опиоидных μ-рецепторов эффекты возникли случайно, поэтому требуют дальнейших многочисленных испытаний. Кроме того, будет ли такой беспрецедентный положительный эффект сохраняться in vivo в условиях многообразия реакций и всех процессов жизнедеятельности человеческого организма. Каковы будут метаболизм, фармакокинетика и фармакодинамика такого препарата — для нас пока неизвестность.
Авторы исследования указывают, что источником их вдохновения явились предыдущие опыты поиска агонистов μ-рецепторов [14]. Например, в 2014 году была опубликована статья «Biased agonism of the μ -opioid receptor by TRV130 increases analgesia and reduces on-target adverse effects versus morphine: a randomized, double-blind, placebo-controlled, crossover study in healthy volunteers» [20]. Наблюдали 30 здоровых мужчин, из которых часть получала препарат вещества TRV130 (агонист μ-рецепторов), часть — плацебо, часть — морфин. Исследовались многочисленные показатели, включая безопасность, переносимость и обезболивающий эффект TRV130. Обезболивающий эффект препарата был прекрасный даже по сравнению с воздействием морфина, но вот угнетение дыхания, пусть и в меньшей мере, все же происходило. Плюс наблюдался ряд дополнительных побочных эффектов, например, тошнота [20].
В исследовании 2016 года ученые также сравнили «новоиспеченный» PZM21 с TRV130 и морфином на предмет угнетения дыхания. Выяснили, что морфин приводит к апноэ через 30 минут, TRV130 индуцирует временное, преходящее угнетение, в среднем, на 15 минут, а вот PZM21 не влияет на дыхательный ритм [14]. Даже если проблема побочных эффектов опиоидов и не будет решена, хочется, чтобы данное исследование послужило основой для дальнейших открытий. Особенно хочется, чтобы исследования касались не только фармакологических эффектов и синтезирования новых молекул, а уточнения вышеизложенных гипотез. Все же, читая современную статью, не хочется видеть фразу «механизм до конца не выяснен».
Выводы
К боли можно относиться по-разному: можно ее терпеть и пытаться победить согласно трактату Иммануила Канта «О способности духа силою только воли побеждать болезненные ощущения». Можно о ней философствовать и говорить словами Делии Гусман: «Нам бы следовало не бороться с болью, а скорее воспринимать ее как путеводный свет, как некий способ предостеречь нас и заставить пересмотреть наши поступки и скорректировать действия». Можно рассматривать боль, как некую функцию высокоорганизованной системы и защитную реакцию, но все это остается позади, когда ты чувствуешь ее сам или видишь, как чувствует ее кто-то другой. Необходимо бороться с болью, необходимо предпринять все возможные меры для того, чтобы облегчить человеку жизнь, улучшить ее качество. Теперь нам остается наблюдать за дальнейшими многочисленными клиническими испытаниями и исследованиями этого чрезвычайно интересного и важного открытия, возможно, ждать новых работ, связанных с блокированием воздействия β-аррестина, а, возможно, участвовать в открытиях самим. Все для того, чтобы человек, испытывающий боль, жил не по принципу графа Монте-Кристо «ждать и надеяться», а жил полноценной жизнью, насколько возможно включить все положительное в это понятие.
Статья написана в соавторстве с Серегиным Г. З.
Литература
- Рекомендации ВОЗ по медикаментозному лечению персистирующей боли у детей с соматическими заболеваниями. М.: Практическая медицина, 2014. — 208 с.;
- Муляр А.Г., Бунятян Н.Д., Саядян Х.С. Фармакология. Тверь: Триада-Х, 2010. — 432 с.;
- Глязер Г. Драматическая медицина. Опыты врачей на себе. М.: Молодая гвардия, 1965. — 216 с.;
- Opioid receptor. Сайт Chemeurope.com;
- Дегтярев В.П. и Будылина С.М. Нормальная физиология. М.: Медицина, 2006. — 736 с.;
- Snyder S.H. (1980). Brain peptides as neurotransmitters. Science. 209, 976–983;
- Коста Э. и Трабукки М. Эндорфины. М.: Мир, 1981. — 386 с.;
- Pert C.B., Kuhar M.J., Snyder S.H. (1976). Opiate receptor: autoradiographic localization in rat brain. Proc. Natl. Acad. Sci. USA. 73, 3729–3733;
- Mosińska P., Zielińska M., Fichna J. (2016). Expression and physiology of opioid receptors in the gastrointestinal tract. Curr. Opin. Endocrinol. Diabetes Obes. 23, 3–10;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Pattinson K.T.S. (2008). Opioids and the control of respiration. Br. J. Anaesth. 100, 747–758;
- Luttrell L.M. and Lefkowitz R.J. (2002). The role of β-arrestins in the termination and transduction of G-protein-coupled receptor signals. J. Cell Sci. 115, 455–465;
- Raehal K.M., Walker J.K., Bohn L.M. (2005). Morphine side effects in β-arrestin 2 knockout mice. J. Pharmacol. Exp. Ther. 314, 1195–1201;
- Manglik A., Lin H., Aryal D.K., McCorvy J.D., Dengler D., Corder G. et al. (2016). Structure-based discovery of opioid analgesics with reduced side effects. Nature. 537, 185–190;
- Zamponi G.W., Striessnig J., Koschak A., Dolphin A.C. (2015). The physiology, pathology, and pharmacology of voltage-gated calcium channels and their future therapeutic potential. Pharmacol. Rev. 67, 821–870;
- Manzke T., Guenther U., Ponimaskin E.G., Haller M., Dutschmann M., Schwarzacher S., Richter D.W. (2003). 5-HT4(a) receptors avert opioid-induced breathing depression without loss of analgesia. Science. 301, 226–229;
- Al-Hasani R. and Bruchas M.R. (2011). Molecular mechanisms of opioid receptor-dependent signaling and behavior. Anesthesiology. 115, 1363–1381;
- Руденко А.В. Организационно-экономические аспекты управления фармацевтической промышленностью при производстве наркотических средств: автореф. дис....канд. экон. наук. — Москва, 2003. — 23 с.;
- Jurado-Pueyo M., Campos P.M., Mayor F., Murga C. (2008). GRK2-dependent desensitization downstream of G proteins. J. Recept. Signal. Transduct. Res. 28, 59–70;
- Soergel D.G., Subach R.A., Burnham N., Lark M.W., James I.E., Sadler B.M. et al. (2014). Biased agonism of the μ -opioid receptor by TRV130 increases analgesia and reduces on-target adverse effects versus morphine: a randomized, double-blind, placebo-controlled, crossover study in healthy volunteers. Pain. 155, 1829–1835.