
Лаборатория на чипе: как изучить накопление антибиотиков в клетках бактерий
03 февраля 2021
Лаборатория на чипе: как изучить накопление антибиотиков в клетках бактерий
- 431
- 0
- 3
Микрофлюидный чип, изготовленный с помощью 3D принтера.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: «Вы, конечно, шутите, мистер Флеминг!» — наверное, так бы ответили первопроходцу в мир антибиотиков, если бы он предположил, каким образом люди будущего будут изучать его «случайное» открытие. И хотя в ХХI веке человечество чуть менее склонно удивляться достижениям технического прогресса, учёным из Великобритании есть что нам показать. А именно — комбинацию аутофлуоресцентной микроскопии и микрофлюидного чипа. Если вас всё же больше заинтересовала, чем напугала такая комбинация названий, присаживайтесь поудобнее, поездка будет увлекательной!
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Out of control
Через несколько десятков лет после того, как группа британских учёных во главе с А. Флемингом получила Нобелевскую премию «за открытие пенициллина и его лечебного эффекта при разнообразных инфекционных заболеваний» [1], и люди нашли способ спасти огромное количество жизней при помощи антибиотиков, мир столкнулся с новой проблемой — нарастающей резистентностью к антибиотикам бактерий. В действительности это можно назвать настоящей угрозой для человечества. Учёные прогнозируют рост смертей от неэффективного лечения противомикробными средствами уже к 2050 году в размере 10 млн потерянных жизней ежегодно. Звучит действительно устрашающе [2]. Но даже если не ждать, а проанализировать настоящее, мы увидим не самую приятную картину. Уже сейчас многие используемые ранее антибиотики попросту не работают. Не зря бактерии считаются одними из самых первых жизненных форм на Земле: в течение нескольких миллиардов лет они адаптировались к новым условиям жизни, переживали катаклизмы, входили в контакт с различными видами живых существ. Без шуток — выжившие! То, что мы видим сейчас — результат огромного эволюционного опыта, с которым в одно столетие не справиться. Более развернуто эта перспектива обсуждается в статье «Антибиотики и антибиотикорезистентность: от древности до наших дней» [3], к которой мы с удовольствием адресуем читателей.
Что же делать? Однозначного ответа, наверное, не даст никто. С одной стороны, разработка новых антибиотиков занимает в среднем больше десяти лет, а срок службы такого препарата — вполовину меньше, пока бактерии вновь не приобретут резистентность. С финансовой точки зрения такой подход весьма затруднителен. С другой же стороны, появляется всё больше альтернативных стратегий преодоления антибиотикорезистентности: от использования личинок насекомых до всеми любимой коры дуба [4], [5]. Что остаётся? Улучшать уже существующие препараты и методы изучения лекарственной устойчивости разных бактерий.
Исследование, о котором будет сказано в этой статье, было опубликовано в журнале Lab on a Chip в июне 2020 года [2]. Озадаченные проблемой неэффективности многих антибиотиков, объединившиеся учёные Великобритании предлагают подойти к вопросу разработки лекарств именно со стороны изучения процесса накопления антибиотиков в клетке и влияния их количества на резистентность бактерий. Предметом исследования стали грамотрицательная бактерия группы кишечных палочек E. coli , признанная одной из самых антибиотикорезистентных, и один из наиболее активных в отношении этой бактерии антибиотик — офлоксацин. Опираясь на знания о структуре клеточной стенки, влиянии питательного субстрата, а также динамике и фазе роста бактерий, британские учёные предложили новый метод — мощный инструмент, имеющий все шансы стать возможным решением общечеловеческой проблемы.
Рекомендуем всем ознакомиться со спецпроектом «Двенадцать модельных организмов», где даны прекрасные иллюстрации и подробная характеристика её величества E. coli [6] — Ред.
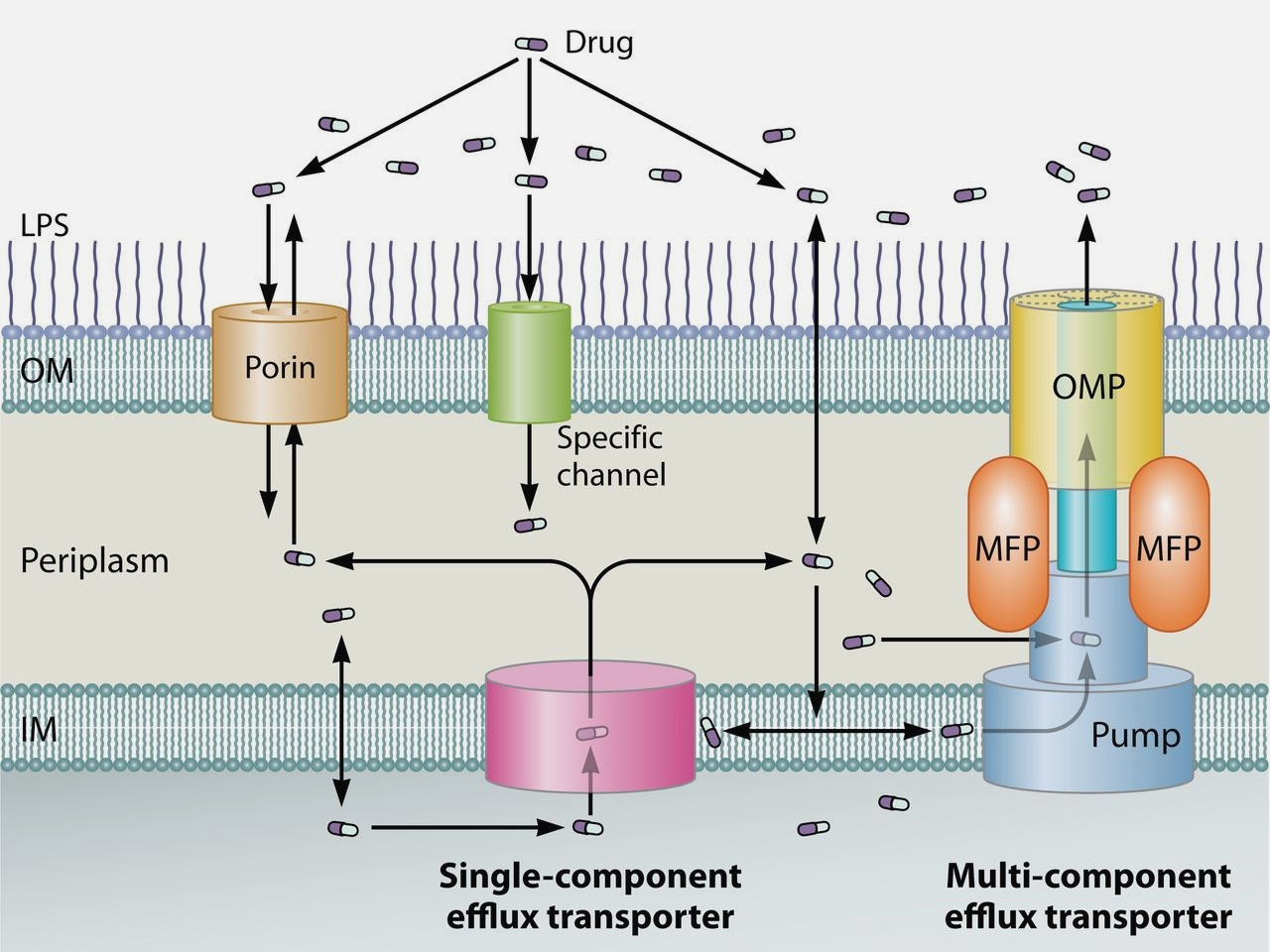
Рисунок 1. Схема транспорта антибиотика через клеточные оболочки грамотрицательных бактерий. Вход вещества в клетку осуществляется через порины, другие специфические белковые каналы или в местах, где липидный бислой асимметричен. Вывод вещества — с помощью эффлюксного отвода (различают однокомпонентные и многокомпонентные эффлюксные системы). Однокомпонентные эффлюксные системы после захвата лекарства из цитозоля и периплазмы транспортируют вещество за пределы клеточных оболочек — в основном при помощи поринов других белковых каналов. Многокомпонентные системы же, напротив, выводят лекарство из клетки напрямую, самостоятельно.
Mother-machine и полная иллюминация
Мать всех машин? И нет, вы не угадали, если подумали, что метал-группа Delain хочет спасти мир от апокалипсиса. «Mother-machine» — это название микрофлюидного чипа, разработанного для исследования старения, жизненного цикла клеток и влияния физико-химических аспектов на рост и целостность клеточной оболочки бактерии E. coli, который вместе с флюоресцентным микроскопом предстаёт главным блюдом на нашем сегодняшнем застолье.
Антибиотик офлоксацин был также выбран не случайно. Он относится к лекарственным веществам группы фторхинолонов, антибактериальное действие которых основано на угнетении активности ДНК-гиразы (фермента, регулирующего спирализацию молекулы ДНК). Проще говоря, проникая в клетку, офлоксацин начинает подавлять процессы, связанные с клеточным делением, и в конце концов приводит к гибели бактерии. Кроме того, поскольку цель данного исследования — определить количество поглощённого клеткой лекарства, а многие антибиотики из группы фторхинолонов флуоресцируют, офлоксацин — идеальный претендент [10].
Больше узнать об этом ферменте можно из статьи «Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова» [11].
Теперь углубимся в детали. Конструкция микрофлюидного устройства (чипа) представляет собой две герметично совмещённые пластины, внутри одной из которых находится основной посевной канал с тысячью маленьких боковых каналов — такое внутреннее строение ограничивает клеточное движение и позволяет изучать каждую клетку индивидуально. Функция другой пластины — защитная, поэтому её структура монолитна. Высота чипа 0,5–1 см, общий объем всех каналов — 150 нл (в этих каналах потом и будут находиться исследуемые клетки и офлоксацин) (рис. 2).
Данная конструкция сперва заполняется бычьим сывороточным альбумином для предотвращения налипания клеток на стенки каналов. В качестве питательной среды используется лизогенный бульон LB (стандарт для культивирования E. coli). После распределения питательной среды по всем каналам чип равномерно заполняется очищенными клетками (рис. 3). Следующий шаг — введение антибиотика. Он заполнит пространство внутри чипа и будет «омывать» клетки. Ток жидкости для промывания чипа, его заполнение питательными веществами и офлоксацином регулируют параллельные шприцевые насосы. Несомненные преимущества чипа — возможность быстро и детально анализировать одиночные клетки, строго контролировать состав среды, неограниченное время наблюдения, а также комбинация чипа с микроскопом. В итоге мы можем не только отличать клетки с разной концентрацией накопленного антибиотика, но и регулировать дозировку подаваемого лекарства [2], [12], [13].

Рисунок 3. Микрофотография фрагмента mother-machine. На фотографии видно, что в первую очередь бактерии проникают в основной посевной канал (концентрация клеток в нём больше) и со временем начинают заполнять боковые.
Итак, девайс готов, клетки внутри, что дальше? А дальше эстафету перенимает флуоресцентный микроскоп Olympus IX73. Благодаря комплексу возбуждающих фильтров, которые пропускают опредёленный диапазон излучения, и особому направлению света от светодиода в микроскопе, глаз или камера (как в нашем случае) фиксируют момент свечения молекулы (рис. 4). Сама по себе флуоресценция — это разновидность физического процесса люминесценции. Наблюдаемое излучение вызвано переходом электронов молекулы с одного энергетического уровня на другой. Сначала молекула поглощает энергию, переносимую светом, и её электроны переходят в возбуждённое состояние, которое длится в среднем 10−11–10−6 с, что говорит об их нестабильности в таком положении. Из-за неспособности удержаться на высоком энергетическом уровне электроны молекулы переходят на более низкий. Потеря энергии происходит в виде испускания квантов света (фотонов), чем и обусловлено видимое в микроскоп свечение молекулы [14], [15].
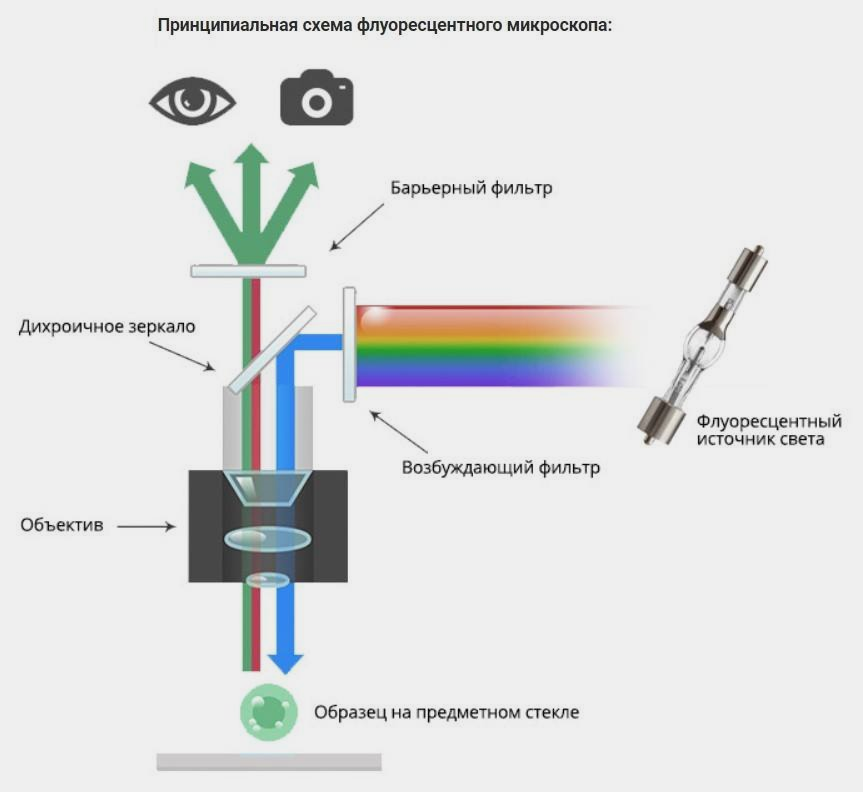
Рисунок 4. Принцип работы и направление движения лучей света внутри флуоресцентного микроскопа. Испускаемый источником света луч имеет опредёленную длину волны, которая отражается от дихроичного зеркала и попадает на исследуемый образец, поглощающий этот луч. Вслед за этим образец начинает светиться сам, испуская луч уже другой длины, что позволяет ему проходить в обратном направлении через дихроичное зеркало, не отражаясь. Барьерный фильтр же обрезает нужный нам спектр, который фиксируется камерой. В качестве источника света можно использовать ртутные лампы, лазеры или светодиоды. Подробнее о световой и, в частности, флуоресцентной микроскопии можно прочесть в материале «12 методов в картинках: микроскопия» [14].
В чём новизна использования комбинации микрофлюидного чипа «mother-machine» и аутофлуоресцентной микроскопии? Данный метод впервые позволяет анализировать накопление антибиотиков не на уровне популяции, а в индивидуальных клетках. Строение чипа предусматривает размещение и фиксацию клеток в ряд по отдельным каналам, а микроскоп позволяет отслеживать накопление офлоксацина в бактерии в реальном времени, что сокращает время получения результата в разы. Теперь, когда с технической стороной исследования всё понятно, предлагаю перейти от внешнего к внутреннему и разобраться в сути происходящего.
Расти или не расти?
В проведённом эксперименте популяцию E. coli разделили на две группы по признаку фазы роста. В первую группу отнесли клетки в стационарной фазе роста, во вторую — растущие и делящиеся. Также было выбрано несколько штаммов кишечной палочки, имеющих разные транспортные белки (порины) на внешней мембране. Целью было определить, только ли транспортные пути мембраны влияют на проникновение и накопление веществ в клетке, а если нет — может ли клеточный метаболизм влиять на ситуацию.
Загрузив клетки в чип, учёные начали вводить в него офлоксацин, одновременно контролируя его дозировку и накопление в клетках, опираясь на их флуоресценцию (с повышением концентрации антибиотика в окружении клетки увеличивалось и излучение рис. 5).
В эксперименте выяснилось, что активно растущие клетки флуоресцировали в три раза сильнее клеток, находящихся в стационарной фазе роста. Предположительно это можно объяснить уровнем ДНК-гиразы в клетке. Было выявлено, что с переходом из экспоненциальной фазы роста в стационарную снижается уровень ДНК-гиразы (гипотетически, данный фермент играет роль «приманки» для офлоксацина), чем объясняется менее яркое свечение клетки [2].
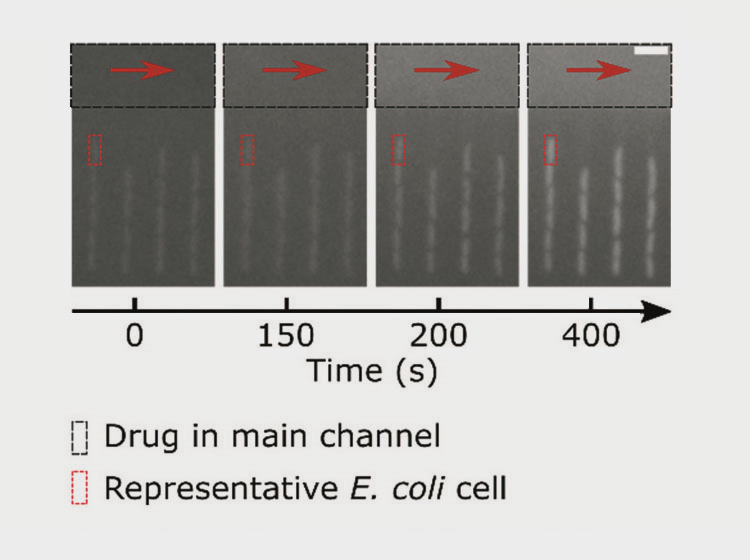
Рисунок 5. Клетки бактерий в боковых каналах микрофлюидного чипа. Флуоресцентное изображение получено с помощью камеры Evolve 512 EMCCD (Photometrics), которая одновременно с собственным запуском активировала светодиод микроскопа. Мы видим, как от первой картинки (секунда 0 — офлоксацин ещё не поступил в чип) к последней (400 секунд, где содержание офлоксацина 12,5 мкг/мл) вместе с концентрацией антибиотика увеличивается флуоресценция каждой клетки и окружающего пространства.
Также в ходе эксперимента обнаружилось, что штамм с удалённым транспортным белком (порином) OmpF на внешней мембране накапливал намного меньше антибиотика, чем штамм дикого типа (у него-то всё было на месте) в одинаковой фазе роста, что говорит о положительном влиянии данного белка на транспортировку лекарства внутрь клетки. Интересно и то, что даже с удалённым белком OmpF этот штамм в растущей фазе накопил больше офлоксацина, чем дикий штамм в стационарной фазе.
Подводя итог, можно однозначно ответить на два вопроса:
- Влияет ли фаза роста на количество антибиотика внутри клетки? — Да, влияет.
- Влияют ли определённые порины клетки на количество антибиотика? — Да, влияют, но в меньшей степени, чем фаза роста.
«Приятны завершённые труды»*
* — Гомер
Что же нам в конечном итоге даёт это исследование, как оно поможет в неравной борьбе с резистентностью бактерий, чем послужит для будущего? В действительности, данный эксперимент предлагает новую методику изучения накопления антибиотиков в бактериях, основанную на понимании роли метаболизма и строения клеточной оболочки. Использование комбинации микроскопа и чипа помогут быстрее тестировать микрофлору на чувствительность к антибиотикам, рациональнее подбирать лекарства, эффективнее разрабатывать препараты нового поколения или модернизировать процесс тестирования уже существующих. Перед нами предстаёт намного более обширная и детальная картина взаимодействия клеток с веществом. Благодаря относительной простоте реализации данного метода уже сейчас врачи, клиники и фармкомпании могут сделать огромный шаг вперед. За счёт конструкции параллельных каналов в чипе становится возможным тестировать сразу несколько лекарств, проверять проницаемость отдельных патогенов разными видами антибиотиков в разных питательных средах и фазах роста. Также данный метод предусматривает использование очень низких дозировок лекарств, что потенциально может снизить экономические затраты на исследования.
А что касается нас, лучшее, что мы можем сделать в такое непростое время — вспомнить банальную истину: антибиотики — серьёзное лекарство, за которым нельзя бежать и сметать его с полок по наитию без рецепта врача! Помнить: здоровье нашего микромира зависит от нас. И непрерывно учиться, стараясь понемногу разбираться в происходящем вокруг и внутри нас.
Литература
- Победитель бактерий;
- Jehangir Cama, Margaritis Voliotis, Jeremy Metz, Ashley Smith, Jari Iannucci, et. al.. (2020). Single-cell microfluidics facilitates the rapid quantification of antibiotic accumulation in Gram-negative bacteria. Lab Chip. 20, 2765-2775;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Ju-Chi Chen, Muhammad Tanveer Munir, Florence Aviat, Didier Lepelletier, Patrice Le Pape, et. al.. (2020). Survival of Bacterial Strains on Wood (Quercus petraea) Compared to Polycarbonate, Aluminum and Stainless Steel. Antibiotics. 9, 804;
- Модельные организмы: кишечная палочка;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Пиневич А.В. Микробиология. Биология прокариотов. СПб: Издательство С-Петербургского университета, 2006. — 350 c.;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Jehangir Cama, Michael Schaich, Kareem Al Nahas, Silvia Hernández-Ainsa, Stefano Pagliara, Ulrich F. Keyser. (2016). Direct Optofluidic Measurement of the Lipid Permeability of Fluoroquinolones. Sci Rep. 6;
- Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова;
- Кухтевич И.В., Евстрапов А.А., Букатин А.С. Микрофлюидные устройства для исследований клеток. Наука, 2013. — 66–75 с.;
- Schwall C., Braeuninger-Weimer P., Martins B. The Green Mother Machine: A microfluidics device for cyanobacteria full application. Synthetic Biology in Cambridge, 2017.;
- 12 методов в картинках: микроскопия;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Xian-Zhi Li, Patrick Plésiat, Hiroshi Nikaido. (2015). The Challenge of Efflux-Mediated Antibiotic Resistance in Gram-Negative Bacteria. Clin. Microbiol. Rev.. 28, 337-418.









