
Кто живет во рту у медведя
25 сентября 2018
Кто живет во рту у медведя
- 670
- 0
- 1
Возможно, ключ к решению проблемы с повсеместной антибиотикорезистентностью заключается в колоссальном разнообразии микробиомов и входящих в их состав микроорганизмов
-
Автор
-
Редакторы
Недавно российско-американская группа ученых опубликовала результаты своей работы по изучению микробов, обитающих... во рту сибирского бурого медведя! Оказалось, что некоторые обитатели этого необычного места, а именно, бактерии вида Bacillus pumilus, выделяют антибиотик амикумацин А и сами защищаются от него весьма незаурядным способом. Это исследование крайне любопытно прежде всего с методической точки зрения, поскольку для выделения бактерий, продуцирующих антибиотик, был применен очень остроумный новый подход. Наша статья посвящена деталям этой интересной во всех отношениях работы.
Совсем недавно в престижном журнале Proceedings of National Academy of Sciences (USA) вышла статья исследователей из России и США [1], среди которых — специалисты Института биоорганической химии (а именно, лаборатории биокатализа, про которую «Биомолекула» уже рассказывала [2]), МГУ, Сколтеха и других организаций. Статья посвящена поиску антибиотиков, действующих против золотистого стафилококка, в необычном микробиоме, обитающем в ротовой полости бурого медведя. Ученым удалось не только найти такой антибиотик, но и продемонстрировать эффективность разработанного ими ранее нового метода, который позволяет выделять отдельные бактериальные клетки с определенными физиологическими свойствами. Что же это за метод и какие удивительные открытия он позволил совершить?
Один из перспективных аспектов исследований микробиомов — биологически активные вещества, которые выделяются разными видами микроорганизмов и регулируют взаимодействия между ними. Многие из них являются антибиотиками, поэтому исследование молекулярных механизмов взаимодействий между микробами чрезвычайно важно для медицины, особенно в свете всё более актуальной проблемы повсеместной устойчивости микробов к известным антибиотикам. На «Биомолекуле» в прошлом году вышел целый спецпроект, посвященный антибиотикам и устойчивости к ним.
Микробиомы из повседневно доступных источников, таких как почва и биологические жидкости человека, изучены сравнительно неплохо. Гораздо более интересны микробиомы необычных источников — например, слюны медведя (к слову, это уже не первая статья про метагеном медведя на «Биомолекуле» [11]!). Именно ее выбрали для поиска антибиотиков авторы новой статьи в PNAS. Целью исследования было обнаружение соединений, которые эффективно подавляют очень распространенную патогенную бактерию — золотистого стафилококка (Staphylococcus aureus). Любопытно, что, как показали в 2016 году, эффективный антибиотик против стафилококка синтезируют даже некоторые обитатели из носа человека [12].
Для выделения отдельных бактерий, подавляющих рост стафилококка, использовали ультравысокопроизводительную микрофлюидную капельную платформу (ultrahigh-throughput (uHT) microfluidic droplet platform). Суть метода примерно такова. Клетки стафилококка, синтезирующие зеленый флуоресцентный белок (GFP), и отдельные клетки бактерий из слюны заключали в маленькие капельки двойной эмульсии (вода в масле в воде). В тех капельках, куда попали бактерии, продуцирующие антибиотики против стафилококка, после совместной культивации флуоресценции GFP не будет. Далее капельки окрашивали по специальной методике, чтобы убедиться, что в капельках с ослабленной флуоресценцией GFP есть живые клетки, и сортировали при помощи проточной цитометрии. Содержимое отсортированных капелек секвенировали высокопроизводительными методами и анализировали с помощью биоинформатики . Платформа может обрабатывать 30 тысяч капелек в секунду, что позволяет производить очень глубокий и тщательный анализ бактерий, содержащихся в исследуемом образце (рис. 1).
Если вы хотите освежить в памяти принципы биологических методов, лежащих в основе работы микрофлюидной капельной платформы, вам помогут статьи на «Биомолекуле»: «Проточная цитофлуориметрия», «Секвенирование нуклеиновых кислот» и «„Cухая“ биология» [13–15].
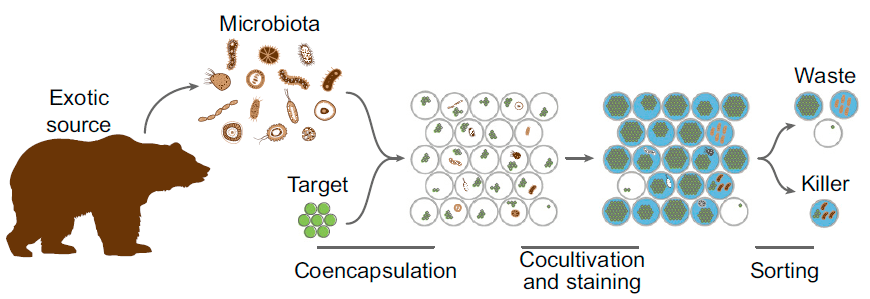
Рисунок 1. Основные этапы новой ультравысокопроизводительной методики. Индивидуальные клоны представителей микробиоты слюны медведя изолируются в капельки двойной эмульсии вместе с клетками золотистого стафилококка, экспрессирующими GFP. После совместной культивации отбираются капельки, содержащие живые клетки и имеющие низкий уровень флуоресценции в зеленом канале.
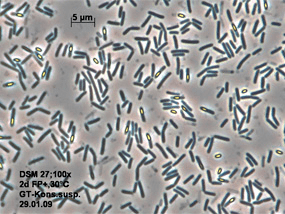
Рисунок 2. Клетки бактерии Bacillus pumilus, выделяющей амикумацин — антибиотик, подавляющий рост золотистого стафилококка
Оказалось, что наиболее эффективно рост стафилококка подавляли «медвежьи» бактерии определенного штамма Bacillus pumilus (рис. 2) [2]. Клетки этого штамма выделяют антибиотик амикумацин А, и, действительно, полногеномное секвенирование показало наличие в геноме штамма гены его биосинтеза. Известные бактерии, которые производят амикумацин, защищаются от него при помощи фермента AmiS — N-ацетилтрансферазы, инактивирующий этот антибиотик. Однако у B. pumilus гена AmiS не оказалось. Каким же образом эти бактерии защищаются от произведенного ими амикумацина? Выяснили, что ключевую роль в их защитном механизме играет фосфорилирование антибиотика: фосфорилированный амикумацин неактивен. В геноме B. pumilus обнаружили гены amiN и amiO, кодирующие киназу и фосфатазу соответственно. AmiN фосфорилирует внутриклеточный амикумацин и инактивирует его, а наружу выделяется антибиотик, дефосфорилированный фосфатазой AmiO.
Выделение дефосфорилированного амикумацина значительно зависит от окружающих условий: при ограниченной аэрации и отсутствии перемешивания среды клетки B. pumilus выделяют в 20 раз меньше амикумацина, чем в нормальных условиях. Дело в том, что для эффективного подавления размножения стафилококка необходимо образование биопленок из клеток B. pumilus, которые «запирают» клетки стафилококка в замкнутом пространстве. В условиях, когда рост стафилококка подавляется клетками B. pumilus, последние активно производят ферменты, связанные с синтезом пептидогликана (основного компонента клеточной стенки бактерий) и построением жгутика. Вероятно, ферменты, связанные с пептидогликаном, играют важную роль в образовании биопленок, а перестройки жгутика необходимы для сохранения подвижности клеток B. pumilus в условиях повышенной вязкости и «запирания» клеток стафилококка.
Какие бактерии, кроме стафилококка, чувствительны к амикумацину? Чтобы получить ответ на этот вопрос, клетки бактерий слюны медведя, а также фекалий здорового человека и пациента с колитом инкубировали в капельках, содержащих амикумацин. Оказалось, что многие представители микробиоты кишечника человека чувствительны к амикумацину, поэтому этот антибиотик можно использовать для регуляции состава кишечной микробиоты.
Как отмечает Станислав Терехов, научный сотрудник лаборатории биокатализа ИБХ и один из соавторов статьи в PNAS, в данном исследовании удалось изучить только антибиотики, продуценты которых легко культивируются: бактерии из многих капель, в которых рост стафилококка подавлялся, так и не удалось вырастить на питательной среде. В то же время ультравысокопроизводительная микрофлюидная капельная платформа позволила надежно детектировать многочисленные некультивируемые и медленнорастущие виды. Таким образом, последующий анализ геномов таких бактерий позволит в будущем использовать эту важную информацию для открытия новых антибиотиков. Авторы отмечают, что природный амикумацин довольно нестабилен, что резко ограничивает возможности его использования. По словам Станислава, возможным продолжением работы может стать синтез стабильных аналогов амикумацина, которые смогут найти практическое применение.
Литература
- Stanislav S. Terekhov, Ivan V. Smirnov, Maja V. Malakhova, Andrei E. Samoilov, Alexander I. Manolov, et. al.. (2018). Ultrahigh-throughput functional profiling of microbiota communities. Proc Natl Acad Sci USA. 115, 9551-9556;
- Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники;
- Зоопарк в моем животе;
- Чего от нас хотят микробы?;
- Новые функции кишечной микрофлоры;
- Микробиом кишечника: мир внутри нас;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Чем пахнет здоровье?;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- А кто живет у вас во рту?;
- Бурый медведь: сонный метагеном;
- Антибиотики прямо под нашим носом;
- 12 методов в картинках: проточная цитофлуориметрия;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: «сухая» биология.






