
Кто придумал употреблять алкоголь? Испорченное общество или «традиция» длиною в миллионы лет
03 сентября 2019
Кто придумал употреблять алкоголь? Испорченное общество или «традиция» длиною в миллионы лет
- 1919
- 0
- 9
Сможет ли этот медленный лори съесть перебродивший плод?
коллаж автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Предложив милейшему медленному лори сходить в бар, вы с удивлением узнаете, что... Нет, это не начало какой-то выдуманной истории, просто это чудесное создание не прочь налечь на что-нибудь покрепче. Неужели у лори был неудачный день на дереве, или же это вполне обоснованный выбор? Сейчас мы и разберемся.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Сколтех» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Ничто в биологии не имеет смысла, кроме как в свете эволюции. Так, и тяга к такому противоречивому напитку, как алкоголь, имеет под собой вполне адекватную почву. Может быть, в какой-то момент стало выгодно потреблять такой хороший источник «быстрой» энергии, как этанол? Или же у наших предков просто не было выбора — умей метаболизировать ядовитый спирт или переставай кушать сладкие фрукты. Но когда же именно возникла способность усваивать этанол и можем ли мы извлечь из этой информации какую-либо практическую пользу? На эти вопросы можно ответить, изучив молекулярную эволюцию ферментов, участвующих в метаболизме спиртов.
Молекулярная эволюция — процесс изменения биомолекул (ДНК, РНК, белков) в череде поколений живых организмов. Изучение молекулярной эволюции тесно связано с такими дисциплинами, как палеонтология, генетика, молекулярная биология, математика и информатика. На основании данных о молекулярной эволюции можно построить филогенетическое дерево, наглядно показывающее степень родства между разными организмами, моменты появления и изменения определенных признаков и т.д. (подробнее об этом можно узнать в статье «Как прочитать эволюцию по генам?» [20]).
Коротко о метаболизме этанола
Для начала необходимо понять, происхождение каких ферментов нам предстоит рассмотреть. Для этого коротко опишем метаболизм этанола в норме.
Усвоение этанола у человека начинается прямо в слизистой желудка при участии фермента АДГ4 (НАД+-зависимой алкогольдегидрогеназы 4 класса), причем вклад этого процесса является достаточным для того, чтобы считать его частью пресистемного метаболизма этанола [1], [2].
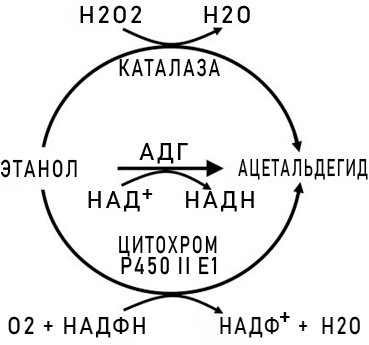
Рисунок 1. Схема метаболизма этанола при помощи цитохрома P450 II E1, каталазы и АДГ. На данный момент у человека идентифицировано целых 5 классов АДГ и три изоформы АДГ первого класса. Номенклатура основывается на гомологии аминокислотных последовательностей, каталитических свойствах ферментов и содержании мРНК, кодирующей АДГ, в различных органах и тканях. Субстратная специфичность АДГ различных классов имеет существенные различия: не каждый фермент может метаболизировать этанол, а наибольшей активностью обладают АДГ1 и АДГ4 (см. табл. 1).
Следующий и основной этап — окисление этанола в печени. За это ответственна АДГ1 со всеми ее изоформами (альфа, бета и гамма), способными образовывать гомо- и гетеродимеры, в форме которых они и проявляют свою активность.
Существуют также и другие окисляющие этанол ферменты: изофермент Р450 II E1, играющий значительную роль только при хроническом алкоголизме, и каталаза, расщепляющая только около 2% алкоголя.
Сама реакция в упрощенном виде выглядит следующим образом — рисунок 1.
| Класс АДГ | Преимущественная локализация | Окисление этанола | Окисление других веществ | Участие в метаболизме других соединений |
|---|---|---|---|---|
| 1 | Печень | Да | Длинноцепочечные алифатические и ароматическиеспирты, диолы, гераниол, фарнезол, метанол (медленно), омега-оксижирные кислоты | Катаболизм норадреналина серотонина, синтез ретиноидов, влияние на интенсивность синтеза холестерина |
| 2 | Печень | Да, но только при высоких концентрациях | Длинноцепочечные алифатические и ароматические спирты, бензохиноны | Катаболизм норадреналина серотонина, синтез ретиноидов |
| 3 | В большинстве органов | Нет | Длинноцепочечные алифатические и ароматические спирты, формальдегид | Участие в переносе однонуклеотидных фрагментов |
| 4 | Слизистая желудка | Да | Длинноцепочечные спирты | Наибольшее среди остальных АДГ участие в синтезе ретиноидов |
В ходе окисления этанола образуется очередное токсичное соединение — ацетальдегид, окисляющийся до уксусной кислоты АЛДГ (НАД+-зависимой ацетальдегиддегидрогеназой), которая в организме представлена цитозольной и митохондриальной изоформами. В меньшей же степени в окислении участвует фермент АО (ФАД-зависимая альдегидоксидаза).
Таким образом, чтобы отследить момент, когда же все-таки наши предки приобрели возможность усваивать этанол, можно посмотреть на филогению видов, в которых присутствовали ферменты АДГ и АЛДГ.
Родословная ферментов
Предковой формой всех АДГ является АДГ3, почти не проявляющая активности относительно этанола. Она есть у позвоночных, беспозвоночных, растений и даже прокариот. АДГ3 дает начало всем остальным АДГ (рис. 2) [4].
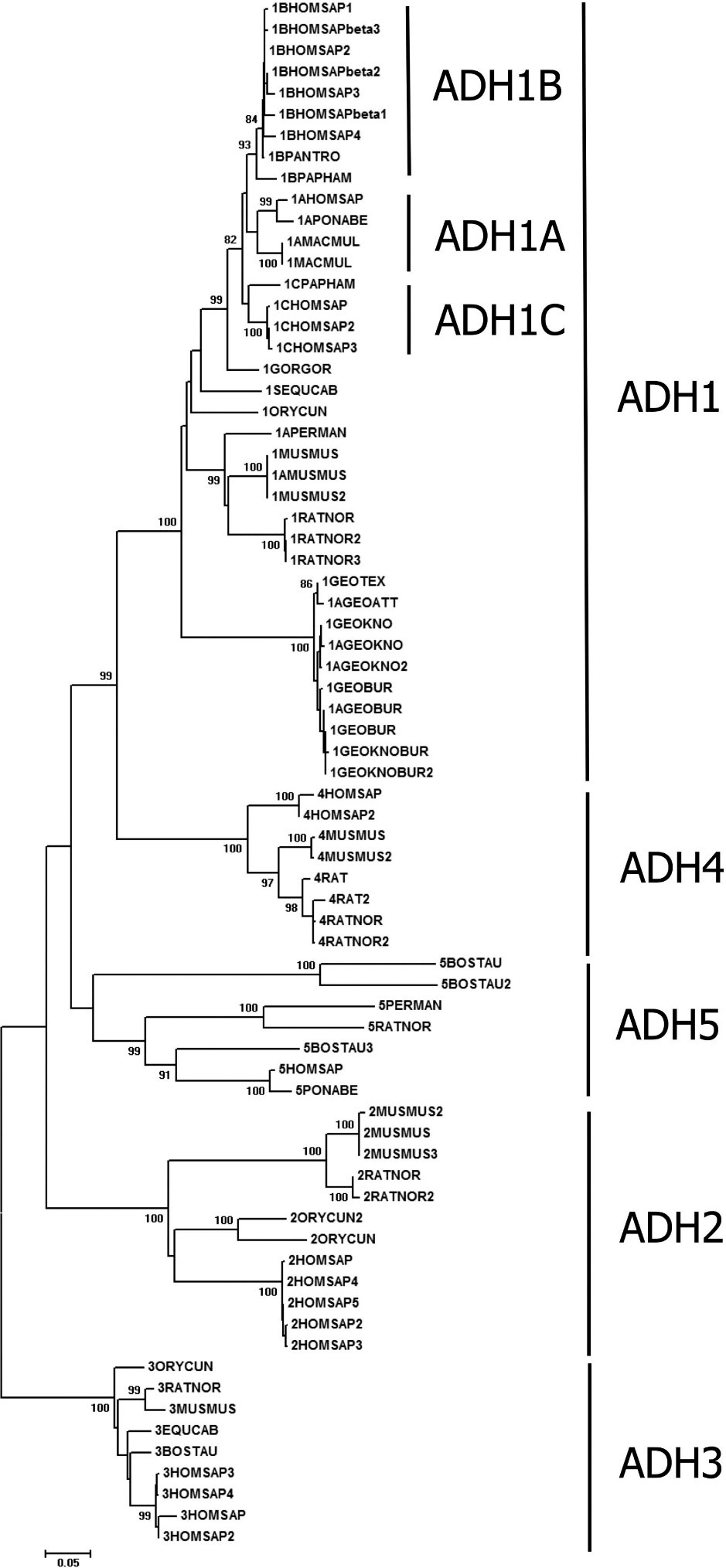
Рисунок 2. Филогенетическое дерево АДГ млекопитающих, полученное с помощью алгоритма присоединения соседей. Как видно на рисунке, АДГ1 имеет субкластеры (АДГ1A, АДГ1B, АДГ1C), соответствующие различным субъединицам. Ветвь АДГ4 расположена близко к АДГ1 — предполагается, что она возникла вследствие дупликации гена фермента АДГ1.
Теперь посмотрим, для кого же родным субстратом является этанол, и начнем с первого этапа метаболизма — с АДГ4. Используя гены 28 млекопитающих, включая 17 приматов, исследователи составили филогенетическое дерево протяженностью около 60 миллионов лет, где разветвления показывали момент изменения последовательности аминокислот в АДГ4 [5].
Последовательности для такого палеогенетического исследования можно брать из публичных баз данных, например, NCBI (National Center for Biotechnology Information) или Ensembl. Также они могут быть получены с помощью ПЦР (полимеразной цепной реакции) с обратной транскрипцией на основе мРНК или геномной ДНК, выделенной из хорошо сохранившейся ткани. Все это использовали авторы рассматриваемой статьи [5] (подробнее о ПЦР советую почитать «12 методов в картинках: полимеразная цепная реакция» [21]). Далее, чтобы «получить на руки» предковые ферменты и изучить их свойства, нужные гены клонировали в вектор, затем проводили трансформацию, то есть захват полученной плазмиды бактериальной клеткой, в которой затем экспрессировали нужные ферменты (подробнее об этом можно узнать в статье «Молекулярное клонирование, или Как засунуть в клетку чужеродный генетический материал» [22]).
Оказалось, что, несмотря на довольно раннее появление АДГ4 у приматов, активность относительно этанола она приобрела только спустя пару миллионов лет (рис. 3).
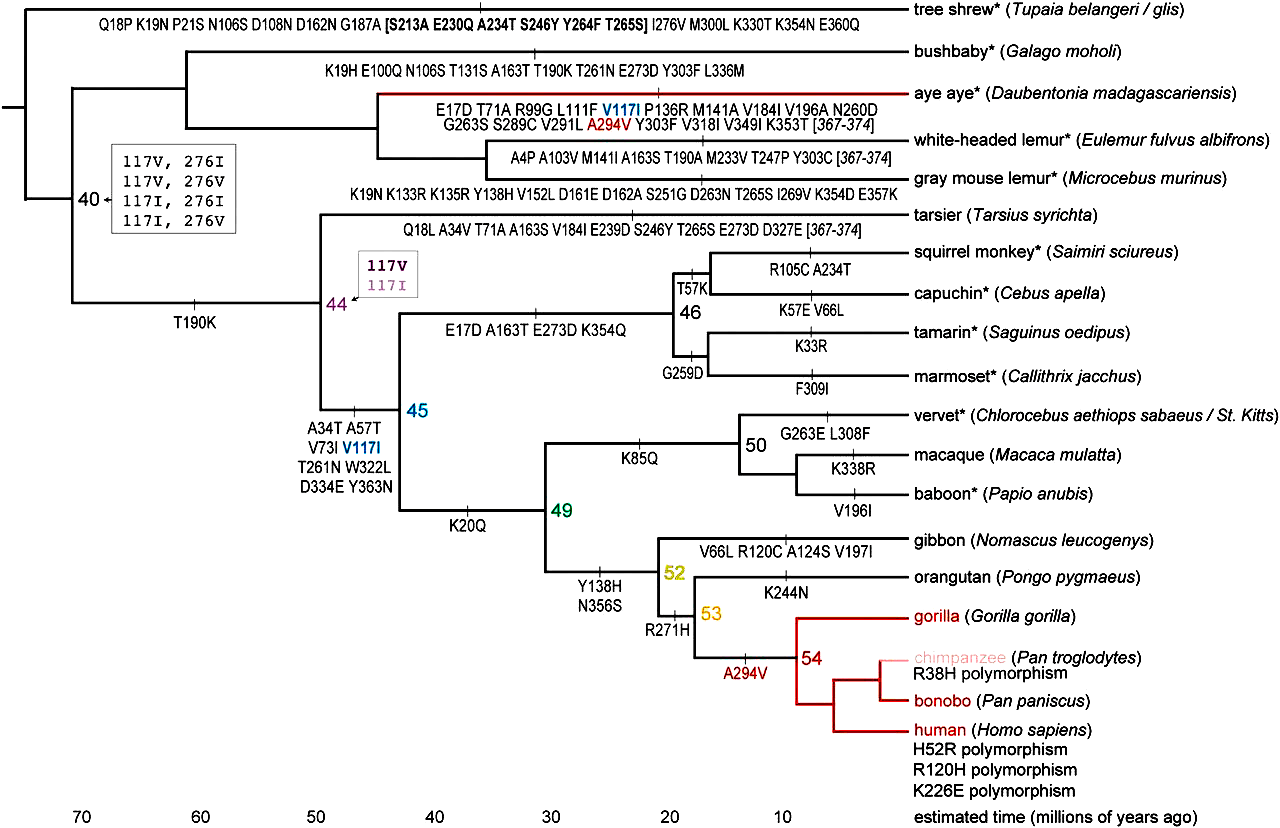
Рисунок 3. Филогения последовательностей АДГ4. Вдоль ветвей показаны изменения в последовательности аминокислот, узлы представлены предковыми формами АДГ4. На оси абсцисс отмечено приблизительное время в миллионах лет. Неопределенности в узлах заключены в серые рамки: например, последовательность в узле 44 содержала одну неоднозначность в сайте 117 (апостериорные вероятности для этого сайта составляли 86% для валина и 14% для изолейцина). Все неоднозначные версии наследственных белков были воссозданы, и оказалось, что они имеют сходные кинетические свойства. Синий и красный текст под ветвями — это гомоплазии, общие для линий мадагаскарской руконожки (лат. Daubentonia madagascariensis) и гоминин. Ветви дерева красного цвета указывают на активность ферментов относительно этанола. Ветвь, ведущая к шимпанзе, имеет розовый цвет, говорящий о том, что полиморфизм R38H (замена аргинина на гистидин в 38 положении) является частым среди обыкновенных шимпанзе, и влияние этого полиморфизма неизвестно.
Большая часть наших предков уж точно была трезвенниками. Однако после отделения линии орангутана (лат. Pongo pygmaeus) от линии, ведущей к человеку, ситуация резко изменилась: одна замена аланина на валин в 294 позиции — и АДГ4 становится в целых 40 раз более активным относительно этанола. Кстати, если внимательно посмотреть на картинку выше, то можно заметить, что точно такая же замена есть и у мадагаскарской руконожки ай-ай (лат. Daubentonia madagascariensis). Остальных же животных приглашать в бар строго не рекомендуется.
Считается, что закрепление подобной мутации было связано с миоценовым похолоданием, вследствие которого значительно сократились площади тропических лесов и увеличились площади саванн. Это привело к массовому вымиранию подавляющего большинства гоминоидов, однако часть из них перешла к наземному образу жизни, и в их рационе появились забродившие фрукты (рис. 4) [6].
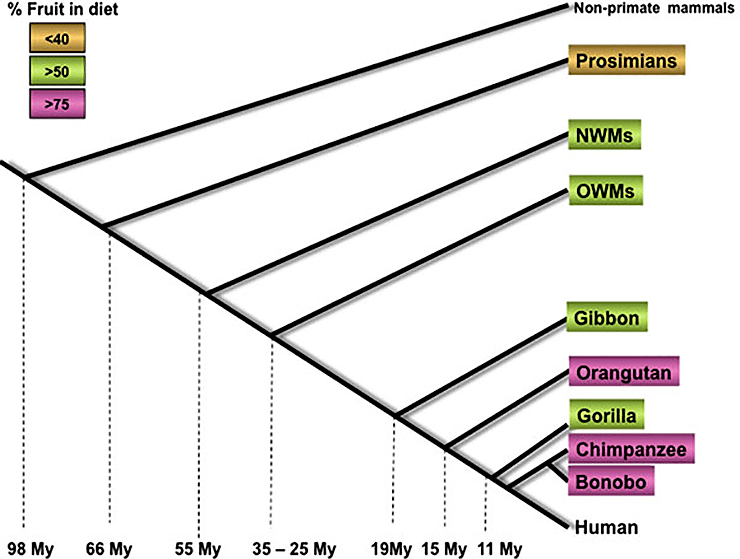
Рисунок 4. Приблизительное время расхождения приматов и увеличение количества фруктов, употребляемых в пищу. My (Million years) — миллионы лет; NWMs (New World Monkeys) — обезьяны Нового Света; OWMs (Old World Monkeys) — обезьяны Старого Света.
Мы разобрались с первым этапом усвоения алкоголя при помощи АДГ4, однако он вносит меньший вклад в метаболизм этанола сравнительно с его биотрансформацией в печени с участием АДГ1.
АДГ1 представлена в организме человека в виде трех субъединиц — альфа, бета и гамма, формирующих гомо- и гетеродимеры, однако так было не всегда. Предполагается, что эти формы возникли вследствие генной дупликации 44–70 миллионов лет назад. Более того, существует гипотеза, что количество генов в кластере АДГ1 зависит от количества употребляемых приматами фруктов (рис. 5) [7].
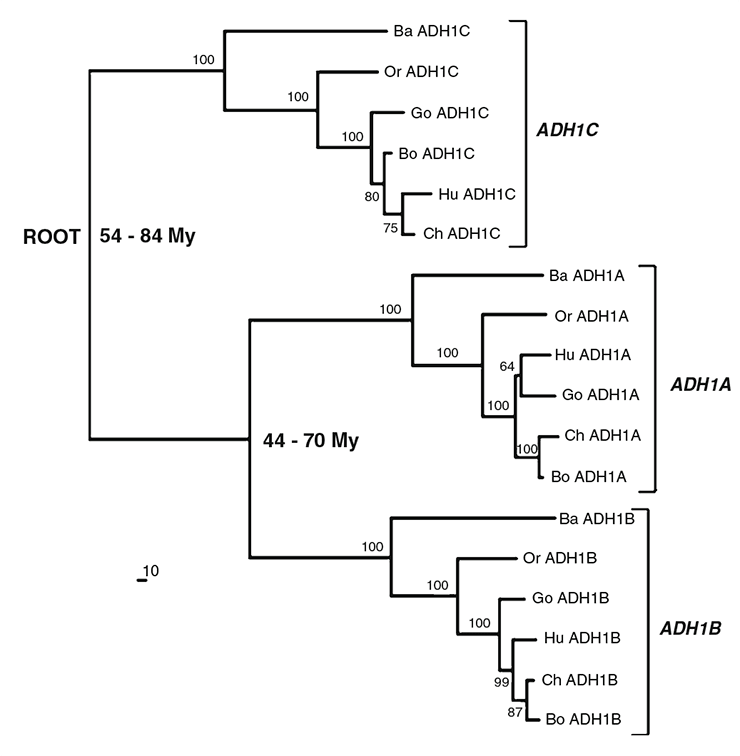
Рисунок 5. Филогенетическое дерево происхождения субъединиц АДГ1, построенное с помощью метода максимального правдоподобия. Hu (Human, лат. Homo sapiens) — человек; Bo (Bonobo, лат. Pan paniscus) — бонобо; Ch (Chimpanzee, лат. Pan troglodytes) — шимпанзе; Go (Gorilla, лат. Gorilla gorilla) — горилла; Or (Orangutan, лат. Pongo pygmaeus) — орангутанг; Ba (Baboon, лат. Papio hamadryas) — бабуин; ROOT — корень.
Несмотря на то, что в этом вопросе еще нет абсолютной определенности, с некоторой долей уверенности можно говорить, что как минимум 10 миллионов лет назад приматы научились метаболизировать этанол, превращая его в ацетальдегид. Что же касается самого ацетальдегида — его биотрансформация в уксусную кислоту была доступна уже очень давно (рис. 6) [8].
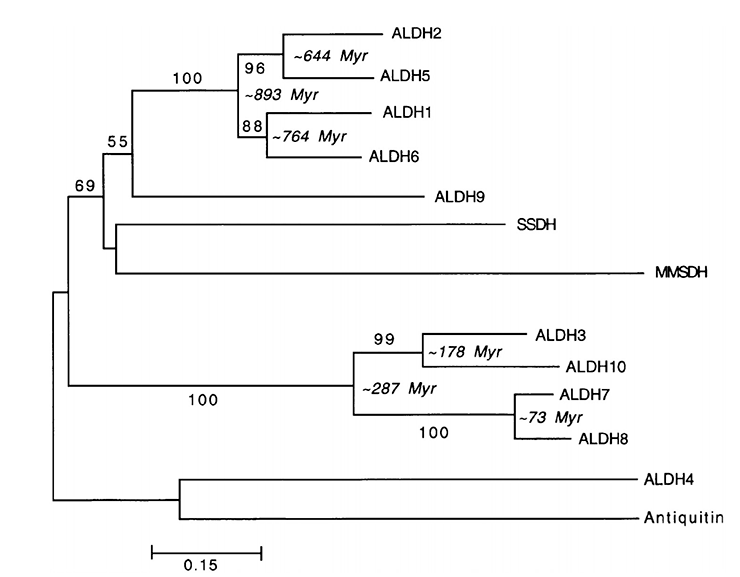
Рисунок 6. Филогенетическое дерево, построенное с помощью метода присоединения соседей (для построения использовали гены АЛДГ двенадцати людей). Время дивергенции оценивали с помощью алгоритма линеаризации, основанного на аминокислотных последовательностях АЛДГ нескольких видов млекопитающих.
Таким образом, употребление этанолсодержащих продуктов оказывается настолько древним занятием, что теперь каждый человек и даже вышеупомянутый медленный лори может назвать это традицией.
Более того, некоторые животные не только могут метаболизировать этанол, но и предпочитают его большую дозу в пище. В исследованиях медленных лори и мадагаскарской руконожки ай-ай (той самой, сидящей на отдельной филогенетической ветке на рис. 3) слепой рандомизированный эксперимент показал, что, выбирая среди жидкостей, имитирующих нектар, с содержанием этанола от 0 до 5% животные с большей частотой выбирали крепкие напитки (рис. 7) [9]
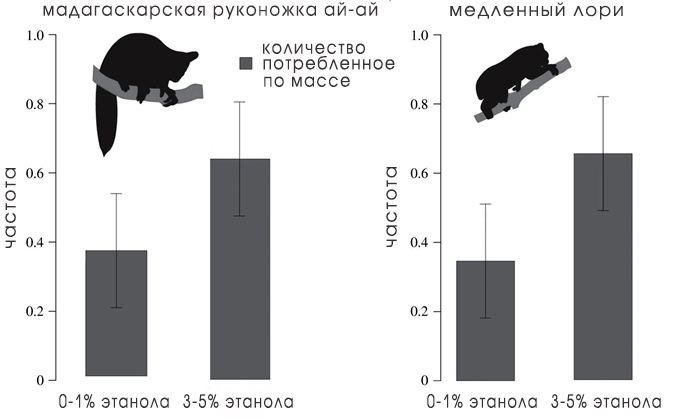
Рисунок 7. Гистограмма, показывающая, что мадагаскарские руконожки ай-ай и медленные лори предпочитают более высокие концентрации этанола в жидкостях, имитирующих нектар
Но какую же пользу можно извлечь из изучения всех этих ферментов и кодирующих их генов? Оказывается, внутри самой человеческой популяции не все так однозначно — у некоторых народов ферменты работают несколько иначе, что выливается в довольно занятные для исследования фенотипы.
Все люди разные
Как уже было сказано, для человека характерно пять классов АДГ, и они кодируются семью генами, находящимися на четвертой хромосоме (рис. 8) [10].
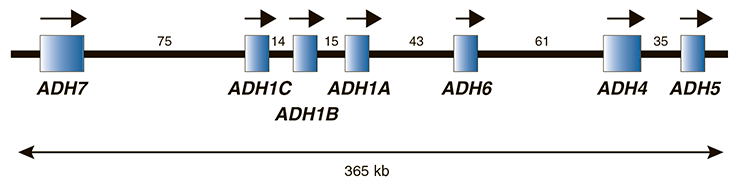
Рисунок 8. Относительный размер и расположение генов семи АДГ на длинном плече четвертой хромосомы. Показаны в той последовательности, в которой они транскрибируются (стрелки), но противоположно их ориентации на хромосоме. Расстояния между генами показаны в тысячах пар нуклеотидов (килобазах — kb).
Сравнение человеческих геномов показывает частую встречаемость однонуклеотидных полиморфизмов в генах АДГ. Точечная мутация, значимо меняющая аминокислотную последовательность, — и ваш фермент имеет уже иные кинетические характеристики. Например, среди азиатов нередко встречается аллельная форма гена АДГ1В — АДГ1В*2, экспрессия которой формирует уже новую, бета2, субъединицу фермента с заменой на гистидин в 42 положении. А вот для населения Африки характерен аллель АДГ1В*3, кодирующий субъединицу бета3 с заменой на цистеин в положении 370. В обоих случаях это приводит к появлению фермента со значительно бóльшим числом оборотов — примерно в 70–80 раз. Также существуют три аллеля гена АДГ1С (табл. 2).
| Название гена | Отличие в аминокислотах | Название протеина | Константа Михаэлиса (этанол), мМ | Число оборотов (мин–1) |
|---|---|---|---|---|
| АДГ1А | альфа | 4,0 | 30 | |
| АДГ1В*1 | Арг48, Арг370 | бета1 | 0,05 | 4 |
| АДГ1В*2 | Гис48, Арг370 | бета2 | 0,9 | 350 |
| АДГ1В*3 | Арг48, Цис370 | бета3 | 40 | 300 |
| АДГ1С*1 | Арг272, Иле350 | гамма1 | 1,0 | 90 |
| АДГ1С*2 | Глн272, Вал350 | гамма2 | 0,6 | 40 |
| АДГ1С*352Тре | Тре352 | — | — | — |
| АДГ4 | пи | 30 | 20 | |
| АДГ5 | хи | >1000 | 100 | |
| АДГ6 | АDH6 | ? | ? | |
| АДГ7 | сигма | 30 | 1800 |
Было установлено, что разные комбинации этих аллелей могут как увеличивать этанолокисляющую способность фермента АДГ1 в несколько раз, так и уменьшать ее на несколько десятков процентов (однако нужно дополнительно учитывать индивидуальные характеристики — уровень экспрессии генов, размер печени и т.д.).
Так, многим известно, что значительная часть восточных азиатов (китайцев, тайваньцев, японцев и корейцев) имеет «непереносимость алкоголя». Это состояние даже называют Asian Flush («азиатский румянец»). Считается, что аллель АДГ1B*2, имеющий высокую встречаемость среди восточных азиатов, препятствует развитию алкоголизма: фермент работает очень быстро, в организме накапливается много ацетальдегида, что приводит к неприятным последствиям, к которым мало кому хотелось бы вернуться. Интересно, что также среди восточных азиатов часто встречается вариант гена АЛДГ2 (кодирует митохондриальную АЛДГ) — АЛДГ2*2, — экспрессия которого ведет к возникновению белка с заменой лизина на глутамин в 504 позиции, в результате чего фермент становится практически неактивным по отношению к ацетальдегиду. Более того, данный аллель является доминантным, следовательно, даже единственный его экземпляр обрекает человека на неприятное похмелье после употребления относительно небольших доз алкоголя (один дринк или меньше) (рис. 9) [11].

Рисунок 9. Непереносимость алкоголя у молодого азиата (гетерозигота). Слева — до употребления алкоголя; справа — после. Другие симптомы включают в себя головокружение, учащенное сердцебиение, головную боль, ухудшение зрения, спутанность сознания.
Кстати, аналогичная реакция возникает при терапии дисульфирамом, лекарственным препаратом, применяемым при лечении алкоголизма. Выступая в качестве ингибитора АЛДГ, он в комбинации с этанолом вызывает острую интоксикацию организма и, соответственно, имеет множество побочных действий вплоть до комы [12]. Конечно, такой серьезный побочный эффект, как кома, может возникнуть только у самых «целеустремленных» пациентов — которые не собираются отказываться от употребления алкоголя, несмотря на лечение. Обычно же отравление дает о себе знать достаточно быстро, что отбивает желание продолжать «торжество». Более того, пациент должен быть проинформирован обо всех рисках, связанных с терапией дисульфирамом, что может полностью отбить желание употреблять алкоголь.
Также есть и более изощренный подход — генная терапия. Если ввести с помощью вирусного вектора в клетки печени больного специфические малые РНК, образующие шпильки (shRNA), произойдет нокдаун гена АЛДГ2. При нокдауне гена путем РНК-интерференции снижается его экспрессия, следовательно, уровень АЛДГ в организме будет очень низким (кстати, об уже введенном в практику препарате, работающем на основе РНК-интерференции, можно узнать в статье «Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!» [23]) Предполагается, что генотерапия более эффективна в сравнении с терапией тем же дисульфирамом — симптомы интоксикации будут ярче и отвращение к алкоголю возникнет с более высокой вероятностью. На данный момент такой подход испытан только на клеточной культуре, где отлично себя показал, подавив экспрессию гена АЛДГ2 на целых 90% [13].
Что делать?
А как же тогда лечить алкоголизм? Ингибирование ферментов приводит к неприятным последствиям, которые могут навредить и так слабому здоровью людей, злоупотребляющих алкоголем.
Можно подойти с другой стороны и посмотреть, что предположительно повышает склонность человека к такого рода зависимостям. Для этого ученые часто ищут варианты генов среди выборки людей с определенным фенотипом, то есть производят полногеномный поиск ассоциаций. Так, выяснили, что главным кандидатом, играющим важную роль в формировании алкогольной зависимости, является OPRM1 — ген мю-опиоидного рецептора (подробнее о том, где еще применяется полногеномный поиск ассоциаций, можно почитать в теме о GWAS на «Биомолекуле»). Однонуклеотидный полиморфизм и здесь сыграл свою роль — аффинность бета-эндорфина к этому рецептору возросла в три раза, а также увеличились субъективные эффекты, вызываемые алкоголем.
Таким образом, люди с данным полиморфизмом испытывают большее «удовольствие» от употребления алкоголя и, соответственно, имеют увеличенную вероятность развития алкоголизма. Для терапии в этом направлении в 2010 году на рынок вывели препарат налтрексон — неселективный антагонист опиоидных рецепторов (однако наибольшее сродство он имеет именно к мю-рецепторам). Предполагается, что механизм его действия заключается в подавлении подкрепляющих субъективных эффектов алкоголя. Однако, согласно свежему метаанализу, налтрексон имеет довольно скромный эффект в терапии алкогольной зависимости по сравнению с плацебо: относительный риск для пациентов вернуться к употреблению какой-либо дозы алкоголя составляет 0,96, в то время как риск возвращения пациента к употреблению больших доз — 0,83 [14]. Исследования показывают, что люди с олигонуклеотидным полиморфизмом в гене опиоидного рецептора несколько лучше поддаются лечению [15].
Относительный риск (relative risk) представляет собой частное от деления экспериментальной вероятности возникновения события (experimental event rate) на вероятность возникновения события в контрольной группе (control event rate). В данном случае мы находим отношение вероятностей возвращения пациента к употреблению алкоголя в экспериментальной группе (той, где производится терапия налтрексоном) и аналогичной вероятности в группе контрольной (там, где участникам дают плацебо).
Другие виды лекарств, связанные с терапией алкоголизма, смотрите в таблице 3:
| Лекарство | Механизм действия | Комментарии |
|---|---|---|
| Дисульфирам | Ингибитор АЛДГ | Обладает гепатотоксичностью, применение может иметь тяжелые последствия |
| Налтрексон | Антагонист опиоидных рецепторов | Может вызвать синдром отмены |
| Налмефен | Антагонист опиоидных рецепторов | Может вызывать синдром отмены |
| Акампросат | Модулятор NMDA- и ГАМКА-рецепторов | В терапии сопоставим с налтрексоном |
| Баклофен | Агонист ГАМКВ-рецепторов | Ведутся исследования по увеличению дозировки и изучению побочных эффектов |
| Топирамат | Антиконвульсант | Эмбриотоксичен |
Таким образом, сегодня не существует лекарств, обладающих и достаточной эффективностью, и не такими серьезными побочными эффектами. Лечение алкоголизма по большей части заключается в работе над собой самого пациента и поддержке специалистов и окружающих, ведь статистически такой человек часто имеет дополнительные психологические проблемы, например, СДВГ (синдром дефицита внимания и гиперактивности) или большое депрессивное расстройство [17]. Исследования показывают, что психотерапевтические подходы (как медикаментозные, так и немедикаментозные, например, когнитивно-поведенческая психотерапия) показывают клинически значимые результаты в терапии алкогольной зависимости на фоне дополнительных психологических проблем [18].
Ну, и еще по одной!
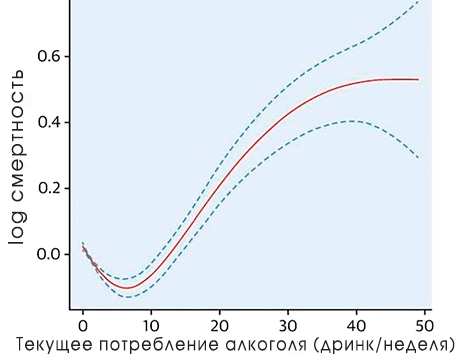
Рисунок 10. Классическая J-образная кривая более низкой смертности умеренно пьющих людей. Считается, что исследования, где получались такие кривые, являются методологически неверными (подробнее в тексте).
Употребление этанола является очень древним и эволюционно обоснованным занятием, однако пить или не пить — вопрос сугубо личный. В принципе, каждый человек может заблаговременно генотипировать себя и решить, стоит ли ему придерживаться описанной многолетней «традиции». Более того, среди людей бытует мнение, что бокал красного вина в день — это чуть ли не обязательная привычка! Однако оно сформировалось на базе не очень чистых с точки зрения методологии исследований [19]. В них говорится о том, что «умеренно пьющие» люди имеют более низкую смертность в сравнении с трезвенниками и с теми, кто пьет алкоголь в больших количествах (рис. 10).
Однако часто оказывается, что так называемые трезвенники являются просто бывшими алкоголиками, а люди, злоупотребляющие алкоголем, поступают так в силу других серьезных заболеваний. Получается, что выборка в исследовании сформирована неверно, и опираться на эти результаты не стоит. При учете всех факторов, которые могут тем или иным образом повлиять на продолжительность жизни исследуемых, не удается воссоздать J-образную кривую — получается предсказуемый график, и умеренно пьющие люди не обладают пониженной смертностью. Так что, как говорится, думайте сами, решайте сами.
Литература
- Arthur I. Cederbaum. (2012). Alcohol Metabolism. Clinics in Liver Disease. 16, 667-685;
- Yu-Chou Chi, Shou-Lun Lee, Ching-Long Lai, Yung-Pin Lee, Shiao-Pieng Lee, et. al.. (2016). Ethanol oxidation and the inhibition by drugs in human liver, stomach and small intestine: Quantitative assessment with numerical organ modeling of alcohol dehydrogenase isozymes. Chemico-Biological Interactions. 258, 134-141;
- Ашмарин И.П. (2003). Алкогольдегидрогеназа млекопитающих — объект молекулярной медицины. «Успехи биологической химии». 43, 3–18;
- Claudia E. Thompson, Loreta B. Freitas, Francisco M. Salzano. (2018). Molecular evolution and functional divergence of alcohol dehydrogenases in animals, fungi and plants. Genet. Mol. Biol.. 41, 341-354;
- Matthew A. Carrigan, Oleg Uryasev, Carole B. Frye, Blair L. Eckman, Candace R. Myers, et. al.. (2015). Hominids adapted to metabolize ethanol long before human-directed fermentation. Proc Natl Acad Sci USA. 112, 458-463;
- Fleagle J.G. Primate adaptation and evolution. NY: Stony Brook University, 2013. — 464 p.;
- Hiroki Oota, Hiroki Oota, Kenneth K. Kidd. (2012). Duplicated Gene Evolution of the Primate Alcohol Dehydrogenase Family. Post-Genome Biology of Primates. 149-161;
- Akira Yoshida, Andrey Rzhetsky, Lily C. Hsu, Cheng Chang. (1998). Human aldehyde dehydrogenase gene family. Eur J Biochem. 251, 549-557;
- Samuel R. Gochman, Michael B. Brown, Nathaniel J. Dominy. (2016). Alcohol discrimination and preferences in two species of nectar-feeding primate. R. Soc. open sci.. 3, 160217;
- Edenberg H.J. (2007). The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res. Health. 30, 5–13;
- Philip J Brooks, Mary-Anne Enoch, David Goldman, Ting-Kai Li, Akira Yokoyama. (2009). The Alcohol Flushing Response: An Unrecognized Risk Factor for Esophageal Cancer from Alcohol Consumption. PLoS Med. 6, e1000050;
- J. Mutschler, M. Grosshans, M. Soyka, S. Rösner. (2016). Current Findings and Mechanisms of Action of Disulfiram in the Treatment of Alcohol Dependence. Pharmacopsychiatry. 49, 137-141;
- Anamaria C. Sanchez, Chengwen Li, Barbara Andrews, Juan A. Asenjo, R. Jude Samulski. (2017). AAV Gene Therapy for Alcoholism: Inhibition of Mitochondrial Aldehyde Dehydrogenase Enzyme Expression in Hepatoma Cells. Human Gene Therapy. 28, 717-725;
- Lara A. Ray, ReJoyce Green, Daniel J.O. Roche, Molly Magill, Spencer Bujarski. (2019). Naltrexone effects on subjective responses to alcohol in the human laboratory: A systematic review and meta‐analysis. Addiction Biology;
- Johan Franck, Nitya Jayaram-Lindström. (2013). Pharmacotherapy for alcohol dependence: status of current treatments. Current Opinion in Neurobiology. 23, 692-699;
- The American Psychiatric Association Practice Guideline for the Pharmacological Treatment of Patients With Alcohol Use Disorder — American Psychiatric Association Publishing, 2018;
- Raymond K. Walters, 23andMe Research Team, Renato Polimanti, Emma C. Johnson, Jeanette N. McClintick, et. al.. (2018). Transancestral GWAS of alcohol dependence reveals common genetic underpinnings with psychiatric disorders. Nat Neurosci. 21, 1656-1669;
- Heleen Riper, Gerhard Andersson, Sarah B. Hunter, Jessica de Wit, Matthias Berking, Pim Cuijpers. (2014). Treatment of comorbid alcohol use disorders and depression with cognitive-behavioural therapy and motivational interviewing: a meta-analysis. Addiction. 109, 394-406;
- Ed Day, James H. F. Rudd. (2019). Alcohol use disorders and the heart. Addiction. 114, 1670-1678;
- Как прочитать эволюцию по генам?;
- 12 методов в картинках: полимеразная цепная реакция;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!.







