
Криобиология: как остановить биологические часы и запустить их обратно
06 октября 2023
Криобиология: как остановить биологические часы и запустить их обратно
- 1846
- 0
- 7
Криобиология — наука, которая изучает влияние низких температур на живые организмы. Она так и манит исследователей заглянуть за грань возможного: например, проверить, можно ли при помощи температуры управлять биологическими часами
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Остановить время — звучит очень даже заманчиво! Человечество грезит об этом на протяжении многих веков. Может, воздействовать на физическое время пока не представляется возможным, но вот биологические часы действительно можно остановить, используя предельно низкие температуры. Но так ли все просто, и можно ли снова запустить эти часы после остановки? Попробуем разобраться в новой статье из цикла «Ультрасовременные методы».
Ультрасовременные методы
Методы, которыми оперирует современная наука, постоянно совершенствуются. Некоторые области развиваются настолько стремительно, что порой даже специалистам сложно уследить за новейшими приборами и модификациями методик. Так происходит, например, в геномике. Другие же области (такие как гистология и связанные с ней световая и флуоресцентная микроскопия) развиваются куда медленнее, но всё равно расширяются и обзаводятся более высокопроизводительными методами. В статьях нового спецпроекта (он продолжает наш хит — «12 биологических методов в картинках») мы хотим рассказать, какие методы помогают ученым совершать новые открытия сегодня, и чего нам ждать в будущем.

Партнер этой статьи — «СкайДжин».
Пять причин выбрать SkyGen:
- Доступ к высококачественной продукции для молекулярной биологии.
- Высококвалифицированная научная поддержка.
- Быстрая логистика и складская программа.
- Удобное и взаимовыгодное сотрудничество.
- Адекватные цены.
Идеальный резервуар для остановки биологических часов — вечная мерзлота. Организмы, попавшие в нее, имеют шансы случайно ожить спустя много тысяч лет. Так, например, произошло с семенами смолевки узколистной — 31 000 лет назад, в ледниковый период, запасливая земляная белка спрятала их в свои кладовые (рис. 1), а в наши дни ученые обнаружили их и сумели заставить цвести и плодоносить [1], [2]. Другие примеры — коловратки, ожившие спустя 24 000 лет в вечной мерзлоте [3], и нематоды, ожившие спустя 46 000 лет [4]. Последние, кстати, после оживления преспокойно отправились размножаться. Конечно, такие случаи — скорее исключение, нежели правило, и далеко не каждый замороженный организм можно оживить после разморозки.

Рисунок 1. Саблезубая белка из мультфильма «Ледниковый период» готовится спрятать в кладовую семена смолевки узколистной желудь. Кстати, в конце первой части франшизы этот персонаж оттаивает из ледника и оживает спустя 20 000 лет. Такой поворот событий, как и существование саблезубых белок, — полностью художественная выдумка! Речь о том, почему это так, пойдет ниже (см. рис. 7).
скриншот из видео по франшизе «Ледниковый период»
Однако ученые не были бы учеными, если бы не постарались создать искусственную «вечную мерзлоту» с контролируемыми условиями, надежно сохраняющую образцы на долгое время. С развитием криобиологии и открытием веществ, которые защищают клетки и ткани от холодового повреждения, криоконсервация биологического материала стала довольно рутинной задачей. Она используется в самых разных сферах: от искусственного оплодотворения до сельского хозяйства, от спасения вымирающих видов до лечения болезней, от хранения клеточных линий и штаммов бактерий до решения фундаментальных биологических проблем. Заморозка стала настолько широко распространена и востребована в биологических исследованиях, что в мире стали появляться специальные биобанки, основная задача которых — коллекционировать, каталогизировать и хранить образцы при экстремально низких температурах, а также выдавать их в пользование заинтересованным исследователям и врачам.
Биобанки
Биобанк в широком смысле — это место, в котором хранятся биологические образцы для использования в исследованиях. Преимущество таких хранилищ в том, что исследователям не нужно тратить усилия на самостоятельный сбор обширного материала и его правильное хранение. Кроме того, одни и те же пробы из банка могут использовать для своих задач несколько групп ученых, а это экономит колоссальное количество ресурсов. Более того, биобанки упрощают получение материала для исследований [5], в которых оперируют большими массивами данных: геномики, транскриптомики и прочих «-омиков» , и стимулируют переход к персонализированной медицине [6].
Подробнее про «-омики» можно прочесть на «Биомолекуле» в статьях «Факты и легенды о мультиомиксных технологиях» [7] и «„Омики“ — эпоха большой биологии» [8].
Фундаментальные исследования
Заморозку применяют во многих фундаментальных исследованиях, где так или иначе требуется долгосрочное хранение материала. Криоконсервацию могут использовать для культур клеток: специально культивированным для одного исследования или относящихся к широко используемым клеточным линиям; образцов ткани, ДНК и антител, которые не планируют использовать в ближайшее время. Именно глубокая заморозка позволяет сохранять материал, полученный в долгосрочных экспериментах.
Например, еще в 1988 году Ричард Ленски начал эксперимент по изучению эволюции двенадцати популяций кишечной палочки. Он идет уже 35 лет, и за это время сменилось более 70 000 поколений бактерий, что дает ученым возможность созерцать и изучать ход эволюции в реальном времени как на уровне генома (новых мутаций), так и на уровне организма (новых признаков). Часть каждой популяции регулярно замораживают при −80 oC и сохраняют для последующего изучения. Таким образом, представителей каждой популяции и их свойства изучают здесь и сейчас, существующими методами, но все поколения будут доступны и будущим ученым, которые поставят новые задачи и применят для их решения новых, более точных подходов.
Медицина
Заморозку можно использовать и для конкретных биомедицинских целей. Наверное, самые открытые и доступные для обывателей — это криобанки спермы и яйцеклеток. В них можно заморозить и хранить свои яйцеклетки или сперматозоиды и использовать их по прошествию времени, а можно запросить донорские. Также в биобанках хранят эмбрионы на ранних стадиях развития: например, оплодотворенные яйцеклетки, которые были созданы, но не были использованы при экстракорпоральном оплодотворении. Эти банки нужны, чтобы помочь людям, которые хотят иметь детей, но по разным причинам не могут завести их при помощи полового акта.
Другое важное применение заморозки — хранение донорских органов и клеток в целости до момента, когда они будут пересажены больным пациентам [9]. Например, пересадка гепатоцитов используется в лечении некоторых болезней печени [10], а гемопоэтические стволовые клетки вводятся внутривенно пациентам, страдающим болезнями крови (лейкемией, тяжелой апластической анемией, рефрактерной рецидивирующей лимфомой). Пересадка островков поджелудочной железы (островков Лангерганса) — это отличная альтернатива для лечения диабета первого типа [11].
Спасение вымирающих видов
Один из примеров сохранения нечеловеческого биологического материала — замороженные зоопарки (рис. 2А), в которых хранятся клеточные линии многих видов животных. Эти хранилища возникли в связи с серьезным беспокойством мирового сообщества по поводу массовой потери биоразнообразия в планетарных масштабах [12]. У большинства «жителей» замороженных зоопарков еще есть полноценные живые представители, но для некоторых видов культивированные клетки — всё, что осталось. Так, например, обстоят дела с чернолицей гавайской цветочницей, популяцию которой не удалось восстановить (рис. 2Б). Этих птиц больше нет ни в живой природе, ни в обычных, привычных нам зоопарках, и только в замороженном зоопарке Сан-Диего осталась линия глазных клеток, которую чудом удалось культивировать после смерти последней птицы [13].
В замороженных зоопарках также хранятся половые клетки животных, и в последнее время искусственное оплодотворение для животных и птиц применяется всё чаще [14]. Конечно, проще всего использовать эту технологию для видов, физиология которых изучена вдоль и поперек (например, для копытных или кошачьих), нежели для редких вымирающих видов, о которых известно не так много [15]. Однако по иронии, именно для последних искусственное оплодотворение может оказаться единственным шансом на спасение (рис. 3).

Рисунок 3. Северный белый носорог Ангалифу — самец, погибший в 2014 году. Иногда ситуация с сохранением популяции может быть очень сложной, как, например, для белого носорога. Существует два подвида: северный и южный. Популяция южного белого носорога уже была на грани вымирания и прошла через бутылочное горлышко — в конце 19 века в природе осталось всего-то 20 животных. Однако усилия по охране, прилагавшиеся в течение целого века, оправдали себя, и сейчас южные белые носороги в относительно неплохом положении: около 16 000 животных обитают на воле, а недавно появился план по реинтродукции еще 2000 носорогов с проданного ранчо в дикую природу [16]. А вот положение северного белого носорога — другого подвида — совсем не такое обнадеживающее. Сегодня в мире остались только две живые самки этого подвида (мать и дочь), но благодаря тому, что ученые успели собрать и заморозить образцы спермы от самцов, надежда спасти носорогов от тотального вымирания пока не утрачена окончательно. В настоящее время три искусственно созданных эмбриона хранятся в замороженном виде и ожидают часа, когда их подсадят суррогатной матери. Скорее всего, мать будет выбрана среди южных белых носорогов.
Сельское хозяйство
Существуют также хранилища, куда помещают биоматериалы, полученные от растений: например, национальные банки семян и семенные фонды (рис. 4). Эти организации хранят тысячи разновидностей растений с целью сохранения биоразнообразия и лучшего его понимания. Более того, они направляют свои усилия на то, чтобы быть способными накормить людей в быстро меняющемся мире, а также сохранить разнообразие генов, которые определяют важные для нас свойства растений, такие как аромат, питательность, засухоустойчивость и прочие.

Рисунок 4. Это довольно неприветливое здание — вход во Всемирное семенохранилище на Шпицбергене. Его неприступный вид обусловлен суровыми внешними условиями и серьезными задачами, которые стоят перед этим биобанком. Само хранилище находится на глубине 130 метров под землей в вечной мерзлоте. По сути, это бункер, главная задача которого — сохранить семена сельскохозяйственных культур при любых условиях: даже если на Землю упадет астероид или начнется ядерная война.
Проблема коммерческого земледелия заключается в том, что оно сосредотачивает все свое внимание на нескольких массовых пищевых культурах, игнорируя прочее биоразнообразие. К сожалению, такая система совершенно беспомощна перед стихийными бедствиями и вспышками болезней. В чрезвычайных ситуациях именно семенные банки, а не коммерческое земледелие могут спасти много жизней. Так, например, после того, как цунами в 2004 году затопило прибрежные рисовые поля от Индонезии до Шри-Ланки, семенные банки быстро предоставили устойчивые к соли сорта, чтобы заново засеять поля [17]. Очевидно, что в эпоху климатических изменений и непредсказуемых природных явлений человечеству наверняка понадобятся самые разные сорта растений: например, устойчивые к более жарким и засушливым условиям, или способные расти на подтопленных соленых почвах, как в примере выше, а возможно, наделенные свойствами, о которых мы пока даже не задумываемся. И именно семенохранилища — наша главная надежда на сытое завтра.
Заморозка: как?
В целом, выбор температуры хранения биоматериала определяется двумя самыми важными факторами: частотой его использования (и разморозки) и устойчивостью к условиям среды или их резким переменам. Образцы, которые могут разрушаться при плюсовой температуре, но в то же время хорошо переносят частое замораживание-оттаивание и регулярно используются в лаборатории, обычно хранят в морозилке при −20 oC (легкая заморозка). Так поступают с ДНК и РНК, пептидами, антителами. Если же образцы портятся от постоянных циклов замораживания—оттаивания, и их собираются использовать в ближайшее время (например, образцы крови), оптимальный способ хранения — в холодильнике при +4 oC. Эти два способа хранения используют в лабораторной рутине чаще всего.
Однако когда основная задача исследователей — сохранить пробы в течение длительного времени (как, например, в биобанках), нужна глубокая заморозка — та самая искусственная «вечная мерзлота», которая останавливает биологические часы. Этот способ — более сложный, требует специального оборудования и реагентов, но в то же время позволяет расширять возможности для исследований. Наиболее широко распространенные рубежи глубокой заморозки — при температуре −80 oC на сухом льде и −196 oC в жидком азоте. Эти температуры определяются границами фазовых переходов вспомогательных веществ: сухой лед при −78,5 oC сублимируется (переходит из твердого состояния в пар), а жидкий азот при −195,75 oC — испаряется. Конечно, существует множество других температурных решений (−70 oC; −120 oC; −150 oC и т.д.), и каждый ученый сам решает, какой способ лучше всего подойдет для его задач [18].
В целом, подбор правильных условий для заморозки зависит от особенностей клеток и их метаболизма. Нужно учитывать, что некоторые биомолекулы, как, например, β-гликозидаза, сохраняют активность даже при очень низких температурах (−70 и −80 oC). Это означает, что заморозка при −80 oC в таком случае не остановит метаболизм полностью и, следовательно, будет неэффективна. Исследования, в которых изучают влияние условий хранения на сохранность образцов, могут указать, при каких температурах активность в клетке продолжатся. Например, гепатоциты и клетки сердечных клапанов, которые хранились при −80 oC, постепенно теряли жизнеспособность и функциональность в течение нескольких месяцев. Однако клетки этих типов, которые хранили при температурах ниже −135 oC при прочих равных условиях заморозки, оставались жизнеспособными в течение года или двух. В то же время, подобное исследование для гемопоэтических стволовых клеток не показало значимых различий в жизнеспособности клеток, а эритроциты, которые хранили при −80 oC, сохраняли свою жизнеспособность в течение 37 лет [18].
Проблемы глубокой заморозки
С первого взгляда может показаться, что главная проблема глубокой заморозки в том, чтобы хранить пробы в очень низкотемпературной среде. На самом деле, самое сложное — преодолеть «серую зону» примерно от −15 oC до −60 oC, в которой клетки очень легко гибнут [19]. К тому же, пройти через этот интервал температур нужно дважды: при заморозке и при оттаивании. Что же именно опасного в этом интервале температур? Что губит клетки в этих условиях?
Точные механизмы смерти клеток при заморозке все еще до конца не изучены, но на этот счет существуют две независимые гипотезы [20]. Одна из них предполагает, что кристаллы льда наносят необратимые механические повреждения клеточным мембранам, а другая — что из-за образования кристаллов льда концентрация растворенных веществ в оставшейся жидкой фазе становится летально высокой (рис. 5). Однако, что бы ни губило клетки — резкие перепады осмотического давления или формирование кристаллов льда внутри клетки, — ясно одно: без специальных техник и реагентов, о которых мы поговорим позже, клетки из глубокой заморозки к жизни не вернуть.
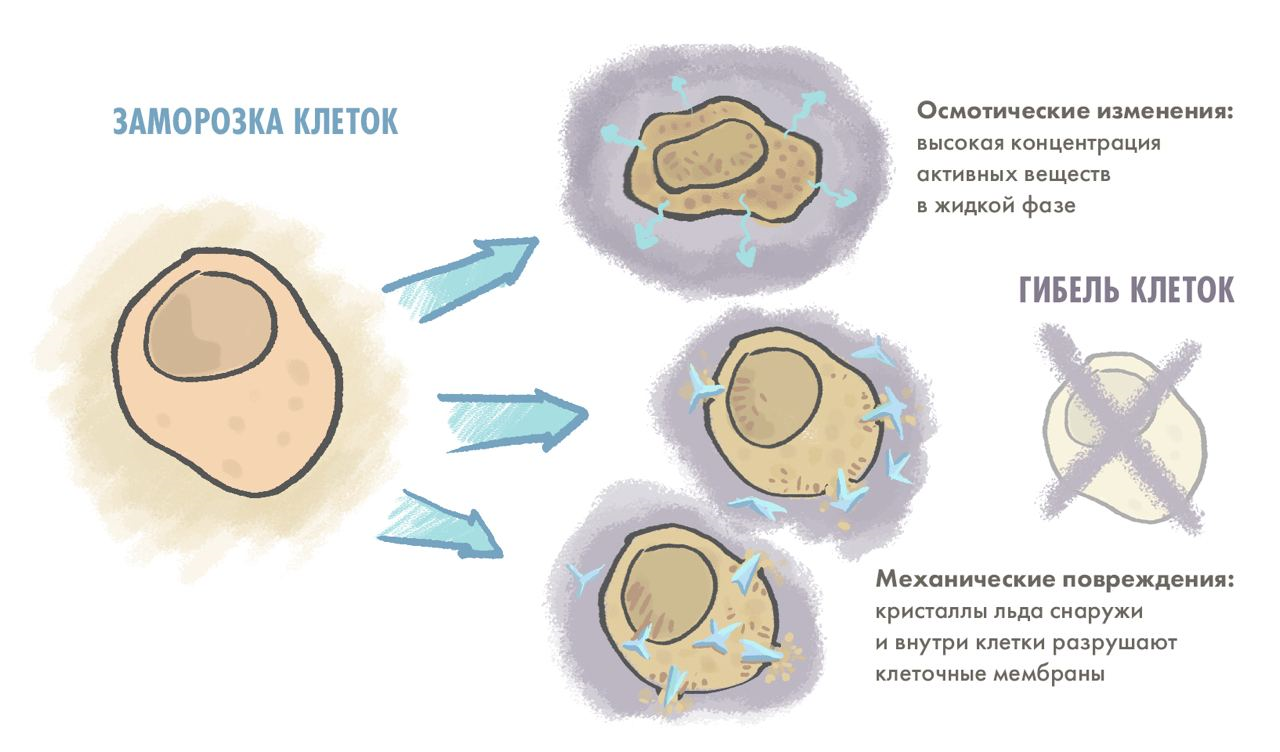
Рисунок 5. Упрощенная схема происходящего в клетке при заморозке. При охлаждении клетка избавляется от воды, но не всегда может сохранить осмотический баланс, а концентрация веществ внутри клетки может стать летально высокой. Более того, образовавшийся лед может травмировать клеточные мембраны как изнутри, так и снаружи.
иллюстрация Елены Беловой
Заморозка и последующее возвращение к жизни крупных органов произвели бы революцию в трансплантологии, но связанные с этим технические проблемы пока что непреодолимы. Основная проблема трансплантологии, не связанная напрямую с заморозкой, заключается в том, что органы вне организма способны оставаться жизнеспособными в течение очень ограниченного интервала времени. Так, для почек это 50–100 минут, для сердца, печени, поджелудочной железы и легких — 10–30 минут, а для мозга — вообще 3–5 минут. Органы для трансплантации в настоящее время держат на холоде, чтобы немного замедлить процессы деградации и сохранить жизнеспособность, а пересадку стараются провести как можно скорее: в течение нескольких часов или суток после изъятия органа у донора. Поэтому долгосрочное хранение органов могло бы существенно улучшить возможности для пациентов. Однако, несмотря на недавние успехи в криоконсервации органов (см. ниже), создание биобанков с замороженными органами, готовыми к трансплантации — это пока научная фантастика.
Проблемы с замораживание крупных органов — это расширение воды при превращении в лед и неравномерная заморозка (рис. 6). Вода, которая выходит из клеток при охлаждении, попадает в любое свободное пространство между органами и превращается в лед; за счет этого объем пространства значительно увеличивается (ведь вода, превращаясь в лед, увеличивается в объеме примерно на 10%) [19]. Это травмирует эндотелиальные клетки, выстилающие, например, капилляры. Более того, к моменту, когда орган заморозится полностью, внешние ткани уже успеют подвергнуться некрозу, и орган при разморозке не сможет нормально функционировать.
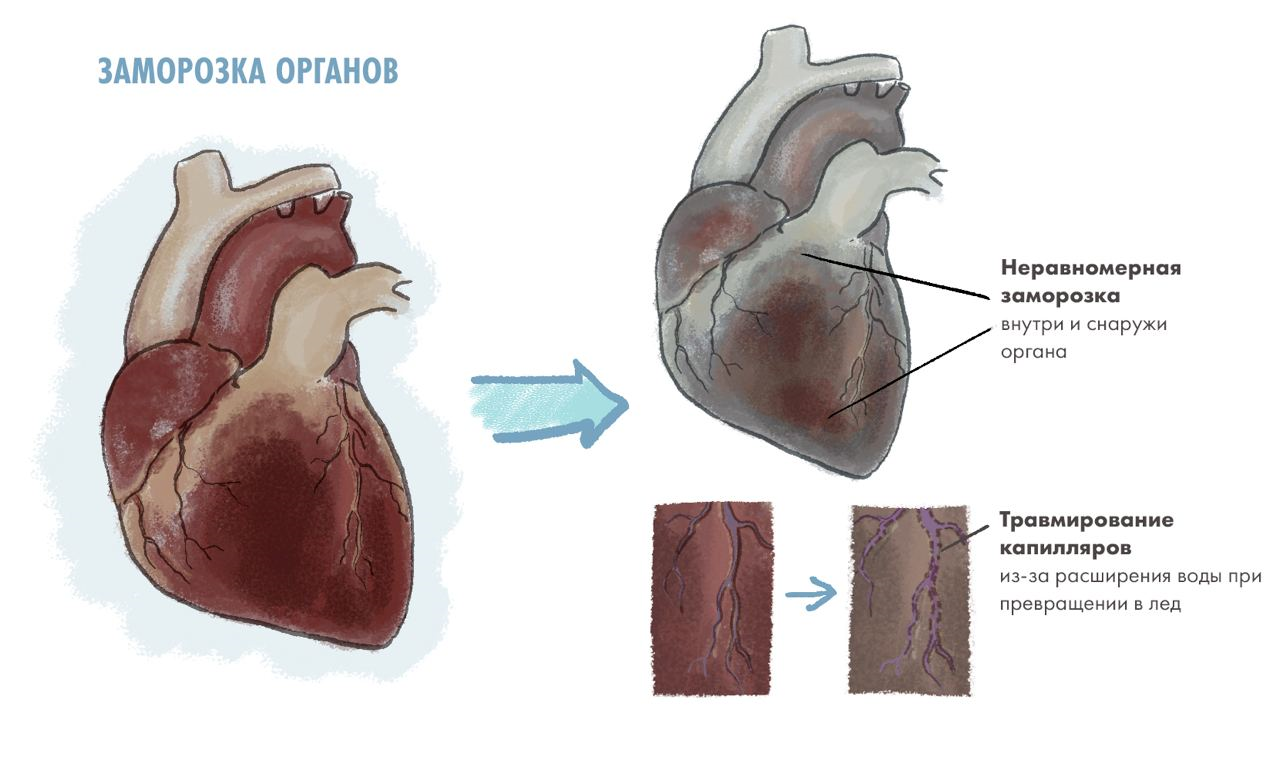
Рисунок 6. Упрощенная схема происходящего в органах при заморозке. Крупный орган сложно заморозить равномерно, потому что заморозка может не дойти до центра, в то время как внешние части будут гибнуть от холода. Также эндотелиальные клетки, выстилающие капилляры, могут слишком сильно деформироваться и погибать из-за превращения воды в капиллярах в лед.
иллюстрация Елены Беловой
Решения проблем заморозки
Итак, главная задача криоконсервации заключается в том, чтобы не допустить внутриклеточное замораживание и осмотический стресс. Чтобы ее выполнить, используют два приема: манипулируют скоростями замораживания на разных этапах процесса, а также используют криопротекторы — вещества, добавление которых значительно повышает жизнеспособность клеток после разморозки [9], [21].
Скорость заморозки
Чтобы не допустить гибели клетки, используют либо медленное замораживание, либо, наоборот, очень быстрое (практически мгновенное). При медленной заморозке клетка успевает постепенно выкачивать воду во внешнюю среду и сохранять осмотическое равновесие. Считается, что в этом случае опасный внутриклеточный лед не образуется. Если же клетка охлаждается быстро (но не мгновенно), то не успевает терять воду в достаточных объемах, чтобы удержать равновесие с внешней средой; в итоге она замораживается изнутри и погибает.
Однако если внутриклеточное замораживание так опасно для клеток, возможно ли не допустить превращения воды в лед при предельно низких температурах? Хоть и звучит парадоксально, но да, этого можно достичь при сверхбыстрой заморозке. Хитрость заключается в том, что переохлажденная жидкость может переходить в особое стеклоподобное состояние. Этот процесс — витрификация — фазовый переход, при котором аморфное вещество приобретает структуру стекла и свойства кристаллических твердых тел. «Аморфный лед» не повреждает клеточные мембраны и дает большой потенциал для сохранения жизнеспособности после разморозки.
Витрификацией называют вышеупомянутый фазовый переход из жидкого в стеклоподобное состояние, но в криобиологии этот термин также закрепился за методом сверхбыстрой заморозки (потому что очень быстрое охлаждение и ведет к получению стеклоподобного состояния). Поэтому в литературе по криоконсервации регулярно противопоставляют «медленную заморозку» и «витрификацию», имея в виду два разных метода замораживания (табл. 1). Подробнее про витрификацию как фазовый переход можно почитать в статье «Витрификация — контролируемая пауза развития в стеклоподобном состоянии» [22].
Криопротекторы
Второй необходимый для глубокой заморозки элемент — криопротекторы [20]. Их используют как при медленной заморозке, так и при сверхбыстрой (табл. 1), и значение этих веществ трудно переоценить. Некоторые криопротекторы — относительно маленькие молекулы (менее 100 дальтон), такие как глицерин, диметилсульфоксид (ДМСО), этиленгликоль и пропиленгликоль (рис. 8), — проникают в клетку и работают изнутри. Вероятно, их свойства определяются хорошей способностью образовывать водородные связи [23]. В норме, когда вода превращается в лед, выстраивается жесткая кристаллическая решетка, в узлах которой и находятся молекулы воды. Однако проникающие в клетку криопротекторы связывают воду, и в клетке просто не остается достаточно свободных молекул воды, которые могли бы образовать кристаллическую решетку льда. Видимо, именно криопротекторы играют важную роль в том, чтобы достичь спасительной витрификации внутри клетки.
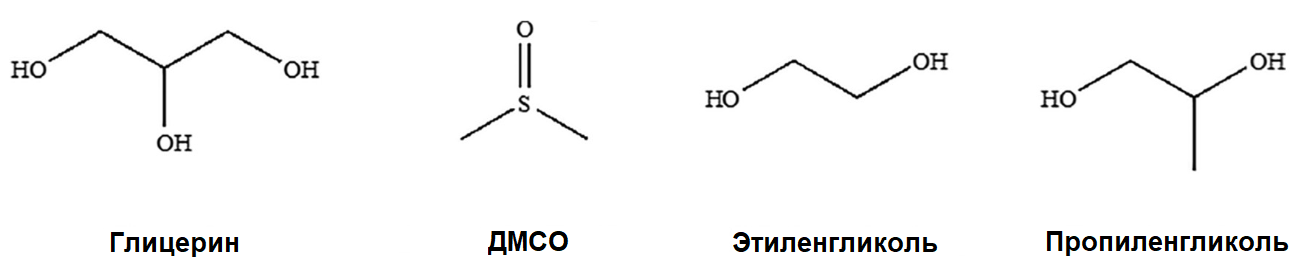
Рисунок 8. Четыре проникающих в клетку криопротектора, которые чаще всего используются в криоконсервации.
Есть и другие криопротекторы, которые слишком массивны и не проникают в клетку. Это, например, полиэтиленгликоль, трегалоза или сахароза, которые также индуцируют витрификацию, но вне клетки и в меньших масштабах. К сожалению, криопротекторы (особенное проникающие) могут быть токсичны для клеток в повышенных концентрациях, поэтому эти вещества стараются использовать на протяжении максимально короткого времени и в небольших количествах [9].
Методические детали криоконсервации могут варьироваться от задачи к задаче. Существуют наблюдения и рекомендации: например, для криоконсервации островков поджелудочной железы, эмбриональных стволовых клеток и яйцеклеток обычно рекомендуется витрификация, тогда как медленное охлаждение предлагается для хранения гепатоцитов, гемопоэтических стволовых клеток и мезенхимальных стволовых клеток [9]. Однако чаще для максимальной эффективности заморозку разбивают на несколько шагов и комбинируют медленную заморозку и витрификацию. Например, в одном из методов островки поджелудочной железы замораживают в несколько этапов с разными скоростями изменения температуры. Сначала пробы держат при температуре +4 oC в течение 25 минут, а потом начинают заморозку: сначала от +4 oC до −9 oC со скоростью 2 oC/мин; до −40 oC со скоростью 0,3 oC/мин; до −140 oC со скоростью 10 oC/мин; и, наконец, их кладут в жидкий азот (−196 oC), в котором образцы и будут храниться [25].
| Характеристики | Медленная заморозка | Витрификация (сверхбыстрая заморозка) |
|---|---|---|
| Скорость замораживания | 1 oC/мин в интервале от +4 oC до −70...−80 oC, далее — хранение в жидком азоте | 102−104 oC/мин — мгновенное погружение в жидкий азот |
| Используемые криопротекторы | Чаще всего ДМСО, также этиленгликоль, глицерин и т.д. | Смесь из нескольких криопротекторов |
| Концентрации криопротекторов | Низкая: 5−10% | Высокая: более 25% |
| Оборудование | Настольная портативная морозилка | Оборудование для работы с жидким азотом |
| Потенциальный урон | Механическое повреждение образующимися кристаллами льда / осмотический стресс | Химическое повреждение в результате цитотоксичности криопротекторов в высоких концентрациях |
| Рекомендованный объем материала | До 200 мл, обычно — 0,3−5 мл | До 0,5 мл, обычно — 1−2 мкл |
В области заморозки органов также совсем недавно случился важный прорыв [26]. А именно, почки крысы смогли заморозить до −150 oC, хранить в течение 100 дней, разморозить и пересадить другой крысе. Секрет успеха в данном случае — в специальном способе разморозки, так называемом «нанонагревании». В сосуды почки влили раствор, содержащий наночастицы оксида железа, а при разморозке ее поместили в специальное устройство (рис. 10). Оно создавало магнитное поле, меняющее полюса 360 000 раз в секунду, что нагрело наночастицы железа и разморозило почку всего за 90 секунд, не повредив ее.

Рисунок 10. Цзунху Хан — постдок в университете Миннесоты — извлекает пластиковый пакет с почкой из устройства, которое нагревало ее при помощи быстро меняющегося магнитного поля.
Внутри хранилища
История об открытии криопротекторных свойств глицерина, казалось бы, подсказывает очень удобную мысль: ошибки случаются, и они ведут к замечательным открытиям! К сожалению, с ошибками все далеко не так просто. Во-первых, эксперименты зачастую разбиты на много этапов и сопряжены с использованием большого количества реагентов и сложного оборудования. Проверить каждый элемент и найти точную причину отклонения от методики в таких случаях часто невозможно. Во-вторых, ошибку можно вообще не заметить, если нет значимых отклонений, но она в любом случае будет искажать результаты. Так что одна история про замечательное открытие благодаря ошибке — скорее редкое исключение в море потенциально искаженных результатов, которые могут вести к неверным выводам. Поэтому для науки так важно все стандартизировать, правильно хранить образцы и реактивы и по возможности автоматизировать некоторые процессы, чтобы исключить человеческий фактор, где это возможно.
Правильное хранение
В биобанках очень важны организационная дотошность и исправность оборудования. Просто представьте, какая огромная коллекция ценных образцов может быть потеряна, если во всем хранилище, например, отключится электричество! Зачастую банки хранят образцы в разных местах и делают копии: например, несколько пробирок с одними и теми же линиями могут хранить в разных морозильниках или даже в разных корпусах биобанка.
Также очень важно, чтобы образец всегда без сомнений можно было сопоставить с подробной информацией о нем. Если этикетки перепутаются, исследования на основе этих образцов будут содержать ошибки, а если потеряются — такую пробу вообще нельзя будет использовать.
Более того, надо учитывать специфику хранимых проб и помнить, что даже в надежном криохранилище они могут портиться. Например, в Национальном банке семян их всхожесть проверяют каждые 10 лет, чтобы семена из образца можно было высадить, дорастить до зрелости, собрать новые и пополнить ими коллекцию [17].
Автоматизация
Чтобы работа биобанка была максимально эффективной, процессы стараются оптимизировать и автоматизировать . Конечно, речь пока не идет о том, чтобы создавать криохранилища без единого человека, где по гулким коридорам ездят роботы, а с пробами работают механические руки. Наоборот, сейчас в биобанках нужны люди — высококвалифицированные специалисты, хорошо знающие свое дело. Однако чем больше однотипных монотонных действий (которых в лабораторной работе очень много) совершает человек, пусть даже квалифицированный, тем выше вероятность случайной ошибки. Поэтому для такой рутинной работы «механические руки» очень нужны, поскольку позволят сократить количество ошибок в обращении с образцами и сохранить ресурсы специалистов для более важных задач, для которых и нужна их квалификация.
Автоматизация нужна не только в криоконсервации, но и во многих других областях биологии: от биотехнологии до фармакологии, от работы с клетками до оперирования большими данными. Про историю автоматизации, а также о том, как она применяется в перечисленных областях, можно почитать в спецпроекте «Биомолекулы», например, в статье «История автоматизации: от сифона к лаборатории роботов» [27].
В лабораториях, где уже используют автоматизированные системы раскапывания, пробирки обычно имеют штрих-код или QR-код на дне. С помощью этих кодов пробирки можно сканировать, не вынимая из штатива, что существенно упрощает работу с большим количеством образцов.
Существуют и полностью автоматизированные системы хранения, которые не только раскапывают необходимые реагенты в пробирки, но и сами подготавливают образец, идентифицируют его, замораживают, хранят и размораживают. В этом случае от пользователя требуются только навыки работы с программным обеспечением для управления процессом. У таких систем есть только один существенный недостаток — высокая стоимость самой системы и сервисного обслуживания.
Описанные выше истории только подчеркивают, насколько важно иметь современную, удобную и «неубиваемую» базу данных, в которой будет храниться вся необходимая информация о каждом образце. Большинство биобанков пользуется специальными системами управления лабораторной информацией (LIMS — laboratory information management systems); существует много разновидностей таких систем, и у каждой есть свои особенности. В любом случае, каждая из них должна обновлять базы данных в реальном времени, а также быть достаточно простой и удобной в использовании. В идеале, эти системы должны быть совместимы друг с другом, чтобы при необходимости ученым было проще скомпоновать информацию из разных баз данных [28]. В то же время, они должны быть сконструированы так, чтобы информация сохранялась в безопасности, и анонимность пациентов и их персональные данные оставались неприкосновенными.
Стандартизация
Зачастую лаборатории в разных или даже в одном исследовательском центре по-разному хранят пробы. Если в такой ситуации потребуется обмен образцами или их совместное использование, ученые не смогут утверждать, что все исходные материалы находились в одних и тех же условиях. Это может затруднить коллаборации и повлияет на результаты исследований, поэтому важно, чтобы в лабораториях соблюдали принятые стандарты для хранения образцов (например, разработанное руководство [29]). Если институты смогут соблюдать стандарты хранения образцов, это откроет новые перспективы для сотрудничества.
А что дальше?
Безусловно, значение глубокой заморозки для науки и для общества огромно. Без криоконсервации не было бы ни множества счастливых родителей, которые прежде не могли завести детей, ни надежды на сохранение биоразнообразия, ни планирования на случай голода в чрезвычайных ситуациях, ни многих исследований. Однако наука движется вперед, и на горизонте еще немало амбициозных замыслов.
Например, у ученых много планов по возрождению вымерших животных при помощи современных техник, возможностей глубокой заморозки и знаний репродуктивной биологии конкретных видов. Наверное, самый широко известный пример — проект ученого Джорджа Черча по возвращению мамонтов к жизни при помощи слоновьих клеток (рис. 19). Есть и другие кандидаты на возрождение: например, первобытный бык — с использованием клеток коров и быков; тасманийский волк — при помощи клеток... мыши. Правда, не обычной плацентарной мыши, а сумчатой — ближайшего родственника сумчатого волка.

Рисунок 19. Бен Ламм (слева) и Джордж Черч (справа) — основатели компании Colossal Biosciences, которая стремится возродить вымершие виды. Кстати, Институт зоологии и дикой природы ассоциации Лейбница, который активно занимается сохранением северных белых носорогов (см. рис. 3), недавно объединил усилия с Colossal Biosciences в надежде, что технологии последних помогут в восстановлении популяции носорогов.
Более того, криоконсервация и глубокая заморозка дают отличную почву для размышления и новых идей для научных фантастов. Пожалуй, ни одна история про межзвездные путешествия не обходится без идеи криосна (то есть погружения живого человека в глубокую заморозку с последующим оживлением), либо более специфическими идеями вроде колонизации космоса замороженными человеческими эмбрионами.
Именно возможности криобиологии и остановки биологических часов наталкивают на размышления о том, какие пределы возможного человечество сможет перейти в будущем, и заставляет осваивать новые рубежи. Посмотрим, куда нас это приведет.
Литература
- «Элементы»: «Расцвело растение, пролежавшее в вечной мерзлоте 30 тысяч лет»;
- S. Yashina, S. Gubin, S. Maksimovich, A. Yashina, E. Gakhova, D. Gilichinsky. (2012). Regeneration of whole fertile plants from 30,000-y-old fruit tissue buried in Siberian permafrost. Proceedings of the National Academy of Sciences. 109, 4008-4013;
- Жизнь спустя 24 000 лет в вечной мерзлоте возможна?;
- Anastasia Shatilovich, Vamshidhar R. Gade, Martin Pippel, Tarja T. Hoffmeyer, Alexei V. Tchesunov, et. al.. (2023). A novel nematode species from the Siberian permafrost shares adaptive mechanisms for cryptobiotic survival with C. elegans dauer larva. PLoS Genet. 19, e1010798;
- Generoso Bevilacqua, Fred Bosman, Thibaut Dassesse, Heinz Höfler, Anne Janin, et. al.. (2010). The role of the pathologist in tissue banking: European Consensus Expert Group Report. Virchows Arch. 456, 449-454;
- Robert E Hewitt. (2011). Biobanking: the foundation of personalized medicine. Current Opinion in Oncology. 23, 112-119;
- Факты и легенды о мультиомиксных технологиях;
- «Омики» — эпоха большой биологии;
- Gaizhen Kuang, Qingfei Zhang, Jinxuan Jia, Yunru Yu. (2022). Freezing biological organisms for biomedical applications. Smart Medicine. 1;
- Mark Barahman, Patrik Asp, Namita Roy-Chowdhury, Milan Kinkhabwala, Jayanta Roy-Chowdhury, et. al.. (2019). Hepatocyte Transplantation: Quo Vadis?. International Journal of Radiation Oncology*Biology*Physics. 103, 922-934;
- M. McCall, A. M. James Shapiro. (2012). Update on Islet Transplantation. Cold Spring Harbor Perspectives in Medicine. 2, a007823-a007823;
- Это страшное слово «дефаунизация»;
- Колберт Э. «Шестое вымирание. Неестественная история». М: «АСТ»: CORPUS, 2019 г. — 368 с.;
- Thomas B. Hildebrandt, Robert Hermes, Frank Goeritz, Ruth Appeltant, Silvia Colleoni, et. al.. (2021). The ART of bringing extinction to a freeze – History and future of species conservation, exemplified by rhinos. Theriogenology. 169, 76-88;
- «Элементы»: «Замороженный зоопарк. Введение в криоархивирование»;
- N+1»: «Более 2000 белых носорогов выпустят по всей Африке»;
- Хэнсон Т. «Триумф семян. Как семена покорили растительный мир и повлияли на человеческую цивилизацию». М.: «Альпина нон-фикшн», 2018 г. — 374 с.;
- Allison Hubel, Ralf Spindler, Amy P.N. Skubitz. (2014). Storage of Human Biospecimens: Selection of the Optimal Storage Temperature. Biopreservation and Biobanking. 12, 165-175;
- Peter Mazur. (1996). Chapter 10 Principles of medical cryobiology: The freezing of living cells, tissues, and organs. Cell Chemistry and Physiology: PartIV. 355-384;
- David Whaley, Kimia Damyar, Rafal P. Witek, Alan Mendoza, Michael Alexander, Jonathan RT Lakey. (2021). Cryopreservation: An Overview of Principles and Cell-Specific Considerations. Cell Transplant. 30, 096368972199961;
- Henrik Nausch, Johannes F. Buyel. (2021). Cryopreservation of plant cell cultures – Diverse practices and protocols. New Biotechnology. 62, 86-95;
- Витрификация — контролируемая пауза развития в стеклоподобном состоянии;
- Jestin B. Mandumpal, Cara A. Kreck, Ricardo L. Mancera. (2011). A molecular mechanism of solvent cryoprotection in aqueous DMSO solutions. Phys. Chem. Chem. Phys.. 13, 3839;
- C. POLGE, A. U. SMITH, A. S. PARKES. (1949). Revival of Spermatozoa after Vitrification and Dehydration at Low Temperatures. Nature. 164, 666-666;
- Rana Malek, Stephen N. Davis. (2016). Novel Methods of Insulin Replacement: The Artificial Pancreas and Encapsulated Islets. RRCT. 11, 106-123;
- Zonghu Han, Joseph Sushil Rao, Lakshya Gangwar, Bat-Erdene Namsrai, Jacqueline L. Pasek-Allen, et. al.. (2023). Vitrification and nanowarming enable long-term organ cryopreservation and life-sustaining kidney transplantation in a rat model. Nat Commun. 14;
- История автоматизации: от сифона к лаборатории роботов;
- Wiktor Paskal, Adriana M. Paskal, Tomasz Dębski, Maciej Gryziak, Janusz Jaworowski. (2018). Aspects of Modern Biobank Activity – Comprehensive Review. Pathol. Oncol. Res.. 24, 771-785;
- Анисимов С.В., Ахмеров Т.М., Балановский О.П., Баранич Т.И., Беляев В.Е., Борисова А.Л., Брызгалина Е.В., Воронкова А.С., Глинкина В.В., Глотов А.С., Гранстрем О.К., Долудин Ю.В., Драпкина О.М., Ершова А.И., Ефименко А.Ю., Ефимова И.А., Кондрацкая В.А., Мартынов А.Д., Метельская В.А., Мешков А.Н., Михайлова А.А., Муджири Н.М., Муравьев А.И., Насыхова Ю.А., Ноздрачева А.В., Покровская М.С., Пруцкий В.Ю., Семененко Т.А., Сухоруков В.С., Сысоева В.Ю. Биобанкирование. Национальное руководство. М.: «Триумф», 2022. — 308 с.;
- Irina Arutyunyan, Andrey Elchaninov, Gennady Sukhikh, Timur Fatkhudinov. (2022). Cryopreservation of Tissue-Engineered Scaffold-Based Constructs: from Concept to Reality. Stem Cell Rev and Rep. 18, 1234-1252.









