
Клик и готово! Укрощение строптивых биомолекул
02 октября 2018
Клик и готово! Укрощение строптивых биомолекул
- 1845
- 0
- 4
В настоящее время методы клик-химии активно применяются для разработки лекарств и способов их доставки
иллюстрация Ярославы Лобановой
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Создание лекарств, разработка диагностических методов, структурно-функциональные исследования биологически активных веществ ведут к неизбежной работе с биомолекулами и биополимерами. К сожалению, подобные вещества — очень прихотливые товарищи, а направить реакцию с ними в нужное русло бывает достаточно непросто. Или все-таки нет? Маленькая помощница, о которой пойдет речь в этой статье, превращает биомолекулы в элементы конструктора, сборка которого не составит труда даже для начинающего исследователя.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Биотехнология vs. Химия
Существует несколько способов получения биологически активных веществ (БАВ), однако наибольшее значение в промышленном масштабе имеют химический и биотехнологический.
Под химическим синтезом понимают так называемый тонкий органический синтез. Он имеет следующие особенности:
- многостадийность;
- необходимость очистки продукта;
- небольшой выход (то есть получение небольшого объема продукта в ходе химических реакций);
- высокая стоимость продуктов синтеза;
- возможность автоматизации процесса.
Основой для синтеза БАВ биотехнологическим способом являются биообъекты: вирусы, грибы, бактерии, растительные или животные клетки, а также биомолекулы, обладающие различными физиологическими свойствами. Особенности этого способа следующие:
- сложность работы с питательными средами (многокомпонентность, обеспечение стерильности при сохранении качеств среды);
- трудности в управлении биосинтезом (например, неожиданные мутации могут привести к непредвиденному изменению биотехнологического процесса);
- сложность автоматизации.
Однако применение микробиологического синтеза значительно облегчает процесс создания БАВ за счет следующих факторов:
- простота организации генома бактерий;
- легкая приспосабливаемость бактерий к среде обитания;
- высокие скорости протекания бактериальных ферментативных реакций при низких температурах (20–60 °C);
- быстрое увеличение клеточной массы [1].
Кажется, что корпеть день и ночь над живым объектом намного сложнее, чем разработать технологию автоматического химического синтеза, однако выход и чистота продукта тоже вещи очень важные.
Казалось бы, все ясно: микробиологический синтез сегодня более предпочтителен для пищевой и фармакологической промышленностей, где особенно требуется чистота получаемого вещества, однако существует удобный инструмент, объединяющий в себе биологическую точность и химическую простоту, о котором-то и пойдет речь далее.
Химические штучки
Клик-химия (click chemistry, от англ. click — «щелчок») — набор химических реакций, приспособленных для быстрого и надежного получения разнообразных химических веществ путем соединения между собой относительно небольшого количества маленьких элементов (рис. 1) [2].
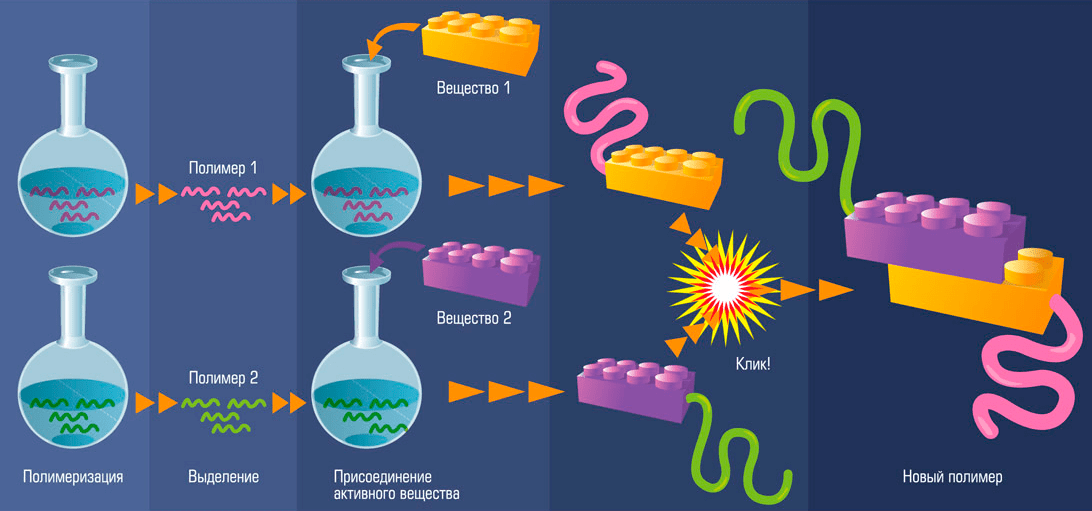
Рисунок 1. Модель клик-химической реакции. Два разных полимера за счет присоединения к ним активного вещества соединяются в один новый. Простота этой реакции сравнима со сбором лего-конструктора.
Предложенная в начале 20 столетия американским химиком Барри Шарплессом клик-химия была исходно задумана как подражание природе, которая создает большие биомолекулы из маленьких частей. Концепция клик-химии заключается в модульности и простоте химических реакций: никаких сложных условий протекания, большой выход и избирательность процесса делают клик-химию удобным инструментом для проведения различных медико-биологических манипуляций.
Клик-химия — это не конкретная реакция, это концепция, под которую в настоящее время подходит широкий ряд химических превращений, открытых еще до появления такого понятия. В области химии биополимеров под клик-реакцией обычно принято понимать взаимодействие азидов с алкинами, приводящее к получению замещенных триазолов (рис. 2).
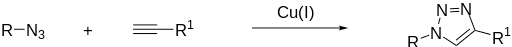
Рисунок 2. Реакция азид-алкинового циклоприсоединения. Благодаря введению катализатора реакция получила несколько преимуществ, позволивших применять ее в различных биотехнологических приложениях, и стала известна под аббревиатурой CuAAC (Cu-catalyzed azide-alkyne cycloaddition, катализируемое медью азид-алкиновое циклоприсоединение). Этими преимуществами являются: скорость протекания (каталитический вариант реакции протекает приблизительно в 107 раз быстрее по сравнению с некаталическим вариантом, что позволяет проводить реакцию азид-алкинового циклоприсоединения при температурах, близких к комнатной); слабое влияние заместителей при азидной и алкиновой группах на протекание реакции; широкий спектр подходящих растворителей (включая воду и водно-органические смеси); региоселективность (продукты представлены только 1,4-дизамещенными 1,2,3-триазолами).
В этой статье я постараюсь описать, как именно клик-химия нашла свое применение в медицине и биологии, мы пробежимся по широкому ряду подходов к синтезу лекарств и созданию диагностических методик, а также поймем, что даст клик-химия рядовым научным сотрудникам.
Синтез пептидомиметиков
Пептидомиметики — это вещества небелковой природы, имеющие такие же функциональные фрагменты, как и конкретный пептид, а потому обладающие такой же активностью [3]. Пептидомиметики обычно «притворяются» пептидом, являющимся лигандом какого-то рецептора — молекулярной мишени, на которую должно действовать изобретаемое нами лекарство. Отличительная черта пептидомиметика по сравнению с обычным пептидом — бóльшая устойчивость к агрессивным средам, а также хорошая растворимость в воде (рис. 3). Как говорится, тот же пептид, только лучше.
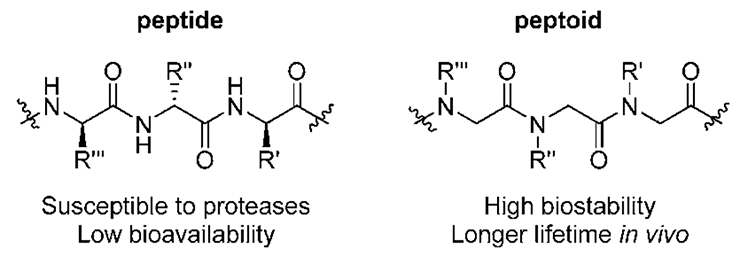
Рисунок 3. Отличие пептида от пептоида — одного из видов пептидомиметиков. В пептоидах боковая цепь (R) перемещается с Cα-атома на азот главной цепи, в пептидах образующий пептидную связь. Это приводит к существенному увеличению химической и биологической стабильности: многочисленные протеазы «не обучены» расщеплять такие связи.
Изменение фармакокинетических свойств вещества происходит благодаря изменению его структуры, что непосредственно влияет на активность вещества. Именно поэтому такие изменения должны производиться с «наименьшими потерями». Для этой цели идеально подходят клик-химические реакции.
Например, в недавнем исследовании таким образом видоизменили антимикробный пептид низин, являющийся лигандом липида-II плазматической мембраны бактерий (рис. 4) [4]. Липид-II выполняет роль переносчика пептидогликановых строительных белков с внутренней стороны клеточной мембраны на наружную, где эти белки встраиваются в клеточную стенку. При этом липид-II — «дефицитная» молекула, а потому вещества, нацеленные на ее захват, не оставляют бактерии шансов на выживание [5], [6]. К таким веществам относят и низин, однако как антибиотик его использовать не получается из-за быстрого расщепления в организме человека, а также потому, что его невозможно запатентовать: это вещество известно уже почти сто лет, и давно используется не в медицине, а в... пищевой промышленности — как консервант.
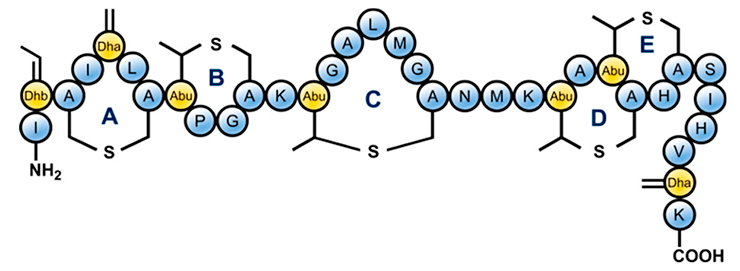
Рисунок 4. Структура низина. Классифицируется как лантибиотик из-за присутствия в его структуре лантиониновых колец [4].
Получение пептоида на основе низина отвечает всем требованиям клик-химических реакций, делая его более фармакокинетически удобным для применения. Более того, новое вещество уничтожает золотистого стафилококка, чего уже нельзя сказать о природном низине. Изучение нового вещества и испытание его на других штаммах бактерий будет вестись и дальше.
Еще одним видом пептидомиметиков можно назвать пептид-олигонуклеотидные конъюгаты. Суть в том, что для подавления экспрессии генов обычно применяют искусственно созданные антисмысловые олигонуклеотиды, которые связываются с участками мРНК клетки по принципу комплементарности. К сожалению, самостоятельно эти олигонуклеотиды пробраться в клетку не могут. На помощь им приходят пептиды, проникающие через клеточную мембрану [7]. Пептид-олигонуклеотиды рассматриваются, как потенциальные высокоселективные мембранотропные регуляторы экспрессии генов, и простота проведения клик-реакции наряду с высокими выходами конденсации сделали этот метод одним из наиболее популярных для синтеза таких соединений [8].
Микрокликочип
Даже при изготовлении ДНК-микрочипов пригодилась клик-химия! Такие чипы представляют собой маленькие пластинки, на которые нанесены фрагменты ДНК известной последовательности (рис. 5).
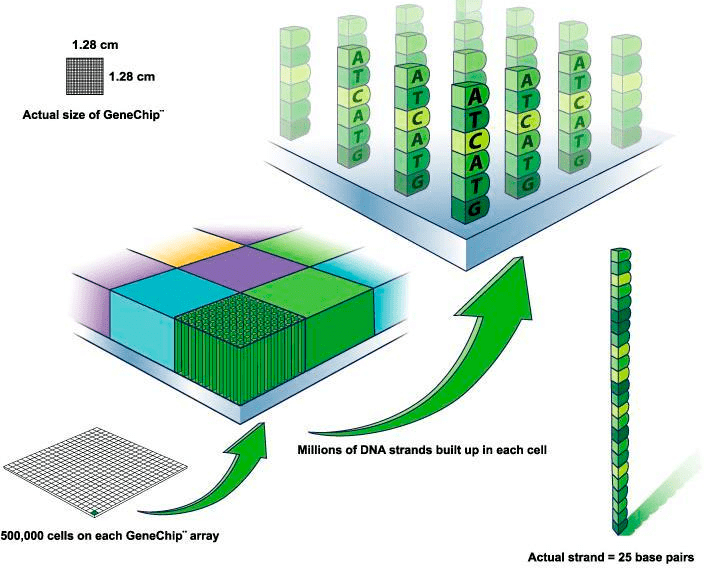
Рисунок 5. Устройство ДНК-микрочипа: на нем присутствуют около полумиллиона проб, в каждой пробе миллионы одинаковых зондов, длина каждого из которых 25 пар нуклеотидных оснований.
С помощью этих устройств изучают экспрессию генов и производят поиск мутаций [9]. Кстати, если вы хотите больше узнать про ДНК-микрочипы — на «Биомолекуле» есть отдельная тема, посвященная этому замечательному изобретению.
Как и большинство современных биоаналитических методов, технология ДНК-чипов основана на использовании гетерофазных систем. На данный момент, клик-иммобилизация олигонуклеотидов на подложке позволяет получать воспроизводимую плотность молекул в поверхностном слое, а также разрабатывать новые высокотехнологичные методы по сборке чипов. Одним «но» является Cu(I) — катализатор данной реакции, а заодно — так уж получилось — разрушитель нуклеиновых кислот [10]. Чтобы справиться с этой проблемой, либо применяют хелатирующие лиганды, либо обходятся без меди как таковой [11]. Однако о сравнимой с Cu(I) каталитической активности говорить еще рано.
CuAAC-иммобилизация, под приставкой «клик» здесь и далее имеется в виду реакция азид-алкинового циклоприсоединения, если не указано другое.
ДНК не по канону
Если вы представляете ДНК как линейную двухцепочечную молекулу, то вам просто необходимо бросить всё и начать читать потрясающую статью на «Биомолекуле» [12], где рассказывается, что еще ДНК способна вот на что: шпильки, кресты, тройные и четверные спирали, организованные различным образом, — сплошной бодипозитив (рис. 6 и 7).
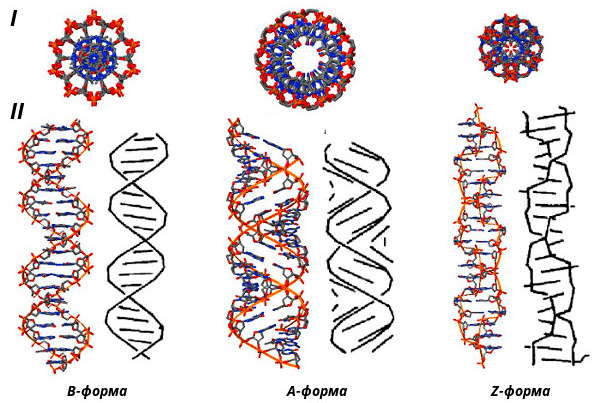
Рисунок 6. Формы организации двухцепочечной ДНК. I — вид с торца, II — вид сбоку. B, A — канонические формы, Z — неканоническая форма.
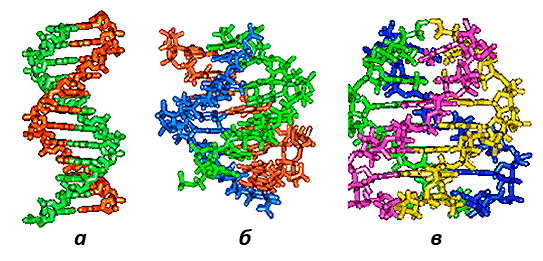
Рисунок 7. Двойная (а), тройная (б) и четверная (в) спирали ДНК
Особенно активно в последнее время изучают G-квадруплексы — структуры, представляющие собой спирали из четырех нитей ДНК или РНК, соединенных одними только гуанинами (рис. 8).
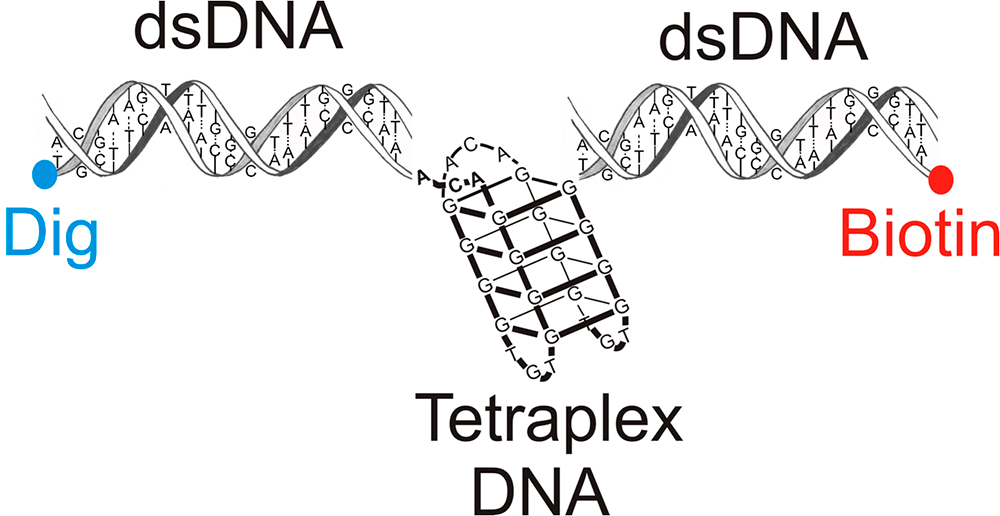
Рисунок 8. Схематическое изображение структуры G-квадруплекса
Интересны такие структуры из-за частой встречаемости в геноме и возможных применений в биологии. Считается, что G-квадруплексы образуются в области теломер, тем самым стабилизируя ДНК, а присутствие квадруплексов в промоторных регионах обеспечивает регуляцию экспрессии генов.
Изучение структуры квадруплексов на данный момент проводят с помощью ЯМР-спектроскопии [13], однако это довольно трудоемко и не всегда информативно. Альтернативным методом анализа является клик-лигирование. Например, благодаря клик-реакции показали возможность образования ДНК/РНК-квадруплексов в последовательности теломер человека (рис 9).
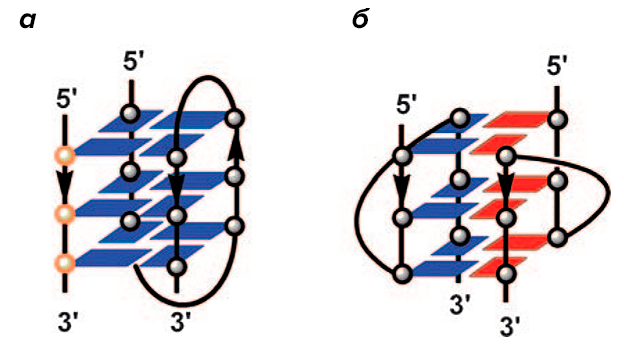
Рисунок 9. Схематическое представление двух G-квадруплеклесов. а — Димерный ДНК-квадруплекс, образованный последовательностями человеческих теломер. б — ДНК-РНК гибрид G-квадруплеклеса, входящий в теломерные последовательности.
Такая реакция проводилась в отсутствии катализатора, а значит, лигирование могло происходить только за счет пространственной близости теломерных олигомеров азидных и алкиновых групп, что и подтверждало наличие G-квадруплексов [14].
Что там у нас в клетке?
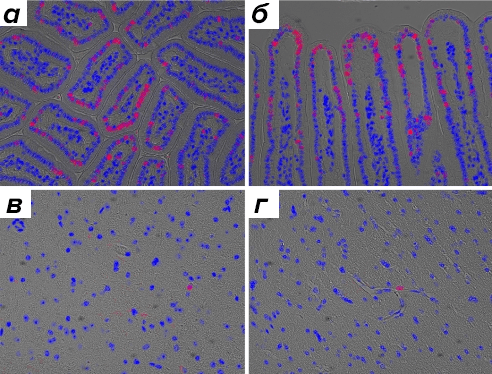
Рисунок 10. Маркировка ДНК in vivo. Наложены флуоресцентные изображения клеточной ДНК (окраска Hoechst, синий) и меченой ДНК, обнаруженной при взаимодействии с азидом (красный). а и б — Ткань тонкого кишечника. в и г — Ткань мозга. Подавляющее большинство ядер на срезах мозга не были помечены, подтверждая, что метка не обнаруживается в ДНК неделящихся клеток.
Традиционные методы контроля синтеза ДНК предлагают применение радиографических и иммунологических методик диагностики. Однако данные способы контроля имеют ряд недостатков: радиографический — трудоемкий, а в результате получаются микрофотографии с очень низким разрешением; иммунологический, в свою очередь, требует жестких условий проведения контроля. Клик-метод позволяет снять все эти ограничения.
В данном случае изучение внутриклеточных процессов с участием нуклеиновых кислот in vivo проводят при помощи клик-маркирования ДНК. Этот метод очень избирателен и дает возможность вводить функциональные группы в нуклеиновые кислоты прямо во время их ферментативного синтеза. Например, таким образом проводится контроль синтеза ДНК в активно делящихся клетках. Суть метода заключается во встраивании в растущие цепи ДНК аналога тимина, а затем инкубации образца с азидсодержащими флуорофорами, то есть маркирование [15]. Данные флуорофоры с азидогруппами легко проникают в клетку, а сам метод не требует фиксации или денатурации ДНК (рис. 10).
Поделки из ДНК
Такие структуры как катенаны также могут быть созданы с помощью клик-химических превращений. Особенность подобных веществ — отсутствие химической связи между их циклическими «мономерами»: один цикл просто продевается через другой, образуется по сути механическая связь. Кстати, не так давно даже нашли фермент, имеющий такое строение [16].
Клик-синтезированные катенаны представляют из себя триазолсодержащие ДНК-наноструктуры, что позволяет называть их синтетическими плазмидами (рис. 11) [17].
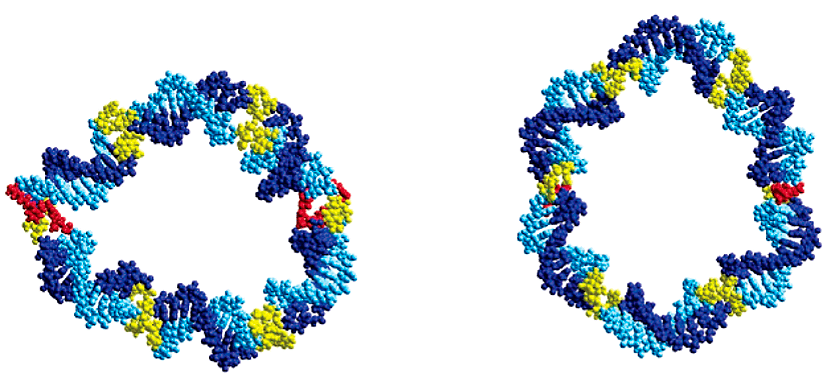
Рисунок 11. Формирование двухцепочечного псевдогексагона (неидеального шестиугольника) из одноцепочечных циклических шаблонов при помощи клик-реакции
Однако их биологическая роль еще изучена недостаточно. Возможно, что они будут обладать бóльшей устойчивостью к экзонуклеазам in vivo [18].
Другим примером клик-сборки наноструктур являются клетки с олигонуклеотидными последовательностями на поверхности. Как нетрудно догадаться, такие клетки способны к ассоциации за счет комплементарности нуклеотидных последовательностей. Клетки, собранные таким образом вместе, по сути, представляют собой трехмерную ткань с функционально обусловленной клеточной совместимостью. Существует несколько достаточно эффективных методов, позволяющих прикреплять олигонуклеотиды к поверхности клетки, например, аффинная иммобилизация олигонуклеотидов со стрептавидином за счет взаимодействия с биотинилированными мембранными белками [19], [20]. Подобная методика является отличным подспорьем для тканевой инженерии, где актуален предмет создания межклеточных контактов.
Древообразные молекулы
Речь, конечно же, идет о дендримерах — макромолекулах, которые имеют симметричное и регулярное «ветвление» своих частей (рис. 12).
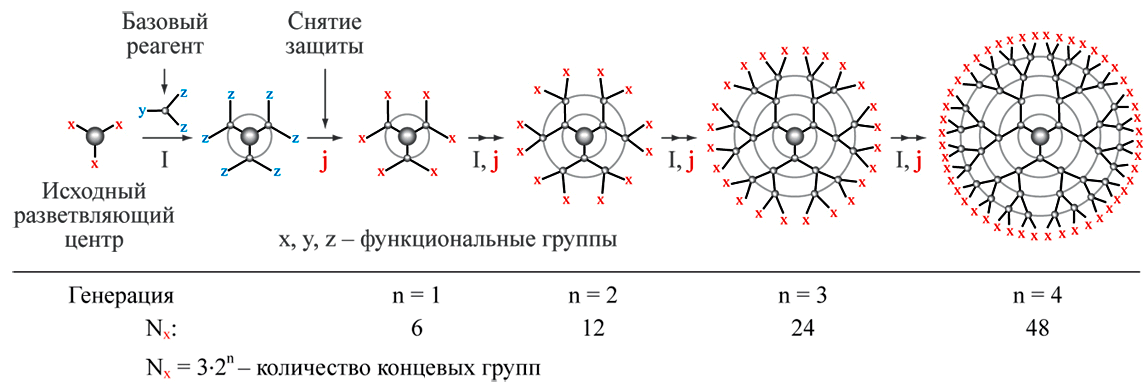
Рисунок 12. Схема синтеза дендримера, растущего с сердцевины (двумерная проекция)
Такие молекулы имеют довольно большое число ветвлений, часто даже бóльшее, чем у современных промышленных полимеров [21]. Обычно дендримеры получают из мономеров, проводя последовательные конвергентную и дивергентную полимеризации. Контролируемые размеры и свойства поверхности, а также стабильность дендримеров делают их весьма перспективными для использования в качестве переносчиков лекарств (рис. 13) [22].
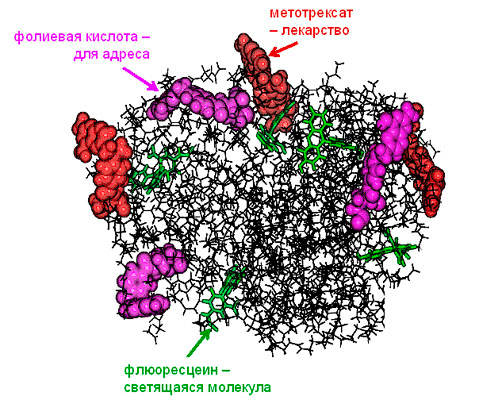
Рисунок 13. Дендример, к внешней оболочке которого прикреплены молекулы фолиевой кислоты (фиолетовые), прилипает преимущественно к раковым клеткам из-за повышенной потребности этих клеток в росте и развитии кровеносных сетей. Светящиеся молекулы флуоресцеина (зеленые) позволяют обнаружить эти клетки, а молекулы метотрексата (красные) убивают их.
Удобным и быстрым способом получения дендримеров является клик-лигирование. Например, молекулы азидотимидина, соединенные алкильными линкерами, обладают антибактериальной активностью и потенциальным пролонгированным действием [23].
Благодаря клик-реакциям практически нет ограничений для синтеза сложных молекул: несимметричные, гибридные, содержащие регулярные линейные группы, многослойные, функционализированные на концах дендримеры — все они синтезируются за один клик [24].
Подобные дендримерные структуры обязательно найдут свое применение в таких высокоценных областях, как таргетная доставка лекарств, тканевая инженерия, создание маркеров для диагностической визуализации и многое другое. Например, австралийская нанобиотехнологическая компания StarPharma разработала вагинальный гель, предотвращающий проникновение ВИЧ в организм человека половым путем. Активное вещество представляет из себя полилизиновый дендример, «украшенный» нафталиндисульфонатом по периферии [25].
Фармацевтическая помощница
Антибиотикорезистентные бактерии наступают, и нужны новые способы борьбы с ними. В настоящее время используются пептиды, нацеленные на разрушение бактериальных мембран. А что если сделать антибактериальный препарат из сахара? И это возможно благодаря клик-химии!
Предметом для модификации в недавнем исследовании выбрали циклодекстрин. Ученые заметили, что гамма-циклодекстрин содержит восемь D-глюкозных остатков, создающих структуру усеченного конуса диаметром около 1 нм, причем аналогичной структурой обладает и полимиксин B, пептидный антибиотик (рис. 14).
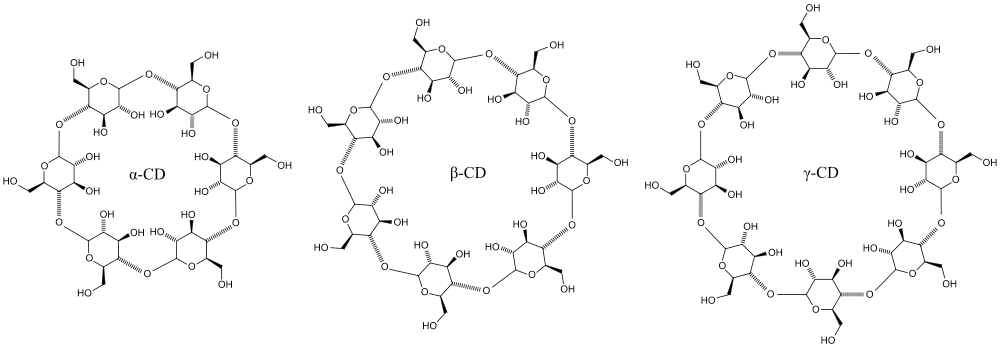
Рисунок 14. Структуры трех основных циклодекстринов. Циклодекстрины различают по количеству остатков глюкозы, содержащихся в одной их молекуле. Так простейший представитель — α-циклодекстрин — состоит из шести глюкопиранозных звеньев. β-циклодекстрин содержит семь, а γ-циклодекстрин — восемь звеньев. Нам интересен первый справа гамма-циклодекстрин.
«Кайма» конуса была клик-химически модифицирована алкиламиногруппой так, чтобы взаимодействовать с мембраной бактерий наилучшим образом. И действительно, модифицированный циклодекстрин проявил высокую активность против многих штаммов бактерий (Bacillus subtilis, Streptococcus aureus, Escherichia coli, Salmonella typhimurium и другие). Таким же образом были модифицированы и некоторые другие сахара, также проявившие разную по интенсивности антибактериальную активность. Исследования в этой области еще только начались, но, возможно, полученные вещества смогут стать альтернативой привычным антибиотикам [26].
Заключение
За последнее десятилетие клик-химия показала себя как очень удобный инструмент решения важных проблем биологии и медицины. На данный момент разрабатываются новые противораковые, антимикотические и антибактериальные препараты, и, создаваемые с помощью клик-химических методик, они смогут стать достойной заменой современным лекарствам, а также, что немаловажно, позволят снизить экономические затраты на производство как таковое.
Более того, простота клик-химических превращений позволит выполнять их людям даже без чисто химической специализации. Химия в массы — это очень удобно!
Литература
- Громова Н.Ю., Косивцов Ю.Ю., Сульман Э.М. Tехнология синтеза и биосинтеза биологически активных веществ. Тверь: ТГТУ, 2006. — С. 19–20, 60–62;
- Тарантул В.З. Толковый словарь по молекулярной и клеточной биотехнологии. М.: «Языки славянской культуры», 2015. — 984 с.;
- Josef Vagner, Hongchang Qu, Victor J Hruby. (2008). Peptidomimetics, a synthetic tool of drug discovery. Current Opinion in Chemical Biology. 12, 292-296;
- Hannah Bolt, Laurens Kleijn, Nathaniel Martin, Steven Cobb. (2018). Synthesis of Antibacterial Nisin–Peptoid Hybrids Using Click Methodology. Molecules. 23, 1566;
- Элементы: «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы»;
- Anton Chugunov, Darya Pyrkova, Dmitry Nolde, Anton Polyansky, Vladimir Pentkovsky, Roman Efremov. (2013). Lipid-II forms potential “landing terrain” for lantibiotics in simulated bacterial membrane. Sci Rep. 3;
- Арзуманов А.А., Гейт М.Д, Коршунов В.А. (2009). Пептид-олигонуклеотидные конъюгаты как антисмысловые агенты нового поколения. Молекулярная биология. 9, 998–1006;
- Северов В.В., Варижук А.М., Позмогова Г.Е. (2012). Перспективы использования методов клик-химии в биологии и медицине. Эфферентная и физико-химическая медицина. 7, 10–16.;
- Генетическое тестирование и патернализм в медицине;
- Sunita Thyagarajan, Narasimha N. Murthy, Amy A. Narducci Sarjeant, Kenneth D. Karlin, Steve E. Rokita. (2006). Selective DNA Strand Scission with Binuclear Copper Complexes: Implications for an Active Cu2−O2Species. J. Am. Chem. Soc.. 128, 7003-7008;
- Dorota I. Rozkiewicz, Johannes Gierlich, Glenn A. Burley, Katrin Gutsmiedl, Thomas Carell, et. al.. (2007). Transfer Printing of DNA by “Click” Chemistry. ChemBioChem. 8, 1997-2002;
- Реалии ДНК-«аномалии»;
- Сверхпроводящие магниты и рецепторы биомембран: Лаборатория биомолекулярной ЯМР-спектроскопии ИБХ РАН;
- Yan Xu, Yuta Suzuki, Makoto Komiyama. (2009). Click Chemistry for the Identification of G-Quadruplex Structures: Discovery of a DNA-RNA G-Quadruplex. Angew. Chem. Int. Ed.. 48, 3281-3284;
- A. Salic, T. J. Mitchison. (2008). A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105, 2415-2420;
- Фермент-катенан, или Зацепленные кольца без химической связи;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Ravindra Kumar, Afaf El-Sagheer, John Tumpane, Per Lincoln, L. Marcus Wilhelmsson, Tom Brown. (2007). Template-Directed Oligonucleotide Strand Ligation, Covalent Intramolecular DNA Circularization and Catenation Using Click Chemistry. J. Am. Chem. Soc.. 129, 6859-6864;
- A.J. Foster, R.A. Bird, S.N. Smith. (2007). Biotinylation and characterization of Cryptococcus neoformans cell surface proteins. J Appl Microbiol. 103, 390-399;
- Grigory G. Borisenko, Marina A. Zaitseva, Andrey N. Chuvilin, Galina E. Pozmogova. (2009). DNA modification of live cell surface. Nucleic Acids Research. 37, e28-e28;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Yong Ju, Pei-Yuan Jin, Peng Jin, Yi-An Ruan, Yu-Fen Zhao. (2007). Synthesis of Some Novel 1,2,3-Triazole-Fused Oligonucleoside and Oligosaccharide Analogues. Synlett. 2007, 3003-3006;
- Anna Carlmark, Craig Hawker, Anders Hult, Michael Malkoch. (2009). New methodologies in the construction of dendritic materials. Chem. Soc. Rev.. 38, 352-362;
- B. Helms. (2006). CHEMISTRY: Dendrimers at Work. Science. 313, 929-930;
- Hatsuo Yamamura, Takahiro Mabuchi, Tomoki Ishida, Atsushi Miyagawa. (2017). Syntheses and structure-membrane active antimicrobial activity relationship of alkylamino-modified glucose, maltooligosaccharide, and amylose. Chem Biol Drug Des. 90, 1012-1018.







