Изучение эволюции белков уточнило механизм действия противоопухолевого лекарства иматиниб
14 марта 2015
Изучение эволюции белков уточнило механизм действия противоопухолевого лекарства иматиниб
- 656
- 1
- 1
-
Автор
-
Редактор
В раковых клетках работают сигнальные пути, запускающие их деление. Одну из ключевых ролей в таких реакционных каскадах играют киназы. Иматиниб (торговые названия: Гливек®/Gleevec®/Glivec®, Филахромин® ФС, Генфатиниб®) — таргетный препарат, который используют для лечения ряда опухолей, — ингибирует киназу Abl, однако его действие не распространяется на похожую киназу Src. Почему так происходит, попытались выяснить ученые из университета Говарда Хьюза, изучая эволюцию белков.
Во время эмбрионального развития животного его клетки очень быстро делятся. Это обеспечивает рост и развитие зародыша. Процесс деления запускается особыми каскадами реакций. Например, чрезвычайно консервативные сигнальные пути Wnt контролируют развитие многих органов и определяют билатеральную симметрию организма как дрозофилы, так и человека [1]. Одними из ключевых белков, запускающих деление, являются киназы. Они осуществляют реакцию фосфорилирования (навешивают на молекулы фосфатную группу, что может активировать белки клеточного цикла). Сигнальные пути, запускающие деление клетки, работают не только в норме, но и при развитии опухолей. Поэтому для лечения многих злокачественных новообразований используют препараты, избирательно блокирующие активность киназ, перешедших из категории протоонкогенов в онкогены в результате мутаций. Такие онкогенные киназы выходят из-под контроля, непрерывно стимулируя деление клеток.
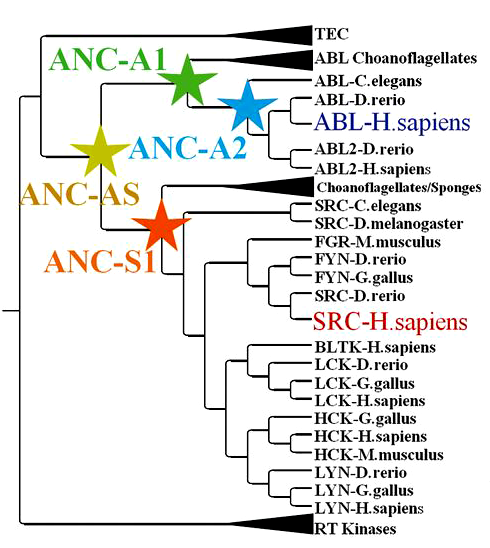
Рисунок 1. Филогенетическое древо цитоплазматических тирозинкиназ. Белок ANC-AS определен как последний общий предок тирозиновых протеинкиназ Abl и Src. Для построения дерева использовали программу BAli-Phy (анализирующую Байесовским методом [5] невыровненные последовательности и дендрограммы одновременно). Рисунок из [4].
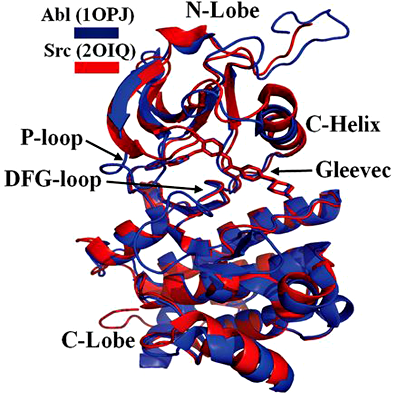
Полагают, что эволюция киназ играла ключевую роль в происхождении многоклеточности [2] и развитии высших организмов, поскольку приводила к усложнению сигнальных путей. Несмотря на большое разнообразие этих ферментов и их функций, каталитические домены (части белка, ответственные за химическую реакцию и специфичность к субстратам) киназ консервативны, даже почти идентичны [3]. Поэтому оставалось непонятным, по какой причине противоопухолевые лекарства, блокирующие одну онкогенную киназу, практически неспособны влиять на работу другой, родственной. Ярким примером может служить препарат иматиниб. Он ингибирует нерецепторную тирозинкиназу Abl (от Abelson leukemia), но не влияет на схожую с ней Src (от sarcoma), сродство к которой у иматиниба в 3 000 (!) раз ниже.
Ученые из США проанализировали эволюцию этих двух ферментов с целью найти принципиальные, однако неочевидные, различия между ними. Для этого им пришлось изучить специфичность взаимодействия препарата с киназами на атомном уровне, причем залогом успеха в решении задачи 20-летней давности стала реконструкция предковых ферментов, а также выбор интересного подхода — восстановление эволюции «энергетического ландшафта» (свободной энергии и кинетических параметров во время биологических процессов) белков [4].
Для анализа эволюционных изменений киназ Abl и Src сравнили между собой 76 родственных белков. Исследователи реконструировали (экспрессировали) и охарактеризовали четыре фермента, подходящих на роль ключевых предковых форм, включая последнего общего предка двух анализируемых человеческих киназ (рис. 1). «Восставший» из эволюционной пропасти (миллиард лет — дистанция не шуточная) пращур — ANC-AS — оказался активен и термостабилен, хоть и отличался от современных цитозольных тирозинкиназ 96-ю аминокислотными остатками, а главное — его чувствительность к иматинибу была промежуточной между Abl и Src. Если сравнить белок Abl, который очень хорошо ингибируется лекарством, с предковым, то становится ясно, что различающие их аминокислоты можно найти по всей длине полипептида. Это согласовывалось с наблюдением, что иматиниб, связываясь с киназой, изменяет ее структуру в целом, а не локально.
Получив предковую форму исследуемых белков, ученые решили определить, какие именно аминокислоты в Src инактивируют лекарство, а в Abl — усиливают его эффект. Это не получалось сделать до воскрешения ANC-AS из-за более существенной разницы между последовательностями Src и Abl (143 а.о.), чем между каждой из них и общим предком. Теперь же появилась возможность пошагово проанализировать кинетику взаимодействия ферментов разного эволюционного возраста с иматинибом и ограничить список замен, потенциально виновных в разнонаправленном изменении сродства к препарату по мере расхождения этих двух эволюционных линий.
Важно отметить, что взаимодействовать с препаратом могут обе киназы, но Src высвобождается из комплекса с ним гораздо быстрее. Выяснилось, что на судьбу взаимодействия влияет группа из 15 аминокислот в N-доле (N-Lobe на заглавном рисунке) исследуемых белков. Эти аминокислоты не являются частью активного центра (не отвечают за каталитическую работу), поэтому меняются в ходе эволюции без вреда для функции белка. Так вот у киназы Src (и предковой ANC-AS тоже), в отличие от Abl, аминокислоты этой группы образуют сеть водородных связей, как только с ферментом связывается иматиниб. Это блокирует необходимые для стабилизации комплекса «киназа-препарат», а следовательно, и ингибирования, перестройки эволюционно-консервативных структур протеинкиназы. Scr вскоре освобождается от связи и продолжает фосфорилировать свои мишени.
Таким образом, мутации, влияющие на конформационную динамику киназы, определили высокое сродство иматиниба именно к представителям эволюционной линии белка Abl.
Анализ «энергетического ландшафта» позволил также уточнить механизм резистентности к иматинибу белка Abl с клинически значимой мутацией T315I, возникающей под селективным давлением препарата.
Исследование проливает свет не только на фундамент, определяющий терапевтическую эффективность противоопухолевого лекарства, но и на роль изменений конформационной динамики («энергетических ландшафтов») в эволюции.
Литература
- Важнейшие стрелочники клеток организма: белки Wnt;
- Richter D.J. and King N. (2013). The genomic and cellular foundations of animal origins. Annu. Rev. Genet. 47, 509–537;
- Manning G., Plowman G.D., Hunter T., Sudarsanam S. (2002). Evolution of protein kinase signaling from yeast to man. Trends Biochem. Sci. 27, 514–520;
- Wilson C., Agafonov R.V., Hoemberger M., Kutter S., Zorba A., Halpin J. et al. (2015). Using ancient protein kinases to unravel a modern cancer drug’s mechanism. Science. 347, 882–886;
- Как прочитать эволюцию по генам?.