
Важнейшие стрелочники клеток организма: белки Wnt
13 октября 2012
Важнейшие стрелочники клеток организма: белки Wnt
- 7371
- 0
- 8
Дилемма стрелочника
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Говорят «стрелочник во всем виноват», а ведь он только выполняет переданную команду: скажут ему «переводи стрелку», он и направит поезд по другому пути, а не скажут — так он и не переведет. Таким же образом действуют и сигнальные молекулы нашего организма, в том числе в сигнальном пути Wnt. Задача этих биомолекул — передать «приказы» клеток-«начальников» клеткам-«подчиненным».
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Гликопротеины Wnt — это семейство секретируемых клетками сигнальных молекул, которые участвуют в координации поведения клеток в организме. Эти белки, открытые еще в начале 1980-х в качестве маркеров многих видов раковых заболеваний, оказались ключевыми регуляторами эмбрионального развития, процессов регенерации, роста костей, дифференцировки стволовых клеток и массы других процессов, связанных с морфогенезом и определением клеточной судьбы.
Структура Wnt белков
Структура белков семейства Wnt напоминает кисть руки (рис. 1; [1]). Роль большого пальца играет аминоконцевой домен, состоящий из пучка α-спиралей, стабилизированных пятью дисульфидными мостиками. «Указательный палец» — карбоксиконцевой домен, включающий два β-тяжа, поддерживаемых шестью дисульфидными мостиками. «Ладонь» обладает высокой гибкостью, обеспечивая конформационную подвижность белка. Кроме этого, к «большому пальцу» ковалентно присоединяется пальмитолеиновая жирная кислота, необходимая для взаимодействия с транспортными белками. Присоединение остатка жирной кислоты называется ацилированием, и зависит оно от другой модификации участка «ладони» — гликозилирования. Без него становится невозможным взаимодействие с транспортными белками и, следовательно, секреция.
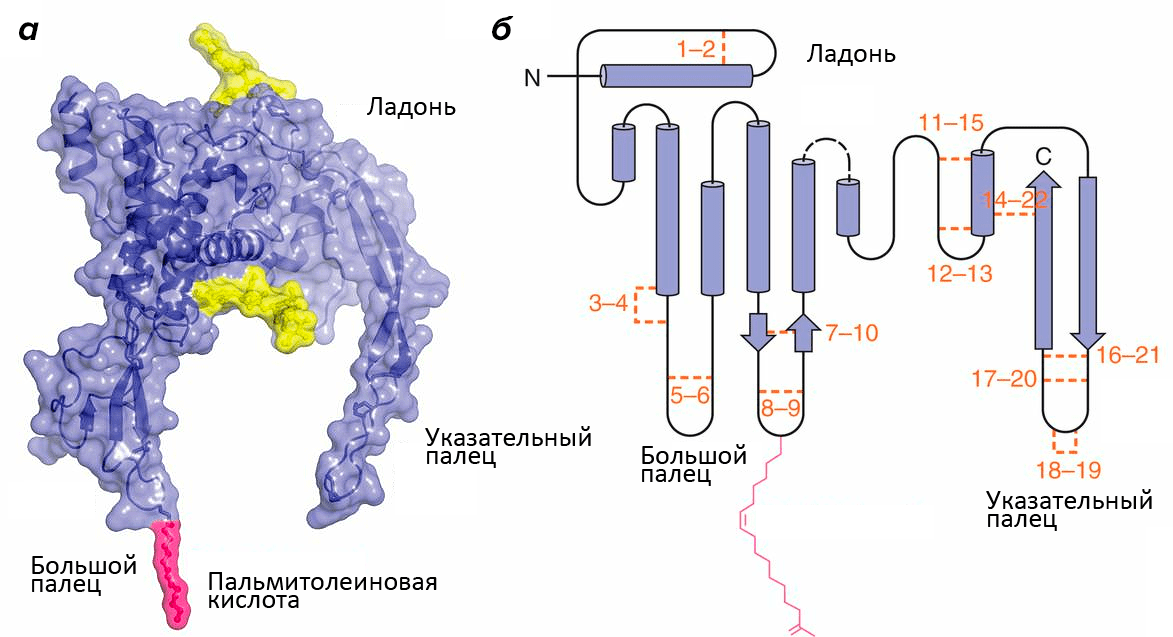
Рисунок 1. Структура Wnt. а — Объемная модель Wnt8. Желтым цветом обозначены гликозилированные участки. б — Вторичная структура Wnt. Оранжевым цветом обозначены и пронумерованы 22 остатка цистеина, которые образуют парные дисульфидные мостики. Розовым цветом обозначена ковалентно присоединенная ацильная группа: жирная кислота.
Секреция Wnt
Предполагается, что присоединение необходимого для секреции Wnt остатка жирной кислоты осуществляет ацилтранферраза эндоплазматического ретикулума Поркупин (PORCN), так как делеция этого гена нарушает секрецию Wnt (рис. 2; [4]). После ацилирования Wnt распознается белками аппарата Гольджи — трансмембранным рецептором GPR177 (широко известным как Wntless (Wls)), «белками-грузчиками» p24, которые переносят Wnt от эндоплазматического ретикулума на поверхность клетки (рис. 3; [5]) и транспортным белком Swim, который поддерживает растворимость и сигнальную активность компллекса Wnt/Wls [6].
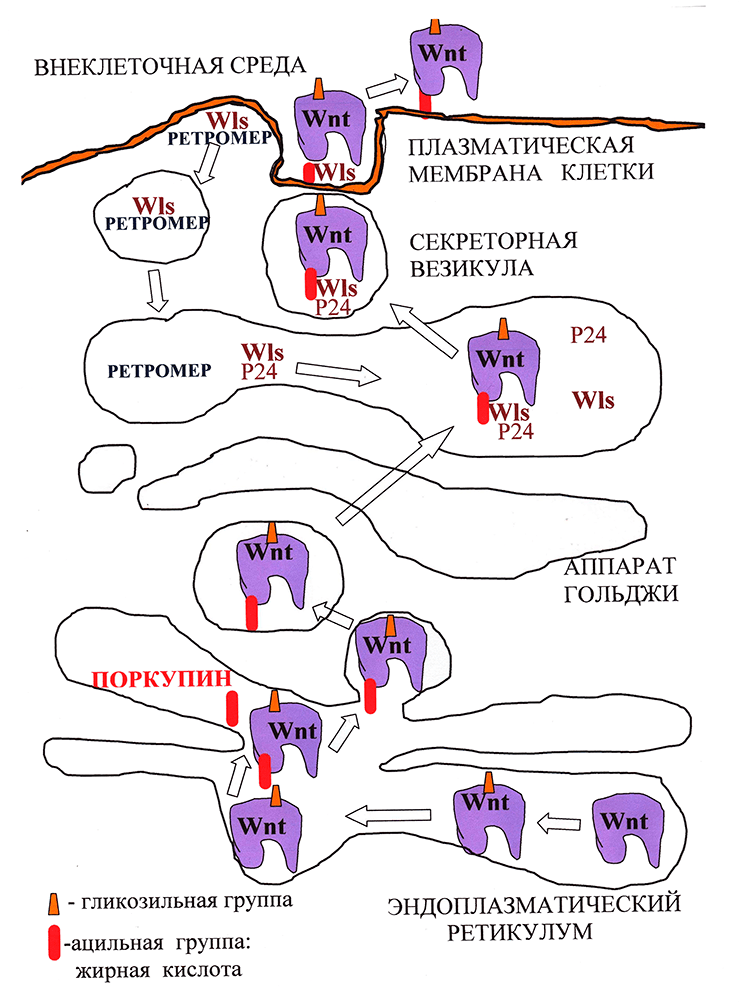
Рисунок 2. Биогенез и секреция Wnt. Молекулы Wnt в процессе созревания в эндоплазматическом ретикулуме подвергаются гликозилированию, а затем ацилированию. Затем в сопровождении белка Wntless из аппарата Гольджи они попадают в секреторные везикулы, внутри которых пересекают плазматическую мембрану, после чего секретируются. Wntless извлекается из отработанных секреторных везикул и переносится обратно в аппарат Гольджи с помощью комплекса Retromer.
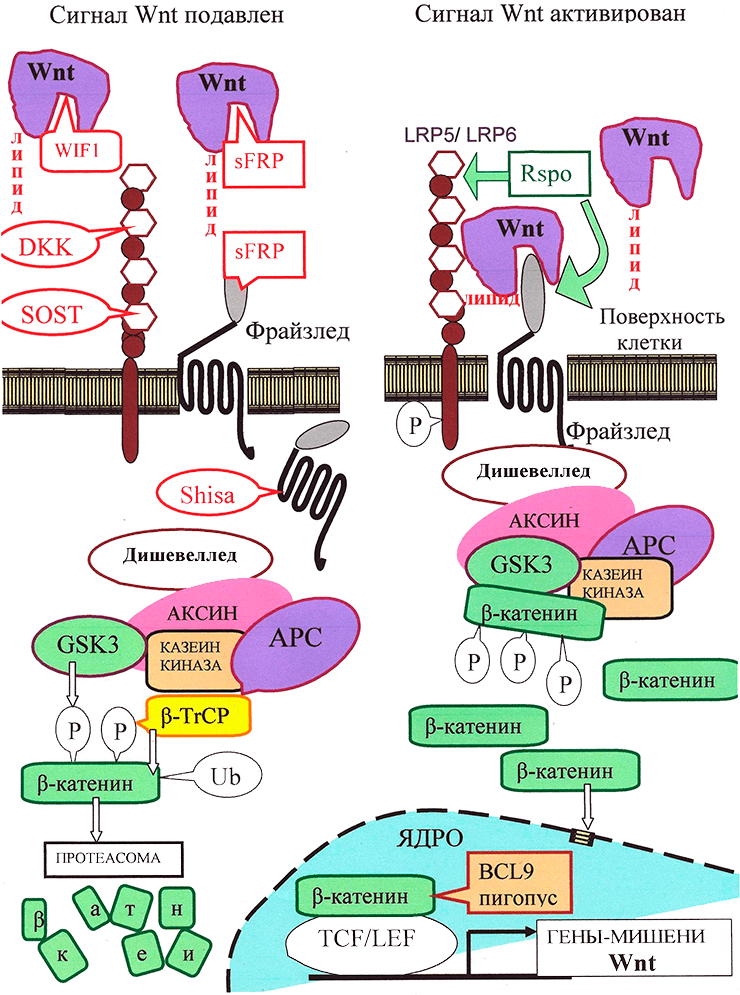
Рисунок 3. Канонический путь Wnt-сигнализации. «Рабочим телом» канонического пути является β-катенин: в неактивном состоянии его мало, а в активном — много, и он активирует транскрипцию в ядре.
Неактивное состояние: в отсутствии взаимодействия между Wnt и рецептором LRP5/6 количество цитоплазматического β-катенина малó за счет «деградационного комплекса», состоящего из белков APC, казеинкиназы и гликоген-синтезы-киназы GSK3, расположенных на «платформе» белка Аксин. С помощью этого комплекса цитоплазматический β-катенин фосфорилируется, а затем подвергается убиквитилированию белком β-TrCP, что приводит к его деградации с помощью протеасомы.
Активированное состояние: Wnt-сигнал начинается с образования комплекса Wnt с LRP5/6 и рецептором Фрайззлед (Frizzled), что приводит к активации белка Dishevelled. Это ингибирует «деградационный комплекс» и «выключает» убиквитилирование β-катенина. В результате накапливающийся в цитоплазме свободный β-катенин [16] проникает в ядро и активирует транскрипцию с помощью транскрипционных факторов TCF/LEF и ряда других.
Регуляция пути Wnt: с секретируемыми молекулами Wnt непосредственно связываются их антагонисты: Wnt-ингибирующий фактор (WIF) и Фрайззлед-узнающий белок 1 (sFRP). Кроме того, для предотвращения образования комплекса Фрайззлед—Wnt—LRP, c белками LRP5/LRP6 могут связаться DKK и склеростин. Белки Shisa, захватив рецептор Фрайззлед, мешают ему выйти на поверхность клетки. Если Wnt образует комплекс с LRP5/6 и Фрайззлед, сигнализация активируется. Белок R-spondin 2 (RSPO), стабилизируя рецепторы Фрайззлед и LRP5/6, повышает сигнализацию по пути Wnt. В эндоплазматическом ретикулуме для созревания LRP5/6 необходим сопровождающий белок MESD.
Мембранные рецепторы Wnt
Для того чтобы воздействовать на клетку-мишень, Wnt должен связаться с клеточными рецепторами. В качестве таких рецепторов на поверхности клетки выступают трансмембранный белок Фрайзлед Frizzled (Fz) и липопротеиды низкой плотности LRP5/LRP6. Связаться с ними молекуле Wnt активно мешают различные антагонисты, которым противостоят агонисты (рис. 3). Помимо этих рецепторов Wnt может связываться с рецепторными тирозинкиназами Ror и Ryk . Ror, связавшись с Wnt5a, фосфорилирует белок Дишевеллед и таким образом контролирует морфогенез тканей, тогда как Ryk, фосфорилируя мембранный белок Vangl2, контролирует полярность клетки.
Кстати, Frizzled и уже упомянутый рецептор GPR177 относятся к семейству рецепторов GPCR, за исследование которых в 2012 году была вручена Нобелевская премия по химии [7]. Рецепторные тирозинкиназы также представляют важный класс сигнальных рецепторов мембраны клетки (см., например, [8]). — Ред.
Механизмы воздействия Wnt на клетку
По традиции механизмы воздействия Wnt на клетку подразделяют на:
- канонический (β-катенин—зависимый) путь, который, в конечном счете, контролирует программы генной экспрессии, связанные с определением судьбы клетки и морфогенезом [9];
- неканонические (β-катенин—независимые) пути [10], которые регулируют полярность клетки, стимулируя реорганизацию цитоскелета [11], [12] и метаболизм кальция [13].
В основе канонического пути Wnt-сигнализации лежит стабилизация цитоплазматического белка β-катенина (рис. 3). В отсутствие сигнала β-катенин не активен и быстро деградирует. Когда клетки активируются Wnt, скорость деградации β-катенина снижается. Избежавший деградации β-катенин накапливается в цитоплазме и входит в ядро.
В ядре β-катенин, захватив ядерные белки BCL9 и пигопус (Pygopus), взаимодействует с белками TCF/LEF, превращая их в мощные активаторы транскрипции. TCF/LEF являются многофукциональными белками, которые, обладая способностью избирательно связываться с определенными последовательностями ДНК и с определенными белками-активаторами, «принимают решение», какие из генов будут активированы сигналом Wnt [14]. Обнаружено, что связь между β-катенином и TCF4, необходимая для такой активации, может быть нарушена ресвератролом. Это позволяет предположить, что ресвератрол, являющийся флавоноидом кожицы черного винограда и получаемого из него вина, может быть использован в качестве безвредного лекарства для подавления сигнала Wnt при раковых заболеваниях [15].
Влияние Wnt-сигнализации на клеточный цикл и пролиферацию клеток
Появляется все больше доказательств сложной взаимосвязи канонического пути Wnt-сигнализации и клеточного цикла. Компоненты сигнального каскада Wnt действуют непосредственно на формирование митотического веретена. Так, например, у излюбленного модельного организма молекулярных биологов — червячка C. elegans — сигнализация Wnt вызывает асимметрию митотического веретена, приводящую к асимметричному распределению β-катенина [17]. Более того, сигнализация Wnt сильно активируется в митозе, свидетельствуя о том, что «митотическая Wnt-сигнализация» играет важную роль в организации программы клеточного деления и таким образом способствует клеточной пролиферации [18].
Стволовые клетки в основном характеризуются двумя свойствами: способностью к самообновлению и дифференцировке в различные типы клеток . Эти процессы регулируются различными факторами роста, в том числе белками Wnt [19]. Накопленные данные показывают, что сигнальный путь Wnt/β-катенина играет ключевую роль в поддержании плюрипотентности, а также в процессах перепрограммирования соматических клеток. В то же время сигнализация Wnt/β-катенин играет важную роль и в процессе дифференцировки.
Дифференцировка и де-дифференцировка стволовых клеток — также предмет Нобелевской премии 2012 года (по физиологии и медицине): «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [20]. См. также [21], [22]. — Ред.
Обнаружено, что добавление белка Wnt или же, наоборот, ингибитора Wnt (малой молекулы IWP2) снижает неоднородность популяции клеток. При этом образуются либо клетки со стабильно высоким уровнем синтеза Wnt, либо клетки с низким уровнем синтеза Wnt. При дифференцировке эмбриональные клетки с высоким уровнем синтеза Wnt преимущественно образуют энтодермальные и сердечные клетки, а с низким — в первую очередь нейроэктодермальные клетки [23]. Знание того, что сигнализация Wnt на ранних стадиях дифференцировки повышает, а на поздних стадиях наоборот угнетает развитие сердца, позволило путем правильной стратегии использования малых молекул и механизмов сигнализации Wnt получить in vitro из индуцированных плюрипотентных стволовых клеток человека кардиомиоциты с недостижимой до сих пор эффективностью — до 98% [24]!
Перспективы
Вот уже 30 лет как ежегодно появляется огромное количество статей, так или иначе затрагивающих тему сигнализации Wnt. Такое пристальное внимание к этой теме вполне заслуженно, потому что «вездесущая» молекула Wnt регулярно преподносит сюрпризы. Так, например, выяснилось, что β-катенин, избежавший деградации благодаря активации Wnt-сигнала, активирует синтез ферментативной субъединицы теломеразы (TERT) в стволовых и раковых клетках. В этом ему помогает один из транскрипционных факторов плюрипотенции — Klf4, направляющий его на промотор гена Tert [25]. Как известно, теломераза — фермент, поддерживающий длину теломеров в противовес их укорочению, приводящему к старению клетки [26]. Поэтому открытие роли Wnt в стабилизации теломер может помочь как борьбе с раковыми заболеваниями, так и борьбе со старением.
Литература
- Yingzi Yang. (2012). Wnt signaling in development and disease. Cell Biosci. 2, 14;
- K. Willert, R. Nusse. (2012). Wnt Proteins. Cold Spring Harbor Perspectives in Biology. 4, a007864-a007864;
- Claudia Y. Janda, Deepa Waghray, Aron M. Levin, Christoph Thomas, K. Christopher Garcia. (2012). Structural Basis of Wnt Recognition by Frizzled. Science. 337, 59-64;
- Patrick Herr, Konrad Basler. (2012). Porcupine-mediated lipidation is required for Wnt recognition by Wls. Developmental Biology. 361, 392-402;
- Tina Buechling, Varun Chaudhary, Kerstin Spirohn, Matthias Weiss, Michael Boutros. (2011). p24 proteins are required for secretion of Wnt ligands. EMBO Rep. 12, 1265-1272;
- K. A. Mulligan, C. Fuerer, W. Ching, M. Fish, K. Willert, R. Nusse. (2012). Secreted Wingless-interacting molecule (Swim) promotes long-range signaling by maintaining Wingless solubility. Proceedings of the National Academy of Sciences. 109, 370-377;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Рецептор «нетрадиционной ориентации»;
- R. van Amerongen, R. Nusse. (2009). Towards an integrated view of Wnt signaling in development. Development. 136, 3205-3214;
- R. van Amerongen. (2012). Alternative Wnt Pathways and Receptors. Cold Spring Harbor Perspectives in Biology. 4, a007914-a007914;
- Helen L May-Simera, Matthew W Kelley. (2012). Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1;
- L. V. Goodrich, D. Strutt. (2011). Principles of planar polarity in animal development. Development. 138, 1877-1892;
- Aimee D. Kohn, Randall T. Moon. (2005). Wnt and calcium signaling: β-Catenin-independent pathways. Cell Calcium. 38, 439-446;
- K. M. Cadigan, M. L. Waterman. (2012). TCF/LEFs and Wnt Signaling in the Nucleus. Cold Spring Harbor Perspectives in Biology. 4, a007906-a007906;
- Hui-Jye Chen, Le-Shiang Hsu, Yu-Ting Shia, Meng-Wei Lin, Chung-Ming Lin. (2012). The β-catenin/TCF complex as a novel target of resveratrol in the Wnt/β-catenin signaling pathway. Biochemical Pharmacology. 84, 1143-1153;
- Vivian S.W. Li, Ser Sue Ng, Paul J. Boersema, Teck Y. Low, Wouter R. Karthaus, et. al.. (2012). Wnt Signaling through Inhibition of β-Catenin Degradation in an Intact Axin1 Complex. Cell. 149, 1245-1256;
- Kenji Sugioka, Kota Mizumoto, Hitoshi Sawa. (2011). Wnt Regulates Spindle Asymmetry to Generate Asymmetric Nuclear β-Catenin in C. elegans. Cell. 146, 942-954;
- Christof Niehrs, Sergio P Acebron. (2012). Mitotic and mitogenic Wnt signalling. The EMBO Journal. 31, 2705-2713;
- Silvia Muñoz-Descalzo, Joaquin de Navascues, Alfonso Martinez Arias. (2012). Wnt-Notch signalling: An integrated mechanism regulating transitions between cell states. Bioessays. 34, 110-118;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Timothy A. Blauwkamp, Shelly Nigam, Reza Ardehali, Irving L. Weissman, Roel Nusse. (2012). Endogenous Wnt signalling in human embryonic stem cells generates an equilibrium of distinct lineage-specified progenitors. Nat Commun. 3;
- X. Lian, C. Hsiao, G. Wilson, K. Zhu, L. B. Hazeltine, et. al.. (2012). Cozzarelli Prize Winner: Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109, E1848-E1857;
- K. Hoffmeyer, A. Raggioli, S. Rudloff, R. Anton, A. Hierholzer, et. al.. (2012). Wnt/ -Catenin Signaling Regulates Telomerase in Stem Cells and Cancer Cells. Science. 336, 1549-1554;
- Bruno Bernardes de Jesus, Elsa Vera, Kerstin Schneeberger, Agueda M. Tejera, Eduard Ayuso, et. al.. (2012). Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. EMBO Mol Med. 4, 691-704.







