
Изменение генома и... мировой науки?
16 июля 2019
Изменение генома и... мировой науки?
- 3638
- 8
- 12
Можно ли называть опыты по редактированию генома человека путем к изменению мировой науки?
-
Автор
-
Редактор
Темы
Статья на конкурс «био/мол/текст»: Наверняка почти все, кто следит за последними новостями биологии и медицины, наслышаны о курьезном случае, произошедшем под занавес 2018 года в Поднебесной. Вокруг эксперимента, о котором пойдет речь в статье, до сих пор ведутся активные споры. Это событие вызвало огромный общественный резонанс из-за нарушения всех существующих норм биоэтики. Возможно, вы и сами приняли чью-то позицию, оправдывая деятельность ученого-«виновника» или, наоборот, осуждая её. Давайте разберемся в этом сюжете поподробнее, взвесим все «за» и «против» и тем самым получим пищу для новых размышлений на эту тему.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что же это за случай? Осенью 2018 года впервые в мире на свет появились генетически модифицированные дети — близняшки Лулу и Нана. Неудивительно, что это событие взбудоражило общество. Аргументировали противники подобных экспериментов свою позицию тем, что нельзя ставить опыты на людях, если нет полной уверенности в их последствиях, тем более если речь идет об эмбрионах. Совершив поистине революционное открытие, ученый «вскрыл» многие нерешенные проблемы современной науки, определив при этом вектор развития генетики человека, причем цена этого для самого ученого оказалась высока — его арестовали и навсегда лишили возможности заниматься наукой.
С какой целью ученый взялся за запрещенный законом опыт — редактирование человеческого генома? Своевременным ли оказалось исследование? И главное, какой вклад внесла эта работа в науку? На эти и другие вопросы мы и попытаемся ответить.
Отредактированный ген
По замыслу осуществившего эту авантюру ученого, Хэ Цзянкуя из Южного университета науки и технологий (Шэнчжэнь, Китай), генетические манипуляции, которые легли в основу данного исследования, должны были придать близняшкам иммунитет к вирусу иммунодефицита человека . Ученый попытался воспроизвести открытую в 1996 году мутацию гена CCR5, которая есть у некоторых жителей Северной Европы и действительно делает своих носителей резистентными к ВИЧ, а если вирус все же заразил организм, то замедляет развитие вызываемой им болезни — СПИДа.
О том, как устроен ВИЧ и как он воздействует на иммунную систему, рассказано в статье «СПИД: как ВИЧ разрушает нашу иммунную систему» [1]. — Ред.
Исследования этой мутации сразу стали как никогда актуальны — ведь у тысяч больных СПИДом (а этот диагноз в то время звучал как приговор) появилась надежда на выздоровление. Тогда ученые окрестили СПИД «чумой XX века». И это неудивительно — количество его жертв действительно сопоставимо с эпидемией «чёрной смерти» . Пандемия началась с единичных случаев в 1981 году (когда и был открыт ВИЧ), очень быстро превратившись в проблему мирового уровня. СПИД до сих пор остается одной из самых грозных болезней, и ученые со всего мира ищут лекарство от нее и исследуют пути заражения .
Об уникальной патогенности чумного микроба читайте в статье «Смертельный поцелуй чумы» [2]. — Ред.
Как вести себя, чтобы не заразиться ВИЧ, и что делать, если это все-таки произошло, объясняет статья «Связанные одной лентой» [3]. — Ред.
Так что же это за ген — CCR5? Он кодирует специальный белковый рецептор, который нужен для управления работой иммунной системы. Этот рецептор находится на поверхности лейкоцитов и, когда это нужно (а именно после связывания с выделяемыми «больными» клетками маленькими белочками семейства хемокинов), заставляет их направляться в очаг воспаления [4].
При исследовании подвергавшихся риску заражения здоровых людей (например, вступавших в интимную близость с ВИЧ-положительными) оказалось, что для успешного инфицирования вирусом важно, чтобы в лейкоцитах был нормальный рецептор CCR5. Выяснилось, что заражение начинается с того, что вирус «пристыковывается» одновременно к CCR5 и еще одному рецептору на лейкоцитах — CD4 (рис. 1). Ученые заметили также, что у «непробиваемых» для вируса людей рецептор синтезировался лишь частично из-за того, что в кодирующем его гене был утрачен маленький фрагмент длиной в 32 нуклеотида (поэтому эту мутацию называют CCR5-Δ32, где буква Δ обозначает делецию, то есть потерю участка определенной длины). А этот «огрызок», понятное дело, уже выполнять свою функцию не может, равно, как и «впустить» вирус в клетку. Именно поэтому носители мутации, которую попытался воспроизвести Хэ Цзянькуй, имеют устойчивость к ВИЧ [5–7].
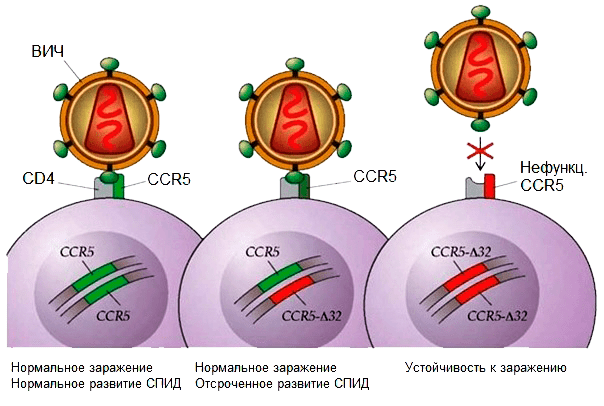
Рисунок 1. Связь заражения ВИЧ и наличия мутации CCR5
Напомним, что любой человек имеет по две копии каждого гена — одну копию от отца, а другую от матери. Так вот, у людей с иммунитетом к возбудителю СПИДа мутантны обе копии гена — такие гены называются рецессивными. А вот если у человека повреждена только одна копия гена, то нормальный CCR5 синтезируется со второй копии, но в клетке по понятной причине его оказывается в два раза меньше, чем если бы оба гена были нормальными. При этом вирус все равно проникает в клетку через здоровые рецепторы, и болезнь проявляется в полной мере, но прогрессирует чуть медленнее. Хорошо это или плохо? Скорее, плохо, так как выявить СПИД у таких людей можно лишь спустя достаточно длительное время, а сама болезнь в итоге протекает ничуть не менее тяжело, чем у людей с двумя немутантными генами.
Что именно мутация CCR5-Δ32 придает иммунитет к ВИЧ, сразу же подтвердили. Биологи показали, что все клетки людей с двумя мутантными генами не заражались ВИЧ. Причем среди больных обладатели двух мутантных копий гена попадались крайне редко — всего несколько на сотни исследуемых (вирус хоть и очень редко, но может использовать другие рецепторы). Если вы — редкий носитель двух дефектных копий гена, то риск инфицирования у вас снижен в целых 17 раз [8]!
Исследования на этом не остановились. Почти сразу же ученым пришла в голову мысль: «А что, если пересадить больному СПИДом лейкоциты с двумя дефектными генами CCR5?» Ведь инфекция ВИЧ заключается в том, что вирус проникает в лейкоциты и мешает им работать. А если в крови появятся лейкоциты, в которые вирус проникнуть не может, то человек может выздороветь.
Ученые долго изучали все плюсы и минусы данной процедуры, и в 2007 году все-таки решились ее осуществить. Группа берлинских врачей под руководством Геро Хюттера пересадила в организм пациента стволовые клетки с мутантным CCR5, которые дают начало лейкоцитам с иммунитетом к ВИЧ. Как ни странно, это помогло! Даже спустя три года, несмотря на прекращение лечения специальными подавляющими препаратами, врачи не смогли обнаружить ВИЧ в организме больного. Пациентом, впервые вылечившимся от СПИДа, стал американец Тимоти Рэй Браун, родившийся в 1966 году (рис. 2). Страшный диагноз был поставлен Брауну в 1995 году, во время учебы в Берлине, из-за чего он получил свое знаменитое прозвище «берлинский пациент» [9], [10].
Случай «берлинского пациента» описан в материале «Победа над ВИЧ: смертельная лотерея со счастливым концом» [11]. — Ред.

Рисунок 2. «Берлинский пациент» — первый в истории человек, вылечившийся от ВИЧ, вместе со своей собакой
Всего история знает троих пациентов, излечившихся от ВИЧ (причем способ лечения для всех троих врачи избрали один и тот же), но только Браун пожелал раскрыть свое имя — остальных двоих мир знает лишь по данным им прозвищам: «лондонский пациент» и «дюссельдорфский пациент».
Почему же сейчас ВИЧ всё еще считается неизлечимым? Дело в том, что, когда исследователи взвешивали все «за» и «против», они поняли, что подобная операция связана с огромным риском для жизни. Самое худшее, что может случиться, — это гибель от конфликта «родных» клеток с клетками донора, ведь в организм пересаживают заведомо другие лейкоциты, неспособные поддерживать ВИЧ-инфекцию. «Берлинский пациент» болел тяжелой формой рака крови, и единственный шанс выжить давала ему только такая операция по замене лейкоцитов. А донора с двумя мутантными генами CCR5 врачи выбрали лишь на всякий случай: вдруг больной вылечится и от рака, и от СПИДа одновременно? Аналогично поступили и с двумя другими пациентами.
Однако когда речь не идет о жизни пациента, которую может прервать какое-нибудь другое заболевание, врачи предпочитают не рисковать, чтобы ненароком еще не ухудшить состояние и так тяжелобольного. На сегодняшний день подавление вируса специальными препаратами в течение жизни намного безопаснее и позволяет жить ВИЧ-положительным людям столько же, сколько и здоровым. Поэтому до тех пор, пока не появится безопасное средство от СПИДа, которое излечивает всего за один курс, одну инъекцию или одну операцию, человечество не откажется от подавляющей терапии.
Помимо этого, есть еще одна проблема, из-за которой подход, использованный для лечения «берлинского пациента», не может стать массовым, а именно недостаток доноров костного мозга. Мало того, что подобрать донора костного мозга сейчас и так очень сложно — риск получить реакции несовместимости при пересадке костного мозга намного выше, чем при переливаниях крови, — так еще этот донор должен быть обладателем двух мутантных копий CCR5, а таких людей намного меньше 1% — это слишком мало. Поэтому, необходимо искать другие способы лечить СПИД [12].
А что, если направленно изменить CCR5 в самом организме, не затрагивая остальные гены? Эту идею вынашивали многие ученые и даже проводили опыты на животных, однако никто (кроме Хэ Цзянькуя, того самого опального ученого) так и не решился воплотить эту идею в реальность, так как редактирование генома человека запрещено не только этическими нормами, но и законом.
Тот самый эксперимент
Следующим шагом в исследовании мутации CCR5-Δ32 стал тот самый злосчастный эксперимент, на выходе из которого и получились Лулу и Нана — китайские близняшки, родившиеся (по заверениям Хэ Цзянкуя (рис. 3) абсолютно здоровыми) в ноябре 2018 года. Их настоящие имена так и не были раскрыты, а Лулу и Нана — это лишь псевдонимы, которые дал им ученый [13].

Рисунок 3. Хэ Цзянькуй на Международном саммите по редактированию генома человека
В чем же заключается суть знаменитого эксперимента по редактированию генома близняшек? Взяв неоплачиваемый отпуск в университете, ученый начал работать в городской больнице. Там он отбирал пары, которые желали иметь детей: мужчина должен был быть ВИЧ-положительным, а женщина — здоровой [18]. Ученый взял сперму и яйцеклетки у нескольких пар (да, Лулу и Нана — не единственные дети в Китае, которым Хэ отредактировал геном, просто они родились первыми), провел экстракорпоральное оплодотворение, а затем отредактировал геномы полученных эмбрионов с помощью технологии CRISPR/Cas9 , создав придающую устойчивость к ВИЧ делецию. В отличие от других революционных опытов, этот эксперимент проходил тайно до самого рождения детей, то есть до ноября 2018 года.
Эффективное узнавание и разрезание ДНК, лежащее в основе технологии CRISPR/Cas9, оказалось полезно для использования в биологии, и сейчас это самая популярная система редактирования генома. На сайте о ней написаны подробные статьи: «Просто о сложном: CRISPR/ Cas» [19] и «Битва века: CRISPR vs ВИЧ» [20].
Хэ Цзянькуй впервые объявил о своем проекте в интервью изданию Associated Press 19 ноября 2018 года. Самым интересным является то, что проект не получил подтверждения, не прошел рецензирования и не был опубликован ни в каком научном издании!
Спустя неделю, 25 ноября 2018 года журнал MIT Technology Review опубликовал рассказ об эксперименте Хэ Цзянькуя, основанный на документах, которые были размещены в том же месяце в китайском реестре клинических испытаний [21].
Когда эта история была опубликована, Хэ выпустил видео о близняшках на YouTube (видео 1), а через несколько дней, 28 ноября, представил свою работу на Международном саммите по редактированию генома человека, заявив, что гордится проделанной работой и что история на его стороне (полная часовая запись его выступления — видео 2). После этого профессор пропал: на его YouTube-канале перестали появляться новые видео, а попытки журналистов со всего мира связаться с генетиком не увенчались успехом [22].
Видео 1. Рассказ о Лулу и Нане
Видео 2. Презентация проекта Хэ Цзянькуя на II Международном саммите по редактированию генома человека
Реакцией на деятельность Хэ Цзянькуя стала волна критики и озабоченности судьбой детей. И это не удивительно, ведь вопрос редактирования человеческого генома пока остается нерешенной этической проблемой . Общественность заявляла: мало того, что ученый не предусмотрел наличия отрицательных эффектов этой мутации, так еще и не учел тот факт, что существуют формы ВИЧ, которые используют другой рецептор вместо CCR5, и манипуляции, проведенные Хэ, не смогли бы защитить Лулу и Нану от этих форм заболевания [23]. Кроме того, считается, что технология CRISPR/Cas9 еще не до конца «обкатана»: ее применение может повлечь такие неприятности как мозаицизм (когда часть клеток организма несет нормальный ген, а часть — его мутантную версию) и «нецелевое» редактирование, приводящее к раку. Собственные расследования по этому делу начали Южный научно-технологический университет, местные власти и правительство Китая. Навсегда вписав свое имя в историю науки, Хэ Цзянькуй одновременно стал изгоем научного мира, которому вряд ли представится шанс когда-либо продолжить свою работу.
Этические проблемы, связанных с генной инженерией, затронуты в статье «12 методов в картинках: генная инженерия. Часть I, историческая» [24]. А о биоэтике в целом на «Биомолекуле» опубликован отдельный материал: «Этюды о биоэтике» [25]. — Ред.
Американский специалист Майкл В. Дим, профессор биоинженерии из Университета Райса и консультант Хэ Цзянькуя, который принимал участие в исследовании, заявил, что испытуемые, участвовавшие в его опытах, давали свое согласие. Однако это никого не спасло, и Дим также попал под следствие [26]. Оказывается, участники эксперимента (всего было набрано восемь пар), возможно, сами были введены в заблуждение: Хэ демонстрировал им поддельное заключение комиссии по этике, якобы одобряющее проведение опыта. Кроме того, китайское законодательство запрещает оказывать ВИЧ-инфицированным помощь в рождении детей. А поскольку во всех парах отец был носителем ВИЧ, сдавать за них кровь на анализ профессор нанимал здоровых волонтеров. На что только не пойдет ученый ради науки...
Южный научно-технологический университет (SUSTech), сотрудником которого являлся Хэ Цзянькуй, сразу поспешил откреститься от его деятельности, и в свое оправдание сказал, что Хэ проводил исследования за пределами их кампуса в нерабочее время, и другие сотрудники ничего не знали о проекте [27].
Китайские власти тут же запретили Хэ Цзянькую заниматься наукой, заявив, что его деятельность «чрезвычайно отвратительна по своему характеру» и незаконна. В конце декабря газета New York Times сообщила, что Хэ Цзянькуй помещен под домашний арест в номере отеля в Шэньчжэне и находится под охраной десятка людей в штатском [28], [29].
Тогда еще было под вопросом, действительно ли он проводил свои опыты, так как нигде не было соответствующих публикаций. Однако месяц спустя китайские власти сообщили результаты расследования, впервые официально подтвердив информацию о генетически модифицированных близняшках. Еще одна участница эксперимента должна родить в ближайшее время. О дальнейшей судьбе ученого пока ничего и неизвестно...
Так как же реагировать на этот опыт? Какое он нам дал наследие? Своевременно ли поступил ученый, в тайне от всех редактируя человеческий геном? Сейчас разберемся подробнее и обратим свой взор на мутацию, которую ученый пытался воссоздать.
Спасение популяции человечества или неоправданный опыт?
Частота встречаемости дефектного гена CCR5 сильно варьирует у жителей разных уголков планеты (рис. 4). Чаще всего этот ген встречается на севере России и в Прибалтике — более четверти жителей этих регионов являются носителями одной или двух копий дефектного гена (но это не значит, что 25% русских защищены от ВИЧ: ведь иммунитетом к нему обладают только обладатели двух дефектных копий гена, а таких людей среди наших соотечественников от силы 1−2%). К югу и востоку частота заметно снижается. Так, в Южной Европе лишь 5−10% людей имеют дефектную копию гена, причем две такие копии из них имеет много меньше 1%. А у коренных жителей Центральной и Южной Африк, Юго-Восточной Азии и Америки эта мутация вообще не встречается [30], [31], [39].
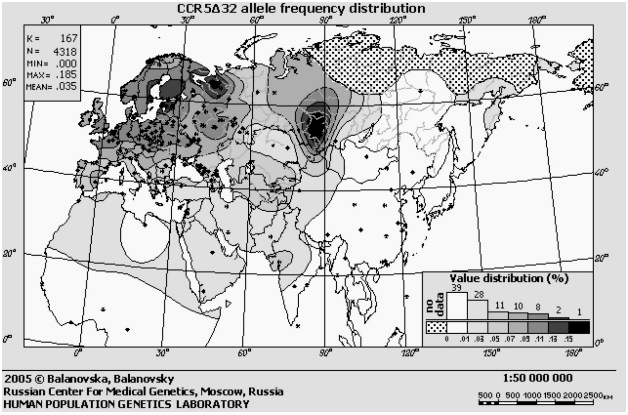
Рисунок 4. Карта частот дефектного гена CCR5 в Евразии и Северной Африке
Мутантный вариант гена CCR5 дает преимущество в ходе естественного отбора в условиях высокого риска заражения СПИДом. Это демонстрирует следующий факт. В начале 1980-х годов, когда ВИЧ был уже распространен в Европе и Америке, но еще не был взят «под контроль», людям делали переливания крови без специальных тестов на ВИЧ, которые делают сейчас. Тогда часть пациентов, которым регулярно делали переливания (например, больные гемофилией), была инфицирована ВИЧ, а часть — нет. Обследование пациентов, не заразившихся вирусом после частых трансфузий, показало, что у 16,3% из них оба гена CCR5 были дефектны. Это сильно превышает 1–2% — среднее количество обладателей двух дефектных копий гена [32], [39].
Что же могло привести к распространению мутации, защищающей от ВИЧ, в древней Европе? Ведь ВИЧ появился там лишь около 40 лет назад, и защитный ген в это время уже существовал, а вот в Африке, на родине вируса, CCR5 наоборот — редкость. Дефектный вариант гена был найден даже в останках людей, живших более 5000 лет назад, причем в этих останках частота встречаемости мутации CCR5-Δ32 примерно такая же, как и сейчас. Было выдвинуто несколько гипотез, но почти все они сразу же разрушились из-за слишком явных несоответствий [39].
Исследователи обратили внимание на тот факт, что существует два народа, исследование CCR5 у которых показывает, что отбор по мутантному варианту гена происходил сравнительно недавно. Речь идет о евреях, которые мигрировали в разные уголки Европы в течение последних 2000 лет, а также о европейских цыганах, предки которых покинули свою прародину Индию около 1000 лет назад. Здесь надо сказать, что евреи, которые живут в Европе, Америке и странах СНГ принадлежат к группе ашкеназов, а евреи-израильтяне принадлежат к группе сефардов [39].
Так вот, оказалось, что среди европейских ашкеназов хотя бы один мутантный CCR5 встречается в среднем у 13,8% представителей этой этнической группы. А вот у их азиатских и африканских предков эта величина не превышает 2−5%, что примерно равно частоте этого гена у их «соседей» в тех же регионах [39].
| Исследуемая популяция | Частота мутации в исследуемой популяции, % | Популяции-соседи | Частота мутации в популяциях-соседях, % |
|---|---|---|---|
| Евреи-ашкеназы | 13,8 | Народы Европы | 3–18 |
| Евреи-сефарды | 4,9 | Народы Ближнего Востока | 0–4 |
| Марокканские евреи | 3 | Марокканцы | 1,5 |
| Йеменские евреи | 3 | Йеменцы | 0 |
| Европейские цыгане | 12,2 | Венгры | 11,1 |
| Прародители цыган | Менее 5 | Народы Индии | Менее 5 |
То есть, частота дефектного CCR5 у них возросла после того, как они ушли из «земли обетованной» и переселились в Европу [33]. Причем этот факт нельзя объяснить тем, что еврейская нация претерпела смешение с жителями Европы, ибо частоты других генов у ашкеназов поменялись несильно [35]. Следовательно, частота встречаемости мутации у ашкеназов повысилась именно под действием естественного отбора.
Безусловно, необходимо учитывать и другие, статистические, данные, такие как, к примеру, эффект основателя (когда от популяции отделяется небольшая группа, которая может иметь сильно отличающиеся частоты вариантов генов от исходной) и случайные изменения частот вариантов генов. Однако данные исследований прямо показывают, что большее значение имел все-таки отбор, который действовал в Европе как в древнейшие времена, так и в эпоху расселения по Европе евреев и цыган. Причем причины отбора так и остаются неизвестными. Это может быть, например, какая-то инфекция, угрожавшая древним европейцам и переставшая быть опасной для современных (или же вовсе исчезнувшая) [39].
Но почему бы всем не обзавестись мутацией, если она защищает от смертельно опасного заболевания? Все не так радужно, как хотелось бы. Дело в том, что раз ген CCR5 есть и выполняет далеко не самую бесполезную функцию в организме, «управляя» белыми кровяными тельцами, логично предположить, что его поломка может негативно отразиться на работе естественных «защитников» нашего организма.
Это предположение подтверждают многочисленные исследования. Так, у носителей двух мутантных генов CCR5 повышена смертность при таком простом и распространенном заболевании, как грипп , хуже прогноз при заражении вирусом лихорадки Западного Нила, чаще встречаются осложнения при тропической болезни Шагаса, и даже отмечены нарушения функций мозга.
Различным аспектам проблемы гриппа посвящена специальная серия статей «Биомолекулы»: «Грипп». — Ред.
После курьезного эксперимента ученые плотно взялись за изучение функций отредактированного гена. Так, в июне 2019 года было опубликовано исследование, проведенное на более чем 400 тысячах добровольцев старше 40 лет. Оказалось, что у носителей двух мутантных копий гена из-за серьезных нарушений работы иммунной системы на целых 20% меньше шансов дожить до 76 лет, тогда как носители одной дефектной копии не отличаются по продолжительности жизни от тех, у кого мутации нет [36], [37], [39]. В данный момент проводят и много других исследований всего одного гена — CCR5. То есть, у опыта Хэ Цзянькуя есть и положительный момент — он побудил ученых проводить исследования подающего надежды для излечения человечества от СПИДа гена. А какое еще наследие оставил прошлогодний эксперимент?
Наследие Хэ Цзянькуя
Мировое сообщество уже пришло к консенсусу по вопросу того, оправданы ли опыты Цзянькуя, и эти выводы неутешительны для ученого. Защиту от ВИЧ можно обеспечить гораздо более простыми и безопасными способами без генетических вмешательств. Кроме того, исследователю не удалось в точности воспроизвести природную мутацию, эффект которой давно известен — ведь он использовал совершенно другой подход, нежели использовала матушка-Природа, а именно — CRISPR/Cas9. А защищают ли те изменения, которые он внес, от инфицирования ВИЧ и не дают ли каких-либо побочных эффектов, пока что до конца не известно. Именно непредсказуемость вносимых в геном изменений делает использованный метод редактирования генома пока что недозволенным для применения на человеке.
Многие исследования показывают, что цена за устойчивость к ВИЧ — это потеря здоровья от других, более распространенных заболеваний. Так что пока использование мутации CCR5-Δ32 для профилактики СПИДа остается спорным.
Тем не менее, Хэ Цзянькуй оставил неоценимое наследство. Так, этот опыт позволит ученым вплотную приступить к разработке генной терапии, которая в перспективе станет лекарством от вируса иммунодефицита. Опыт уже показал, что в принципе подобные манипуляции с геном CCR5 осуществимы и не приводят к критическим последствиям в младенческом возрасте. Главное теперь — найти еще более безопасный и этичный способ модифицировать ген CCR5, ведь технологии, которыми сейчас владеют ученые, все еще слишком «сырые», чтобы их использовать на человеке. Кроме того, опыт особенно остро поставил вопрос, на который до этого никто не мог ответить: «На что мы имеем право, вмешиваясь в организм человека, а что уже за гранью дозволенного?». Этот вопрос до сих пор порождает все новые споры, и такая ситуация чревата пересмотром многих норм биоэтики.
Есть одно условие, которое поможет человечеству извлечь максимальную пользу из молекулярной биологии: если с Лулу и Наной что-то случится, то это грозит остановкой прогресса. В такой ситуации вся отрасль может стать крайне жестко зарегулированной, не будет финансироваться и т. д. Подобные прецеденты уже были в истории науки. Поэтому в случае плохих последствий редактирования генома близняшек, прогресс не должен останавливаться, а ошибки должны быть учтены на будущее. Только в этом случае ученые смогут довести технологию до ума и ввести в практику практически идеальное средство для генетической профилактики СПИДа. Тем более что они двигаются в правильном направлении, раз все вылечившиеся от ВИЧ пациенты избавились от него благодаря мутации CCR5.
Даже после прокатившейся по миру волны негодования по поводу эксперимента Хэ Цзянькуя, есть вдохновившиеся этим событием люди, готовые продолжать его дело, а также плотно изучать мутацию гена CCR5. То есть амбициозный поступок китайца (по крайней мере сейчас, когда близняшки здоровы) не остановил прогресс, а только ускорил его.
Напоследок расскажем об одном наиболее известном продолжателе дела Хэ.
Уже в июне 2019 года, едва оправившийся от поступка китайского биолога научный мир потрясла еще одна новость — появился второй человек, готовый бросить вызов общественности и отредактировать геном человека. Меньше месяца назад всемирно известный научный журнал Nature опубликовал необычное интервью. Журналист издания беседовал с нашим соотечественником, биологом Денисом Ребриковым (рис. 5), который возглавляет лабораторию по редактированию генома в крупнейшей в России клинике репродуктивной медицины — Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. Кулакова в Москве, — а также является сотрудником московского РНИМУ им. Н.И. Пирогова. Неудивительно, что почти все мировые ученые обеспокоены планами Ребрикова.

Рисунок 5. Россиянин Денис Ребриков — второй человек в мире, готовый отредактировать ген CCR5 у зародыша человека
Ребриков, как и Хэ, собирается редактировать тот же самый ген, CCR5, но заверяет, что методика принесет большую пользу, создаст меньший риск и будет более этически приемлемой для общественности. По словам Ребрикова, у него даже есть соглашение с московским ВИЧ-центром о наборе больных женщин, которые хотят принять участие в эксперименте.
Во-первых, Ребриков собирается набирать для своих опытов не ВИЧ-больных отцов, как это делал его китайский коллега, а ВИЧ-больных матерей, причем только тех, у которых инфекция настолько тяжела, что стандартная терапия не в состоянии никак повлиять на ход болезни. Ведь риск передачи ВИЧ от отца несоизмеримо мал по сравнению с риском передачи вируса от больной матери. Таким образом, ученый сразу узнает, получился ли опыт или нет. К слову, опыты его китайского коллеги общественность назвала необоснованными в том числе и по причине того, что Хэ Цзянькуй брал для опытов ВИЧ-больных отцов.
Кроме того, Ребриков не скрывает своих планов, как это делал Хэ, так как уверен в своей методике. В России нет законов, которые прямым образом запрещали бы подобную деятельность, поэтому, чтобы уменьшить вероятность наказания, Ребриков планирует сначала получить одобрение трех правительственных учреждений, включая Минздрав. Это может занять от одного месяца до двух лет. Если разрешение будет получено, подобные опыты не отразятся настолько негативно на репутации ученого, насколько они отразились на репутации Хэ Цзянькуя, а ведь он до опытов был на хорошем счету в научном мире, а после — с позором изгнан из большой науки.
Есть опасения относительно безопасности редактирования генов у эмбрионов в целом. Ребриков же утверждает, что его эксперимент, который, как и эксперимент Хэ, предусматривает использование CRISPR/Cas9, будет безопасным. Он уже разрабатывает усовершенствованную методику CRISPR/Cas9, которая исключает побочные эффекты, и планирует в ближайшее время опубликовать результаты этого исследования в рецензируемом издании.
«Я думаю, что я достаточно сумасшедший, чтобы сделать это», — говорит ученый. Скоро мы, узнаем, чем закончится эта история, а пока что надеемся на успех и на другие исследования CCR5, которые активно начались после той истории с Лулу и Наной [38].
Наука не стоит на месте, и каждый год, даже месяц, публикуются все новые исследования, которые приближают тот день, когда можно будет с уверенностью сказать, что человечество, наконец, победило в войне с «чумой XX века». История науки творится прямо у нас на глазах, и, быть может, лекарство от ВИЧ выйдет уже совсем скоро.
Заключение
Деяние китайского ученого, вдохновившегося излечением от ВИЧ знаменитого «берлинского пациента», можно как осудить, так и поощрить. С одной стороны, ученый повел себя безрассудно — ведь технология CRISPR/Cas9 еще недостаточно «обкатана», чтобы ее применять на людях, а мутация CCR5-Δ32 имеет массу негативных побочных эффектов, из-за которых она не так распространена среди людей. Все ученые как один заявляют, что «опыт был преждевременным». Поэтому неудивительно, что общественность взбунтовалась, когда узнала об эксперименте.
Тем не менее опыт Хэ Цзянькуя оставил и огромное положительное наследие. Опальный ученый своей деятельностью побудил человечество плотно взяться за исследование этой мутации и усовершенствование технологии CRISPR/Cas9. Исследования CCR5 проводили, конечно, и раньше, что привело, в частности, к появлению первого в мире вылечившегося от ВИЧ человека, однако за последние полгода они стали наиболее интенсивными. Эти исследования в будущем могут помочь обезопасить и стандартизировать те манипуляции, которые провел Хэ, и, возможно, скоро СПИД (и не только его) будут лечить (или даже предупреждать его появление) именно генотерапией. Если с Лулу и Наной что-то случится, нельзя останавливать исследования, а надо принять все ошибки к сведению, чтобы больше их не допускать, и довести технологию лечебного редактирования генома до ума. И, быть может, именно тогда мы сможем вздохнуть с облегчением, победив в этой многолетней борьбе с бичом человечества — вирусом иммунодефицита человека. Это лишь вопрос времени.
Кроме того, опыт остро поставил этическую проблему: на что мы имеем право, вмешиваясь в организм человека, а что уже за гранью дозволенного? Законодатели отвечают на этот вопрос всегда одинаково: введением запретов. Однако одними запретами уже не отделаться, ведь редактирование генома в перспективе может открыть перед человеком массу возможностей, и глупо было бы отказываться от этого неиссякаемого рога изобилия. Технология редактирования генома развивается стремительно, чуть ли не ежедневно появляются новые публикации. А отладить технологию редактирования ДНК, отказавшись от экспериментов на человеке, — невозможно. Вскоре, вероятно, благодаря исследованиям «наследников Хэ Цзянькуя», редактирование ДНК войдет в нашу жизнь так крепко, как когда-то вошли компьютеры и интернет. В любом случае, изменения, которые внес Хэ Цзянькуй в геном эмбрионов близняшек, побудили к изменениям всю мировую науку. После рождения Лулу и Наны мир уже никогда не будет прежним...
Литература
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Смертельный поцелуй чумы;
- Связанные одной лентой;
- Joel Henrique Ellwanger, Valéria de Lima Kaminski, José Artur Bogo Chies. (2019). CCR5 gene editing – Revisiting pros and cons of CCR5 absence. Infection, Genetics and Evolution. 68, 218-220;
- Rong Liu, William A Paxton, Sunny Choe, Daniel Ceradini, Scott R Martin, et. al.. (1996). Homozygous Defect in HIV-1 Coreceptor Accounts for Resistance of Some Multiply-Exposed Individuals to HIV-1 Infection. Cell. 86, 367-377;
- Michel Samson, Frédérick Libert, Benjamin J. Doranz, Joseph Rucker, Corinne Liesnard, et. al.. (1996). Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 382, 722-725;
- M. Dean, M. Carrington, C. Winkler, G. A. Huttley, M. W. Smith, et. al.. (1996). Genetic Restriction of HIV-1 Infection and Progression to AIDS by a Deletion Allele of the CKR5 Structural Gene. Science. 273, 1856-1862;
- Боринская С. А., Кожекбаева Ж. М., Залесов А. В., Ользеева Е. В., Максимов А. Р., Куцев С. И. и др. (2012). Снижение риска инфицирования ВИЧ и летальности у гетерозигот по делеционному аллеля CCR5del32 гена хемокинового рецептора: исследование случая фокусной нозокомиальной ВИЧ-инфекции и мета-анализ. Acta Naturae. 1, 44−54;
- Picard A. (2012). Meet the man who was cured of HIV. The Globe and Mail;
- K. Allers, G. Hutter, J. Hofmann, C. Loddenkemper, K. Rieger, et. al.. (2011). Evidence for the cure of HIV infection by CCR5 32/ 32 stem cell transplantation. Blood. 117, 2791-2799;
- Победа над ВИЧ: смертельная лотерея со счастливым концом;
- Evans D. (2008). Transplanting hope: stem cell experiment raises eyebrows at CROI. POZ;
- Begley S. (2018). The CRISPR shocker: How genome-editing scientist He Jiankui rose from obscurity to stun the world. Stat News;
- Kuo L. (2018). Work on gene-edited babies blatant violation of the law, says China. The Guardian;
- Joseph A., Robbins R., Begley S. (2018). An outsider claimed genome-editing history; the world snapped to attention. Stat News;
- Coleman Z. (2018). The businesses behind the doctor who manipulated baby DNA. Nikkei Asian Review;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Marchione M. (2018). Chinese researcher claims first gene-edited babies. The Associated Press;
- Просто о сложном: CRISPR/Cas;
- Битва века: CRISPR vs ВИЧ;
- Regalado A. (2018). Exclusive: Chinese scientists are creating CRISPR babies. MIT Technology Review;
- Hynes S. (2018). The whereabouts of China's gene-editing doctor He Jiankui remain unknown. Time;
- Belluck P. (2018). Chinese scientist who says he edited babies’ genes defends his work. The New York Times;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Этюды о биоэтике;
- LaMotte S. (2018). Rice professor under investigation for role in 'world's first gene-edited babies'. CNN News;
- Southern University of Science and Technology statement on the genetic editing of human embryos conducted by Dr. Jiankui HE. (2018). SUSTC;
- Kolata G. and Belluck P. (2018). Why are scientists so upset about the first Crispr babies? The New York Times;
- Senthilingam M. (2019). Chinese scientist was told not to create world's first gene-edited babies. CNN News;
- Oleg Balanovsky, Elvira Pocheshkhova, Andrey Pshenichnov, Daria Solovieva, Marina Kuznetsova, et. al.. (2005). Is Spatial Distribution of the HIV-1-resistant CCR5Δ32 Allele Formed by Ecological Factors?. J. Physiol. Anthropol.. 24, 375-382;
- Ute V. Solloch, Kathrin Lang, Vinzenz Lange, Irina Böhme, Alexander H. Schmidt, Jürgen Sauter. (2017). Frequencies of gene variant CCR5-Δ32 in 87 countries based on next-generation sequencing of 1.3 million individuals sampled from 3 national DKMS donor centers. Human Immunology. 78, 710-717;
- Janelle R. Salkowitz, Scott F. Purvis, Howard Meyerson, Peter Zimmerman, Thomas R. O'Brien, et. al.. (2001). Characterization of High-Risk HIV-1 Seronegative Hemophiliacs. Clinical Immunology. 98, 200-211;
- S Maayan, L Zhang, E Shinar, J Ho, T He, et. al.. (2000). Evidence for recent selection of the CCR5-Δ32 deletion from differences in its frequency between Ashkenazi and Sephardi Jews. Genes Immun. 1, 358-361;
- Emese Juhász, Judit Béres, Szilvia Kanizsai, Károly Nagy. (2012). The Consequence of a Founder Effect: CCR5-∆32, CCR2-64I and SDF1-3’A Polymorphism in Vlach Gypsy Population in Hungary. Pathol. Oncol. Res.. 18, 177-182;
- Harry Ostrer, Karl Skorecki. (2013). The population genetics of the Jewish people. Hum Genet. 132, 119-127;
- Xinzhu Wei, Rasmus Nielsen. (2019). CCR5-∆32 is deleterious in the homozygous state in humans. Nat Med. 25, 909-910;
- Jeremy Luban. (2019). The hidden cost of genetic resistance to HIV-1. Nat Med. 25, 878-879;
- David Cyranoski. (2019). Russian biologist plans more CRISPR-edited babies. Nature. 570, 145-146;
- Боринская С. (2019). Благо и зло испорченного гена. «Троицкий вариант». 281, 8–9.







