
Смертельный поцелуй чумы
05 октября 2017
Смертельный поцелуй чумы
- 12983
- 0
- 1
Фрагмент картины Ханса Бальдунга «Смерть и девушка».
сайт allpainters.ru
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Возбудитель чумы как самая опасная бактерия в мире продолжает создавать угрозу безопасности мировому сообществу. Что делает его столь смертоносным? В статье рассмотрены основные причины уникальной патогенности чумного микроба на уровне биомолекул и их систем, а также обозначена перспектива поиска новых маркеров вирулентности.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Один монах, странствуя по белому свету, встретил Чуму, которая направлялась в его город.
— Ты куда это направляешься, Чума? — спросил он ее.
— Иду в твой родной город, — ответила она. — Мне нужно забрать там тысячу жизней.
Через некоторое время монах снова встретил Чуму на своем пути.
— Почему ты меня обманула тогда? — спросил он ее с укором. — Ты говорила, что должна забрать тысячу жизней, а забрала пять тысяч.
— Я тогда сказала тебе правду, — ответила Чума. — Я действительно забрала тысячу жизней. Остальные умерли от страха.
Частникова В. Еврейские притчи. Мудрец выше пророка [1]
Жертвы чумы исчислялись сотнями тысяч и даже миллионами человек, вымирали города, становились безлюдными целые области, и ужас пандемий чумы затмевал ужасы всех войн, какие знала история человечества. Целые тысячелетия люди не понимали, что является источником заболевания [2].
Библия — одно из древнейших дошедших до нас свидетельств эпидемий чумы (1 книга Царств, глава 5; 4 книга Царств, глава 19, стихи 35–36). В мировой истории отмечают три пандемии этой болезни:
- первая пандемия — «юстинианова чума» — по имени византийского императора Юстиниана, началась в Египте (542 г. н. э.) и охватила территорию всего цивилизованного мира;
- вторая пандемия — «черная смерть» (1340 г.) — неистово свирепствовала от Китая до Западной Европы и сопровождалась смертью около 25 млн. человек (примерно четвертой части тогдашнего населения Европы), а количество жертв во всем мире исчислялось 75 млн. человек [3];
- третья пандемия, зародившаяся в китайской провинции Юньнань в 1855 году, за несколько десятилетий распространилась на все обитаемые континенты. Только в Китае и Индии общее число умерших составило более 12 миллионов человек. По данным Всемирной организации здравоохранения, отголоски пандемии наблюдали и в 1959 году [4].
Крупные вспышки чумы регистрируют с определенной периодичностью (Индия — 1994 г.; Мадагаскар — 2011 и 2013 гг.). В США с 1965 по настоящее время ежегодно регистрируют до 40 случаев заражения людей чумой (в среднем 10 больных в год) [5]. В России в сентябре 2014 г. и в августе 2015 г. впервые за последние 35 лет были зарегистрированы два случая заражения человека чумой [6], [7].
Бубонная форма чумы является наиболее распространенной формой заболевания и при отсутствии лечения приводит к гибели 40–60% заболевших. Легочная форма возникает либо как осложнение бубонной или септической форм, либо при вдыхании воздуха, зараженного возбудителем чумы. Если лечение не начинают в первые 24 часа после появления симптомов, смерть наступает через 48 часов [8].
В природе чумной микроб встречается практически на всех континентах, исключая Австралию, Антарктиду, а также Арктику, что обусловливает ежегодно регистрируемые случаи этой болезни. Стремительная эволюция микроорганизмов приводит к появлению популяций бактерий (штаммов), устойчивых к антибиотикам [9], что в случае с возбудителем чумы особенно опасно. Кроме того, этих бактерий могут использовать в качестве агента биотерроризма. Все вышесказанное объясняет необходимость изучения чумного микроба.
Возбудитель чумы Yersinia pestis — самая опасная бактерия в мире [10]. Что делает ее столь смертоносной?
Факторы вирулентности, или вооружен и очень опасен
Любые патогенные бактерии должны обладать целым рядом свойств: «способностями» к инвазии (внедрению), колонизации, противостоянию иммунным реакциям организма хозяина и токсичностью. Биомолекулы, осуществляющие эти функции, называются факторами патогенности (вирулентности).
Со времен открытия возбудителя чумы в 1894 году французом Александром Йерсеном и японцем Китасато Сибасабуро ученые пытались выяснить, что определяет патогенность Y. рestis. В результате многолетней тяжелой и рискованной работы, которая продолжается и по сей день, выделили следующие факторы патогенности возбудителя:
- белки внешней мембраны (Yersinia outer proteins — называемые Yop-белками, эффекторными белками, или комплексом Yop-вирулона) [11];
- комплекс области пигментации [12];
- активатор плазминогена [13];
- капсульный антиген [14];
- пили адгезии или pH6-антиген [15].
Белки внешней мембраны, или зачем возбудителю чумы шприц?
Изучение отдельных Yop-белков, а именно V- и W-антигенов, началось еще в 1956 году [16]. Описаны также YopM, YopN, YopH, YopE, YopD и другие белки [17]. Они подавляют развитие иммунных реакций, в частности, фагоцитоз, а при «заглатывании» микробов макрофагами (иммунными клетками) обеспечивают размножение возбудителя внутри макрофагов [11]. Белки внешней мембраны синтезируются только при температуре 37 °С и в условиях дефицита ионов кальция (low calcium response) [18]. Механизм действия Yop-белков — система секреции III типа — открыт в конце прошлого века [19]. Согласно этому механизму, чумной микроб, приблизившись к эукариотической клетке, впрыскивает эффекторные белки в цитоплазму (по принципу работы шприца с образованием особого канала — «иглы») (рис. 1) [20]. Особое внимание ученые уделяют V-антигену, так как на его основе создают химическую вакцину против чумы [21].

Рисунок 1. Схема действия системы секреции III типа.
Комплекс области пигментации, или может ли стать потребность в чем-либо фактором патогенности?
В ходе лабораторных работ исследователи установили, что чумной микроб может стать авирулентным (безопасным) для мышей. При высеве таких бактерий на питательные среды с гемином (железосодержащим веществом, образующимся при действии соляной кислоты на гемоглобин) они образуют неокрашенные колонии, в отличие от пигментированных колоний вирулентных штаммов. Так появился один из простейших способов определения вирулентности штаммов возбудителя чумы без использования лабораторных животных. Если популяция бактерий на среде с гемином (среде Джексона—Берроуза) «дает» рост пигментированным колониям, то она является опасной (вирулентной), если непигментированным — то не опасной (авирулентной) [22].
Впоследствии выяснилось, что за окраску вирулентных колоний отвечают гены hms-локуса области пигментации на бактериальной хромосоме. В этой области пигментации также находится остров патогенности Y. pestis — HPI. Чем же примечательны гены этого острова и почему ему присвоили такое емкое название? Оказывается, для жизнедеятельности чумной бактерии необходимы ионы железа Fe3+. Захват и транспорт Fe3+ в клетку осуществляют низкомолекулярные молекулы, обладающие высоким сродством к железу — сидерофоры [23]. Гены, кодирующие сидерофоры, и образуют остров патогенности. По крайней мере, одна сидерофорная система, а именно система синтеза и транспорта белка иерсиниобактина, обеспечивает активный транспорт железа у иерсиний. Однако вся область пигментации крайне нестабильна и может спонтанно делетироваться из хромосомы. Выпадение из генома сидерофорной системы приводит к значительному снижению вирулентности возбудителя чумы [24]. Поэтому потребность в железе стали рассматривать как детерминанту вирулентности чумного микроба. А поскольку при делеции области пигментации удаляется и hms-локус, кодирующий признак пигментсорбции, по этой «метке» начали разделять опасные и неопасные популяции иерсиний.
Активатор плазминогена, или двуликий Янус
Большое внимание уделяют омптинам — семейству протеаз наружных мембран, которые выполняют множество функций в бактериальной клетке, в том числе перенос различных веществ через внешнюю мембрану, и, в целом, способствуют адаптации микроорганизма к условиям окружающей среды. Один из них — активатор плазминогена (Pla) [25]. Еще до выделения Pla, специалисты приходили к противоречивым, на первый взгляд, выводам. С одной стороны, чумной микроб сворачивает плазму крови (плазмокоагулирующая активность), с другой стороны — предотвращает образование кровяного сгустка (фибринолитическая активность). Тем более удивительно, что обеими этими активностями, как впоследствии выяснилось, обладает один и тот же белок — активатор плазминогена. Оказалось, что при температуре ниже 30 °С Pla проявляет плазмокоагулирующую активность. В преджелудке зараженной блохи (переносчика чумных микробов) сворачивается кровь, поступившая из больного чумой грызуна, и образуется «блок» — резервуар для размножения иерсиний. При этом голодная блоха начинает активно кусать животное или человека, не чувствуя насыщения. При поступлении свежей порции крови возбудитель с «отрыжкой» блохи проникает в ранку и инфицирует ее. Попадая в другую среду с температурой 36–37 °С — температурой тела человека (или немного выше — теплокровного животного), — активатор плазминогена начинает действовать в прямо противоположном направлении: проявляет фибринолитическую активность — препятствует образованию кровяного сгустка в месте укуса и тем самым обеспечивает распространение возбудителя [26].
Подробнее о переносчиках чумы рассказывает статья «Черная смерть. История о том, как безобидная бактерия стала беспощадной убийцей» [35]. — Ред.
При вдыхании чумных микробов (и развитии легочной чумы) этот белок обеспечивает быстрое размножение бактерий в тканях легких и приводит к развитию молниеносной пневмонии и отеку легких, тогда как в отсутствии Pla инфекция не развивается в смертельную пневмонию. Установлено, что активатор плазминогена нарушает постоянство внутренней среды организма хозяина и блокирует иммунные реакции, направленные на уничтожение патогена [27].
Капсульный антиген, или скользкий тип этот возбудитель чумы
Бактерии окружены капсулой из слизистого вещества (фракция I, Fra1), которая препятствует поглощению и обезвреживанию Y. pestis иммунными клетками организма-хозяина в процессе фагоцитоза. На выявлении этого вещества-антигена основаны многие современные методы лабораторной диагностики чумы, оно входит в состав многих экспериментальных химических вакцин против чумы. Однако позднее обнаружили популяции бактерий, лишенные капсулы [28]. Кроме того, слизистая капсула есть у многих других микроорганизмов, например, возбудителя сибирской язвы, туляремии. Капсульное вещество иерсинии образуют при температуре 37 °С.
Пили адгезии (pH6-антиген), или «агент 007»
Специфический антиген pН6 (пили адгезии — мелкие ворсинки, белок PsaA) также синтезируется только при температуре 37 °С, но есть и еще одно условие — pН ниже 6,4 (что нашло отражение в его названии). Cчитается, что это значение рН близко к рН лизосом макрофагов или некротического содержимого абсцессов, где, вероятно, и синтезируется этот антиген. рН6-антиген ответственен за прикрепление чумных микробов к эпителиальным клеткам дыхательных путей и колонизацию их. Этот антиген интересен еще и тем, что подавляет фагоцитоз: при попадании иерсиний в кровь, pH6-антигены соединяются с аполипопротеинами В плазмы, что делает бактериальные клетки «невидимыми» для макрофагов [29]. Следовательно, в изначально агрессивном теплокровном организме хозяина популяции чумного микроба с рН6-антигеном имеют больше шансов на выживание, чем популяции возбудителя чумы без рН6-антигена — феномен селекции PsaA+ бактерий [30]. В природных очагах чумы выделяют только штаммы Y. pestis с рН6-антигеном.
Антигены, схожие с рН6, были обнаружены у ряда возбудителей, вызывающих менее опасные болезни — кишечные инфекции (Y. pseudotuberculosis [31], Y. enterocolitica [32], Escherichia coli [8]).
Температурный фактор, или то, что действительно имеет значение
Необходимо заострить внимание на особой роли температуры в физиологии чумного микроба. Именно при температуре 37 °С у него повышаются питательные потребности [33] и синтезируются практически все известные детерминанты вирулентности (рис. 2) [34]. У других бактерий подобная зависимость выражена в меньшей степени, что позволяет говорить о ведущей роли температурного фактора в вирулентности возбудителя чумы [8].
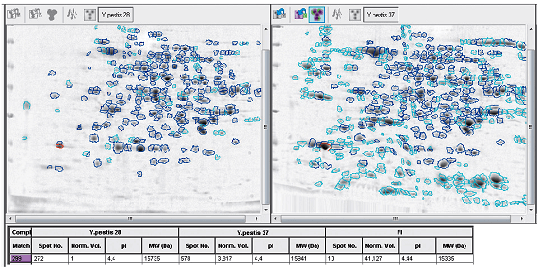
Рисунок 2. «Белковые портреты» чумного микроба, выращенного при температурах 28 и 37 °С соответственно.
Геном или все важное внутри
Современные технологии позволили расшифровать геном чумного микроба , который, как выяснилось, имеет более чем 98-процентное сходство с относительно безобидной бактерией Y. pseudotuberculosis — эволюционным предшественником возбудителя чумы (событие 5–7-тысячелетней давности) [35]. Интересно, что приобретение уникальной вирулентности Y. pestis сопровождалось утратой части генов. Например, потеря чумным микробом гена, кодирующего адгезин А (YadA), — одного из важнейших факторов вирулентности возбудителя псевдотуберкулеза, — приводит к блокированию процесса образования внеклеточных нейтрофильных ловушек — самого эффективного на настоящий момент процесса уничтожения патогенов [36]. Нейтрофильные лейкоциты в отсутствии адгезина А не могут образовывать «ловчую сеть» из собственной ДНК и протеолитических ферментов, захватывать в нее бактерий и расщеплять их [37]. У возбудителя чумы также «беднее» набор генов эффекторных белков Yop-вирулона, чем у других представителей рода иерсиний [8].
О секвенировании генома иерсиний, вызвавших «черную смерть» 1340 года, читайте в материале «Это чума» [3]. — Ред.
Помимо хромосомы у чумного микроба есть плазмиды — внехромосомные участки ДНК [38]. Большинство белковых факторов вирулентности закодированы на плазмидах: эффекторные белки на плазмиде pCad; капсула — pFra; активатор плазминогена — рPla (pPst, pPCP). Плазмиды pFra и рPla обнаружены только у Y. pestis (видоспецифические), pCad является общей с возбудителем псевдотуберкулеза (родоспецифическая) [20].
Заключение
Несмотря на успехи, достигнутые в изучении чумного микроба, вопрос о ведущих факторах вирулентности его возбудителя остается открытым. Так отмечена «неодинаковая агрессивность» штаммов Y. pestis, обладающих одинаковым набором известных факторов патогенности [8].
В настоящее время продолжается работа по выявлению новых, еще не изученных маркеров вирулентности [39]. С использованием 2D-электрофореза, масс-спектрометрии, полногеномного секвенирования проводят сравнительный анализ отличающихся по вирулентности популяций чумного микроба для выявления различий в их белковых спектрах и геномных последовательностях. Ранее не известные белки и участки генома становятся объектом пристального внимания и изучения как потенциальные детерминанты вирулентности.
Таким образом, патогенность возбудителя чумы — это множественный (полидетерминантный) признак. Соединение многих факторов в единое целое создает страшную угрозу чумных эпидемий, с противостоянием которым, однако, прогрессивное человечество успешно справляется.
Литература
- Частникова В. Еврейские притчи. Мудрец выше пророка. Litres, 2017. — 518 с.;
- Даниэл М. Тайные тропы носителей смерти / Под ред. Черкасского Б.Л. М.: «Прогресс», 1990. — 416 с.;
- Это чума;
- Википедия: Третья пандемия;
- Арутюнов Ю.И. (2016). Чума: случаи инфицирования людей в природных очагах США и сложность их выявления. ЖМЭИ. 6, 94–100;
- Кутырев В.В., Попова А.Ю., Ежлова Е.Б., Демина Ю.В., Пакскина Н.Д., Щучинов Л.В. с соавт. (2014). Заболевание человека чумой в Горно-Алтайском высокогорном природном очаге в 2014 г. Сообщение 1. Эпидемиологические и эпизоотологические особенности проявления чумы в Горно-Алтайском высокогорном (Сайлюгемском) природном очаге чумы. Проблемы особо опасных инфекций. 4, 9–16;
- Балахонов С.В., Ярыгин М.Б., Рождественский Е.Н., Базарова Г.Х., Витязева С.А., Остяк А.С. с соавт. (2016). Случай заболевания человека чумой в Кош-Агачском районе Республики Алтай в 2015 г. Сообщение 2. Микробиологическая и молекулярно-генетическая характеристика изолированных штаммов. Проблемы особо опасных инфекций. 4, 51–55;
- Домарадский И.В. Чума. М.: «Медицина», 1998. — 176 с.;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Санитарно-эпидемиологические правила СП 1.3.3118-13 «Безопасность работы с микроорганизмами I–II групп патогенности (опасности)»;
- Gregory V. Plano, Kurt Schesser. (2013). The Yersinia pestis type III secretion system: expression, assembly and role in the evasion of host defenses. Immunol Res. 57, 237-245;
- Vladimir V. Kutyrev, Andrew A. Filippov, Olga S. Oparina, Olga A. Protsenko. (1992). Analysis of Yersinia pestis chromosomal determinants Pgm+ and Psts associated with virulence. Microbial Pathogenesis. 12, 177-186;
- Куклева Л.М. и Бойко А.В. (2016). Активатор плазминогена — многофункциональный белок возбудителя чумы. Проблемы особо опасных инфекций. 3, 13–20;
- Baker E.E., Sommer H., Foster L.E., Meyer E., Meyer K.F. (1952). Studies on immunization against plague. I. The isolation and characterization of the soluble antigen of the Pasteurella pestis. J. Immunol. 68, 131–145;
- Linder L.E., Klempner M.S., Straley S.C. (1990). Yersinia pestis pH6 antigen genetic, biochemical and virulence characterization of a protein involved in the pathogenesis of bubonic plague. Infect. Immun. 58, 2569–2577;
- Bacon G.A. and Burrows T.W. (1956). The basis of virulence in Pasteurella pestis: an antigen determining virulence. Brit. J. Exp. Pathol. 37, 481–493;
- S. Felek, T. M. Tsang, E. S. Krukonis. (2010). Three Yersinia pestis Adhesins Facilitate Yop Delivery to Eukaryotic Cells and Contribute to Plague Virulence. Infection and Immunity. 78, 4134-4150;
- Goguen J., Yother J., Straley S. (1984). Genetic analysis of the low calcium response in Yersinia pestis mu d1 (Ap-lac) insertion mutants. J. Bacteriol. 160, 842–848;
- Å. Forsberg, A.-M. Viitanen, M. Skurnik, H. Wolf-Watz. (1991). The surface-located YopN protein is involved in calcium signal transduction in Yersinia pseudotuberculosis . Unknown journal title.. 5, 977-986;
- Cornelis G.R., Boland A., Boyd A.P., Geuijen C., Iriarte M., Neyt C. et al. (1998). The virulence plasmid of Yersinia, an antihost genom. Microbiol. Mol. Biol. Rev. 62, 1315–1352;
- Hill J., Williamson E., Titball R. (2009). Vaccine against Yersinia comprising one or two antibodies, one specific for Yersinia pestis F1-antigen and the other one for Yersinia pestis V-antigen. Patent US7572449 B2;
- Аракелян И.С., Кенжебаева К.Ж., Сулейменов Б.М., Некрасова Л.Е. (2002). Способ дифференциации популяции чумного микроба Yersinia pestis по Psb+ признаку. Патент 12419 (Казахстан);
- Ракин А. и Газетти Д. (2013). Различные сидерофоры обуславливают фенотип высокой патогенности иерсиний. Проблемы особо опасных инфекций. 3, 58–62;
- R. D. Perry, P. B. Balbo, H. A. Jones, J. D. Fetherston, E. DeMoll. (1999). Yersiniabactin from Yersinia pestis: biochemical characterization of the siderophore and its role in iron transport and regulation. Microbiology. 145, 1181-1190;
- Richard W Titball, Petra C F Oyston. (2007). A plague upon fibrin. Nat Med. 13, 253-254;
- W. W. Lathem, P. A. Price, V. L. Miller, W. E. Goldman. (2007). A Plasminogen-Activating Protease Specifically Controls the Development of Primary Pneumonic Plague. Science. 315, 509-513;
- J. L. Eddy, J. A. Schroeder, D. L. Zimbler, A. J. Caulfield, W. W. Lathem. (2016). Proteolysis of plasminogen activator inhibitor-1 by Yersinia pestis remodulates the host environment to promote virulence. J Thromb Haemost. 14, 1833-1843;
- Кадникова Л.А., Копылов П.Х., Дентовская С.В., Анисимов А.П. (2015). Капсульный антиген чумного микроба. Инфекция и иммунитет. 5, 201–218;
- X.-Z. Huang, L. E. Lindler. (2004). The pH 6 Antigen Is an Antiphagocytic Factor Produced by Yersinia pestis Independent of Yersinia Outer Proteins and Capsule Antigen. Infection and Immunity. 72, 7212-7219;
- Бахтеева И.В. Исследование функциональной активности рН6 антигена Yersinia pestis с помощью наборов изогенных мутантов: автореф. ... канд. мед. наук. — Москва, 2008;
- Luther E. Lindler, Ben D. Tall. (1993). Yersinia pestis pH 6 antigen forms fimbriae and is induced by intracellular association with macrophages. Mol Microbiol. 8, 311-324;
- Maite Iriarte, Jean-Claude Vanooteghem, Isabelle Delor, Ramon Diaz, Stuart Knutton, Guy R. Cornelis. (1993). The Myf fibrillae of Yersinia enterocolitica. Mol Microbiol. 9, 507-520;
- Балтазар М. (1964). Стойкость чумы в постоянных очагах. Журн. Гиг. Эпидемиол. (Прага). 8, 333–343;
- Полунина Т.А., Заднова С.П., Краснов Я.М. (2017). Применение 2D-электрофореза для получения белкового спектра фракций экзопротеинов возбудителей чумы и холеры. Проблемы особо опасных инфекций. 2, 40–44;
- Черная смерть. История о том, как безобидная бактерия стала беспощадной убийцей;
- V. Brinkmann. (2004). Neutrophil Extracellular Traps Kill Bacteria. Science. 303, 1532-1535;
- Salome Casutt-Meyer, Francesco Renzi, Mathias Schmaler, Naja J. Jann, Marlise Amstutz, Guy R. Cornelis. (2010). Oligomeric Coiled-Coil Adhesin YadA Is a Double-Edged Sword. PLoS ONE. 5, e15159;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Красильникова Е.А., Копылов П.Х., Шайхутдинова Р.З., Иванов С.А., Дентовская С.В., Анисимов А.П. Поиск факторов, отвечающих за избирательную вирулентность Yersinia pestis // Молекулярная диагностика 2017: сб. трудов. Тамбов: ООО фирма «Юлис», 2017. С. 316–317.







