Испытание временем: роль окислительного стресса в процессах старения
05 февраля 2025
Испытание временем: роль окислительного стресса в процессах старения
- 614
- 1
- 5
Тик-так, тик-так... действительно ли каждая секунда приближает нас к «финальному АФК-боссу»?
Рисунок в полном размере.
рисунок сгенерирован нейросетью ChatGPT
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Старение — тема, не первое столетие волнующая научный мир. Много открытий совершенно в этой области, однако до разгадки еще очень далеко. Одно из интереснейших направлений в изучении старения — окислительный стресс. В этой статье раскрываются ключевые аспекты того, как он связан с возраст-ассоциированными заболеваниями и старением в целом. При чем здесь митохондрии и почему их постоянно сравнивают с электростанциями? Какую роль окислительный стресс играет в развитии возраст-ассоциированных заболеваний? И какие есть перспективы для снижения токсического воздействия на наши клетки окислительного стресса?
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое старение?
Старение — это сложный процесс, который имеет множество различных определений, каждое из которых отражает различные аспекты старения. Выделяют такие термины, как биологическое, успешное, преждевременное, активное старение и другие. В рамках нашей статьи мы рассматриваем прежде всего биологическое старение. Всемирная организация здравоохранения (ВОЗ) определяет его следующим образом:
На биологическом уровне старение — это результат воздействия самых различных молекулярных и клеточных повреждений, которые накапливаются с течением времени
Именно этим определением мы будем пользоваться на протяжении всего обзора.
Причин старения существует множество. На момент проведения анализа выделяют 14 ключевых механизмов старения: нарушенная макроаутофагия, хроническое воспаление, дисбиоз, нестабильность генома, укорочение теломер, эпигенетические модификации, нарушения протеостаза, нарушение распознавания питательных веществ, дисфункция митохондрий, клеточное старение, нарушение сплайсинга, изменение механических свойств, истощение пула стволовых клеток и изменение межклеточного взаимодействия [1].
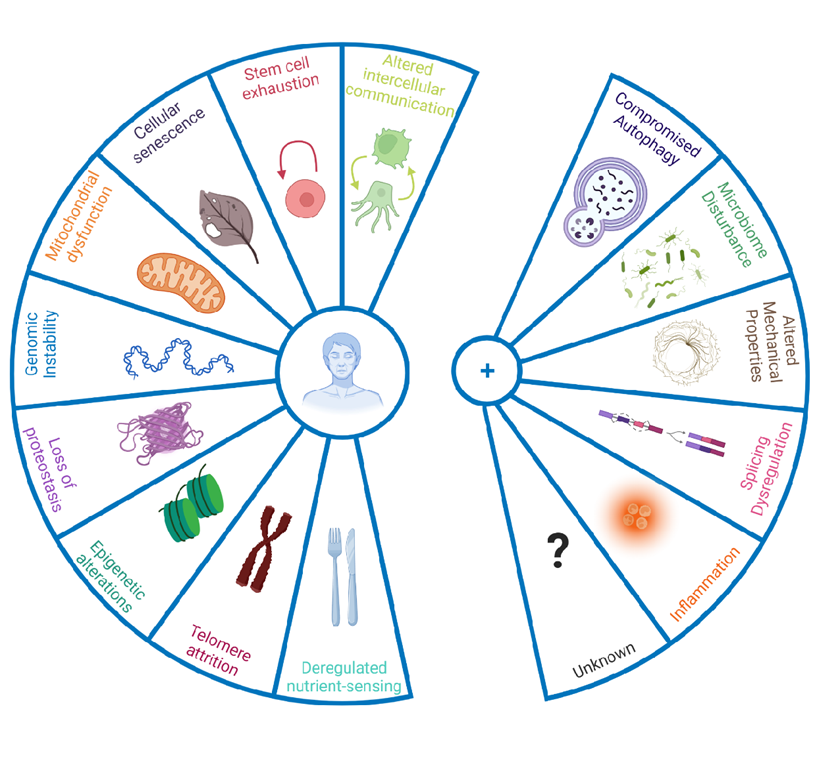
Рисунок 1. Ключевые механизмы старения. Выделяют 14 ключевых механизмов старения: нарушенная макроаутофагия, хроническое воспаление, дисбиоз, нестабильность генома, укорочение теломер, эпигенетические модификации, нарушения протеостаза, нарушение распознавания питательных веществ, дисфункция митохондрий, клеточное старение, нарушение сплайсинга, изменение механических свойств, истощение пула стволовых клеток и изменение межклеточного взаимодействия.
Одной из возможных причин, способных привести к запуску механизмов старения, является окислительный стресс — состояние, при котором нарушается баланс между активными формами кислорода (АФК) и антиоксидантными системами защиты организма.
Историческая справка
С чего же все началось? В далекие 1950-е годы, когда Дэнхем Харман, зная, что свободные радикалы, образующиеся в результате клеточного дыхания, — не самые устойчивые «товарищи», выдвинул теорию об их вредоносности. Он считал, что их накопление становится причиной нарушений функций организма из-за образования мутаций в ДНК [2]. Но на этом история не закончилась, потому что Хармана интересовала их связь со старением. Спустя около 20-ти лет теория уже звучала как митохондриальная теория старения. По сей день она имеет следующие постулаты: митохондрии продуцируют АФК, которые вызывают различные мутации; такие повреждения вызывают еще большее образование и накопление АФК [3].
Сам термин «окислительный стресс» был впервые сформулирован H. Sies в одноименной книге («Окислительный стресс») в 1985 году [4].
Почему про это важно знать?
Окислительный стресс считается одним из важнейших факторов, влияющих на развитие многих возраст-ассоциированных заболеваний. Например, хронический окислительный стресс тесно связан с повышенным риском сердечно-сосудистых заболеваний, таких как атеросклероз и артериальная гипертензия, а также с нейродегенеративными заболеваниями, в частности, болезнью Альцгеймера (БА) [5]. Это объясняет, почему в рамках старения особенно интересно изучение антиоксидантных систем клетки — веществ, которые способны нейтрализовать АФК и замедлить их разрушительное воздействие.
Таким образом, окислительный стресс — это не просто метаболический «шум», а фактор, который напрямую влияет на состояние жизненно важных органов и тканей.
Что такое вообще активные формы кислорода и откуда они берутся?
АФК образуются как побочный продукт работы наших клеток. Митохондрии, которые производят энергию, часто сравнивают с маленькими атомными электростанциями. Для того, чтобы генерировать энергию, они используют кислород. Обычно кислород в клетке находится в стабильном состоянии, и его активность строго контролируется.
Однако в процессе выработки энергии часть кислорода «утекает» и превращается в реактивные формы, такие как супероксид (O2-). Это можно сравнить с тем, как на электростанции иногда случаются выбросы веществ, которые могут быть опасны. Если таких утечек слишком много, они могут начать повреждать другие клеточные структуры [6].
Некоторые характерные примеры повреждений, которые могут нанести АФК клетке [6]:
- Перекисное окисление липидов: АФК могут способствовать окислению липидов, что ведет к потере целостности клеточных мембран и к нарушению клеточного обмена веществ. Липидные пероксиды могут запускать цепную реакцию окисления, повреждая соседние клетки и усиливая воспалительные процессы.
- Окисление белков: повреждение белков под воздействием АФК приводит к изменению их структуры и функций. Это нарушает работу ферментов и других белков, что, в свою очередь, ухудшает клеточную регуляцию и способность клеток к восстановлению. В конечном итоге это может приводить к накоплению денатурированных (поврежденных) белков.
- Повреждение ДНК: АФК могут вызывать разрывы цепи ДНК и повреждать азотистые основания. Такие мутации могут быть критическими для функционирования клетки, особенно в тех случаях, когда повреждаются гены, регулирующие деление и апоптоз. Это увеличивает риск канцерогенеза и других возраст-ассоциированных патологий.
Чтобы защитить себя, клетки используют антиоксидантные ферменты, которые действуют как «пожарные», быстро устраняя опасные АФК. Но если АФК образуется слишком много, защитные механизмы могут не справиться, и тогда начинается процесс, известный как окислительный стресс, который может повредить клетки и ускорить старение.
Несмотря на то, что АФК могут вызывать повреждения клеток, они также играют важную роль в поддержании здоровья организма. АФК необходимы для нормального функционирования многих физиологических процессов. Например, они участвуют в передаче клеточных сигналов, помогая клеткам общаться друг с другом и регулировать ключевые функции, такие как рост, деление и апоптоз [6].
Важно понимать, что продукция не только АФК, но и реактивных форм азота (РФА) увеличивается с возрастом. Именно поэтому данную тему важно рассматривать в структуре возраст-ассоциированных заболеваний. А для лучшего понимания нужно разобраться с источниками и типами радикалов.
Так почему же мы знакомим вас и с РФА? Все просто: эти соединения содержат в своей структуре кислород. К РФА относят оксид азота (NO), катион нитрозония (NO+), нитроксил (HNO), пероксинитрит (ONOO-) и др. Низкая концентрация РФА, как и АФК, не оказывает разрушительного эффекта на клеточном уровне, однако при высокой — эффект противоположный. Стоит отметить, что часто токсичность РФА повышается именно из-за воздействия АФК на них, что может привести к порочному кругу их токсического взаимодействия [6].
Теперь мы можем выделить основных представителей АФК: перекись водорода (Н2О2), супероксидный анион-радикал (O2•–), синглетный кислород (1O2), озон (О3), алкоксил (•OR), гидроксильный радикал (•OH), пероксильный радикал (•OOR) и др. (табл. 1) [6].
| Активные формы кислорода (АФК) | Реактивные формы азота (РФА) | ||
|---|---|---|---|
| Супероксидный анион-радикал | O2•– | Оксид азота | NO |
| Перекись водорода | Н2О2 | Диоксид азота | NO2 |
| Гидроксильный радикал | НО• | Пероксинитрит | ONOO- |
| Пероксильный радикал | •OOR | Нитроксил | HNO |
| Гидропероксил | HO2 | Катион нитрозония | NO+ |
| Алкоксил | •OR | Анион нитрозония | NO- |
| Озон | O3 | Нитрилхлорид | NO2Cl |
| Хлорноватистая кислота | HOCl | Триоксид азота | N2O3 |
| Синглетный кислород | 1O2 | Тетраоксид азота | N2O4 |
| Алкилпероксинитрит | ROONO | ||
| S-нитрозотиол | RSNO | ||
| Динитрозильные комплексы железа | |||
Источники радикалов могут быть как экзогенного характера, так и эндогенного. Из внешней среды (экзогенно) индукторами появления радикалов выступают радиация, различного рода загрязнения, лекарственные и токсические вещества. Внутри организма источниками АФК становятся митохондрии, пероксисомы, мембранные NAD(P)H-оксидазы и некоторые другие структуры [7].
Митохондрии
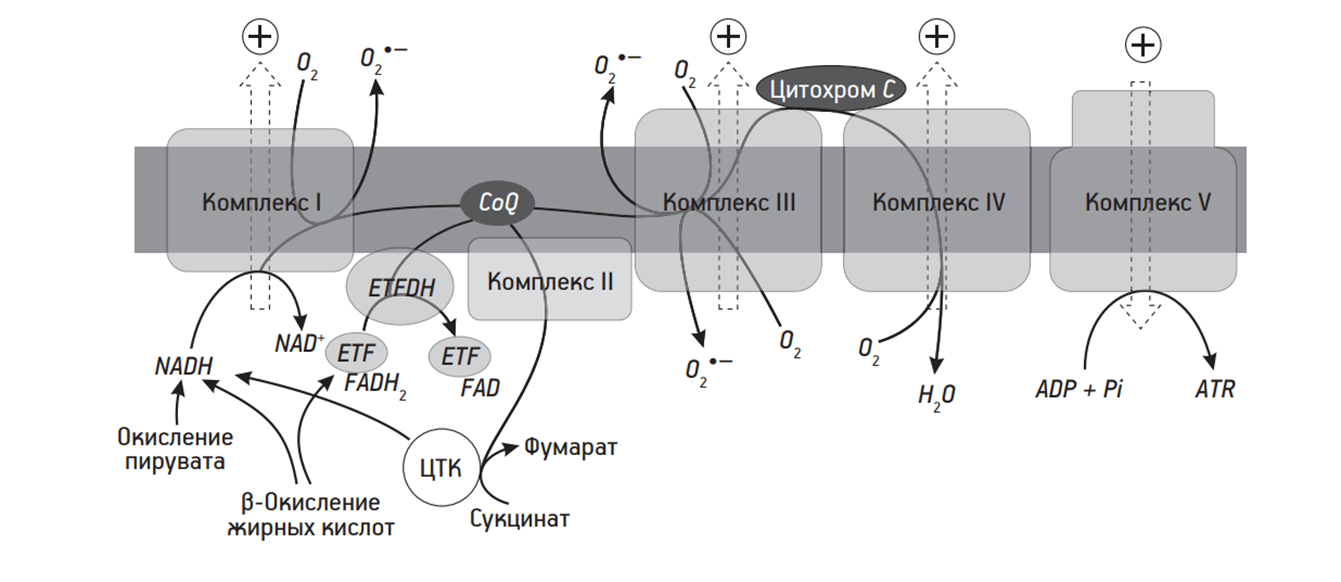
Из всех клеточных структур митохондрии больше всех требуют молекулярный кислород, но и продуцируют АФК они также много из-за функционирования дыхательной цепи. Сфокусируем свое внимание на I и III комплексах дыхательной цепи (рис. 2). По результатам нескольких исследований, в которых ингибировали NADH-убихиноноксидоредуктазу (I комплекс), получали снижение количества продуцируемого О2•–. Это натолкнуло на мысль, что, возможно, основным источником супероксид-аниона является именно NADH-убихиноноксидоредуктаза [7].
В III комплексе анион-радикалы образуются в процессе восстановления убихинона [8].
Избыточная продукция АФК особенно видна в условиях гипоксии, что может повлечь за собой повреждение митохондриальной ДНК, которая кодирует некоторые части дыхательной цепи. В итоге эти мутации только усиливают образование АФК. Такие нарушения отмечаются при возраст-ассоциированных заболеваниях. Так, например, с возрастом снижается продукция Mn-СОД (марганцевая изоформа супероксиддисмутазы) — фермента диспропорционирования, когда окисляется и восстанавливается атом одного и того же элемента. Так как радикал кислорода «не уходит» в реакцию, то он начинает оказывать свое токсическое воздействие. Интересно, что у экспериментальных животных гипопродукция СОДы (Mn, Zn, Cu-СОД) уменьшала продолжительность жизни, при этом выявлялись онкологические, сердечно-сосудистые заболевания и патология нервной системы [9], [10]. Гиперпродукция же, наоборот, способствовала увеличению продолжительности жизни. Голый землекоп (подробнее здесь [11]) — животное, известное своей долгой жизнью, — имеет более высокую скорость утилизации АФК. Все эти данные достаточно хорошо отзываются в свободнорадикальной теории старения [7].
На внешней мембране митохондрий клеток нервной ткани, печени, ЖКТ и других представлены ферменты, которые катализируют окисление биогенных аминных нейротрансмиттеров (серотонин, дофамин, адреналин, норадреналин и другие) — моноаминооксидазы. Существует мнение, что избыточная продукция АФК при нарушениях данных ферментов связана с нейродегенерацией — частой возраст-ассоциированной патологией [8].
Пероксисомы
Пероксисомы участвуют в окислительно-восстановительном гомеостазе, потребляя кислород и образовывая перекись водорода. Важно отметить, что в пероксисомах содержится множество ферментов, контролирующих окислительный стресс (табл. 2). Так, например, NO-синтаза может приводить к образованию супероксидного анион-радикала в ходе катализирования реакции при недостатке L-аргинина [7].
| Синтез АФК | Ингибирование АФК | ||
|---|---|---|---|
| Название фермента | Формула | Название фермента | Формула |
| Ацил-КоА-оксидаза | H2O2 | Каталаз | H2O2 |
| Уратоксидаза | H2O2 | Глутатионпероксидаза | H2O2 |
| Оксидаза D-аминокислот | H2O2 | Mn-СОД | O2•– |
| Оксидаза пипеколовой кислоты | H2O2 | Cu-, Zn-СОД | O2•– |
| Оксидаза D-аспартата | H2O2 | Пероксиредоксин 5 | ROOH |
| Саркозиноксидаза | H2O2 | ||
| Оксидазы L-альфа-гидроксикислот | H2O2 | ||
| Полиаминооксидаза | H2O2 | ||
| Ксантиноксидаза | H2O2, O2•– | ||
| Индуцибельная NO-синтаза | NO•, O2•– | ||
С возрастом, как отмечено в некоторых исследованиях, в перокисомах наблюдается снижение белка пероксина 5, который обеспечивает связывание ферментов с субстратом [13]. Такие возрастные изменения пероксисом могут приводить к увеличению продукции АФК, а следовательно, и к развитию возраст-ассоциированных заболеваний [7].
Эндоплазматический ретикулум
На данный момент нет весомых данных о том, каким образом эндоплазматический ретикулум (ЭПР) подвергается возрастным изменениям, однако было выявлено, что в процессе старения у человека ЭПР фибробластов расширяется [14].
Изменение строения ЭПР и снижение буферной емкости сети протеостаза при старении приводит к нарушению функции ЭПР и накоплению денатурированных белков. Потеря гомеостаза белков связана с одним из развивающихся в этот период патологическим состоянием — окислительным стрессом [15].
Важно понимать, что АФК, хоть и вносят вклад в процесс старения, но их накопление — это такой же биологический процесс, как и другие процессы в организме. Однако это не объясняет всех причинно-следственных связей и неизбежность этого накопления в процессе старения [16].
А что по системам органов?
Окислительный стресс необходимо рассматривать не только на уровне отдельных клеток, но и в масштабе систем органов. Уникальные свойства различных тканей могут приводить к совершенно разным последствиям повреждений. Поэтому начнем с одной из важнейших систем — сердечно-сосудистой, чтобы глубже понять, как эти процессы влияют на старение организма.
Сердечно-сосудистая система
Нарушение функции эндотелия
Эндотелий, выстилающий внутреннюю поверхность кровеносных сосудов, выполняет множество жизненно важных функций, включая регуляцию сосудистого тонуса и контроль агрегации тромбоцитов [17]. Одна из основных молекул, поддерживающих здоровье эндотелия, — NO, который действует как мощный вазодилататор, способствуя расслаблению сосудистых стенок. АФК, в частности, супероксид-анион, быстро инактивируют оксид азота, образуя пероксинитрит, который окисляет липиды, белки и ДНК, усугубляя эндотелиальную дисфункцию и способствуя развитию атеросклероза. А сам дефицит NO снижает способность сосудов к расширению, усиливая вазоконстрикцию и повышая артериальное давление [18].
Современные возможности позволяют диагностировать такие изменения в сосудах при сердечно-сосудистых заболеваниях. Например, можно измерить уровень вещества ADMA (асимметричный диметиларгинин), которое блокирует выработку NO. Исследования показали, что с возрастом уровень ADMA возрастает, что связано с ухудшением состояния сосудов [6]. Таким образом, отслеживание уровня ADMA позволяет понять, как старение может влиять на сердечно-сосудистую систему.
Атеросклероз
Атеросклероз — это хроническое заболевание, при котором в стенках артерий образуются бляшки. Со временем эти бляшки утолщаются, сужая просвет сосудов, снижая их эластичность и препятствуя нормальному кровотоку. Атеросклероз считается основным фактором риска для таких острых состояний, как инфаркт миокарда и инсульт [5].
Одну из ключевых ролей в развитии атеросклероза играют АФК. Они способствуют окислению липопротеинов низкой плотности (ЛПНП), которые являются основным переносчиком холестерина в крови. Окисленные ЛПНП становятся высоко реактивными и воспринимаются организмом как чужеродные частицы, что запускает мощный воспалительный ответ. В ответ на это макрофаги мигрируют и начинают поглощать окисленные ЛПНП, превращаясь в пенистые клетки. Они постепенно накапливаются, образуя первые признаки развития атеросклероза — липидное пятно. Со временем эти клетки высвобождают цитокины, факторы роста, которые запускают синтез соединительной ткани в сосуде, что приводит к формированию фиброзных бляшек. Такие образования могут увеличиваться, становиться нестабильными и разрываться. Формирующиеся в этих местах тромбы вызывают частичную или полную окклюзию (закупорку) сосуда; в дальнейшем это может приводить к развитию острых сердечно-сосудистых осложнений [5].
Структурные изменения миокарда
Главная особенность строения миокарда как мышечной ткани — это большое содержание митохондрий в клетках, а, как мы уже с вами знаем, они являются главным источником АФК. Следовательно, из-за нарушений работы этих органелл часть АФК будет выходить в клетки и нарушать процессы в ней. Именно так может возникнуть дисфункция кардиомиоцитов — главных клеток миокарда, что влияет на способность сердца сокращаться и расслабляться [18].
Согласно данным Росстата, в 2021 году в РФ около 23–38% общего числа смертей приходилось на заболевания сердечно-сосудистой системы. Этот факт подчеркивает важность изучения патогенеза сердечно-сосудистых нарушений и воздействия АФК, чтобы в будущем значительно снизить показатели смертности.
Нервная система
С увеличением продолжительности жизни растет и частота возникновения нейродегенеративных заболеваний. Одним из возможных механизмов нейродегенерации считают повреждение структур мозга под действием АФК [8].
БА — самое распространенное нейродегенеративное заболевание, характеризующееся гибелью нейронов из-за отложения нейротоксичных белковых агрегатов. Клинически БА проявляется снижением когнитивных навыков, поведенческими реакциями и полной потерей независимости в профессиональной сфере и повседневной жизни. Накопление бета-амилоида (Aβ) становится причиной повреждений как в дыхательной цепи митохондрий, так и в других структурах. Это способствует значительному увеличению продукции АФК, то есть развитию окислительного стресса. Также при нейродегенеративных процессах отмечается снижение активности антиоксидантной системы, что напрямую смещает окислительно-восстановительный баланс [19].
Другое клинически значимое нейродегенеративное заболевание — болезнь Паркинсона — связано преимущественно с дегенерацией дофаминергических нейронов. Мутации в некоторых генах, иногда имеющих место при болезни Паркинсона, вызывают митохондриальную дисфункцию, а следовательно, и увеличение продукции АФК. Существуют данные, подтверждающие, что сама черная субстанция (substantia nigra), где, собственно, и происходит дегенерация дофаминергических нейронов, участвует в образовании АФК через накопление пигмента нейромеланина [19].
Таким образом, АФК вносит также свой «токсический» вклад в патогенез нейродегенеративных заболеваний.
Иммунная система
Еще более загадочное и сложное влияние АФК производят на иммунную систему. С одной стороны, они необходимы для уничтожения патогенов: фагоциты, такие как нейтрофилы и макрофаги, производят АФК для борьбы с инфекциями [20]. С другой стороны, избыточное образование АФК этими клетками может приводить к повреждению собственных структур организма, вызывая окислительный стресс.
С возрастом эффективность антиоксидантных систем организма снижается, что приводит к накоплению АФК и нарушению работы иммунной системы. Кроме того, повышенный уровень АФК способствует развитию хронических воспалительных процессов, которые могут приводить к различным возраст-ассоциированным заболеваниям [19], [20].
Более подробно о влиянии АФК на старение иммунной системы можно прочитать в статье на «Биомолекуле»: «Старость — упущение иммунной системы или ее предательство?» [21].
Помимо систем, которые мы рассмотрели ранее, существуют и другие, не охваченные в рамках нашей статьи: эндокринная, опорно-двигательная, пищеварительная, дыхательная и многие другие. АФК воздействуют на них схожим, но в то же время уникальным образом. Это еще раз доказывает нам необходимость изучения не только общего влияния окислительного стресса, но и его специфического воздействия на каждую систему органов в отдельности.
Геропротекторы, антиоксидантные системы и биомаркеры
Биомаркеры
Ученые и врачи постоянно ищут, как можно детектировать старение и измерить биологический возраст человека. Именно поэтому активно изучаются биомаркеры старения — ключевые биологические показатели, отражающие биологический возраст организма. Они включают продукты окисления липидов (например, малоновый диальдегид), белков (например, нитротирозин) и ДНК, которые указывают на степень повреждений, вызванных окислительным стрессом (табл. 3) [6]. Эти маркеры позволяют оценивать уровень старения организма и степень его уязвимости к возрастным заболеваниям.
Биомаркеры используются также для мониторинга эффективности применения антиоксидантов и геропротекторов. Например, снижение уровня 8-OHdG (8-гидрокси-2´-дезоксигуанозин) свидетельствует о восстановлении клеточного баланса и снижении повреждений ДНК [6].
| Соединения | Маркер окисления | Обнаруженный продукт |
|---|---|---|
| Липиды | Сопряженные диены | |
| Альдегидные продукты | Малоновый диальдегид (МДА) | |
| 4-гидрокси-2-ноненаль (4-HNE) | ||
| F2-изопростаны | 8-изо-простагландин F2альфа (8-изоPGF2альфа) | |
| Оксистерол | 7-кетохолестерин (7-КС) | |
| Белки | Окисление аминокислот | 3-нитротирозин (3-HT) |
| Карбонилы белков | 2,4-динитрофенилгидразин (ДФНГ) | |
| Конечные продукты гликирования (AGE) | ||
| ДНК | Окисление нуклеотидов | 8-гидрокси-2’-дезоксигуанозин (8-OHdG) |
| Антиоксидантные маркеры | Ферменты | Супероксиддисмутаза (СОД) |
| Каталаза (КАТ) | ||
| Неферментативный | Общая антиоксидантная способность (ОАС) |
Антиоксидантные системы
Как бы не были страшны АФК, на них часто находится управа со стороны организма — эндогенных антиоксидантных систем. Эти системы призваны с помощью различных химических реакций деактивировать АФК, например, супероксиддисмутаза, каталаза и глутатионпероксидаза, которые нейтрализуют АФК, превращая их в менее реактивные молекулы, такие как вода и кислород. Кроме того, организм использует низкомолекулярные антиоксиданты, такие как глутатион, витамин Е и витамин С, которые действуют как «ловушки» для свободных радикалов, предотвращая повреждение клеток [6].
| Эндогенный ферментативный | Эндогенный неферментативный | Экзогенный | Синтетический антиоксидантный |
|---|---|---|---|
| Супероксиддисмутаза (СОД) | Витамин С | Витамины | Бутилированный гидроанизол (БГА) |
| Пероксидаза (ПОД) | Витамин Е | Минералы | Бутилированный гидротолуол (БГТ) |
| Глутатионпероксидаза (GPX) | Убихинон(коэнзим Q10) | Каротиноиды | Третичный бутигидрохинон (ТБГХ) |
| Пероксидаза (APX) | Альфа-липоевая кислота (АЛК) | Полифенолы | |
| Каталаза (КАТ) | Тиореоксин | ||
| Глюкозо-6-фосфатдегидрогеназа | Глутантион |
Однако с возрастом эффективность антиоксидантных систем снижается, что приводит к накоплению АФК и развитию окислительного стресса. Именно в этом контексте ученые направляют усилия на разработку геропротекторов — веществ, которые могут замедлить процессы старения и защитить организм от негативного воздействия АФК.
Геропротекторы
Геропротекторы делятся на несколько категорий в зависимости от механизма действия. Одни из них усиливают активность естественных антиоксидантных систем организма, стимулируя выработку защитных ферментов. Другие непосредственно нейтрализуют АФК, действуя как мощные антиоксиданты. Примеры таких веществ включают ресвератрол, убихинон (коэнзим Q10) и мелатонин, которые не только уменьшают окислительный стресс, но и улучшают работу митохондрий [6].
Современная медицина активно использует антиоксиданты в терапии заболеваний, связанных с окислительный стрессом. Например, препараты с витамином Е или С применяются для улучшения состояния сосудов при сердечно-сосудистых заболеваниях [19]. Также разрабатываются новые геропротекторы, такие как МТА-соединения — соединения антиоксидантов, нацеленных на митохондрии, которые способны избирательно накапливаться в митохондриях и защищать их от повреждений [19].
Кроме того, перспективными направлениями остаются генные и клеточные технологии, направленные на усиление антиоксидантной защиты организма. Одной из интересных идей является создание искусственных ферментов, которые смогут работать более эффективно, чем природные аналоги или генная терапия, позволяющая активировать антиоксидантные системы на уровне ДНК [22].
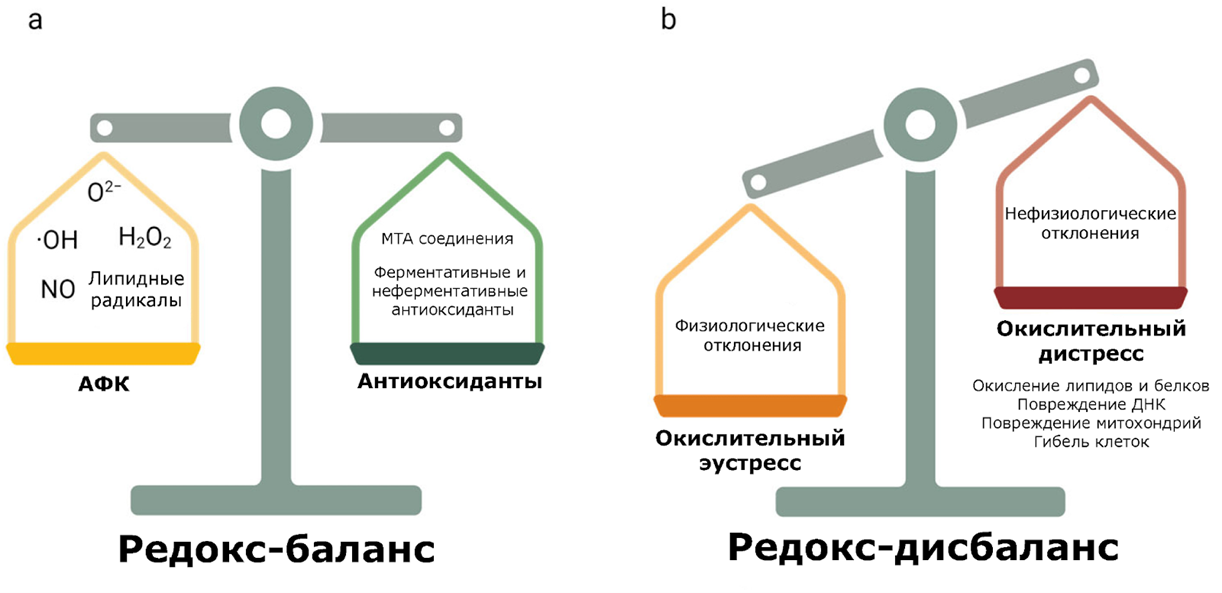
Рисунок 3. Редокс-баланс и редокс-дисбаланс [23]. В организме поддерживается редокс-баланс: умеренные, так называемые физиологические отклонения в этом равновесии называют «окислительным эустрессом», тогда как чрезмерные нарушения, то есть патологические, классифицируются как «окислительный дистресс» [19].
адаптировано из [19]
В будущем комбинированное использование биомаркеров и геропротекторов позволит разработать персонализированные стратегии борьбы со старением, повышая точность диагностики и эффективность лечения. Это делает их важным инструментом как в научных исследованиях, так и в клинической практике.
Завершая наш обзор, необходимо обратить ваше внимание, что теория окислительного стресса в рамках старения действительно испытывалась временем и претерпевала немало изменений. Рассматривая влияние АФК на организм, важно помнить, что существует также много других факторов, которые могут ускорять старение и являться его причиной, поэтому окислительный стресс является важным, но не самым главным из них. Его важно рассматривать в совокупности с другими процессами в организме, чтобы понять истинную причину старения и патогенез возраст-ассоциированных заболеваний.
Литература
- Tomas Schmauck-Medina, Adrian Molière, Sofie Lautrup, Jianying Zhang, Stefan Chlopicki, et. al.. (2022). New hallmarks of ageing: a 2022 Copenhagen ageing meeting summary. Aging. 14, 6829-6839;
- D. Harman. (1956). Aging: A Theory Based on Free Radical and Radiation Chemistry. Journal of Gerontology. 11, 298-300;
- Denham Harman. (2009). Origin and evolution of the free radical theory of aging: a brief personal history, 1954–2009. Biogerontology. 10, 773-781;
- Helmut Sies. (2015). Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183;
- Younis Ahmad Hajam, Raksha Rani, Shahid Yousuf Ganie, Tariq Ahmad Sheikh, Darakhshan Javaid, et. al.. (2022). Oxidative Stress in Human Pathology and Aging: Molecular Mechanisms and Perspectives. Cells. 11, 552;
- Daniela F. Santos, Sónia Simão, Clévio Nóbrega, José Bragança, Pedro Castelo‐Branco, et. al.. (2024). Oxidative stress and aging: synergies for age related diseases. FEBS Letters;
- Н. К. Зенков, П. М. Кожин, А. В. Чечушков, Н. В. Кандалинцева, Г. Г. Мартинович, Е. Б. Меньщикова. (2020). OXIDATIVE STRESS IN AGING. Успехи геронтологии. 10-22;
- Ailton Melo, Larissa Monteiro, Rute M. F. Lima, Diêgo M. de Oliveira, Martins D. de Cerqueira, Ramon S. El-Bachá. (2011). Oxidative Stress in Neurodegenerative Diseases: Mechanisms and Therapeutic Perspectives. Oxidative Medicine and Cellular Longevity. 2011, 1-14;
- Yibing Li, Ting-Ting Huang, Elaine J. Carlson, Simon Melov, Philip C. Ursell, et. al.. (1995). Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat Genet. 11, 376-381;
- R M Lebovitz, H Zhang, H Vogel, J Cartwright, L Dionne, et. al.. (1996). Neurodegeneration, myocardial injury, and perinatal death in mitochondrial superoxide dismutase-deficient mice.. Proc. Natl. Acad. Sci. U.S.A.. 93, 9782-9787;
- Голый землекоп и рак: кто кого?;
- Молодость в энергии;
- Ndidi-Ese Uzor, Diego Morales Scheihing, Gab Seok Kim, Jose Felix Moruno-Manchon, Liang Zhu, et. al.. (2020). Aging lowers PEX5 levels in cortical neurons in male and female mouse brains. Molecular and Cellular Neuroscience. 107, 103536;
- Clémentine Druelle, Claire Drullion, Julie Deslé, Nathalie Martin, Laure Saas, et. al.. (2016). ATF6α regulates morphological changes associated with senescence in human fibroblasts. Oncotarget. 7, 67699-67715;
- Chen Chen, Xueyan Dong, Wang Zhang, Xing Chang, Wulin Gao. (2024). Dialogue between mitochondria and endoplasmic reticulum-potential therapeutic targets for age-related cardiovascular diseases. Front. Pharmacol.. 15;
- Vadim N. Gladyshev. (2014). The Free Radical Theory of Aging Is Dead. Long Live the Damage Theory!. Antioxidants & Redox Signaling. 20, 727-731;
- Francesco Nappi, Antonio Fiore, Joyce Masiglat, Teresa Cavuoti, Michela Romandini, et. al.. (2022). Endothelium-Derived Relaxing Factors and Endothelial Function: A Systematic Review. Biomedicines. 10, 2884;
- Jiao Luo, Kevin Mills, Saskia le Cessie, Raymond Noordam, Diana van Heemst. (2020). Ageing, age-related diseases and oxidative stress: What to do next?. Ageing Research Reviews. 57, 100982;
- Eveljn Scarian, Camilla Viola, Francesca Dragoni, Rosalinda Di Gerlando, Bartolo Rizzo, et. al.. (2024). New Insights into Oxidative Stress and Inflammatory Response in Neurodegenerative Diseases. IJMS. 25, 2698;
- Christopher Dunnill, Thomas Patton, James Brennan, John Barrett, Matthew Dryden, et. al.. (2017). Reactive oxygen species (ROS) and wound healing: the functional role of ROS and emerging ROS‐modulating technologies for augmentation of the healing process. International Wound Journal. 14, 89-96;
- Старость — упущение иммунной системы или ее предательство?;
- Riku Kubota, Taiga Takabe, Kohe Arima, Hideaki Taniguchi, Shoichiro Asayama, Hiroyoshi Kawakami. (2018). New class of artificial enzyme composed of Mn-porphyrin, imidazole, and cucurbit[10]uril toward use as a therapeutic antioxidant. J. Mater. Chem. B. 6, 7050-7059;
- Сказка-комикс о великой битве между радикалами и антиоксидантами.