
Иммунные войны: космическая онкологическая сага
16 октября 2019
Иммунные войны: космическая онкологическая сага
- 987
- 14
- 4
-
Автор
-
Редакторы
-
Иллюстратор
Комикс на конкурс «био/мол/текст»: Давным-давно, в далекой-далекой Галактике... Нет, на самом деле, каждую секунду в каждом человеческом организме... Идет освободительная война. Космические корабли защитников Галактики одержали первую победу в битве со зловещими захватчиками. Во время сражения разведчикам защитников удалось заполучить образцы секретного оружия, способного уничтожить целую Галактику. Эти образцы помогут обнаружить вражеские корабли. Воодушевленные успехом, защитники собирают космический флот, чтобы дать захватчикам решительный отпор.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
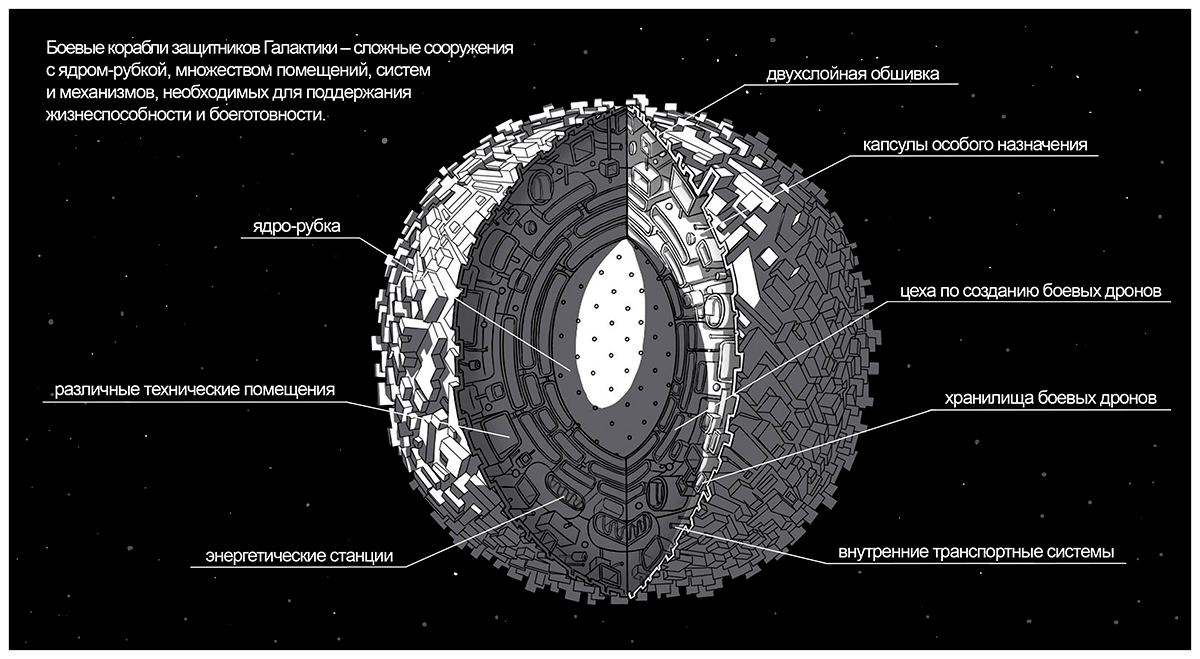
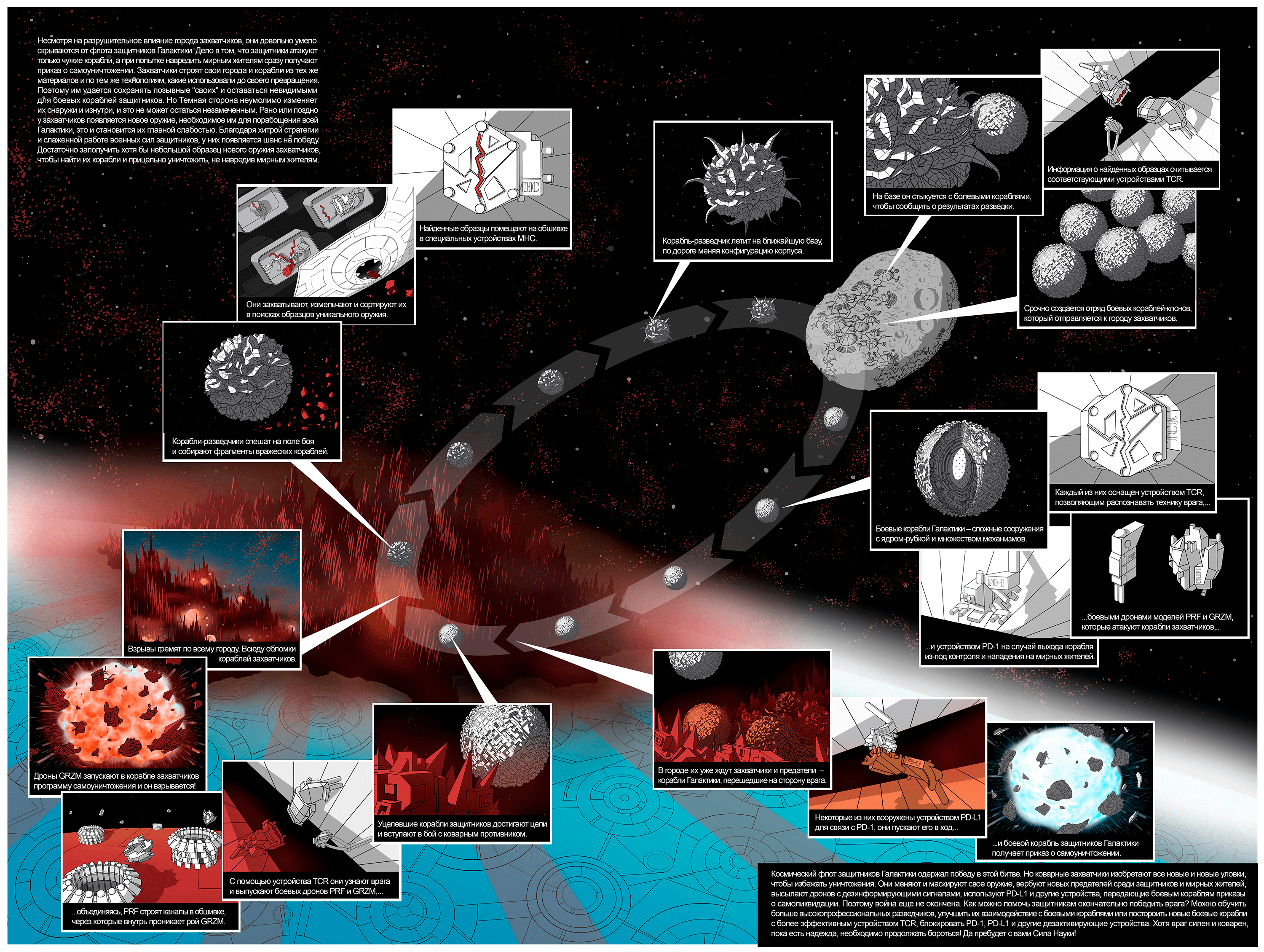
Человеческий организм — как Галактика, состоящая из планет-органов. Жители планет — клетки — образуют ткани — города с разной архитектурой. У разных планет-органов своя специализация (функция в организме). Транспортные магистрали — кровеносные и лимфатические сосуды, по которым путешествуют космические корабли — клетки крови. Также по магистралям-сосудам перемещаются сигнальные дроны — различные молекулы, влияющие на жизнь клеток и целых органов.
Город захватчиков — злокачественное новообразование, состоящее из опухолевых клеток — кораблей захватчиков. Для них характерны способность к неограниченному размножению (репликативное бессмертие), постоянные мутации, измененный метаболизм. Они внешне отличаются от нормальных клеток, от которых они произошли, и часто перестают выполнять присущую им функцию. Опухоль (город захватчиков) потребляет огромное количество питательных веществ и непрерывно растет, активно влияет на окружающие ткани, сдавливая их, формируя свою кровеносную систему, поддерживая воспаление. Как и все захватчики, злокачественные клетки стараются поработить как можно больше городов на родной планете (инвазивный рост), а также отправляют свои космические корабли на другие планеты (метастазирование в другие органы) [1], [2].
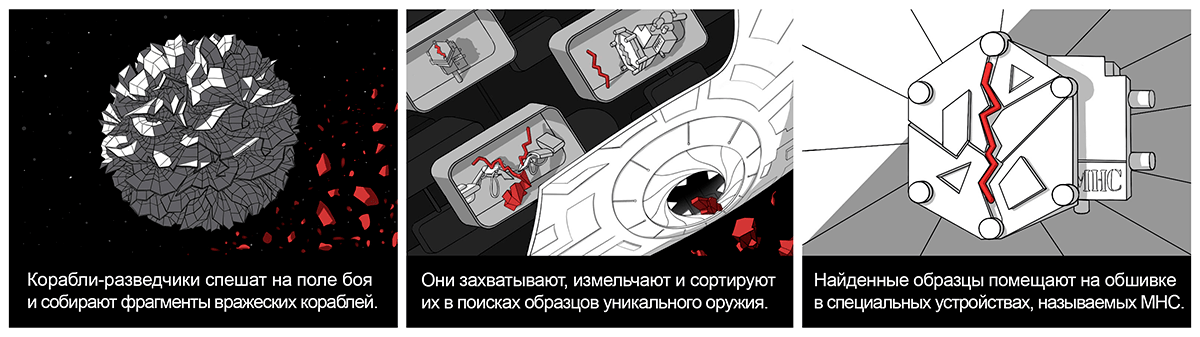
Захватчикам противостоит космический флот защитников Галактики — клетки иммунной системы организма. Передовые отряды этого флота — макрофаги и естественные киллеры — бесстрашные воины, которые осуществляют разведку боем (врожденный, или неспецифический иммунитет). Корабли-разведчики (дендритные клетки) — более узкоспециализированное подразделение. За ними следует элитный отряд боевых кораблей (цитотоксических Т-лимфоцитов, или Т-киллеров), которые обеспечивают приобретенный (адаптивный) иммунитет [3].
Уникальное оружие захватчиков — неоантигены (белки, которых нет или очень мало на поверхности нормальных клеток и которые появляются при злокачественной трансформации). Они необходимы для формирования адаптивного противоопухолевого иммунного ответа [4], [5]. Образцы оружия — пептиды, фрагменты белковых неоантигенов. Разведчики (дендритные клетки) поглощают обломки вражеских клеток, расщепляют антигены до пептидов в ходе процессинга и соединяют с устройствами MHC (англ. major histocompatibility complex — главный комплекс гистосовместимости) — молекулами, которые служат для распознавания «своих». Пептид-образец выставляется на поверхности клетки в рамке из MHC; этот процесс называют презентацией антигена [4–6]. В противоопухолевом иммунном ответе центральную роль играет MHC I типа. Обычно эти молекулы появляются на поверхности клетки, зараженной вирусом, в комплексе с вирусным пептидом и служат сигналом для цитотоксического Т-лимфоцита к уничтожению этой клетки [3]. Но такой профессиональный разведчик, как дендритная клетка, может соединить MHC I типа с пептидом, полученным из антигена, который был ею захвачен извне, чтобы показать его Т-киллеру. Это явление называется кросс-презентацией антигена [7], [8].
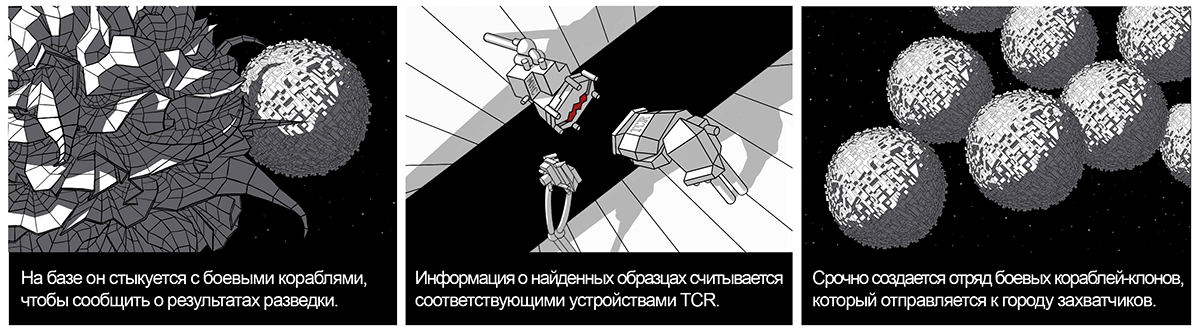
Захват, процессинг и презентация антигена в сочетании с сигналами тревоги (например воздействием цитокинов) приводят к созреванию дендритной клетки. Меняется ее внешний вид, на поверхности появляются новые устройства-молекулы, внутри создаются сигнальные дроны (синтезируются цитокины). Все это необходимо для встречи с элитными боевыми кораблями — цитотоксическими Т-лимфоцитами на военной базе (в лимфатическом узле), куда дендритная клетка перемещается по лимфатическим сосудам [8].
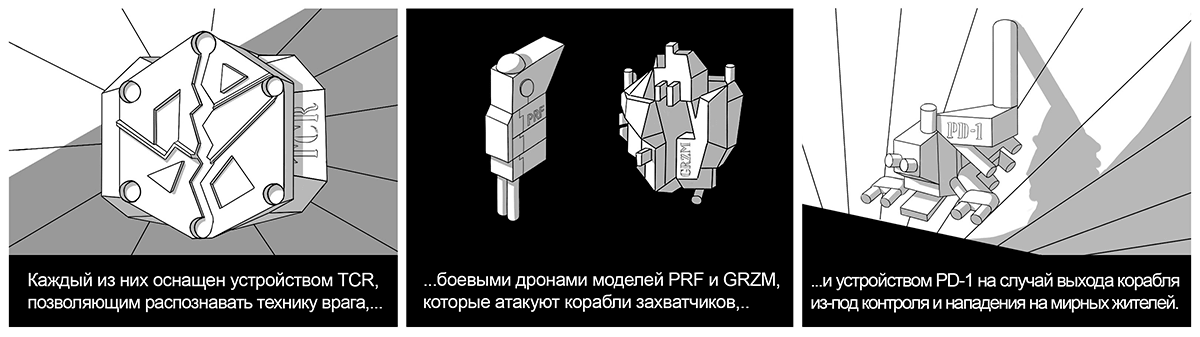
Во время стыковки клетки-разведчика с боевым кораблем-лимфоцитом комплекс «MHC—пептид» связывается с соответствующим устройством TCR (англ. T cell receptor — Т-клеточный рецептор ) на поверхности Т-киллера.
Подробнее о том, как устроены TCR и как они узнают образцы-пептиды можно прочитать в статье «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [9].
У цитотоксических Т-лимфоцитов есть дополнительное устройство, CD8, которое присоединяется к MHC I и участвует в стыковке с кораблем разведчиков. Также при этом происходит взаимодействие других сигнальных устройств (например, CD80/CD86 на поверхности дендритной клетки и СD28 Т-лимфоцита) и запуск дронов (высвобождение цитокинов). В результате в лимфоузле быстро создается армия клонов цитотоксических Т-лимфоцитов с TCR, который распознает представленный пептид, готовых атаковать неприятеля (то есть активированных) [3].
В боевых кораблях-киллерах строят специальных боевых дронов — молекулы перфорина (англ. perforin, PRF) и гранзима (англ. granzyme, GRZM) для уничтожения вражеских клеток-кораблей. Они хранятся в гранулах в неактивном состоянии, пока лимфоцит не вступит в бой с захватчиком [10]. Чтобы обеспечить безопасность мирного населения во время военных действий, боевые корабли размещают на поверхности устройство PD-1 (англ. programmed cell death — белок программируемой клеточной смерти), активация которого приводит к устранению излишне воинствующего Т-киллера. Существуют и другие механизмы для усмирения активированных боевых Т-лимфоцитов, например молекула CTLA-4 [11], [12].
К несчастью, об устройстве PD-1 знают и захватчики. Они вербуют мирных жителей (например фибробласты) и даже корабли защитников (миелоидные клетки, макрофаги, дендритные клетки, Т-лимфоциты), заставляя их работать на себя. Предатели помогают изменять сеть транспортных магистралей (ангиогенный эффект) и держать в ужасе окружающие города (поддержание воспаления), создают и рассылают дронов-диверсантов (продукция иммуносупрессирующих факторов) [13]. На поверхности некоторых кораблей предателей и самих захватчиков есть устройство PD-L1 — молекула, которая связывается с PD-1 (то есть его лиганд) и активирует самоликвидацию (апоптоз) боевого лимфоцита [12].
Несмотря на происки захватчиков, цитотоксические Т-лимфоциты достигают опухоли и атакуют злокачественные клетки. Для точного наведения на цель они используют устройство TCR, которое связывается с таким же комплексом «MHC—пептид», какой показала лимфоцитам клетка-разведчик, но на поверхности корабля захватчика. Распознав противника, Т-киллер высвобождает из гранул-хранилищ перфорин и гранзим [10], [14]. Дроны PRF группируются и вместе формируют в обшивке (мембране) захватчика канал, воспользовавшись которым гранзим попадает внутрь. Там он прицельно активирует служебные механизмы корабля противника (каспазы), что приводит к запуску программы самоликвидации [10]. Атаковав одновременно множество вражеских кораблей, защитники добиваются массивного разрушения города захватчиков. Обломки опухолевых клеток вновь собирают разведчики, чтобы использовать их для наведения новых отрядов боевых Т-киллеров и все этапы повторяются снова [6].
Благодаря уничтожению наиболее уязвимых для иммунной системы злокачественных клеток (феномен иммуноредактирования), а также благодаря присущей им изменчивости баланс может сместиться в сторону вражеской армии (может наступить фаза ускользания опухоли от иммунного надзора). Новые поколения захватчиков могут не иметь антигенов, известных защитникам, или убрать все молекулы MHC с поверхности кораблей, использовать устройства PD-L1, привлекать клеток-предателей и рассылать иммуносупрессирующих дронов [15].
Но зная основные этапы противоопухолевого ответа, можно помочь иммунным войскам победить захватчика [6]. Традиционные стратегии лечения опухолей (химиотерапия, лучевая и таргетная терапия) направлены на уничтожение как можно большего количества злокачественных клеток, что приводит к увеличению количества антигенов-мишеней. Применение дендритноклеточных вакцин повышает эффективность презентации антигенов, использование цитокинов усиливает активацию Т-лимфоцитов и ускоряет создание армии клонов, а ингибиторы контрольных точек иммунного ответа (блокаторы PD-1 и CTLA-4) увеличивают количество Т-киллеров, достигающих цели [6]. Создание цитотоксических Т-лимфоцитов с химерным TCR (CAR-T) позволяет получить боевые корабли, нацеленные на желаемую антигенную мишень, и обходить отсутствие MHC на поверхности опухолевых клеток [16]. Наконец, сочетание различных методов иммунотерапии, воздействующих на разные этапы циклического противоопухолевого иммунного ответа, поможет окончательно победить коварных захватчиков [6], [15].










Литература
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Страшней клешней на свете нет...;
- Иммунитет: борьба с чужими и… своими;
- Mark Yarchoan, Burles A. Johnson, Eric R. Lutz, Daniel A. Laheru, Elizabeth M. Jaffee. (2017). Targeting neoantigens to augment antitumour immunity. Nat Rev Cancer. 17, 209-222;
- Daniel S. Chen, Ira Mellman. (2017). Elements of cancer immunity and the cancer–immune set point. Nature. 541, 321-330;
- Gao D. (2019). Compound-therapy based on cancer-immunity cycle: promising prospects for antitumor regimens. Am. J. Cancer Res. 9, 212–218;
- Emma Reeves, Edward James. (2017). Antigen processing and immune regulation in the response to tumours. Immunology. 150, 16-24;
- Andrés Alloatti, Fiorella Kotsias, Joao Gamelas Magalhaes, Sebastian Amigorena. (2016). Dendritic cell maturation and cross-presentation: timing matters!. Immunol Rev. 272, 97-108;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Ilia Voskoboinik, James C. Whisstock, Joseph A. Trapani. (2015). Perforin and granzymes: function, dysfunction and human pathology. Nat Rev Immunol. 15, 388-400;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Xianjie Jiang, Jie Wang, Xiangying Deng, Fang Xiong, Junshang Ge, et. al.. (2019). Role of the tumor microenvironment in PD-L1/PD-1-mediated tumor immune escape. Mol Cancer. 18;
- Garth W. Tormoen, Marka R. Crittenden, Michael J. Gough. (2018). Role of the immunosuppressive microenvironment in immunotherapy. Advances in Radiation Oncology. 3, 520-526;
- Nele M. G. Dieckmann, Gordon L. Frazer, Yukako Asano, Jane C. Stinchcombe, Gillian M. Griffiths. (2016). The cytotoxic T lymphocyte immune synapse at a glance. J Cell Sci. 129, 2881-2886;
- Jake S. O’Donnell, Michele W. L. Teng, Mark J. Smyth. (2019). Cancer immunoediting and resistance to T cell-based immunotherapy. Nat Rev Clin Oncol. 16, 151-167;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак.







