Страшней клешней на свете нет...
18 сентября 2013
Страшней клешней на свете нет...
- 5788
- 6
- 4
Karkinos (или Carcinus) — гигантский краб, древнегреческое мифологическое существо, бывшее помощником Гидры в борьбе с Гераклом. Герой раздавил его, но в награду за свою службу Karkinos был помещен среди звезд в виде созвездия Рака. Гиппократ (460–370до н.э.) ввел термин «карцинома», обозначавший злокачественную опухоль с перифокальным воспалением. Кровеносные сосуды вокруг злокачественных опухолей казались ему когтями ракообразного. В I в. до н.э. римский врач Авл Корнелий Цельс (Aulus Cornelius Celsius) перевёл греческое слово carcinus на латынь (cancer — краб).
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Каждое заболевание, будь то бубонная чума или обычная бородавка, имеет первичные и вторичные причины. Например, первичной причиной чумы является ее возбудитель — чумная палочка, — а вторичная причина — крысы, грязь и блохи, которые переносят эту палочку от крысы к человеку. Первопричина любой болезни — это то, что мы можем наблюдать и идентифицировать в каждом случае заболевания. Рак, в отличие от других заболеваний, имеет множество вторичных причин. Общее свойство у всех раковых клеток, похоже, только одно — замена трёхэтапного процесса клеточного дыхания на более древний и примитивный гликолиз.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Рак — это злокачественная опухоль, которая дает выросты в окружающие ее ткани, похожие на конечности ракообразного (отсюда и название). Ежегодно это заболевание уносит более 300 тысяч жизней. Основными причинами рака являются три группы факторов: физические (ионизирующее излучение, в т.ч. ультрафиолет), химические (канцерогенные вещества) и биологические (некоторые вирусы и бактерии). Под влиянием этих факторов клетки могут стать атипичными, поменять облик и свойства, что отражается во множестве молекулярно-генетических признаков, отличающих их от здоровых клеток:
- Увеличение лабильности и текучести клеточной мембраны, снижение адгезивности и контактного торможения. В норме клетки, вступая в контакт друг с другом, прекращают деление. В опухолевых клетках отсутствие контактного торможения приводит к безудержной пролиферации.
- Нарушение регуляции роста и дифференцировки опухолевых клеток. В нормальных клетках процессы роста и дифференцировки уравновешивает модулятор — кальций-зависимая протеинкиназа. В опухолевых клетках активность этого белка повышена, что приводит к резкой индукции пролиферации.
- Атипичный энергетический обмен, который проявляется в преобладании гликолиза. Нормальные дифференцированные клетки в присутствии кислорода в качестве основного источника энергии используют трёхэтапный процесс утилизация глюкозы (см. врезку):
- гидролиз высокомолекулярных органических соединений;
- гликолиз;
- окислительное фосфорилирование и цикл Кребса.
- Избыточная пролиферация. В здоровых клетках сотни генов контролируют процесс деления. Баланс между активностью генов, способствующих и подавляющих пролиферацию клеток, является необходимым условием для нормального роста и жизнедеятельности. Например, в 40% злокачественных опухолей человека встречаются онкогенные мутанты семейства сигнальных белков Ras, которые участвуют в стимуляции клеточного деления факторами роста [2]. Важную роль играет активность генов, отвечающих за программируемую клеточную смерть — апоптоз. Если здоровая клетка повреждена, она подвергается апоптозу. Мутации в генах, ответственных за клеточную пролиферацию или апоптоз, могут привести к злокачественному перерождению клеток. В 50% раковых опухолей найдена мутация двух копий гена ТР53, продуктом которого является многофункциональный белок р53 [3]. При повреждении ДНК белок р53 активируется и запускает транскрипцию генов, ответственных за клеточный цикл, репликацию ДНК и апоптоз [4], [5].
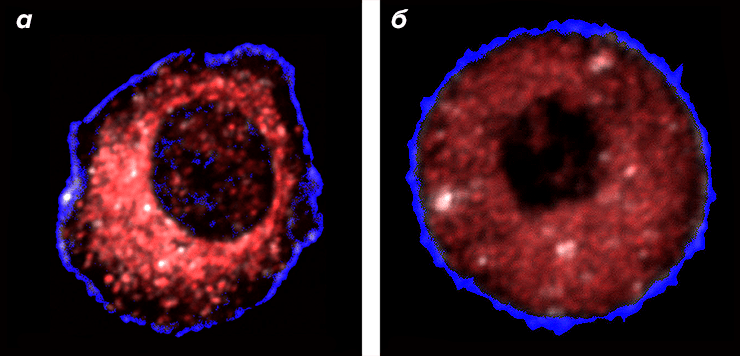
Рисунок 1. Здоровая (а) и раковая (б) клетки печени. Митохондрии помечены флуоресцентным красным красителем. У здоровой клетки митохондрии расположены кластерами вокруг ядра и отсутствуют вблизи внешней биомембраны. В раковой клетке митохондрии располагаются повсеместно и кластеров не образуют, поэтому интенсивность свечения снижается.
И голодно, и холодно, или раковый обмен
В 1926 г. Отто Варбург, исследуя образование молочной кислоты в здоровых и злокачественных (опухолевых) клетках обнаружил, что раковые клетки расщепляют глюкозу до молочной кислоты легче и быстрее, чем это делают нормальные клетки. По данным Варбурга, опухолевая ткань продуцирует молочную кислоту со скоростью в восемь (!) раз больше, чем работающая мышца. Производство лактата с такой скоростью полностью обеспечивает опухолевую ткань энергией (хотя на две молекулы лактата приходится всего две молекулы АТФ). На основе этих данных Варбург предположил существование так называемого «ракового обмена» [6]. Он считал, что в раковых клетках образуется дефект в митохондриях, что и приводит к необратимым нарушениям аэробной стадии энергетического обмена и последующей зависимости от гликолитического метаболизма. В этом случае гликолиз компенсирует энергетическую неполноценность поврежденного дыхания [7]. Он показал, что раковые клетки продолжают использовать гликолиз для получения энергии даже тогда, когда кислород присутствует в тканях в достаточном количестве. Это явление получило название эффекта Варбурга (рис. 2).
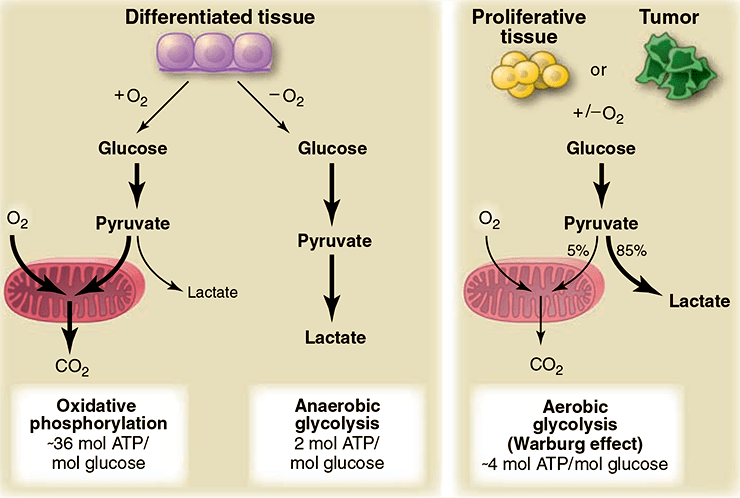
Рисунок 2. Различия между реакциями окислительного фосфорилирования, анаэробного гликолиза и аэробного гликолиза (эффект Варбурга). В присутствии кислорода в нормальных дифференцированных тканях в процессе гликолиза происходит расщепление глюкозы до пирувата, который затем в митохондриях в процессе окислительного фосфорилирования полностью окисляется до СО2. Кислород является необходимым компонентом полного окисления глюкозы; когда кислорода оказывается недостаточно, в клетках в процессе гликолиза синтезируется лактат. Лактат не является субстратом для реакции окислительного фосфорилирования, и полного окисления глюкозы в этом случае не происходит. Такой путь расщепления глюкозы до лактата способен поддерживать стабильный синтез минимального количества АТФ. Варбургом было отмечено, что раковые клетки имеют тенденцию к производству лактата, а не пирувата, независимо от присутствия кислорода в клетках. Это свойство также характерно и для нормальных пролиферирующих клеток. Часть митохондрий в раковых клетках остаются функционально активными, и как в раковых, так и в нормальных пролиферирующих клетках доля окислительного фосфорилирования может составлять примерно 10%.
За последние 80 лет тема «ракового обмена» получила широкое распространение среди онкологов и клеточных и молекулярных биологов. Первые работы в этом направлении действительно свидетельствуют о пониженном содержании ключевых компонентов дыхательной цепи митохондрий — цитохрома c, сукцинатдегидрогеназы и цитохромоксидазы [8–10] — и увеличении интенсивности аэробного гликолиза в раковых клетках. Однако ряд последующих работ показал, что в большинстве опухолевых клеток нарушения функции митохондрий не происходит [11], [12], и предлагает объяснение «ракового обмена» на основе детального изучения обмена пролиферирующих клеток.
Общебиологические законы ракового обмена
Одноклеточные организмы состоят всего из одной клетки, но эта клетка — целостный организм, ведущий самостоятельное существование. Одноклеточные организмы хорошо приспособлены к окружающей среде, в которой они растут и размножаются (рис. 3). Основным фактором эволюционного давления для одноклеточных, ограничивающим их размножение, является доступность питательных веществ. Поэтому метаболизм одноклеточных эволюционно развивался так, чтобы запасы питательных веществ и свободной энергии были направлены, в первую очередь, на построение структур, необходимых для возникновения новой клетки. Большинство одноклеточных размножается с использованием энергии гликолиза, даже когда кислорода достаточно. Следовательно, несмотря на низкую эффективность (две молекулы АТФ против 36), гликолиз может обеспечить достаточно энергии для клеточной пролиферации.
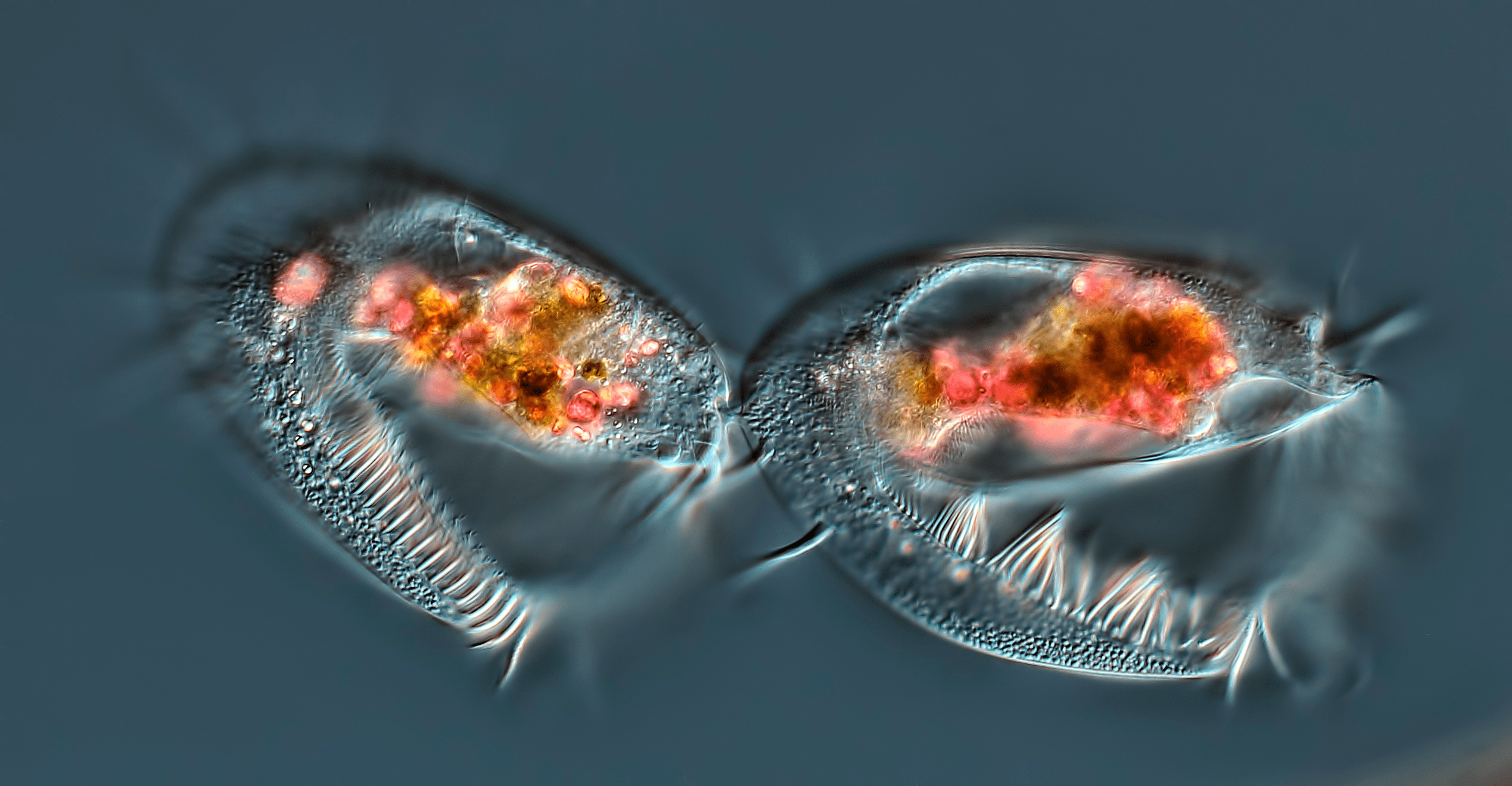
Рисунок 3. Завершающая стадия клеточного деления инфузории. Фотография сделана с использованием дифференциального интерференционного контраста ×40.
У многоклеточных организмов, напротив, клетки дифференцированы и напрямую с окружающей средой не взаимодействуют. В зависимости от функции, предназначенной им природой, клетки формируют ткани, а ткани — органы. За счет разделения функций, клетки в тканях имеют постоянный приток питательных веществ, поэтому деление клеток этим фактором ограничиваться не может. Для предотвращения неконтролируемого деления клеток у многоклеточных организмов появляются дополнительные системы управления. Например, экзогенные факторы роста стимулируют пролиферацию клеток, как бы давая «разрешение» на возможность делящейся клетке использовать питательные вещества из внешней среды [12], [13]. Опухолевые клетки многоклеточного организма способны преодолевать зависимость пролиферации от факторов роста посредством приобретения генетических мутаций, затрагивающих клеточные рецепторы, и использовать питательные вещества из внешней среды постоянно (рис. 2). Кроме того, мутации могут привести к чрезмерному поглощению глюкозы, превышающему биоэнергетические требования нормальных растущих или пролиферирующих клеток (рис. 4) [7], [14].

Рисунок 4. Пролиферация раковых клеток легкого, сканирующий электронный микроскоп (STEM)
Но почему же менее эффективный обмен веществ (с точки зрения производства АТФ) предпочтителен для размножения одноклеточных организмов или безудержной пролиферации раковых клеток?
Одно из возможных объяснений состоит в идее самой пролиферации. Для осуществления процесса деления необходимо наличие большого количества строительного материала — нуклеотидов, аминокислот и липидов [15]. Глюкоза обеспечивает клетку энергией (расщепление дает до 38 молекул АТФ в трёхэтапном процессе), но также используется как стройматериал в процессе биосинтеза (поскольку содержит шесть атомов углерода). Например, в ходе биосинтеза одного из основных компонентов клеточных мембран — пальмитата (эфира пальмитиновой кислоты) — необходимо 16 атомов углерода и семь молекул АТФ [16]. Для синтеза аминокислот и нуклеотидов также требуется больше углерода, чем энергии. Так, одна молекула глюкозы может обеспечить 36 молекул АТФ, либо предоставить свои шесть атомов углерода. Очевидно, что в пролиферирующей клетке бóльшая часть глюкозы не может участвовать в производстве АТФ посредством окислительного фосфорилирования, поскольку одну молекулу глюкозы выгоднее использовать для синтеза 16-ти углеродной цепи пальмитиновой кислоты, в процессе окисления которой образуется 35 молекул АТФ.
Альтернативное объяснение заключается в том, что здоровые клетки многоклеточного организма не испытывают недостатка в поставке глюкозы из циркулирующей крови, и АТФ синтезируется постоянно [17], [18]. При этом даже незначительные колебания содержания АТФ/АДФ в таких клетках могут нарушить их рост. Нормальные клетки с дефицитом АТФ подвергаются апоптозу [19], [20]. Поддержание оптимального уровня АТФ/АДФ обеспечивается активностью специальных регуляторных киназ, которые снижают производство АТФ путем преобразования двух молекул АДФ в одну молекулу АТФ и одну АМФ; пролиферация при этом условии блокируется.
Опухолевые клетки используют в качестве основного источника энергии гликолиз и характеризуются генерацией избыточного лактата (содержащего три атома углерода), который выводится из клетки, хотя мог быть использован для синтеза АТФ или биосинтеза. Но, возможно, вывод избыточного углерода (в виде лактата) имеет смысл, поскольку он позволяет ускорить включение углерода в биомассу и облегчить деление клеток. Для большинства делящихся клеток важным является не выход АТФ, а скорость метаболизма. Например, иммунные реакции и заживление ран зависят от скорости пролиферативного умножения эффекторных клеток. Чтобы выжить, организм должен максимизировать скорость роста клеток. Клетки, которые наиболее эффективно превращают глюкозу в биомассу, растут быстрее. Кроме того, если для организма питательных веществ оказывается недостаточно, включается механизм активной утилизации избытка лактата. В печени в цикле Кори происходит переработка лактата, запасающегося в результате метаболизма активно пролиферирующей ткани [16]. Такой способ переработки органических отходов, образующихся в результате пролиферации клеток при иммунном ответе в результате заживления ран, частично пополняет энергетические запасы организма.
Заключение
В настоящее время гликолитический фенотип раковых клеток — это, по сути, универсальный маркер заболевания. «Раковый обмен» происходит по общебиологическим законам, но изменения касаются, прежде всего, количественной, а не качественной стороны. Эпигенетические изменения в клетках на ранних этапах злокачественной трансформации приводят к потере функциональной активности митохондрий, ингибированию апоптоза, активации пролиферации. Все эти факторы заставляют раковые клетки в качестве основного источника энергии использовать гликолиз даже в присутствии достаточного количества кислорода. Но неэффективный с точки зрения производства АТФ гликолиз дает раковым клеткам определенное преимущество. Безудержная пролиферация раковых клеток требует наличия большего количества биоматериала для репликации клеточных структур, чем энергии АТФ, и только гликолиз способен поддерживать такой путь метаболизма.
Литература
- M. G. Vander Heiden, L. C. Cantley, C. B. Thompson. (2009). Understanding the Warburg Effect: The Metabolic Requirements of Cell Proliferation. Science. 324, 1029-1033;
- Bos J.L. (1989). ras oncogenes in human cancer: a review. Cancer Res. 49, 4682–4689;
- Greenblatt M.S., Bennet W.P., Hollstein M., Harris C.C. (1994). Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis. Cancer Res. 54, 4855–4878;
- Scott W. Lowe, Earlene M. Schmitt, Sallie W. Smith, Barbara A. Osborne, Tyler Jacks. (1993). p53 is required for radiation-induced apoptosis in mouse thymocytes. Nature. 362, 847-849;
- Merritt A.J., Potten C.S., Kemp C.J., Hickman J.A., Balmain A., Lane D.P., Hall P.A. (1994). The role of p53 in spontaneous and radiation-induced apoptosis in the gastrointestinal tract of normal and p53-deficient mice. Cancer Res. 54, 614–617;
- Warburg O. Berlin. 1926. — 49 p.;
- O. Warburg. (1956). On the Origin of Cancer Cells. Science. 123, 309-314;
- Aisenberg A.C. Acad.Press, 1961. — 63 p.;
- Антонеева И.И. и Генинг Т.П. (2005). «Вестник СамГУ — Естественнонаучная серия». 6, 158–165;
- Сейц И.Ф., Луганова И.С. Биохимия клеток крови и костного мозга в норме и при лейкозах. М.: «Медицина», 1967. — 123 с.;
- S. Weinhouse. (1976). The Warburg hypothesis fifty years later. Z. Krebsforsch.. 87;
- Hiroshi Kondoh, Matilde E. Lleonart, Yasuhiro Nakashima, Masayuki Yokode, Makoto Tanaka, et. al.. (2006). A High Glycolytic Flux Supports the Proliferative Potential of Murine Embryonic Stem Cells. Antioxidants & Redox Signaling. 0, 061221112325011;
- Rebecca L. Elstrom, Daniel E. Bauer, Monica Buzzai, Robyn Karnauskas, Marian H. Harris, et. al.. (2004). Akt Stimulates Aerobic Glycolysis in Cancer Cells. Cancer Res. 64, 3892-3899;
- Warburg O., Posener K., Negelein E. (1924). Biochem. Z. 152, 319;
- R. G. Jones, C. B. Thompson. (2009). Tumor suppressors and cell metabolism: a recipe for cancer growth. Genes & Development. 23, 537-548;
- Lehninger A.L., Nelson D.L., Cox M.M. Principles of Biochemistry. Worth: New York, 1993;
- Heather R. Christofk, Matthew G. Vander Heiden, Marian H. Harris, Arvind Ramanathan, Robert E. Gerszten, et. al.. (2008). The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature. 452, 230-233;
- Ralph J. DeBerardinis, Julian J. Lum, Georgia Hatzivassiliou, Craig B. Thompson. (2008). The Biology of Cancer: Metabolic Reprogramming Fuels Cell Growth and Proliferation. Cell Metabolism. 7, 11-20;
- Denis S Izyumov, Armine V Avetisyan, Olga Yu Pletjushkina, Dmitrii V Sakharov, Karel W Wirtz, et. al.. (2004). “Wages of Fear”: transient threefold decrease in intracellular ATP level imposes apoptosis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1658, 141-147;
- Matthew G.Vander Heiden, Navdeep S Chandel, Paul T Schumacker, Craig B Thompson. (1999). Bcl-xL Prevents Cell Death following Growth Factor Withdrawal by Facilitating Mitochondrial ATP/ADP Exchange. Molecular Cell. 3, 159-167.