Игры в демиургов
01 октября 2017
Игры в демиургов
- 2125
- 0
- 1
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Светящиеся в темноте крысы и рыбки. Капуста, производящая яд скорпионов. Вместо прививки — банан. Фантастика? Да нет, уже реальность. Реальность, в которой человек нашел новую забаву — конструировать живые организмы по своему вкусу. Он вставляет одни гены в клетку взамен других — словно ребенок, играющий с кубиками. Как и почему это стало возможным? И главное, к чему приведет?
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Молекула жизни
В мифах Древней Греции химера — это чудовище с головой льва, туловищем козы и хвостом в виде змеи. Ученым идея понравилась, и они решили создать химерные (рекомбинантные) ДНК, состоящие из фрагментов нуклеиновых кислот разных организмов [1], [2]. Зачем? Чтобы передать одному организму признак другого. Например, встраиваем ген морозоустойчивости камбалы в клубнику — и она больше не боится заморозков. Здорово?
1972 год, Стэнфордский университет, США. В лаборатории биохимика Пола Берга получили первую рекомбинантную ДНК [3]. Это стало революцией, положившей начало эре генной инженерии. Эре помидоров с геном скорпиона и рыбок с генами медузы. Эре, где дерзкий человек станет творцом живых организмов. Станет богом?
Но это все впереди. А пока Бергу удалось получить крошечную молекулу, состоявшую из «кусочков» ДНК разных организмов, словно лоскутное одеяло. Как же ему это удалось?
Берг взял «лабораторную мышку» микробиологов — кишечную палочку (Escherichia coli), поражающий ее бактериофаг λ и полиомавирус SV40, вызывающий опухоли у мышей. Затем с помощью фермента рестриктазы разрезал ДНК этих организмов. В результате на концах фрагментов ДНК он получил «липкие концы» (выступающие концы, которые являются комплементарными, то есть могут соединяться друг с другом). Такие «липкие концы» (рис. 1) притягиваются друг к другу, словно липучки на сандалике, и соединяются водородными связями. В этом им помогает другой фермент — ДНК-лигаза. С помощью этих ферментов (лигазы и рестриктазы) Бергу удалось получить первую в мире гибридную ДНК. Она состояла из фрагмента ДНК бактериофага λ, группы генов кишечной палочки (E. coli), ответственных за сбраживание сахара галактозы, и полной ДНК вируса SV40. Эта рекомбинантная ДНК теоретически могла бы проникать и в бактерию, и в животное, и обладать при этом функциональной активностью в их клетках (ДНК бактериофага обеспечивает ее способность самокопироваться в клетках кишечной палочки, а ДНК SV40 — в клетках обезьяны). Однако именно это экспериментально Пол Берг не проверил. Но и создания рекомбинантной ДНК было достаточно, чтобы его назвали «отцом генной инженерии». Внешне рекомбинантная ДНК ничем не отличается от нерекомбинантной, и только ее создатель знает, что это гибрид, да еще такой, какого не смогла сотворить даже неистощимая на выдумки природа [3].
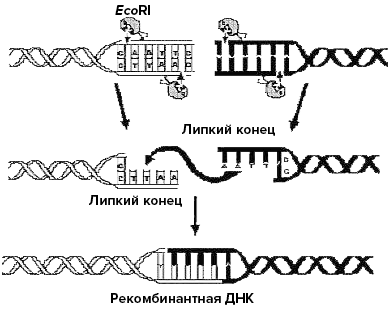
Рисунок 1. Применение эндонуклеазы (EcoRI) для создания рекомбинантной ДНК.
Опыт Берга показал возможность использования бактериальных плазмид (небольших кольцевых молекул ДНК, способных автономно размножаться) как векторов («такси») для введения в микроорганизмы чужих генов. Достаточно с помощью ферментов встроить нужный нам ген в плазмиду, а дальше она уже все сделает самостоятельно — внедрится в бактерию и начнет размножаться. В природе существует большое количество бактериальных плазмид, поэтому у биотехнологов богатый выбор. Также в качестве вектора используют бактериофаги (вирусы бактерий) .
О богатом разнообразии бактериальных мобильных генетических элементов рассказывает статья «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [23]. — Ред.
Прошло 8 лет — и был выдан первый патент на генетически модифицированный штамм микроорганизмов, способный разлагать нефть [4]. А далее — бактерии, синтезирующие инсулин, каучук, шелк, повышающие плодородие почвы или поглощающие углекислый газ из атмосферы и т.д. Но человеку, словно старику из сказки о золотой рыбке, этого было мало. Трансгенные бактерии — замечательно. А если встроить «чужой» ген в растения?
Мне мало бактерий, давайте конструировать растения!
Человек всегда пытался улучшить природу. Он хотел получить растения с самыми красными помидорами и самой сочной клубникой. Сначала он это делал неосознанно — например, отбирал для посева наиболее крупные семена пшеницы. Затем уже сознательно — скрещивал растения одного вида, затем отбирал экземпляры, которые обладали полезными качествами, и скрещивал уже их. Это селекция. А что если комбинировать гены на молекулярном уровне? Не надеяться на слепой случай, а целенаправленно выращивать растения с уже заданными свойствами?
Запрограммируйте мне розу с голубыми лепестками, пожалуйста. И еще фиолетовую картошку — хочу необычным пюре мужа удивить.
Казалось бы, в чем проблема, давайте по аналогии с трансгенными бактериями получим трансгенные растения. Но не все так просто. Одно дело, одноклеточная микроскопическая бактерия, у которой даже ядра нет. Совсем другое — сложно устроенное многоклеточное растение. Как же нам ввести новый ген в каждую его клетку? Ведь дополнительные трудности создает наличие плотной клеточной оболочки. Но тут генетикам повезло. Растения в этом плане имеют одно важное преимущество перед животными — им свойственна тотипотентность (от лат. totus — весь, целый; и potentia — сила). Это страшное слово означает способность отдельных клеток к развитию в целое растение [5]. То есть можно встроить ген другого организма только в одну клетку, а затем вырастить из нее целое растение.
Перед учеными встала новая задача — найти подходящее «такси» (вектор) для доставки нужного гена в растительную клетку. И тут на помощь дерзким демиургам пришла сама природа. Наверняка вы видели галлы, образующиеся на деревьях, — выросты своеобразной формы на листьях, стеблях, почках. Вызвать эти образования могут вирусы, бактерии, грибы, клещи. Но биотехнологов интересовали именно корончатые галлы (рис. 2а и 2б), которые впервые описали еще древние греки. Это настоящие злокачественные опухоли, которые образуются на стеблях или листьях многих двудольных растений. Клетки корончатых галлов приобретают способность неограниченно размножаться, оставаясь недифференцированными [6].
Только в ХХ веке выяснили, что причина образования корончатых галлов — инфицирование растений почвенной бактерией Rhizobium radiobacter (ранее известной под именем Agrobacterium tumefaciens). Как и другие бактерии она содержит плазмиды. Одна из них — Ti-плазмида (от англ. tumor inducing — опухолеиндуцирующая). В Тi-плазмиде есть Т-ДНК — участок, который переносится в клетку зараженного растения и встраивается в ее хромосому за счет гомологичной рекомбинации. Причем гены Т-ДНК в самой бактерии не работают, они могут «читаться» только в клетках эукариот. Слева и справа от Т-ДНК располагаются одинаковые последовательности ДНК, которые называют «фланкирующими» (англ. flank — бок, сторона, фланг) — это несовершенные прямые повторы по 24–25 пар нуклеотидов. Они очень важны, так как любая последовательность ДНК, находящаяся между ними, может быть внедрена в ДНК растений как часть Т-ДНК. Остальные части этой плазмиды отвечают за ее переход из клетки в клетку бактерий и встраивание Т-ДНК в хромосому растительной клетки [6], [8].
Rhizobium radiobacter, проникая через поврежденную ткань растения, заражают его. Примерно за 30 минут Т-ДНК вырезается из Тi-плазмиды и встраивается в хромосому растительной клетки. К чему это приводит? Начинается неконтролируемое деление клеток, в результате чего образуется опухоль. Но зачем это надо бактериям? Не просто же из вредности они внедряются в растения. Рассуждая логически: для того чтобы деление клеток растения приносило Rhizobium radiobacter пользу, необходимо, чтобы они синтезировали что-либо полезное для бактерий. Так и есть — в опухолевых клетках синтезируются необычные соединения, которые не встречаются больше нигде в природе, — опины. Только Rhizobium radiobacter способен расщеплять эти опины и использовать их как источники питательных веществ и энергии. В результате хитрые бактерии получают явные преимущества перед другими почвенными бактериями. Это пример успешной генетической инженерии, осуществляемой самой природой [6–9].
Ученым осталось только воспользоваться этим механизмом. Ti-плазмида оказалась идеальным природным вектором для введения чужеродных генов в клетки растения. В 1978 году Дж. Шелл показал, что Тi-плазмиду можно использовать как переносчик любых генов, надо только вставить их в область Т-ДНК на место онкогенных участков [8]. В растительную клетку переносится Т-ДНК, ограниченная фланкирующими последовательностями нуклеотидов (рис. 3). Если вставить между ними, например, один из генов скорпиона — этот ген встроится в хромосому растительной клетки. Только надо не забыть вырезать из Тi-плазмиды онкогены. Мы же не хотим, чтобы в другие организмы с нашей помощью попали гены, вызывающие рак? Наоборот, нам надо, чтобы ДНК, кодирующая новый признак, передавалась потомкам.
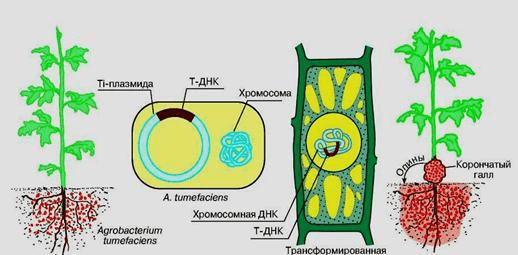
Рисунок 3. Трансформация растений с помощью Rhizobium radiobacter (Agrobacterium tumefaciens).
Для того чтобы перенести гены Rhizobium radiobacter, вовсе необязательно иметь дело с целым растением. Достаточно выдержать некоторое время бактерии совместно с протопластами растительных клеток (то есть клетками, лишенными клеточной стенки). Такие «голые» клетки более беззащитны, и ДНК бактерий проще проникнуть в них, чем в «одетые» клеточной стенкой. Далее из таких «трансформированных» протопластов получаем целые клетки, помещаем их на питательную среду (например, на основе знакомого всем любителям мармелада агар-агара). После этого остается только перенести сосуды с клетками в темное помещение и поддерживать нужные температуру и влажность. Через несколько недель образуется каллусная культура. Затем регенерируем побеги, укореняем их и получаем трансгенное растение (рис. 4).

Рисунок 4. Получение культуры клеток растения.
Впервые этот метод в 1979 году применил венгр Л. Мартен, работавший в Лейденском университете в Голландии под руководством профессора Р. Шильперурта. Однако вероятность успеха оказалась не очень велика — только в один из тысячи протопластов удавалось ввести чужую ДНК. Сейчас разработаны новые методы, и встроить ДНК удается в каждый десятый протопласт. Что же это за методы?
Методы демиургов
А что, если просто пробить дыры в клеточной мембране, через которые смогут беспрепятственно пройти «чужие» ДНК? «Хорошая идея!» — подумали ученые и поместили раствор с живыми клетками и дополнительными молекулами ДНК в пластиковые кюветы с алюминиевыми электродами. Затем с помощью импульсов высокого напряжения создали в мембранах клеток временные крошечные поры, сквозь которые «чужие» ДНК проникают в клетку. Через некоторое время поры закрываются и клетки остаются целыми и невредимыми, но уже «трансформированными», то есть с чужой ДНК. Этот метод называется электропорацией и является наиболее простым и эффективным методом введения молекул ДНК в клетки. Но до недавнего времени его использовали только в немногих российских лабораториях. Почему? Все просто: далеко не в каждой лаборатории был достаточно дорогой прибор — электропоратор (рис. 5).

Рисунок 5. Электропоратор.
«Если хочешь сделать что-то хорошо — сделай это сам», — подумал А. Грессман в 1970 году. И ввел в клетку немного жидкости (около 10-8 мкл раствора с ДНК) с помощью стеклянного микрокапилляра. Этот метод называется микроиньекцией, его достоинство — возможность ввести ДНК в конкретную часть клетки (например, ядро). Эксперимент проводится на предметном столике микроскопа с применением микроманипуляторов и микрошприцев (рис. 6).
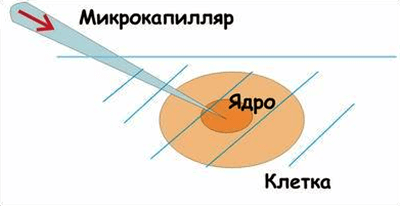
Рисунок 6. Введение ДНК путем микроиньекции.
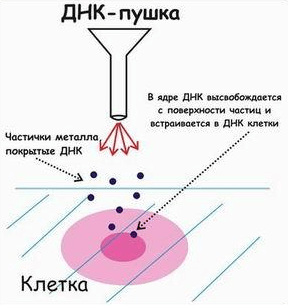
В период между 1983 и 1986 годами была создана первая генная пушка (рис. 7а и 7б). Ее разрабатывали на основе устройства для автоматического забивания гвоздей. На шарик из вольфрама наносили ДНК и выстреливали им в клетки, растущие в чашке Петри. Шарики разрывают стенки клеток, входят в цитоплазму и ядра и доставляют туда ДНК. Из-за силы бомбардировки ткань по центру чашки, как правило, погибает. Однако по периметру остаются живые и хорошо трансформированные клетки. Их и культивируют в дальнейшем, чтобы получить трансгенные растения. Здорово, правда? Кому из нас не хотелось бы пострелять шариками с ДНК по клеткам! Ученым тоже понравилось, и этот метод сейчас широко применяется. Только вольфрам оказался токсичным для клеток, поэтому вместо него шарики делают из золота или серебра [10].
Но какой бы метод мы не применяли, добиться 100-процентной эффективности не удастся. А значит, надо как-то отделить трансформированные клетки от остальных, и создать благоприятные условия для их деления и развития. Для этого в клетку вместе с «целевым» геном (геном, несущим нужный нам признак, например морозоустойчивость) надо внести маркерный ген. Для бактерий обычно используют ген устойчивости к антибиотикам. Потом помещают клетки на питательную среду с антибиотиком, где способны расти только трансформированные клетки.
А что же использовать в качестве маркера для растительных клеток? Чаще всего используют два гена [7], [9]:
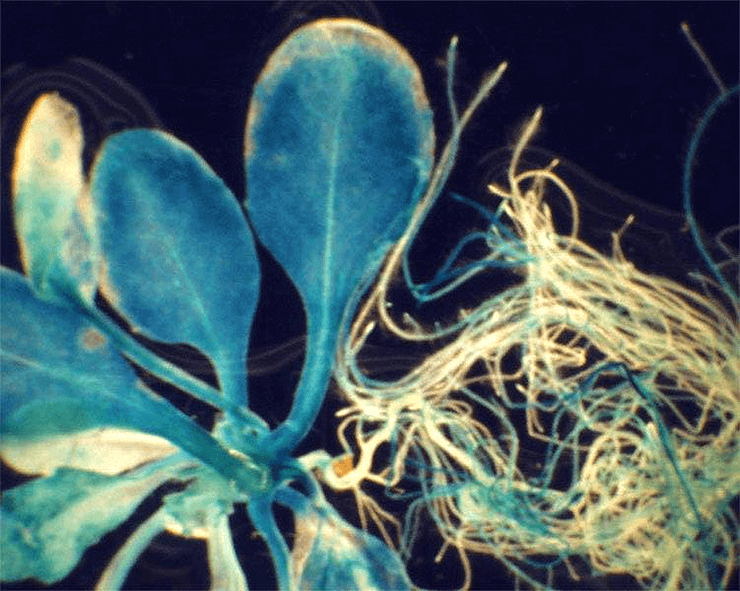
- глюкуронидазы (из бактерий), которая окрашивает трансформированные клетки в тёмно-синий цвет, но при этом они погибают (рис. 8);
- зелёного флуоресцентного белка (из медузы или светлячков) (рис. 9), который светится при освещении ультрафиолетом, а клетки остаются живы.
ГМО выходит на рынок
Итак, ученые нашли способ вводить гены других организмов в растения. Если бы вы были фермером и узнали об этом, какова бы была ваша реакция? Наверное, закружилась бы голова от открывающихся перспектив. Неужели действительно можно создать растения, устойчивые к холоду, засухе, не подверженные вредителям? Не нужны больше дорогие и токсичные гербициды, не будет катастрофических потерь урожая из-за капризов природы.
Формальной датой рождения генной инженерии растений принято считать 1982 год, когда Д. Кемп и Т. Холл в США получили первое в мире химерное растение — санбин. В геном подсолнечника с помощью знакомой нам Ti-плазмиды перенесли ген запасного белка бобовых фазеолина. Таким образом удался перенос гена между растениями, относящимися к различным семействам [10].
Ученые ликовали, а обыватели смотрели с подозрением — так стоит ли допускать такую еду на рынки или пусть остается в области чисто научных исследований?
Первыми рискнуть решили США. После прохождения всех необходимых тестов в 1994 году в продаже появилась первая генномодифицированная еда. Это были томаты Flavr Savr (рис. 10) (от англ. flavor saver — сохранитель вкуса). Обычно в процессе созревания плоды томатов постепенно теряют упругость, становятся мягкими и загнивают. Причиной этого является фермент полигалактуроназа, которая расщепляет пектин (полисахарид, структурный элемент растительных клеток). Что же делать? А если просто выключить ген, кодирующий этот фермент? Для этого создали трансгенные растения, в которых синтезировалась антисмысловая РНК-версия этого гена (эта асРНК соединяется с мРНК и физически препятствует формированию трансляционного комплекса — механизм синтеза полигалактуроназы нарушен). В результате у полученного сорта полигалактуроназа образовывалась в пониженном количестве, благодаря чему спелые помидоры дольше сохраняли товарный вид. Однако при выставлении на продажу такие томаты были восприняты без энтузиазма. Дело в том, что помидоры Flavr Savr оказались совершенно безвкусными [11]. Это была не самая удачная попытка, но маховик генномодифицированной еды уже был запущен. И новые трансгенные продукты на прилавках не заставили себя долго ждать.

Рисунок 10. Трансгенные томаты Flavr Savr.
Рапс поможет нам не остаться без моющих средств
Зайдите в ванную, возьмите любой из стоящих на полочке флакончиков и почитайте этикетки. Шампунь, гель для душа, стиральный порошок, зубная паста — не важно, в описании состава вы, скорее всего, найдете производные лавровой (додекановой) кислоты. Как вы, наверное, догадываетесь, ее можно выделить из лавра благородного, вечнозеленого дерева субтропиков. Но он дает мало семян, их трудно собирать и перерабатывать. Сегодня лавровую кислоту получают, в основном, из масла гвинейской масличной пальмы. Но она растет исключительно в тёплом влажном экваториальном климате и не размножается вегетативно. Поэтому развитым странам необходимо иметь какой-то альтернативный источник лавровой кислоты. На помощь пришли молекулярные биологи. Они выбрали самую рентабельную масличную культуру для умеренной зоны Северного полушария — масличный рапс. Важно, что его можно вырастить в течение одного сезона. Но, к сожалению, лавровой кислоты в этой культуре незначительное количество. Значит, надо было получить трансгенный рапс с повышенным содержанием лавровой кислоты. Для этого из калифорнийского лавра выделили ген, ответственный за синтез этой кислоты. После пересадки этого гена в генетически модифицированном рапсе два из трех остатков жирных кислот в составе масла оказались представлены лавровой кислотой. В 1995 году закончилась экспериментальная проверка, и было получено разрешение от властей США на выращивание и коммерческое использование трансгенных растений рапса [11], [12].
Вирусы, растения и человек — кто кого?
Наиболее остро стоит вопрос о получении растений, устойчивых к вредителям. Вирусы — давние враги фермеров, ведь поражение растений вирусами уменьшает урожай в среднем на 30%. Как с этим бороться? Можно использовать химические средства защиты. Но они негативно влияют на окружающую среду, животных, здоровье человека. Ежегодно в мире ВОЗ регистрирует до полумиллиона случаев отравления людей пестицидами. Попробуем другой путь?
Современные технологии создания устойчивых к вирусам сортов растений основаны на использовании известного с незапамятных времен метода, получившего название перекрестной защиты (cross protection). Он основан на явлении повышенной устойчивости растений к агрессивным формам какого-либо вируса при условии, что оно было ранее заражено менее вредоносной формой того же самого вида вирусов. Механизм этого явления точно не выяснен, однако его достаточно широко используют в Японии для защиты томатов от поражения вирусами томатной и огуречной мозаики, в Бразилии — для защиты цитрусовых, папайи, кабачков цуккини и т.д.
В 1986 г. П. Абель с сотрудниками впервые получил устойчивые к вирусу табачной мозаики растения табака путем переноса в их геном гена этого вируса, кодирующего образование белка оболочки [13]. Подход успешно опробовали на многих растениях. Но для коммерческого использования допущены немногие: папайя, две формы цуккини, сорта картофеля.
Генетически модифицированные джинсы
Но растениеводам приходится бороться не только с вирусами, но и с насекомыми-вредителями сельскохозяйственных культур. Насекомые, как и любые другие живые существа, болеют. Одно из заболеваний насекомых вызывает бактерия тюрингская палочка (Bacillus thuringiensis). Она выделяет белок, нарушающий пищеварение у насекомых (Bt-токсин) и при этом обладающий высокой избирательностью действия. Это означает, что Bt-токсин, выделенный из определенного штамма бактерий, способен убивать определенный вид насекомых (например, жуков). Как же он это делает? Если Bt-токсин попадает в пищеварительный тракт чувствительного к нему насекомого, то под действием протеолитического фермента от него отделяется небольшая часть (активная форма этого белка). Она прикрепляется к специфическим рецепторам пищеварительного тракта насекомого и вызывает лизис (растворение) клеток. Насекомое перестает питаться, происходит обезвоживание организма и в конце концов бедняга погибает. А что будет, если Bt-токсин попадет в нечувствительный к нему организм? Да ничего особенного — этот токсин просто переварится. Со школьных уроков биологии вы, скорее всего, помните, что строения пищеварительного тракта насекомых и человека сильно различаются, да и ферменты разные. Поэтому людям не стоит бояться Bt-токсина — для них он абсолютно безопасен.
Из бактерий выделили ген, отвечающий за синтез Bt-токсина, и внедрили его в геном растений. С 1997 года в Китае начали выращивать генетически модифицированный хлопчатник, устойчивый к вредителям (в частности — к хлопковому долгоносику). В итоге повысились урожаи хлопка и резко сократилось использование химических пестицидов, что значительно улучшило экологическую обстановку в сельскохозяйственных районах Китая. В Индии — одной из лидирующих стран-производителей хлопка — сегодня около 90% площадей заняты генетически модифицированным хлопком [14]. Значит, если вы носите джинсы — 9 из 10 шансов, что генетически модифицированные. И ничего страшного, правда?
Среди Bt-растений, продаваемых в США, преобладают хлопок и кукуруза, а также устойчивый к колорадскому жуку картофель [10–12].
Бизнес и ничего личного
Одной из основных проблем сельскохозяйственного производства является борьба с сорняками. В развитых странах для этих целей широко применяют гербициды. При этом возникает проблема защиты культурных растений, неустойчивых к этим гербицидам. Первое место среди гербицидов по производству в мире занимает глифосат. Его выпускают под названиями «Раундап», «Глифор», «Торнадо» и «Ураган». Этот гербицид разработала скандально известная транснациональная компания Monsanto. И ученые этой компании нашли возможность защитить полезные растения от своего гербицида — чего не сделаешь ради бизнеса?! Как же им это удалось?
Гербицид глифосат относится к гербицидам сплошного действия. Его мишенью в растении является фермент 5-енолпирувил-шикимат-3-фосфатсинтаза (EPSPS), который играет важную роль в синтезе ароматических аминокислот. Под действием гербицида у неустойчивых к нему растений наблюдаются симптомы азотного голодания, и они погибают. Ученые выделили ген этого фермента из агробактерии (уже знакомой нам Rhizobium radiobacter) и заменили в его структуре одну аминокислоту в области, где происходит его связывание с гербицидом. В итоге — глифосат не может дезактивировать такой мутантный фермент. Ген встроили в сою (рис. 11), и такая гербицидоустойчивая соя стала одним из первых трансгенных растений. Она продается под торговой маркой «Раундап Рэди» (что означает «Готовая к „Раундапу“»). Генетически модифицированная соя разрешена к импорту и использованию для пищи в большинстве стран мира и является безусловным лидером среди всех трансгенных культур [8–11].

Рисунок 11. Поле трансгенной сои.
Ассорти трансгенных растений
Перспективным проектом является создание сортов сельскохозяйственных культур, устойчивых к неблагоприятным климатическим условиям [15]. Например, получили устойчивые к засухе трансгенные растения, имеющие в своем геноме ген скорпиона [16]. Создали «помидор с жабрами» — помидор, в который для увеличения морозоустойчивости встроили ген североамериканской плоской рыбы камбалы [16]. Надеемся, вы уже поняли, что никаких жабр у данного помидора нет, просто в его геном встроен маленький кусочек рыбьей ДНК. А вот журналисты, которым лень разбираться в принципах создания ГМО, даже окрестили этот трансгенный помидор «завтраком Франкенштейна». Но вы, как внимательные читатели, не будете же говорить как в анекдоте «не буду есть трансгенные растения: там есть гены, а в обычных — нет».
Внимание ученых привлекает также идея использования трансгенных растений в качестве биореакторов для производства ценных фармацевтических соединений [4]. Созданы растения табака с человеческим интерлейкином 10 (стимулятором иммунитета) [12], [17].
В цветоводстве активно используют получение трансгенных растений с измененными декоративными свойствами. С помощью генов, отвечающих за разные пигменты, выращивают петунии с разноцветными цветками. В 2004 году получили сорт роз Blue Moon с геном пигмента дельфиниума [11]. Синяя роза, издавна встречающаяся в произведениях литературы и искусства как символ недостижимого идеала, стала реальностью?
Трансгенное будущее
Трансгенные растения уже прочно вошли в нашу жизнь. В период с 1996 по 2012 гг. общая площадь посевов трансгенных культур в мире выросла с 0 до 180 млн гектаров. В 2013 году развивающиеся страны обогнали промышленно развитые по площади возделывания трансгенных культур. Лидером оказалась Бразилия, до этого лидировали США. Основные трансгенные культуры — это соя, кукуруза, хлопчатник и рапс. Всего сейчас на рынок допущено 28 трансгенных культур, а в следующие пять лет ожидается получение разрешений еще на 85 [18]. К производителям ГМ-продуктов относятся такие известные компании как Heinz, Coca-Cola, PepsiCo, Mars, Cudbury, Lipton, Calve, Nescafe, Maggi, Nestle, Nesquik.
Транснациональная корпорация «Монсанто» — лидер по производству и продаже семян трансгенных культур. Ее называют самой ненавидимой корпорацией в мире. Регулярно проходят марши и митинги против этой компании и ГМО в целом. Новые болезни, мутанты, суперсорняки, конец эволюции — что это: ГМО-страшилки или реальная угроза?
Как только была создана первая рекомбинантная ДНК, человек почувствовал, что, возможно, переходит черту. Создал то, о чем раньше мог только мечтать, — и испугался. Ученые, в том числе и сам Пол Берг, в 1974 году опубликовали в журнале «Сайенс» письмо с просьбой приостановить работы по генной инженерии до выявления безопасности трансгенных организмов и разработки правил безопасности работы с ними [19]. Чего же они боялись? Эпидемий неизвестных болезней, нарушения равновесия в природе, бесконтрольного размножения трансгенных организмов, хаотичного переноса генов. Неужели Пол Берг стал вторым Робертом Оппенгеймером и создал свою «атомную бомбу»? Может, правильным было бы окончательно запретить любые манипуляции с генами? Дерзкий человек бездумно вторгается в хрупкое равновесие природы — приведет ли это к чему-то хорошему? Эти вопросы задавали ученые — передовая часть общества, что уж говорить об обывателях. Работы по созданию трансгенных организмов приостановили законодательно в том же 1974 году. Возникали различные дискуссии ученых на данную тему, эксперименты продолжали проводить лишь в специальных, хорошо защищенных сооружениях. Но ничего страшного не произошло. В итоге в 1976 г. запрет сняли после разработки правил и техники безопасности работы.
Мнения ученых о безопасности генетически модифицированных источников питания расходятся. Указывают на следующие биологические риски использования ГМО [10-12], [14], [20]:
- Аллергические и токсические эффекты трансгенного белка. Однако появление в пище любого нового белка (не обязательно трансгенного) у чувствительных людей также может вызвать аллергию или снижение общего иммунитета.
- Невозможность предсказания исследователями того, в каком месте произойдет вставка чужеродной ДНК, и невозможность предвиденья последствий этого. Долгое время это было непреодолимой трудностью, однако современная технология CRISPR-Cas позволяет точечно изменять ДНК и решает эту проблему [21], [22].
- Плейотропный эффект встроенного гена. Фрагмент чужеродной ДНК может непредсказуемо изменить интенсивность экспрессии соседних генов («включить» ранее молчащие гены или «выключить» работающие), что приведет к изменению клеточного метаболизма.
- Риск передачи заданных свойств сорнякам.
- Влияние на биоразнообразие планеты.
- Потенциальная опасность для здоровья человека путем переноса встроенного гена в микрофлору кишечника или образования из модифицированных белков под воздействием нормальных ферментов так называемых минорных компонентов, способных оказывать негативное влияние. Конечно, при питании человека или животных такими продуктами генетический аппарат растений должен разрушаться в кишечнике, однако вдыхание пыльцы этих растений теоретически может отрицательно повлиять на организм.
Действующая в России система контроля ГМО считается одной из самых жестких. Российские производители обязаны маркировать продукты, если содержание ГМО превышает 0,9%. А например, в Японии — 5%.
Сегодня в Россию можно ввозить и использовать в пищевых технологиях 16 сортов генетически модифицированных растений. Это кукуруза, соя, картофель, сахарная свёкла, рис. От 30 до 40% продуктов на современном рынке уже содержат компоненты, полученные из ГМО. Парадоксально, что при этом выращивать генетически модифицированные растения в России долго не разрешалось. 23 сентября 2013 г. вышло постановление, разрешающее выращивать трансгенные растения. Это постановление вступило в силу с 1 июля 2014 г. А первый урожай генномодифицированных зерновых планировали собрать уже в 2017 году. Однако в июле 2016 года вступил в силу новый закон, запрещающий выращивать на территории РФ растения и животных для производства продуктов питания. Теперь ГМО можно выращивать только в научных целях, а для питания необходимо ввозить ГМ-продукты из-за границы.
Вместо заключения
Установить 100-процентную безопасность любых пищевых продуктов научно невозможно. Однако генетически модифицированные продукты проходят множество подробных исследований. Пятнадцатилетний опыт стран, производящих трансгенные растения, показывает, что эти растения вполне безопасны . Человеку свойственен естественный страх перед переменами, но прогресс не остановить. А вот стоит ли лично вам есть продукты с ГМО — «думайте сами, решайте сами...»
В 2017 году американские Национальная академия наук, Национальная инженерная академия и Национальная медицинская академия изучили 900 научных публикаций за последние 20 лет. Результаты этого масштабного исследования «биомолекула» изложила в картинках: «ГМО: бояться нельзя питаться. Биологи знают, где поставить запятую!» [23] — Ред.
Мир меняется, хотим мы этого или нет. Время идет только вперед. Мир нашего будущего генетически модифицированный, этого уже не избежать. По мнению американского агронома и лауреата Нобелевской премии Нормана Борлоуга, «только новые развивающиеся биотехнологии могут спасти мир от голода и экологических катастроф».
Кстати, сейчас уже существуют и трансгенные животные, например зеленые светящиеся свиньи или цветные рыбки с геном медузы, отвечающим за синтез флуоресцентоного белка. Но это уже совсем другая история...
Литература
- Павличенко В.И. Основы молекулярной биологии и генетики. Днепропетровск: «ИМА-пресс», 2006. — 467 с.;
- Трансгенные растения — спасители планеты или бомбы замедленного действия?;
- Сингер М. и Берг П. Гены и геномы. М.: «Мир», 1998. — 377 с.;
- Богатырева М.А. (2011). Развитие правовой охраны штаммов микроорганизмов и клеточных культур как объектов изобретения. Новая правовая мысль. 6, 20–23;
- Катлинский А.В., Сазыкин Ю.О., Орехов С.Н., Чакалева И.И. Курс лекций по биотехнологии. М.: Первый МГМУ им.И.М.Сеченова, 2005. — 150 с.;
- Лутова Л.А., Павлова З.Б., Иванова М.М. (1998). Агробактериальная трансформация как способ изменения гормонального метаболизма у высших растений. Генетика. 34, 165–182;
- Поспелов С.М., Арсеньева М.В., Груздев Г.С. Защита растений. Л.: «Колос», 1979. — 432 с.;
- Пирузян Э.С. Основы генетической инженерии высших растений. М.: «Наука», 1988. — 64 с.;
- Першина Л.А. Методы культивирования in vitro в биотехнологии растений. Новосибирск: Изд. НГУ, 2000. — 68 с.;
- Кудрявцев Г. (2009). Генная инженерия от A до Z (часть 3). Geektimes;
- Лутова Л.А. (2000). Генетическая инженерия растений: свершения и надежды. Соросовский образовательный журнал. 10, 10–17;
- Дейнеко Е.В. (2014). Генетическая инженерия растений. Вавиловский журнал генетики и селекции. 18, 125–137;
- Mundembe R., Allison R., Sithole-Niang I. Genetic engineering of plants for resistance to viruses. In: Genetic engineering — basics, new applications and responsibilities / ed. by Barrera-Saldaña H.A. InTech, 2012. P. 121–144;
- Grose L. Sustainable cotton production. In: Sustainable textiles: life cycle and environmental impact / ed. by Blackburn R.S. CRC Press, 2009. P. 33–62;
- Готовим ГМ-рис вместе;
- Ермишин А.П. Генетически модифицированные организмы и биобезопасность. Минск: «Беларус. Навука», 2013. — 171 с.;
- Еще раз про ГМО;
- ISAAA brief 41-2009: executive summary. ISAAA;
- Berg P., Baltimore D., Boyer H.W., Cohen S.N., Davis R.W., Hogness D.S. et al. (1974). Potential hazards of recombinant molecules. Science. 185, 33;
- Лебедев В.Г. Продовольственная безопасность и трансгенные продукты // Россия в окружающем мире: 2004 (Аналитический ежегодник). М.: «Модус К — Этерна», 2005. С. 128–150;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- ГМО: бояться нельзя питаться. Биологи знают, где поставить запятую!.