
Готовим ГМ-рис вместе
20 апреля 2015
Готовим ГМ-рис вместе
- 2774
- 4
- 6
-
Автор
-
Редактор
Темы
«Что там в рисе исследовать? Его китайцы уже вдоль и поперек изучили!» — именно так мне отказали в устном докладе на одной из конференций. В этом есть доля правды, ибо чего только с рисом не делали! А о том, что делали — расскажу.
История одомашнивания риса (да, представьте себе, можно одомашнивать не только животных, но и растения) началась около 10 000 лет назад. Большинство ученых сходится в том, что все современные сорта принадлежат виду Oryza sativa, который произошел от дикого предка Oryza rufipogon. В виде O. sativa выделяют два основных подвида: короткозерный, в основном выращиваемый в Японии (var. japonica), и длиннозерный, выращиваемый в Индии, Южном Китае и Юго-Восточной Азии (var. indica).
Рис участвовал в «зеленой революции», в результате которой в 1960-е были получены его полукарликовые варианты с высокой продуктивностью (в 10 раз большей, чем у обычного риса). Это объяснялось тем, что карликовым растениям нужно меньше энергии для роста, а значит, они могли производить больше семян.
Современные селекционеры уже ушли от простых скрещиваний растений с интересующими признаками и в качестве основного метода используют генетическую инженерию. Ее основное преимущество — в скорости: не надо ждать, пока в природе появится новый ген или хорошее растение даст семена, чтобы можно было анализировать потомство.
Удобно ли исследовать генетические модификации растений? Ситуация двоякая. С одной стороны, легко выращивать (получил одну трансгенную клеточку и можешь из нее вырастить целое растение), с другой — долго растут (особенно если понадобится модифицировать древесные растения), результат придется ждать годами. С одной стороны, легко трансформировать (есть и ядерный геном, и пластидный), с другой — трудно определить конкретное место вставки трансгена, потому что еще не для каждого растения определены позиции всех его генов.
Взвесив все «за» и «против», предположим, мы всё-таки начали выводить новый генетически модифицированный сорт. Что нам нужно сделать?
Во-первых, определить, какой ген будем встраивать.
Во-вторых, спланировать, как будем встраивать.
В-третьих, обдумать, как заставим его работать.
Пойдем по порядку.
Ищем ген
Какой ген вставлять, зависит прежде всего от цели, ради которой затевается модификация. Если мы хотим, чтобы растение было устойчивым к бактериям и грибам, которые могут его съесть раньше нас, — вводим ген, отвечающий за синтез антибиотиков или фунгицидов. Если же мы хотим, чтобы плоды не созревали раньше времени, и их можно было перевозить, — вводим ген, замедляющий созревание. Почву для этих «чудес» готовят фундаментальные исследования, результаты которых тысячами выходят в научных журналах с длинными названиями и, на первый взгляд, бесконечно далеки от народа. К примеру, насколько важно знать, что в шикиматном пути синтеза ароматических аминокислот действует фермент EPSPS (5-енолпирувилшикимат-3-фосфатсинтаза)?!
Если посмотреть на карту метаболических путей, один фермент — лишь капля в море реакций (рис. 1А). В результате исследований выяснилось, что глифосат — самый распространенный гербицид — мешает работать именно EPSPS (рис. 1Б). Увеличив количество этого фермента (например, введя дополнительную копию его гена), можно создать растение, устойчивое к гербицидам. Странно, не правда ли? Гербицид должен убивать растения, так зачем же создавать устойчивые к нему виды? Оказывается, это один из способов борьбы с сорняками: если обработать гербицидом поля устойчивой к нему кукурузы, сорняки «вымрут», а кукуруза — нет. Сейчас 63% всех возделываемых в Бразилии ГМ-растений устойчивы к глифосату [1]. Вот так чисто фундаментальная работа — определение роли фермента в одном из биосинтетических путей — может привести к прорыву в генной инженерии.
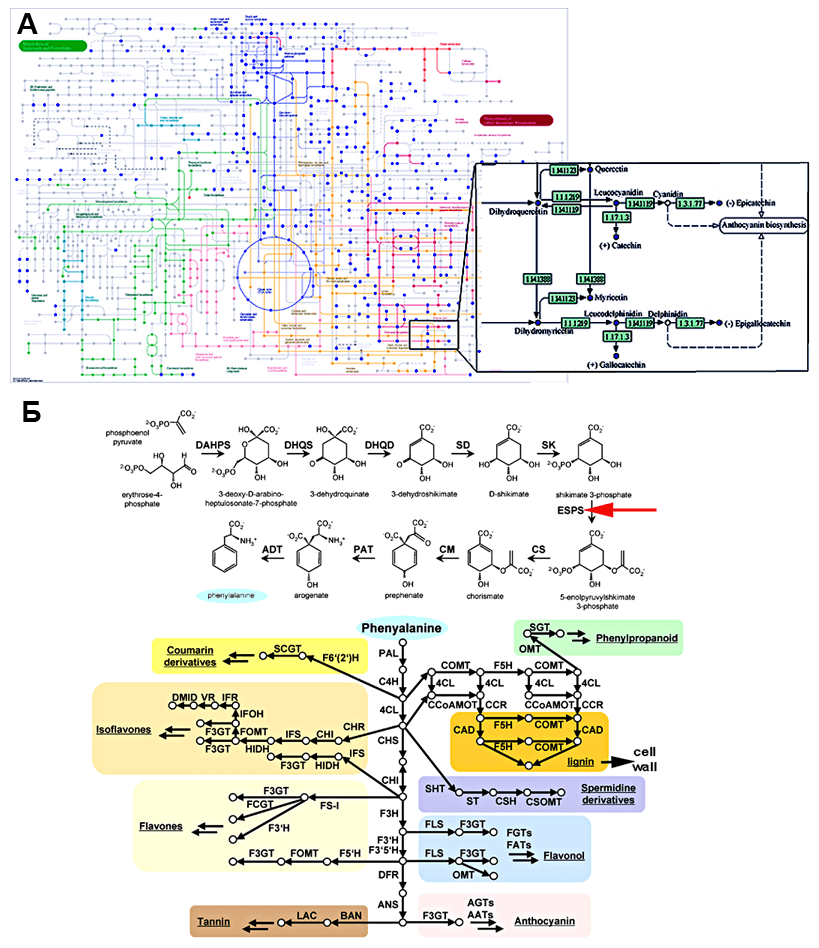
Рисунок 1. Хитросплетения метаболических путей. А — карта путей синтеза вторичных метаболитов винограда (увеличен фрагмент путей биосинтеза флавоноидов). Обратите внимание, как много ферментов, как много путей! Б — шикиматный путь и дальнейшие реакции, ведущие к образованию фенольных вторичных метаболитов (в т.ч. флавоноидов). Красная стрелка символизирует действие глифосата. Рисунки с сайта journal.frontiersin.org.
Переносим ген в растение
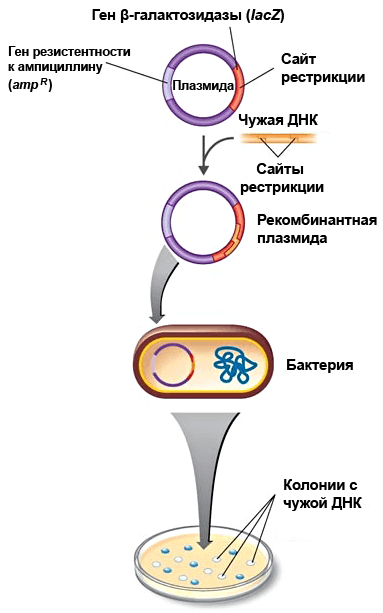
Рисунок 2. Трансформация и отбор бактерий. Специальная бактерия принимает плазмиду с геном устойчивости к ампициллину (ampR) и нужной вставкой (чужой ДНК) в ген β-галактозидазы (lacZ’). Или принимает плазмиду без вставки. Или вовсе ничего не принимает. Чтобы отобрать нужные клоны, бактерий высевают на питательную среду с антибиотиком и субстратом β-галактозидазы — X-Gal. Нетрансформированные бактерии («пустышки») не растут. Трансформированные плазмидой без вставки (до этого этапа различить векторы с целевым геном и без него было невозможно) растут с окрашиванием колоний в синий цвет из-за расщепления X-Gal. А вот нужные нам бактерии-«передовики», содержащие вектор со вставкой (а значит, стабильно нарабатывающие целевую ДНК), формируют белые колонии, т.к. X-Gal они расщепить не могут из-за вставки, повредившей ген β-галактозидазы. Рисунок с сайта classes.midlandstech.edu.
Свершилось — ген выбран! Теперь необходимо трансформировать растение (на языке молекулярной биологии трансформация — перенос ДНК в организм). Но одной молекулой ДНК растение не трансформируешь — их нужно много. И чтобы «наштамповать» ДНК, ученые «нанимают» бактерий, которые «за еду» (на питательных средах в чашках Петри) производят необходимое количество копий гена. Процесс наработки основывается на клонировании ДНК*.
* — Да, при производстве трансгенных организмов клонируют именно ДНК — объект наномасштаба, а не целых овец. О том, почему бедняжка Долли, полученная простой пересадкой ядра соматической клетки в цитоплазму яйцеклетки, здесь совсем ни при чём, то есть о клонировании ДНК в подробностях, но очень доступно и образно рассказано в статье «Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал» [2]. — Ред.
Как это делается? Вспомним, что «среднестатистическая» бактерия обладает одной кольцевой хромосомой и (иногда) разным числом меньших кольцевых молекул ДНК — плазмид. Чтобы заставить бактерию работать не на себя, а «на дядю», можно ввести в нее сконструированную плазмиду с требуемым геном. Такая плазмида называется вектором и содержит минимум три участка: нужный (целевой) ген, участок ori и маркерный ген. Рабочий ген встраивается в вектор при помощи универсальных закройных инструментов молекулярных биологов — ферментов эндонуклеаз рестрикции и лигаз. Ori нужен для того, чтобы плазмида (с помощью бактерии, конечно) могла себя копировать, ибо именно с этого участка начинается репликация плазмид. Маркерный ген обычно обеспечивает устойчивость к какому-то антибиотику. Дело в том, что эффективность трансформации бактерий получившимся вектором весьма далека от 100%, поэтому лишь небольшая часть популяции будет пригодна для дальнейшей работы. Ген антибиотикорезистентности позволяет на питательной среде с соответствующим препаратом отобрать бактериальные клоны, «усвоившие» плазмиду, «пустые» же погибнут от «отравления» (рис. 2). Ведь если в клетке не экспрессируется маркерный ген, с большой долей вероятности можно предположить, что эта клетка просто не содержит векторную конструкцию, и возиться с такими бактериями не стόит.
Итак, у нас много копий гена! Переходим к решению второго вопроса.
Поскольку из одной клетки растения нетрудно вырастить целый организм, то задача осложняется лишь наличием плотной клеточной стенки вокруг растительной клетки, не пропускающей лишнего. Если же ее убрать, образуются протопласты — клетки, окруженные только плазматической мембраной. ДНК в протопласты можно вводить при помощи микроинъекций, слиянием со сферопластами (бактериями без клеточной стенки) или с липосомами (пузырьками с оболочкой из двойного липидного слоя, по составу близкого к мембранам), содержащими ДНК, а также электропорацией и агробактериальной трансформацией.
При электропорации через раствор с протопластами и ДНК импульсно (50 мс) пропускают ток высокого напряжения (200–350 В), что приводит к временному образованию пор в мембране протопластов, и молекулы ДНК попадают внутрь клетки.
Агробактериальная трансформация, в отличие от всех предыдущих методов, — процесс естественный. Многие хотя бы раз слышали, что есть какие-то клубеньковые бактерии, живущие на корнях бобовых. А те, кто с корнем вырывал люпин или горох, могли даже видеть эти клубеньки, в которых живут бактерии семейства Rhizobiaceae. Они «квартируются» у растений, расплачиваясь фиксируемым из воздуха азотом, который необходим для синтеза растительных белков. Но к этому же семейству относится и фитопатоген, не приносящий никакой пользы, но формирующий корончатые галлы на корнях растений, — Agrobacterium tumefaciens. Деятельность агробактерии очень напоминает рейдерский захват: она вносит в растение свою плазмиду (Ti-плазмиду), фрагмент которой встраивается в растительную хромосому и заставляет ткани корня разрастаться и формировать галлы. Так вот, вместо генов «рейдерского захвата», отвечающих за синтез опинов (питательных веществ для бактерий) и фитогормонов (провоцирующих развитие опухоли), в плазмиду вшивают нужный человеку ген и возвращают ее в агробактерию. Не подозревая подлога, разоруженный микроб самостоятельно, традиционным путем, доставляет вектор в растение (рис. 3).
Эта природная система нацелена на двудольные растения: трансформация однодольных посредством агробактерий чаще всего неэффективна. Тогда прибегают к биобаллистике — применяют генную пушку, в прямом смысле обстреливая культуру клеток частицами вольфрама или золота, покрытыми ДНК.
Ну и последний вопрос. А как заставить ген работать?
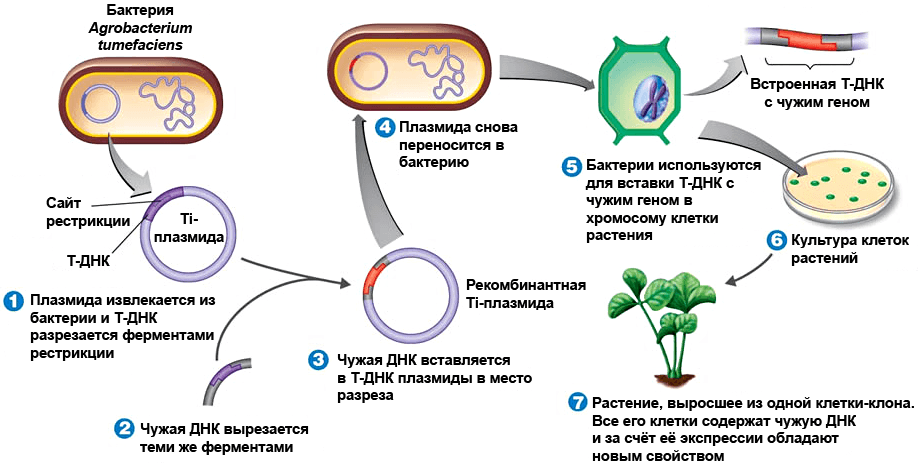
Рисунок 3. Агробактериальная трансформация (пояснения в тексте). Рисунок с сайта classes.midlandstech.edu.
Просим ген заработать
На этот вопрос, на самом деле, дали ответ Жакоб и Моно в 1961 году, выдвинув гипотезу регуляции лактозного оперона бактерий, в которой показали, что работа генов регулируется промотором. Промотор — это обычно находящаяся перед геном последовательность ДНК, с которой связывается РНК-полимераза, чтобы начать синтез мРНК. Кроме того, синтез мРНК должен быть закончен, чему способствует терминаторная область в конце гена. В общем случае гены могут работать постоянно — конститутивно [попробуйте повторить это слово быстро пять раз] — или индуцибельно — только при действии дополнительных факторов. Возвращаясь к примеру с гербицидами, нам важно, чтобы всё растение целиком всегда было от них защищено, и, значит, наш выбор — конститутивный промотор. А если мы хотим красную ромашку — достаточно запустить синтез пигмента в венчике, но не во всем растении. Значит, возьмем индуцибельный промотор, который «сработает» в нужное время.
Чтобы удостовериться, что наш ген попал в клетку и работает в нужном месте, в одной плазмиде с ним вводят репортерный ген: зеленого флуоресцентного белка (GFP) [3], β-глюкуронидазы (GUS) или люциферазы (LUX) [4]. Репортерный ген безвреден для клетки, а его продукт легко обнаружить: GFP флуоресцирует зеленым при возбуждении синим светом, GUS подкрашивает клетки синим при добавлении вещества X-Gluc (5-бром-4-хлор-3-индолил глюкуронид), LUX производит вспышку света при добавлении люциферина, превращая его в оксилюциферин.
Рис
Для риса подобные трансформации проводили много-много раз. Несмотря на то, что рис — однодольное растение, для него разработали особую модификацию агробактериальной трансформации с «неземной» эффективностью — почти 100% [5]. Выделяют два направления трансформации риса: на увеличение количества (рис первого поколения) и качества (рис второго поколения).
ГМ-рис первого поколения
Эта группа модификаций нацелена на повышение устойчивости и продуктивности.
Возможный вариант формирования устойчивости к гербицидам (глифосату) уже упоминался. Для устойчивости к насекомым в растения встраивают ген бактерии Bacillus thuringiensis, отвечающий за синтез Bt-токсина, растворяющего кишечник насекомых изнутри. Кроме этого, была повышена устойчивость риса к засухе, засолению и холоду. Три этих экологических фактора действуют сходным образом — клетка обезвоживается. Увеличив производство веществ, удерживающих воду (осмопротекторов), можно помочь растению запасти ее.
С увеличением продуктивности на целых 50% связана интересная группа мутаций, изменяющих тип фотосинтеза у риса с С3 на С4 (у С4-риса даже есть свой сайт) [6]. С3-растения в процессе фотосинтеза фиксируют CO2 в виде 3-фосфоглицериновой кислоты, в молекуле которой три атома углерода, а С4-растения — в виде щавелево-уксусной кислоты, в которой атомов углерода четыре. Второй способ оказался более эффективным по использованию азота и уменьшению потерь воды, поэтому в эволюции он возникал многократно у растений, живущих в засушливых местах (чего, конечно, не скажешь о рисе). Именно многократность возникновения С4-типа фотосинтеза у растений навела исследователей на мысль, что это не так сложно и может быть сделано в лаборатории. С4-растения отличаются не только биохимически, но и по строению листа: вокруг жилок есть клетки с утолщенными клеточными стенками — клетки обкладки, — в которых и протекает фотосинтез. Круговая структура из этих клеток на срезе напоминает корону или венец, поэтому такое строение листа называется кранц-анатомия (от нем. der Kranz — венец) (рис. 4). Авторы разработки считают, что в первую очередь у риса необходимо сформировать кранц-анатомию. На проект по созданию С4-риса возлагают большие надежды и называют его не иначе как «следующая зеленая революция».
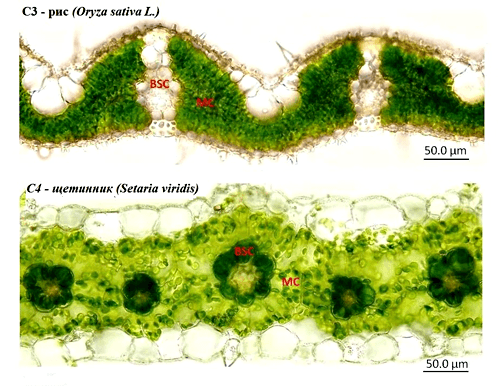
Рисунок 4. Кранц-анатомия. Обратите внимания на разницу клеток обкладки (BSC, bundle sheath cells) растений C3 (рис) и С4 (щетинник). В клетках обкладки С4-растения заметно большое количество хлоропластов — в этих клетках в основном и происходит фотосинтез. Рисунок из [6], адаптирован.
ГМ-рис второго поколения
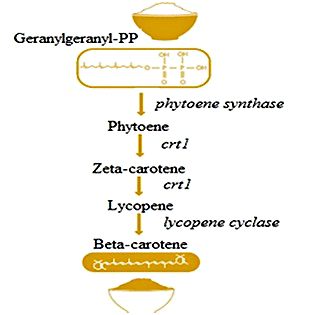
Рисунок 5. Как сделать золотой рис. Вам понадобится: рис, нарцисс и бактерия (Erwinia uredovora). Запустив в зерновках риса ген фитоенсинтазы нарцисса (phytoene synthase) и фитоендесатуразы бактерии (Crtl), вы получаете ликопин. Если хотите получить именно β-каротин, можно добавить немного ликопин-β-циклазы (lycopene cyclase) из нарцисса. Золотой рис готов! Рисунок с сайта s4.hubimg.com.
Цель этих модификаций — улучшение пищевых свойств риса. Речь идет о биообогащении питательными веществами — провитамином А (золотой рис), витамином B9 и железом, о получении риса, не вызывающего аллергии, и даже о производстве активных веществ — например, лизоцима и лактоферрина — в клетках риса.
Самый нашумевший в этой области проект — золотой рис, который начали разрабатывать в 2000 году [7]. В развивающихся странах, где рисом питаются три раза в день, жители испытывают дефицит витамина А, так необходимого для нормального зрения и вообще для здоровой жизни. Чтобы зерновки риса начали производить предшественник витамина А — β-каротин, — ученые ввели гены трех ферментов: фитоенсинтазы (psy) из нарцисса, бактериальной фитоендесатуразы (crtI) под контролем конститутивного промотора и ликопин-β-циклазы (beta-lcy) — тоже из нарцисса (рис. 5).
Дальнейшие модификации приводили к увеличению доступности витамина А зерновок для организма человека, а также обогащали рис фолатом (витамином В9) и железом (рис. 6). Некоторые авторы подчеркивают необходимость «золотых круп» для человеческой популяции, но технология ввиду своей сложности всё еще на стадии разработки [8].
За улучшение качества риса также взялись японские аллергологи. Во-первых, они попытались вывести рис, на который не будет аллергии за счет уменьшения синтеза запасных белков в зерновках (альбумина и глютенина). Во-вторых, создали рис, устраняющий симптомы аллергии на пыльцу кедров (от этой аллергии страдают 20% японцев): в него встроили некоторые белки пыльцы и даже опробовали на обезьянах [9]. Это направление называется разработкой растений-вакцин (GM-based vaccines). Основная трудность — выбор дозировки подобной вакцины.
Не могли обойти вниманием рис и биотехнологи, которые пытаются производить рекомбинантные белки (то есть белки, полученные методами генной инженерии) во всём, что живет. В последнее время растения всё чаще используют в качестве «биореакторов» для производства множества веществ — от углеводов до диагностических белков и биополимеров [10]. В рисе нарабатываются два белка — лактоферрин, необходимый в питании детей, и лизоцим, обладающий антисептическим действием.

Рисунок 6. Золотой рис, полученный в 2000 г. (GR1) и впоследствии усовершенствованный (GR2). Как можно видеть по насыщенности цвета, GR2 накапливает больше β-каротина. Рисунок с сайта www.goldenrice.org.
Поклонникам естественности
И всё же, далеко не каждого человека и даже не каждого биолога при созерцании нежной зелени экспериментального рисового поля посетит мысль: «Как свежо, как прекрасно... модифицировано!» Сочетание букв «Г», «М» и «О» обладает поистине магической силой...
Некоторые ученые видят принципиальные различия между генетически модифицированным рисом и тем, что они называют естественным мутантом. По их мнению, при генетической модификации мы встраиваем чужой ген (бактерии, нарцисса, человека), а в результате мутации лишь чуть-чуть (или значительно) изменяем свой (рисовый). Такие растения, конечно, будут естественными, но найти растение с нужными мутациями трудно. Поэтому используют искусственный мутагенез, ускоряя возникновение мутаций воздействием радиации или химических веществ. Кроме того, оказалось, что при культивировании клеток растений in vitro (в чашках Петри) мутации возникают с высокой скоростью — проявляется так называемая сомаклональная изменчивость. Всё, что остается ученому, — выбрать растения с удачными мутациями.
Так, например, профессор Тимоти Крохан (Timothy Croughan) сообщает об успехах борьбы с красным рисом — сорняком, мешающим обычному рису. Как вы понимаете, найти гербицид, действующий на красный рис, но не действующий на обычный, без генной инженерии трудно. Но ученые обнаружили двух естественных мутантов, устойчивых к гербицидам имидазолинового ряда. У одного из мутантов устойчивость даже не сказывалась на продуктивности [11].
* * *
Таким образом, генная инженерия позволила вывести (или пока только детально «спроектировать») формы риса с улучшенными агротехническими и пищевыми характеристиками. Это формы, устойчивые к гербицидам, фитопатогенам, насекомым, экологическим воздействиям (засухам, засолениям, затоплениям); формы с повышенной продуктивностью (С4-рис) и лучшим усвоением азота. Для медицинских целей разрабатываются растения-вакцины и продуценты рекомбинантных белков, которые можно будет использовать в том числе и при производстве лекарств, а также обогащенный рис, компенсирующий людям недостаток витаминов и микроэлементов. Однако пока еще ни один ГМ-сорт риса, даже разрешенный для культивирования, не получил такого широкого распространения, как соя или кукуруза. Будем ждать!
Литература
- Marinho C.D., Martins F.J.O., Amaral A.T., Gonçalves L.S.A., dos Santos O.J.A.P., Alves D.P. et al. (2014). Genetically modified crops: Brazilian law and overview. Genet. Mol. Res. 13, 5221–5240;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Биолюминесценция: возрождение;
- Ozawa K. (2012). A high-efficiency Agrobacterium-mediated transformation system of rice (Oryza sativa L.). Methods Mol. Biol. 847, 51–57;
- Karki S., Rizal G., Quick W.P. (2013). Improvement of photosynthesis in rice (Oryza sativa L.) by inserting the C4 pathway. Rice. 6, 28;
- Ye X., Al-Babili S., Klöti A., Zhang J., Lucca P., Beyer P., Potrykus I. (2000). Engineering the provitamin A (beta-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm. Science. 287, 303–305;
- Beyer P. (2010). Golden Rice and «Golden» crops for human nutrition. N. Biotechnol. 27, 478–481;
- Domon E., Takagi H., Hirose S., Sugita K., Kasahara S., Ebinuma H., Takaiwa F. (2009). 26-Week oral safety study in macaques for transgenic rice containing major human T-cell epitope peptides from Japanese cedar pollen allergens. J. Agric. Food Chem. 57, 5633–5638;
- Sharma A.K., Sharma M.K. (2009). Plants as bioreactors: Recent developments and emerging opportunities. Biotechnol. Adv. 27, 811–32;
- Croughan T.P. (2010). Clearfield Rice: It’s not a GMO. Louisiana Agriculture Magazine. 46, 24–26..






