
Я стану тебе крылом
30 октября 2016
Я стану тебе крылом
- 485
- 2
- 1
Клетка крыловых зачатков в раздумье о своем дальнейшем существовании. Картина художницы Натальи Деревянко «Крылатые качели».
сайт derevyanko-art.com
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Перед каждой юной клеткой крыловых зачатков плодовой мушки Drosophila melanogaster стоит нелегкий выбор, кем же стать в будущем: либо быть частью жилки, либо развиваться в составе межжилковой ткани. Кроме того, клетка не застрахована и от несчастного случая, который может привести к гибели. Что же помогает юной клетке выбрать жизненный путь?
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Вылет во взрослую жизнь
Конечно, как и любая другая клетка в составе организма, клетка крыловых зачатков не наделена полномочиями единолично вершить свою судьбу: она подчиняется разноуровневым регуляторам и следует «советам» многочисленных помощников. Однако настоящий фронт борьбы за выбор «профессии» разворачивается внутри клетки — там сталкиваются интересы как минимум двух крупных блоков молекул. Но для того чтобы описать удивительные события, происходящие с клетками крыла, стόит выяснить, что же происходит с самόй мухой.
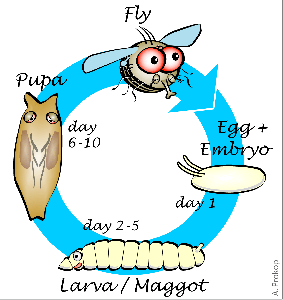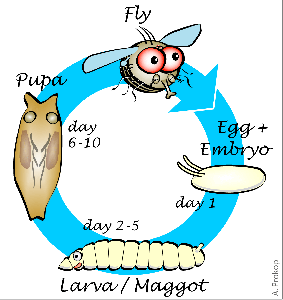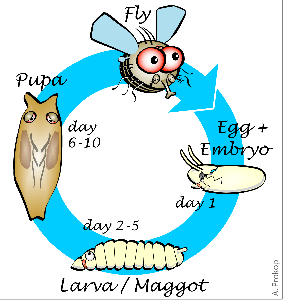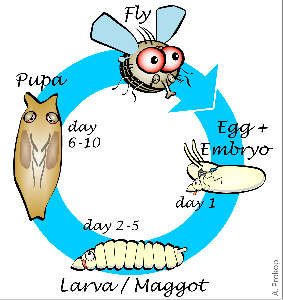
Рисунок 1. Этапы развития плодовой мушки. Жизненный цикл с полным превращением у дрозофилы состоит из этапов личинки, куколки и имаго. Крылья полностью формируются только на последнем этапе.
Дрозофила, подобно бабочке, взрослеет в два этапа. Такой жизненный цикл называется развитием с полным превращением. Вначале из яйца вылупляется личинка, напоминающая гусеницу, которая затем превращается в куколку — кокон, из которого появляется взрослая муха (имаго), уже через несколько часов способная к размножению (рис. 1). На большинстве этапов своего развития муха не имеет крыльев.
На стадии личинки невооруженный глаз видит лишь вытянутое червеобразное тело, но именно в этот момент происходит «зарождение» крыла. У личинки уже появляются особые клетки, которые потом дадут начало летательному аппарату мухи. Совокупность таких клеток образует крыловые зачатки. Основной этап формирования крыльев начинается со стадии куколки. На этой стадии крыловые зачатки называются крыловыми мешками. Крыловые мешки полые внутри и мало похожи на привычные нам летательные органы. Они разворачиваются и распрямляются лишь спустя нескольких дней, поскольку крылья годятся для полета лишь после вылупления взрослой особи [1].
Полностью развившееся крыло имеет особый «каркас» — жилки и ткань, расположенную между ними. Жилки служат крылу «строительными лесами», поддерживая его форму. Внутри жилок проходят каналы, по которым нервные волокна и трахеи доставляют в крыло электрические сигналы и кислород [2]. Клетки, образующие жилки, занимают 10% от всей поверхности крыла. В сравнении с клетками межжилковой ткани клетки жилок плотнее прилегают друг к другу и имеют меньшие размеры (рис. 2).
Крыло состоит из пяти продольных жилок, которые обозначаются L1—L5 (от англ. longitudinal — продольный), и двух поперечных — передней, ACV (от англ. anterior crossvein — передняя поперечная жилка), которая ближе к телу, и задней, PCV (от англ. posterior crossvein — задняя поперечная жилка), расположенной недалеко от края крыла (рис. 2).
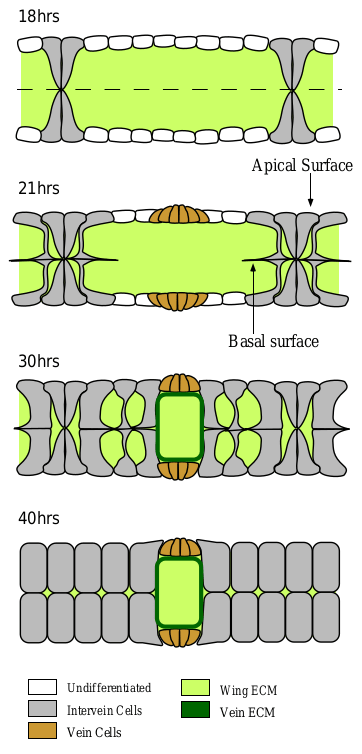
Рисунок 2. Формирование двух типов клеток крыла дрозофилы на стадии куколки. Примерно через 18 часов после окукливания начинают образовываться пары межжилковых клеток (отмечены серым), которые соединяются друг с другом. В то же время еще остается много недифференцированных клеток (отмечены белым). Спустя 21 час в массиве межжилковой ткани начинают возникать клетки жилок, отличающиеся меньшими размерами (отмечены оранжевым). Через 30 часов происходит уменьшение межклеточного пространства (отмечено светло-зеленым) среди межжилковых клеток и появление межклеточного пространства (отмечено темно-зеленым) среди клеток жилок. И наконец через 40 часов после окукливания ткани крыла формируются окончательно, межклеточное пространство в межжилковой ткани исчезает.
Каждая юная клетка, принадлежащая личинке, готовящейся окуклиться, делает выбор в пользу либо жилок, либо межжилковой ткани. После того как выбор сделан, а куколка сформирована, всего за 40 часов из одинаковых, неспециализированных клеток возникает ландшафт из двух разных тканей, составляющих одновременно и высокотехнологичную, и гениально простую конструкцию (рис. 3), которая помогает дрозофиле эффективно перемещаться в пространстве.
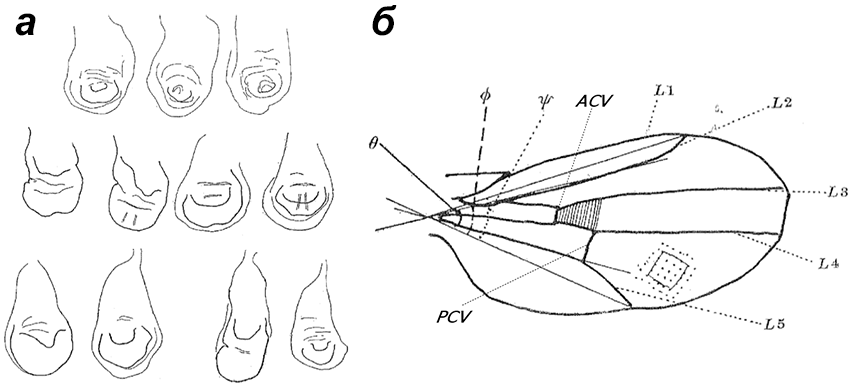
Рисунок 3. Развитие и строение крыла дрозофилы. а — Крыловые мешки на стадии куколки пока еще мало напоминают крылья. б — Крыло взрослой мухи, состоящее из жилок и ткани между ними.
В начале были гены
Крылья — это сложный летательный аппарат, который обеспечивает мухе возможность добывать пищу, исполнять брачный танец, а при необходимости и скрываться от опасности. Как и любой другой орган, обладающий обширным набором функций, крылья кодируются множеством генов. Эти гены определяют надлежащую анатомию и физиологию, которые позволяют дрозофиле оторваться от земли.
Как только сперматозоид оплодотворил яйцеклетку, дав тем самым начало новой жизни, в клеточных ядрах, начинающих активно делиться, активируются многие генетические каскады. Эта совокупность генов определяет план строения будущего организма и в дальнейшем отвечает за образование каждой щетинки на теле мухи [3].
Один из компонентов таких каскадов — ген rho (rhomboid, veinlet) — отвечает за формирование жилок [4]. Исследователи создали специальных мух-мутантов, у которых этот ген экспрессировался слабо, и увидели, что такие мухи имеют укороченные жилки. Лабораторные дрозофилы, у которых ген rho работал активнее, чем у их диких собратьев, наоборот, имели крылья с чрезмерно развитой жилковой тканью (рис. 4).

Рисунок 4. Ген rho отвечает за формирование жилок. а — Нормальное строение крыла мухи. б — Крыло мухи с мутацией, «выключающей» ген rho. в — Крыло мутантной мухи с большей активностью rho.
В некоторых случаях для эффективной работы этому гену нужна помощь. Так, при закладке второй продольной жилки (L2), rho функционирует благодаря другому гену (рис. 5), который называется kni (knirps).
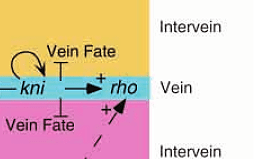
Рисунок 5. Ген kni запускает rho, стимулируя при этом и свою работу. В той области крылового зачатка, где работают эти гены, клетки становятся тканью второй продольной жилки (L2), в противном случае их ожидает участь межжилковой ткани.
Основным соперником rho в борьбе за судьбу крыловых клеток выступает ген bs (blistered). Он отвечает за формирование межжилковой ткани. На стадии куколки эти два гена имеют свои сферы влияния — определенные участки будущего крыла. На границах участков rho и be взаимно подавляют друг друга, не позволяя оппоненту «пробраться» на чужую территорию. Это приводит к разделению клеток будущего крыла на две области, в каждой из которых работает либо один ген, либо другой (рис. 6).
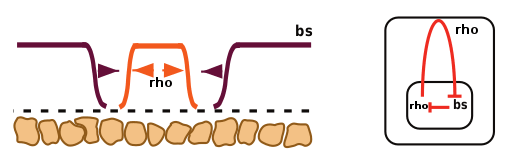
Рисунок 6. Развитие крыловых жилок Drosophila melanogaster на стадии куколки. Оранжевая область, в которой формируется жилка, — территория гена rho; фиолетовые области — будущая межжилковая ткань, за которую отвечает ген bs. Схема справа демонстрирует взаимное подавление этих генов на границе двух областей.
Не только вышеописанные гены позволяют мухе отрастить целое крыло. Любая живая система устроена намного сложнее, что доставляет немало проблем как исследователям, пытающимся постичь ее тайны, так и студентам, которые эти тайны пытаются воспроизводить на экзаменах.
На самом деле, поскольку крыло является неотъемлемой частью целого организма, гены, регулирующие развитие какой-либо ткани или органа, неизбежно влияют друг на друга. Каждый ген имеет специальные регуляторные элементы, которые могут как усиливать его работу, так и ослаблять, но даже знание этих сложных механизмов не позволяет достаточно точно описать дифференцировку крыловых клеток [7].
Дело в том, что гены зачастую просто выступают в роли своеобразных «шлагбаумов», давая разрешение на определенные молекулярные события. Ген — это «чертеж» молекулы белка. Если ген работает, то клетка «конструирует» белок по этому чертежу. При формировании крыльев работа многих генов определяет синтез различных белковых молекул. Эти молекулы взаимодействуют друг с другом, направляя развитие клеток крыловых зачатков в определенном направлении.
Именно среди разнообразных белков скрывается обширный пласт «помощников», которые влияют на формирование жилки либо промежуточной ткани.
«Ген» пишем, «белок» в уме
Итак, упомянутые выше гены запускают биохимические каскады, основные участники которых — белковые молекулы, способные вступать друг с другом в различные взаимодействия [8].
Продукт гена rho опосредованно активирует белок EGFR (от англ. epidermal growth factor receptor — рецептор эпидермального фактора роста), который способствует образованию жилок.
EGFR локализуется внутри клеточной мембраны и отвечает не только за образование крыльев, но и за развитие многих органов и тканей как у дрозофилы, так и других животных, включая человека. Такое обилие функций связано со способностью этого белка передавать сигналы от соседей внутрь своей клетки: определенные лиганды активируют EGF-рецептор, вызывая изменения его конформации и появление у него протеинкиназной активности — белок фосфорилирует сам себя и белок-мишень, а далее фосфат (PO43−) выполняет роль эстафетной палочки, позволяя уже другим молекулам принять участие в судьбе крылового зачатка [9].
Активируясь по цепочке, белки доносят сигнал с самой периферии клетки до ее «сердца» — ядра — и запускают многие гены, которые делают клетку частью жилки. При передаче сигнала снова включается в работу ген rho. Белок Rho снова активирует EGFR, и цикл повторяется по новой. Получается, что rho усиливает свое собственное влияние в тех скоплениях клеток, которым предстоит стать жилковой тканью [10]. Такое усиление называется положительной обратной связью.
Если есть сложно устроенный белковый механизм, который отвечает за образование крыловых жилок, значит, должен быть и способ, позволяющий клеткам развиваться в другом направлении.
И такой способ, конечно же, существует. Создание межжилковой ткани курирует упомянутый ранее ген blistered. Этот ген кодирует белок SRF (от англ. serum response factor — фактор ответа на сыворотку), такой же многофункциональный и распространенный среди животных, как и EGFR. SRF относится к семейству транскрипционных факторов. Это означает, что он умеет связываться непосредственно с молекулой ДНК и регулировать работу генов так, чтобы блокировалось развитие жилок и образовывались межжилковые клетки (рис. 7) [6].
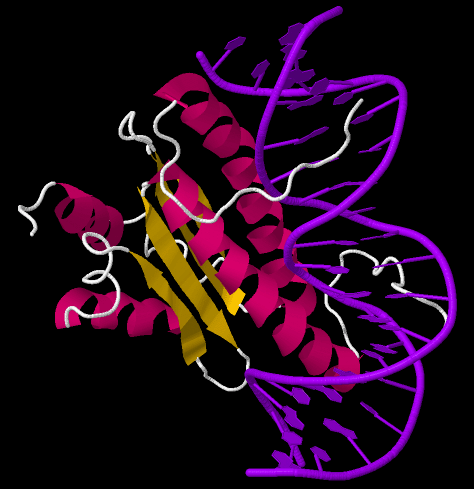
Рисунок 7. SRF связывается с ДНК и блокирует работу «жилковых» генов. SRF имеет особые спиральные участки (помечены розовым). Такая структура позволяет эффективно взаимодействовать с двойной спиралью ДНК (отмечена фиолетовым).
сайт rcsb.org
Неожиданные союзники
Казалось бы, сферы влияния поделены: в каждой области крылового зачатка работает определенная группа генов, и более активен один из основных белковых механизмов — под руководством либо EGFR, либо SRF, — но не так просто обстоят дела на границе этих областей. На стыках зон клеток, избравших разный путь дифференцировки, происходит не только взаимное подавление генов rho и blistered, но и межбелковое противостояние. В такие «пограничные войны» зачастую ввязываются посторонние агенты, не проявляющие себя в других областях крыловых тканей. Например, в некоторых случаях активность EGFR подавляется при помощи продукта гена knot. Но существует множество белков, которые, наоборот, активируют EGFR. Их список постоянно пополняется.
Белок Сap-D3 (от англ. cromatin association protein D3 — связанный с хроматином белок D3) — это конденсин. Белки-конденсины помогают сворачиваться ДНК в петли, чтобы она помещалась в ядре. В 2016 году американские исследователи обнаружили, что помимо своей основной «профессии», Сap-D3 принимает активное участие в формировании у плодовой мушки передней поперечной жилки (ACV) (рис. 8).
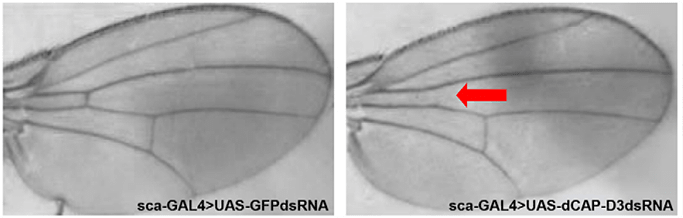
Рисунок 8. Саp-D3 отвечает за формирование ACV. Слева — нормальное крыло дрозофилы. Справа — крыло мухи, у которой выключен синтез Cap-D3 в крыловых областях. Стрелкой показано отсутствие ACV.
Выяснилось, что Cap-D3 способен регулировать развитие ACV, связываясь с энхансером гена knot — особым участком ДНК, который усиливает работу этого гена. Без вмешательства Сap-D3 продукт knot блокирует активность EGFR, обрекая часть клеток на гибель и давая зеленую улицу белку SRF, который направляет клетки по пути межжилковой ткани (рис. 9).
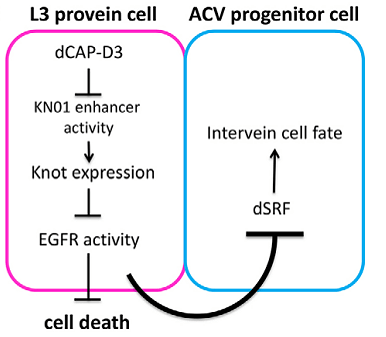
Рисунок 9. Механизм развития ACV при помощи Cap-D3. Розовым обведены события, происходящие в регионе будущей продольной жилки L3. Голубым обведены события, которые происходят в области будущей поперечной жилки ACV. Сap-D3 блокирует энхансер гена knot, не позволяя нарабатывать белок, препятствующий активации EGFR. Поэтому EGFR активируется и, в свою очередь, не допускает молекулярные реакции, приводящие к гибели жилковых клеток. Также EGFR, действуя на пограничную область, блокирует белок SRF, что не дает ему запустить дифференцировку клеток в направлении межжилковой ткани.
И на крыльях бывают белые пятна
Впервые развитие крыла дрозофилы было подробно описано в 1940 году. В связи с бурным развитием молекулярной генетики в 1990-е годы интерес к механизмам дифференцировки крыловых клеток вновь возник и не утихает по сей день. Но даже в XXI веке в этой области остается много белых пятен.
За каждым геном, определяющим судьбу крыловой клетки, стои́т целый легион белков, вспомогательных регионов и других генов. Каждый из многочисленных элементов этой системы находится во взаимосвязи с остальными, и все тонкости этой «социальной сети» на сегодняшний день не известны.
Хотя многие животные, в отличие от плодовой мушки, не имеют крыльев, за развитие их лап, ушей, хвостов, рук и прочих конечностей отвечают механизмы, на молекулярном уровне схожие c «конструкторами крыльев» у дрозофилы. Получается, что устройство маленького крылышка способно дать ответы на больши́е вопросы.
Литература
- Waddington C.H. (1940). The genetic control of wing development in Drosophila. J. Genet. 41, 75–113;
- Fristrom D., Gotwals P., Eaton S., Kornberg T.B., Sturtevant M., Ethan B., Fristrom J.W. (1994). Blistered: a gene required for vein/intervein formation in wings of Drosophila. Development. 120, 2661–2671;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Sturtevant M.A., Roark M., Bier E. (1993). The Drosophila rhomboid gene mediates the localized formation of wing veins and interacts genetically with components of the EGF-R signaling pathway. Genes Dev. 7, 961–973;
- Lunde K., Biehs B., Nauber U., Bier E. (1998). The knirps and knirps-related genes organize development of the second wing vein in Drosophila. Development. 125, 4145–4154;
- Roch F., Baonza A., Martín-Blanco E., García-Bellido A. (1998). Genetic interactions and cell behaviour in blistered mutants during proliferation and differentiation of the Drosophila wing. Development. 125, 1823–1832;
- Развитие и эпигенетика, или История о Минотавре;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Martín-Blanco E., Roch F., Noll E., Baonza A., Duffy J.B., Perrimon N. (1999). A temporal switch in DER signaling controls the specification and differentiation of veins and interveins in the Drosophila wing. Development. 126, 5739–5747;
- Sturtevant M.A., Roark M., Bier E. (1993). The Drosophila rhomboid gene mediates the localized formation of wing veins and interacts genetically with components of the EGF-R signaling pathway. Genes Dev. 7, 961–973;
- Klebanow L.R., Peshel E.C., Schuster A.T., Kuntal D., Sarvepalli K., Lemieux M.E. et al. (2016). Drosophila condensin II subunit chromosome-associated protein D3 regulates cell fate determination through non-cell-autonomous signaling. Development. 143, 2791–2802.







