
Диагностика болезней растений и современные технологии
22 августа 2013
Диагностика болезней растений и современные технологии
- 8179
- 0
- 0
Иллюстрация с обложки книги Ю.Т. Дьякова «О болезнях растений»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Фитопатология — это наука о болезнях растений, о том, как с этими недугами бороться и предупреждать их возникновение. Чтобы побеждать болезни, надо их правильно, точно и своевременно диагностировать. Есть много методов такой диагностики; в последние десятилетия, с развитием молекулярных методов анализа, активно разрабатываются всё новые и новые, постепенно вытесняя из практики классические подходы. О трудностях диагностики болезней растений и об основных путях их преодоления и будет рассказано в этой статье.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Чем болеют растения?
Для начала несколько слов о том, от чего, собственно, специалистам приходится защищать сельскохозяйственные растения. Причинами заболевания растений могут быть как факторы среды (летняя засуха или зимние морозы, недостаток питательных веществ в почве или их избыток и т.п.), так и различные паразитические организмы (бактерии, вирусы, грибы, круглые черви (нематоды) и даже другие растения).
Грибы, бесспорно, являются основными патогенами культурных растений. Известно, например, что из 162 серьёзных заболеваний в Центральной Европе 135 (83%) вызываются грибами [2]. Фитопатогенные грибы — многочисленная группа; их описано свыше 10 000 видов, различных по систематическому положению, степени паразитизма, специализации и т.д. [3]. Они широко распространены в природе и при благоприятных для их развития условиях наносят значительный урон урожаю и сельскохозяйственным продуктам при хранении. Даже самые осторожные оценки говорят об уничтожении болезнями 10–20% потенциального урожая; без контрмер масштабы этих потерь резко возросли бы [2].
Именно о проблемах диагностики болезней растений, вызываемых фитопатогенными грибами, пойдёт речь в данной статье.
Врага надо знать в лицо
Зачем же нужно, с одной стороны — обнаружение, а с другой — быстрое и точное (желательно — до вида, или даже расы) определение фитопатогенных грибов?
На данный момент самым распространённым методом борьбы с фитопатогенными грибами является обработка растений фунгицидами. Понятно, что невозможно защитить культуры от всех возможных потенциальных угроз: это и сложно, и экономически невыгодно, да и для окружающей среды далеко не полезно. Именно поэтому важно знать, желательно — своевременно, с чем именно придётся бороться. Чем раньше обнаружена болезнь, тем больше шансов, что, приняв соответствующие меры, удастся её победить. Это верно для заболеваний как человека, так и растений. Кстати, точное определение вида грибов важно ещё и в довольно неожиданной области — реставрации деревянных строений — поскольку используемые там антисептические меры также очень сильно зависят от типа поражения [4].
Кроме этого, идентификация фитопатогенных грибов необходима для изучения их таксономии и эволюции, их взаимоотношений с растениями-хозяевами, генетических основ восприимчивости и устойчивости растений, что, в конечном счете, должно помочь в разработке способов борьбы с патогенами и в селекции растений, невосприимчивых к болезням [5].
И, наконец, крайне важна сертификация зерна и посадочного материала в рамках карантинных программ. Известно, что фитопатогенные грибы могут распространяться многими путями — как естественными (с током воздуха, водой, насекомыми, животными), так и при помощи человека, перевозящего заражённые растения или их части не только между различными странами, но и между континентами. Зачастую такое перемещение приводит к неожиданному и масштабному распространению заболеваний.
Например, пузырчатая ржавчина (Cronartium ribicola) была эндемична для Альп и востока России. Этот паразит, в цикле развития предполагающий обязательную смену хозяев, обитает круглый год на пятихвойных соснах, а летом поражает листья смородины; ни в одном из исходных ареалов он не причинял серьёзного ущерба. Однако веймутова сосна, завезённая в начале XVIII века из Америки в ряд областей Европы, оказалась крайне восприимчивым хозяином для данного гриба. За счёт этого распространившаяся инфекция причинила большой вред культурам смородины и высаженным веймутовым соснам, а в 1909 году была завезена с их рассадой в Америку, где встретила многочисленных хозяев для обеих фаз развития. Здесь стали страдать, прежде всего, лесообразующие пятихвойные сосны. Поэтому, чтобы разорвать инфекционную цепь паразита с обязательной сменой хозяев, пытаются уничтожать дикорастущие виды смородины [2].
Ещё один показательный пример: возбудитель голландской болезни вяза (Ophiostoma ulmi) уже в XX столетии был занесён из континентальной Европы в Северную Америку. Начиная примерно с 1970 г., после того, как он был завезён в Великобританию, он успел уничтожить половину английских вязовых насаждений [2]. Теперь этот вид встречается и в России.
Для того чтобы избежать подобного впредь, созданы списки карантинных организмов, и при перемещении растений или их семян между странами (или даже частями одной страны) обязательно проводится их обследование.
«Классические» методы диагностики и трудности в их применении
Как только что было показано, идентификация фитопатогенных грибов крайне важна, возник вопрос — каким образом она производится?
Наиболее простой способ — это идентификация патогена по внешним признакам заболевания (симптомам), то есть по тому воздействию, которое он оказывает на поражённое растение [6]. Но здесь проблема в том, что к одним и тем же повреждениям растения-хозяина могут приводить совершенно разные микроорганизмы, отличающиеся разной устойчивостью к фунгицидам, вредоносностью и другими характеристиками. Как пример, здесь можно привести три листовые пятнистости пшеницы (рис. 1).

Рисунок 1. Листовые пятнистости пшеницы. Слева — септориоз листьев пшеницы (возбудитель — Mycosphaerella graminicola). По центру — септориоз листьев и колоса пшеницы, проявление на листьях (возбудитель — Phaeosphaeria nodorum). Справа — жёлтая пятнистость пшеницы (возбудитель — Pyrenophora triticirepentis). Обратите внимание: несмотря на то, что это разные заболевания, поражения листьев очень похожи.
Ещё одна проблема заключается в том, что далеко не все заболевания проявляются сразу же после заражения растения. Например, возбудитель пыльной головни ячменя (Ustilago nuda) обычно проникает во время цветения пшеницы в формирующуюся зерновку. Гриб не препятствует формированию зародыша, само зерно развивается нормально, ничем внешне не отличаясь от здорового. Мицелий зимует в зерновке. Весной одновременно с прорастанием семян происходит и рост мицелия, который по мере роста растения распространяется по различным его органам. Проявляется заболевание только в период колошения. При этом разрушаются все части колоса, превращаясь в чёрную споровую массу, после распыления которой остаются лишь ости и стержень колоса (рис. 2) [8].

Рисунок 2. Пыльная головня ячменя: поражённое соцветие со спорами
Стандартный для фитопатологов подход при определении фитопатогенных грибов — это выделение их в чистую культуру на какой-либо питательной среде, получение характерных образований (чаще всего это, конечно, спороношения) и затем идентификация гриба под микроскопом.
Но здесь возникают определённые трудности. Основная из них заключается в том, что далеко не все паразитические грибы возможно культивировать на искусственных питательных средах: многим требуется наличие живых тканей растения-хозяина, либо присутствие других представителей сложного сообщества [10]. Но даже если гриб удаётся выделить в культуру, следующий вопрос — это то, сколько времени понадобится, чтобы добиться от него появления спороношения. Например, возбудитель белосоломенной болезни пшеницы и ржи (Gibellina cerealis), хотя и хорошо культивируется, даёт спороношение только после четырёх–пяти недель роста. Естественно, что меры по борьбе с патогеном необходимо принимать сразу после его обнаружения, а не через месяц, когда может оказаться, что спасать уже нечего.
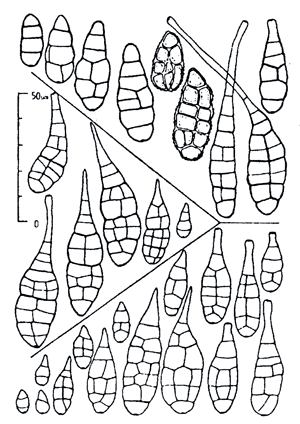
Рисунок 3. Сравнение конидий типовых образцов Alternaria longipes (вверху), Alternaria tenuissima (в центре), Alternaria alternata (внизу). Видно, что на основе сравнения только формы конидий этих трёх видов однозначно различить их крайне сложно. При идентификации видов в данном случае специалист использует не только форму конидий, но и другие признаки (например, способ образования конидий, их взаимное расположение и т.п.).
И даже с определением тех фитопатогенных грибов, спороношения которых получить сравнительно просто, могут возникать сложности. К примеру, идентификация многих микромицетов сопряжена с рядом трудностей, таких как сходство морфологических характеристик разных видов и одновременно внутривидовая вариабельность признаков. Несмотря на внешнее сходство, возбудители могут значительно отличаться по патогенности, токсигенности, степени специализации, генетике взаимоотношений с растением-хозяином, вредоносности, чувствительности к фунгицидам и т.д. То есть разные виды обладают совершенно разными экологическими особенностями и хозяйственной значимостью [12]. Хорошим примером здесь является определение различных видов рода Alternaria (рис. 3). Очевидно, что для идентификации до вида нужны достаточно широкие познания в данной области и немалый опыт работы с исследуемым фитопатогеном.
Ещё один способ, пригодный для обнаружения некоторых фитопатогенных грибов, заключается в смыве с субстрата, фильтрации и микроскопическом определении (и даже подсчёте, что даёт количественные данные) их спор. Чаще всего, таким способом оценивается количество грибных спор в зерне или в почве. Несмотря на то, что идентификация до вида на основании одних только спор чаще всего затруднена, этот способ широко применяется, а для анализа получаемых при помощи микроскопа изображений разрабатываются специальные компьютерные программы [14]. Например, таким образом определяют заражённость зерна возбудителем твёрдой головни (Tilletia caries) (рис. 4) [15]. Несмотря на использование компьютерных технологий, этот метод весьма трудоёмок и не подходит для исследования большого количества образцов.

Рисунок 4. Зерновки, поражённые твёрдой головнёй пшеницы
Молекулярная биология на службе фитопатолога
Во всех описанных случаях на помощь исследователям могут прийти широко развивающиеся в последнее время молекулярные методы анализа. Сейчас в основе большинства из них лежит применение ELISA (enzyme-linked immunosorbent assay, иммуноферментный анализ) [11], либо ПЦР (полимеразная цепная реакция, polymerase chain reaction) [17].
Иммуноферментный анализ состоит из двух основных этапов: иммунной и ферментативной реакций. Иммунная реакция заключается в специфическом связывании характерного для данного микроорганизма антигена с диагностическим антителом. Ферментативная реакция необходима для обнаружения этого связывания. Как правило, она сопровождается изменением цвета, причём степень этого изменения может быть использована для определения количества присутствующего антигена.
Есть много модификаций данного метода, бóльшая часть из которых применяется для обнаружения возбудителей болезней растений [16]. Особенно интересен так называемый «lateral flow assay» (анализ капли, растекающейся в радиальном направлении) (рис. 5), отличающийся высокой скоростью анализа и не требующий никакого специального оборудования или знаний. Используя такой набор (имеющий карманный формат), можно провести анализ непосредственно «в поле», так что не нужно даже отправлять образцы в лабораторию.
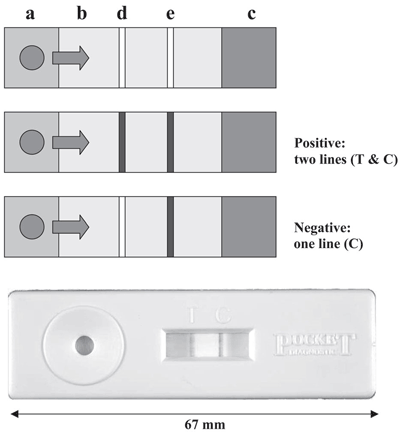
Рисунок 5. Прибор CSL Pocket DiagnosticTM lateral flow immunodiagnostic kit. Растительный экстракт помещается на площадку (a), которая содержит латексные шарики, покрытые специфическими антителами; смесь мигрирует вдоль мембраны (b) к абсорбирующей поверхности (c). При этом имеющиеся в растворе целевые антигены связываются со специфичными антителами на латексных шариках. Мембрана содержит полосу антител, отличающихся необходимой специфичностью (измерительную полосу) (d) и полосу других антител, которые связываются с первыми антителами (контрольную полосу) (e). Латексные шарики, содержащие связанный антиген, задерживаются в тестовой зоне, давая видимую линию, тогда как излишние латексные шарики, которые не содержат антигена, задерживаются в контрольной зоне, показывая, что анализ работает. Наличие двух линий соответствует положительному результату (positive), наличие только одной линии (контрольной) говорит о негативном результате (negative).
Основанные на иммуноферментном анализе методы широко применяются для обнаружения вирусов (в том числе поражающих растения) и значительно реже — для идентификации грибов и бактерий. Основной причиной этого является трудность получения антител с необходимой специфичностью: строение клеточных стенок грибов и бактерий гораздо сложнее, чем вирусного капсида, к тому же может изменяться в ходе их жизненного цикла. В результате получаемые антитела могут оказаться специфичны как сразу к большой группе видов, так и исключительно к отдельным жизненным формам данных микроорганизмов. Тем не менее, основанные на ELISA методы идентификации фитопатогенных грибов всё же разрабатываются: например, существует метод идентификации спор уже упоминавшейся в данной статье твёрдой головни [19].
ПЦР — это ферментативная реакция, в результате которой происходит накопление большого количества копий какого-либо не слишком большого (чаще всего, 200–1500 пар нуклеотидов) фрагмента ДНК. Так как ДНК любого организма содержит как вариабельные (отличающиеся даже у близкородственных организмов), так и консервативные (сходные у эволюционно далёких видов) участки, возможно на основе выбора диагностического участка варьировать специфичность протекающей реакции.
Таким образом, данный метод позволяет обнаруживать последовательности нуклеиновой кислоты, специфичные для конкретного организма или группы сходных организмов и, тем самым, выявлять его (их) присутствие в анализируемой пробе. Методы, основанные на ПЦР, позволяют идентифицировать патогенные виды как в чистой культуре, так и непосредственно в растительном материале, минуя этап изоляции грибов [20]. Как пример, здесь приведены результаты ПЦР, разработанной для идентификации грибов рода Pyrenophora (рис. 6), представители которого являются возбудителями жёлтой пятнистости злаков, в частности — пшеницы (рис. 1).
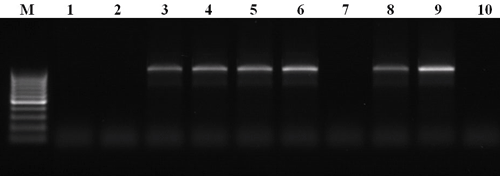
Рисунок 6. Разделённые при помощи электрофореза продукты ПЦР, разработанной для идентификации грибов рода Pyrenophora. М — маркер, представляющий собой набор фрагментов ДНК известного размера, 1–10 — ДНК, выделенная из различных образцов листьев пшеницы, поражённых листовыми пятнистостями. Здесь продукт реакции (фрагмент ДНК известного размера) должен наблюдаться только в том случае, если в образце присутствует ДНК целевого организма, а именно — гриба рода Pyrenophora. В итоге видно, что растения под номерами 3–6, 8 и 9 больны жёлтой пятнистостью, а остальные — каким-либо другим внешне схожим заболеванием.
Существует достаточно много модификаций метода ПЦР, большинство из которых применяется в изучении возбудителей болезней растений. Например, RAPD и RFLP анализы используются для уточнения родственных связей между различными грибами; ПЦР, специфичная для ДНК представителей отдельных родов или видов — для идентификации фитопатогенов (в том числе — в форматах nested и multiplex); ПЦР с регистрацией в режиме реального времени (real-time PCR) — для определения количества присутствующей целевой ДНК.
Рассмотрим подробнее один из самых перспективных методов на основе ПЦР — ПЦР с регистрацией в режиме реального времени (рис. 7). В отличие от большинства других форматов ПЦР, он позволяет не только констатировать факт присутствия ДНК целевого патогена, но и измерить её количество. В качестве примера здесь приведено определение в двух образцах количества ДНК ещё одного возбудителя листовой пятнистости.
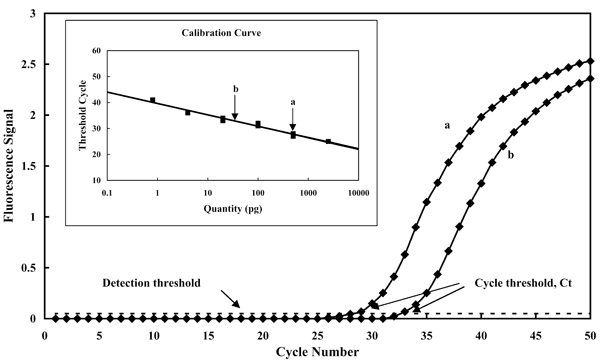
Рисунок 7. ПЦР с регистрацией в режиме реального времени. В ходе реакции непрерывно измеряется флуоресценция пробы (Fluorescence Signal), которая увеличивается по мере накопления продукта реакции (время реакции здесь выражено в числе циклов реакции — Cycle Number). Чем больше целевой ДНК было в смеси на момент начала реакции, тем быстрее происходит накопление продукта, и, соответственно, тем меньше будет номер цикла (cycle threshold, Ct), при котором флуоресценция пробы достигнет порогового значения (Detection threshold). Количество ДНК в исходной пробе определяют по калибровочному графику (приведён на вставке), соотносящему исходное количество целевой ДНК (Quantity) со значениями Ct. В данном случае на графике показано изменение во времени флуоресцентного сигнала для двух образцов, содержащих ДНК Mycosphaerella graminicola (рис. 1), причём кривая «а» соответствует образцу с большей концентрацией.
Интересно применение данного метода для анализа заражённости зерна твёрдой головнёй (рис. 4): при наличии соответствующих калибровочных графиков возможно получение результатов в виде числа спор, имеющихся в образце [7].
Ложка дёгтя в бочке мёда
Хотя преимущества и перспективы применения молекулярных методов идентификации сложно переоценить, на пути их практического использования имеется целый ряд трудностей. Несмотря на универсальность методов при конечном анализе, для их разработки и проверки требуется достаточно много времени и немалая экспериментальная база. Основной проблемой здесь является отсутствие возможности чисто теоретически оценить специфичность разрабатываемых методов.
Ещё одна сложность является прямым следствием высокой чувствительности данных методов (особенно — основанных на ПЦР). Ведь если анализ позволяет выявить в образце присутствие даже одной споры фитопатогенного гриба, или всего лишь нескольких копий его ДНК, то и для получения ложноположительного результата оказывается достаточно даже минимального загрязнения изначально «чистого» образца. Следовательно, требования к стерильности оказываются крайне высоки на всех стадиях анализа, но всё равно всегда приходится использовать отрицательные контроли.
Ну и самая большая проблема всех описанных в данной статье методов — это цена, ограничивающая их широкое применение в условиях небогатых российских хозяйств.
Несколько слов о будущем
Несмотря на все имеющиеся проблемы, молекулярные методы анализа интенсивно развиваются (о чём можно судить хотя бы по числу публикаций на соответствующие темы, которое с каждым годом становится всё больше). Старые методы постоянно совершенствуются, в то же время разрабатываются новые (например, метод биочипов [21] и секвенирование следующего поколения [22]), а цена одного анализа становится всё ниже. Поэтому можно надеяться, что не за горами то время, когда все упоминавшиеся в данной статье методики и их более совершенные аналоги действительно найдут широкое применение и облегчат жизнь фитопатологов и агрономов.
Литература
- Дьяков Ю.Т. О болезнях растений. М.: «Агропромиздат», 1985. — 221 с.;
- Мюллер Э. и Лёффлер В. Микология. М.: «Мир», 1995. — 343 с.;
- Билай В.И. Основы общей микологии: учеб. пособие для вузов (2-е изд.). Киев: «Вища школа», 1980. — 360 с.;
- Внедрение в реставрационную практику молекулярно-генетических методов исследования;
- Narayanasamy P. Microbial Plant Pathogens — Detection and Disease Diagnosis: Fungal Pathogens. Springer, 2011. — 291 p.;
- M. B. Riley, M. R. Williamson, O. Maloy. (2002). Plant disease diagnosis. PHI;
- M. McNeil, A.M.I. Roberts, V. Cockerell, V. Mulholland. (2004). Real-time PCR assay for quantification of Tilletia caries contamination of UK wheat seed. Plant Pathology. 53, 741-750;
- Черепанова Н.П. Систематика грибов: учеб. пособие (2-е изд.). СПб.: Изд-во С.-Петерб. ун-та, 2005. — 344 с.;
- Smut and bunt diseases of cereal - biology, identification and management. Government of Western Australia;
- Paplomatas E.J. (2006). Molecular diagnostics of fungal pathogens. Arab. J. Pl. Prot. 24, 147–158;
- 12 методов в картинках: иммунологические технологии;
- Ганнибал Ф.Б. Мониторинг альтернариозов сельскохозяйственных культур и идентификация грибов рода Alternaria. Методическое пособие. СПб., 2011. — 71 с.;
- Левкина Л.М. Род Alternaria Nees // Новое в систематике и номенклатуре грибов / Ю.Т.Дьякова, Ю.В.Сергеева. М.: «Национальная академия микологии»; «Медицина для всех», 2003. С. 276–303;
- D. Chesmore, T. Bernard, A. J. Inman, R. J. Bowyer. (2003). Image analysis for the identification of the quarantine pest Tilletia indica*. EPPO Bulletin. 33, 495-499;
- Болезни культурных растений (под ред. В.А. Павлюшина). СПб, 2005. — 288 с.;
- ELAINE WARD, SIMON J FOSTER, BART A FRAAIJE, H ALASTAIR MCCARTNEY. (2004). Plant pathogen diagnostics: immunological and nucleic acid-based approaches. Ann Applied Biology. 145, 1-16;
- 12 методов в картинках: полимеразная цепная реакция;
- C. Danks, I. Barker. (2000). On-site detection of plant pathogens using lateral-flow devices. EPPO Bulletin. 30, 421-426;
- T. Kellerer, M. Sedlmeier, F. Rabenstein, B. Killermann. (2012). Development of immunochemical and PCR methods for qualitative detection of Tilletia species in organic seeds. Czech J. Genet. Plant Breed.. 42, 72-74;
- Гагкаева Т.Ю., Ганнибал Ф.Б., Гаврилова О.П. Метод ПЦР-диагностики фитопатогенных грибов родов Fusarium и Alternaria // Высокопроизводительные и высокоточные технологии и методы фитосанитарного мониторинга. СПб., 2009. С. 4-14;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК).







