
Что мы узнали о биологии рака из клинических исследований. Несколько новелл об онкологии
13 марта 2024
Что мы узнали о биологии рака из клинических исследований. Несколько новелл об онкологии
- 657
- 0
- 6
Врач-исследователь проливает свет на злокачественную опухоль, затаившуюся где-то в темных закоулках организма, пытаясь выяснить ее биологические особенности. Однако опухоль не очень рада такому повышенному вниманию к себе.
Рисунок в полном размере.
рисунок Полины Дементьевой
-
Автор
-
Редакторы
-
Иллюстратор
Статья на конкурс «Био/Мол/Текст»: Онкология — молниеносно развивающаяся область медицины: каждый год на рынке появляются совершенно новые препараты, стандарты лечения и диагностики пересматриваются, а знания биологии рака дополняются. Иногда в авангарде фундаментальных исследований опухолевых заболеваний стоят сами врачи, практики, которые непосредственно занимаются лечением пациентов со злокачественными новообразованиями. В этой статье мы расскажем, как клинические исследования изменили понимание механизмов развития и прогрессии рака, как знания биологии злокачественного процесса меняют подходы к терапии и почему это важно для пациентов, столкнувшихся с тяжелым диагнозом.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Идея — получать фундаментальные научные данные из клинических исследований — не нова, однако всякий раз, когда результаты очередного рандомизированного клинического исследования (РКИ) приводят к нетривиальным биологическим выводам, это вызывает живой интерес. Ведь обычно последовательность событий ровно противоположная: сначала ученые-исследователи получают в экспериментах in vitro или in vivo некоторые данные, на основании которых выдвигается научная гипотеза или предлагается новая модель. С учетом полученных результатов в течение многих лет разрабатывается новый препарат, а затем врачи, проводя серии РКИ, проверяют, работает ли препарат для человека и оказалась ли исходная гипотеза ученых верна. Так фундаментальные знания о том, как устроен организм человека (и не только), находят практическое применение, конвертируясь в эффективные лекарственные средства.
На сайте «Биомолекула» есть отдельный спецпроект, посвященный клиническим исследованиям. — Ред.
В то же время, когда результаты клинического исследования позволяют усомниться в правильности существующего понимания биологических процессов, это в какой-то мере добавляет им ценности. Поскольку на выходе в этом случае удается не только получить подтверждение или опровержение эффективности нового лечения, но и пересмотреть конкретную биологическую парадигму.
Как мне однажды сказал один известный ученый: «Хочется изучать то, что потом войдет в учебники». И в этом смысле неоспорима уникальность фундаментальных знаний, полученных из клинических исследований, исходно преследующих исключительно прикладную цель.
Пионером на этом поприще можно по праву считать американского хирурга-маммолога Бернарда Фишера (рис. 1). Помимо того, что он стал одним из основоположников доказательной медицины, внедрив РКИ в качестве стандарта обоснования эффективности того или иного медицинского вмешательства, работы Фишера кардинально изменили понимание биологии рака [1].

Рисунок 1. Слева направо: Уильям Холстед (William Halsted), Бернард Фишер (Bernard Fisher) и Исайя Джошуа Фидлер (Isaiah Joshua Fidler).
Ловля метастазов скальпелем. Вековой спор хирургов

Рисунок 2. Хирург пытается вырезать опухолевую клетку скальпелем, но та уже приобрела метастатические свойства и ловко уворачивается от лезвия. Хирургически эту проблему решить не получится — серьезная операция, к сожалению, не принесет пациенту никаких преимуществ.
рисунок Полины Дементьевой
В медицине в течение многих десятилетий господствовала доктрина, предложенная в 90-х годах XIX века американским хирургом Уильямом Холстедом (рис. 1). Он оперировал женщин по поводу рака молочной железы, рассматривая данную болезнь как локальную проблему. А раз проблема локальная, значит, прогноз заболевания зависит от объема локального лечения, — аргументировал доктор. Этими соображениями Холстед обосновывал повышение степени хирургической агрессии в соответствии с распространенностью опухолевого процесса, внедрив в качестве стандарта лечения радикальную мастэктомию (en bloc резекцию), при которой удалялась не только пораженная молочная железа, но и большая и малая грудные мышцы, а также группа подмышечных лимфоузлов с окружающей их жировой тканью [2], [3].
Здесь стоит сказать, что, во-первых, Уильям Холстед в своих исследованиях оценивал эффективность лечения по частоте локально-регионарных рецидивов заболевания, а вовсе не по показателям отдаленной выживаемости пациентов. Во-вторых, свои выводы он делал, основываясь на результатах индивидуальных клинических наблюдений, что в настоящее время соответствует одному из низших уровней на, так называемой, пирамиде доказательной медицины (рис. 3) [4].
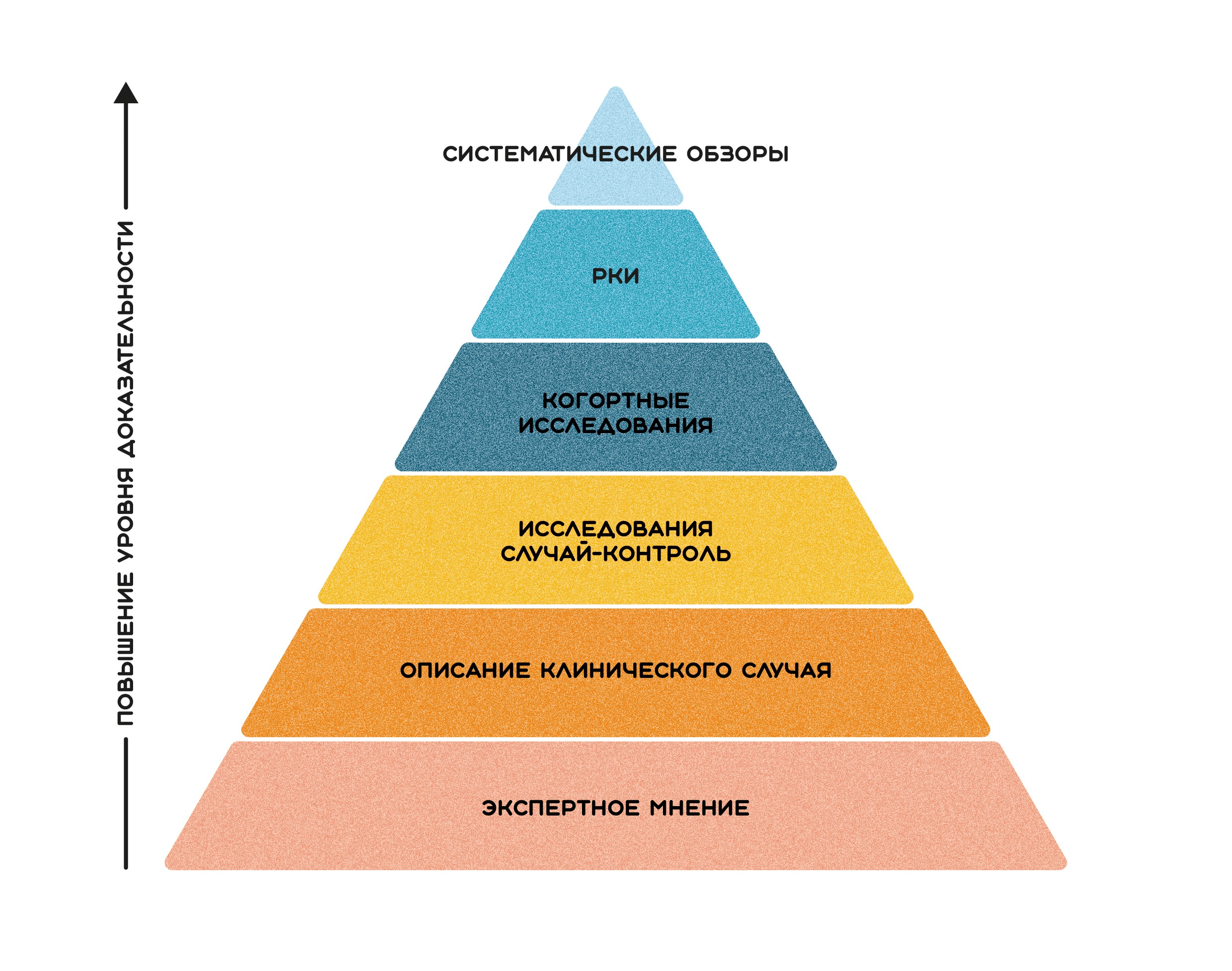
Рисунок 3. Пирамида доказательной медицины и положение на этой пирамиде исследований типа «описание клинического случая» (case report).
рисунок Полины Дементьевой
По мере того, как шло время и развивались методы анестезиологии, радикализм в хирургической онкологии только возрастал, достигнув своего апогея в начале 1950-х, с появлением операции Урбана, сочетавшей en bloc резекцию с удалением интрамаммарной группы лимфоузлов, для доступа к которой удаляли половину грудины и прилегающие к ней концы II–V ребер [5]. Тем не менее, у части женщин даже после развернутой операции с превентивным удалением лимфоузлов заболевание все равно рано или поздно возвращалось [6], [7].
Ситуация с калечащей онкохирургией сохранялась вплоть до семидесятых годов, пока доктор Бернард Фишер, упомянутый ранее (рис. 1), не задался вопросом: приводит ли увеличение объема хирургического вмешательства к улучшению клинических исходов [8], [9]? На тот момент не существовало никакого общепринятого стандарта лечения рака молочной железы, и объем операции определялся хирургом на основе его личного мнения, данных крайне низкого качества, принадлежности к определенной научной школе и прочих необъективных факторов [8], [10]. Чтобы получить ответ на свой вопрос, Фишер инициировал РКИ, известное как NSABP Protocol B-04, организованное по многим актуальным и по сей день правилам проведения таких исследований [11]. Целью ученых было выяснить, как изменятся показатели выживаемости пациенток в том случае, если не прибегать к радикальной операции по Холстеду, а ограничиться удалением только лишь пораженной железы (тотальной мастэктомией)? В ходе сравнения результатов лечения оказалось, что уменьшение объема хирургической инвазии не приводит к снижению общей выживаемости, при этом удается снизить риски послеоперационных осложнений и улучшить косметический эффект, а значит, и качество жизни пациенток [11], [12]. Фишер с коллегами показал, что прогноз заболевания зависит прежде всего от наличия метастазов в регионарных лимфоузлах, а вовсе не от объема вмешательства (рис. 4) [11].
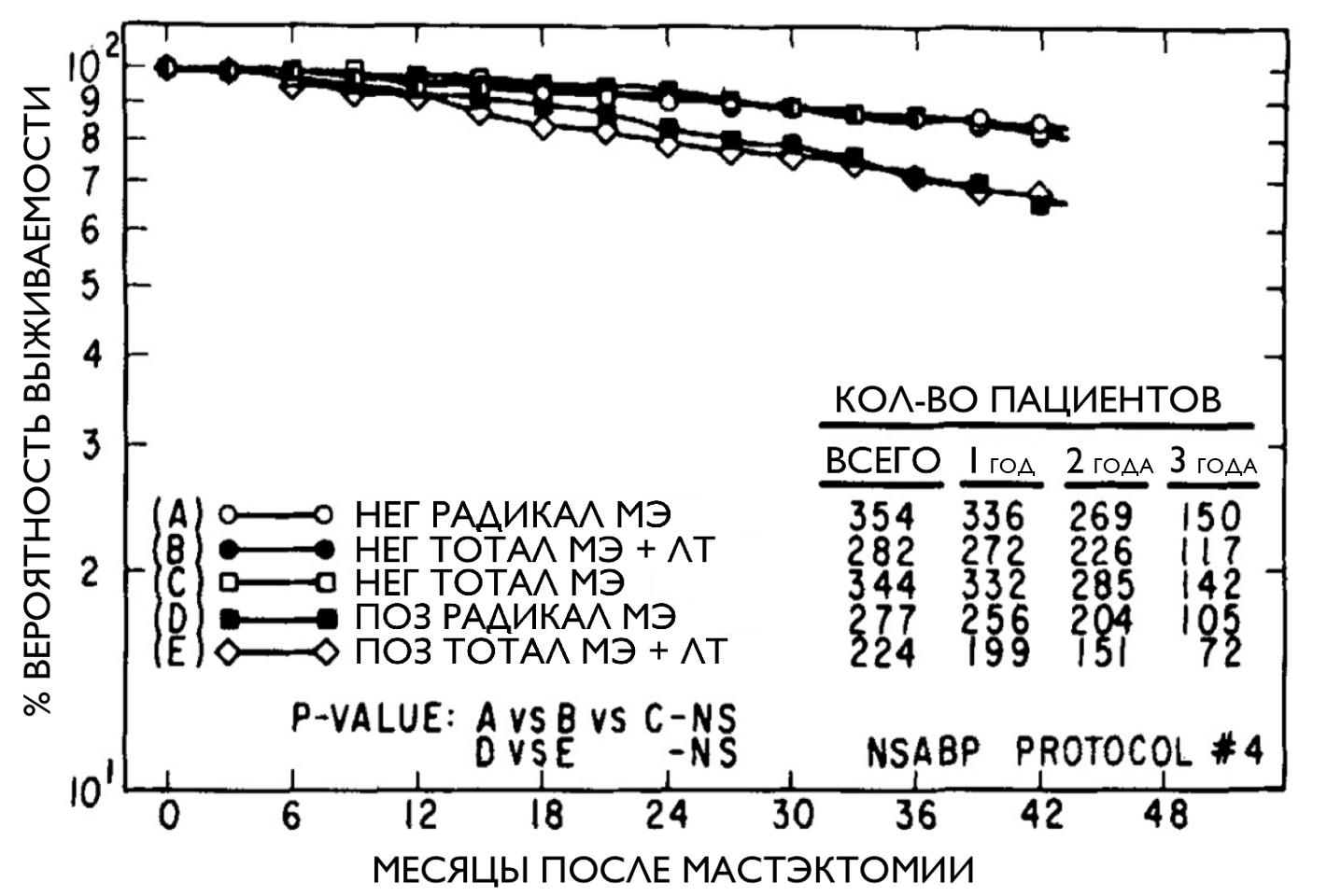
Рисунок 4. Анализ выживаемости групп, получавших различное лечение, в исследовании NSABP Protocol B-04. НЕГ — отсутствие метастазов в подмышечных лимфоузлах; ПОЗ — наличие метастазов в подмышечных лимфоузлах; РАДИКАЛ МЭ — радикальная мастэктомия по Холстеду; ТОТАЛ МЭ — тотальная мастэктомия (меньший объем операции); ЛТ — лучевая терапия. На графике видно, что выживаемость пациентов в большей степени зависит от вовлечения в опухолевый процесс лимфоузлов (ПОЗ), чем от объема вмешательства.
[11], рисунок адаптирован
В то же время, отдаленные рецидивы рака у женщин, получивших интенсивное лечение, можно было объяснить только тем, что на момент операции в их организме уже произошло распространение опухолевых клеток. Эти клетки, осев в других органах, находились там в «спящем» состоянии до тех пор, пока не возобновили свое развитие, оказавшись в благоприятном микроокружении [13–16]. То есть метастазирование у таких пациенток произошло еще до операции, а скорее всего, даже до постановки онкологического диагноза, что было доказано впоследствии [17].
Герои роста и инвазии. Рак как стратегическая игра
Из наблюдений и результатов, полученных Фишером и коллегами, следовал вывод, что рак нужно рассматривать как системный биологический процесс, а не как анатомически изолированное заболевание [18]. По мере развития экспериментальных методов и изучения рака на глубоком молекулярно-генетическом уровне формировалось понимание того, что видимые нами стадии распространения опухолевого процесса являются по сути отражением его биологических свойств, а молекулярно-генетические характеристики опухоли порой являются более сильными предикторами прогноза, чем стандартные морфологические параметры [19–21].
Наглядно эту концепцию можно представить по аналогии с компьютерной игрой жанра «стратегия»: в клетке происходит патогенная мутация, позволяющая ей уклоняться от сигналов остановки клеточного цикла и запускающая активную пролиферацию. Нарушения систем репарации ДНК [22] и структуры генов-онкосупрессоров, активация протоонкогенов, происходящие на каждом последующем этапе деления, способствуют накоплению большого количества мутаций в дочерних клетках, в результате чего с каждым циклом деления они постепенно приобретают все новые свойства [23–26]. Эти свойства наделяют различные опухолевые клетки уникальными способностями и «скиллами», нетипичными для нормальных клеток организма, такими как умение уходить из-под иммунного контроля [27], способность стимулировать рост новых сосудов, изменять метаболизм, чтобы выживать в условиях гипоксии, создавать комфортное для себя микроокружение (рис. 5) [16], [28].
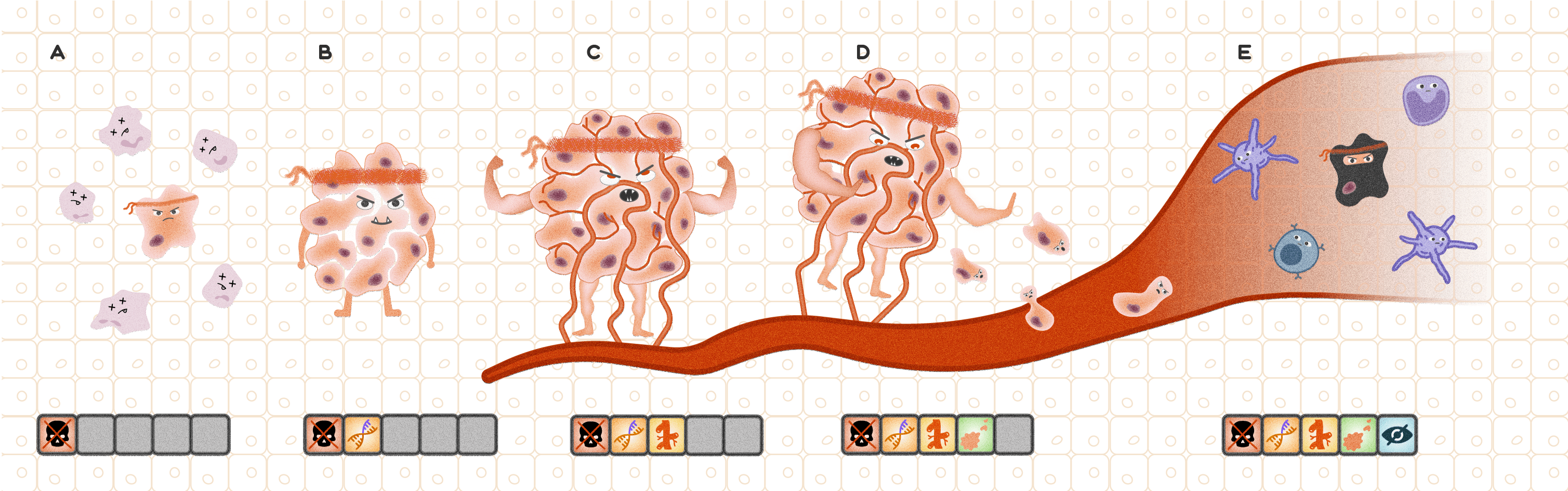
Рисунок 5. Развитие злокачественной опухоли как компьютерная игра жанра «стратегия».
A — клетка, в которой произошла вредная мутация, «прокачивает скилл» уклонения от апоптоза и остается жизнеспособной, вставая на путь опухолевой трансформации.
B — опухоль продолжает свое развитие и приобретает способность инициировать геномные перестройки, что увеличивает скорость накопления мутаций.
C — опухоль становится все более агрессивной и, индуцируя рост кровеносных сосудов (ангиогенез), начинает эффективнее получать кислород и питательные вещества.
D — метастазирование — новый «скилл», который приобретает опухоль. Злокачественные клетки отделяются от основной опухоли и устремляются в кровоток (интравазация).
E — клетки, отделившиеся от основной опухоли, «прокачивают» особую способность, позволяющую им уходить из-под надзора иммунной системы и, оставаясь незамеченными, путешествовать по кровотоку.
рисунок Полины Дементьевой
Параллельно с работами Фишера другой врач-исследователь, Исайя Джошуа Фидлер (рис. 1), уже в лабораторных условиях на линии мышей B16, склонных к развитию рака, продемонстрировал, что способность метастазировать — одно из многих уникальных свойств злокачественной опухоли, механизмы которого также лежат в изменении биологии клеток [29], [30].
Иными словами, метастазирование происходит не потому, что опухоль становится достаточно большой, чтобы дорасти до сосуда и дать отсев, как считал Холстед, а из-за того, что некоторые клетки в составе этой опухоли приобретают такие биологические свойства, которые позволяют им экспрессировать протеазы для расщепления матрикса на пути к сосуду, утрачивать молекулы клеточной адгезии, отделяться от основной опухоли, приобретая мезенхимальный фенотип, перестраивать свой цитоскелет при прохождении через сосудистую стенку и многое другое [30–32].
Размер опухоли, конечно, может иметь значение, но только в том смысле, что чем неоплазия больше, тем больше поделившихся клеток она содержит, а значит, выше вероятность того, что в результате мутагенеза уже возникла хотя бы одна клетка, обладающая метастатическим потенциалом (или, продолжая аналогию с компьютерной игрой, — «прокачавшая» метастатические «скиллы») [24], [26]. Однако и из этого правила были выведены исключения. В 1960-70-х годах накапливались серии сообщений о случаях метастатических очагов в отсутствие первичной опухоли [33], [34]. Первым делом можно было бы подумать о несовершенстве диагностических методов того времени, но с развитием технологий проблема не решилась и остается актуальной по сей день [35], [36]. Единственным объяснением этому феномену могло быть то, что у таких пациентов где-то в организме расположена первичная опухоль, настолько маленького размера, что определить ее не представляется возможным ни одним из современных методов визуализации, однако уже обладающая агрессивными метастатическими свойствами. Данное предположение согласовывалось с результатами экспериментальных работ Фидлера и его коллег и подтвердилось впоследствии [29], [37]. Однако нагруженность таких метастазов мутациями удалось в полной мере установить не так давно, после того как к ним были применены методы высокопроизводительного секвенирования генома и анализа транскриптомного профиля — для определения ткани происхождения [38], [39].
В XX веке работы Фишера и Фидлера привнесли изменения в фундаментальное понимание природы рака и во многом определили наши современные представления об этом заболевании. По мере его изучения в XXI веке все очевиднее становилась глубокая биологическая составляющая проблемы, а новые клинические исследования противоопухолевых препаратов стали все чаще приводить к неоднозначным результатам, которые впоследствии конвертировались не только в поправки гайдлайнов и клинических рекомендаций, но и в новые детали в общей картине многомерной сложности рака.
Биологические координаты колоректального рака
На протяжении десятилетий подходы в онкологии многократно менялись, перед врачами открывались новые опции, позволяющие эффективнее бороться с опухолями, а у многих пациентов появлялись шансы на увеличение продолжительности жизни и на улучшение ее качества. На рынок выходили новые препараты, которые затем включались в состав многокомпонентных схем лекарственной терапии. Например, к началу 2000-х годов при лечении метастатического колоректального рака применялись комбинации цитотоксичных препаратов: режим FOLFOX, включающий в себя прием аналога пиримидинов — 5-фторурацила (5-FU), фолиновой кислоты (FOL), усиливающей действие 5-FU, и платиносодержащего агента, оксалиплатина (OX), приводящего к разрывам цепей ДНК в опухолевых клетках [40]. Другой эффективный режим терапии, FOLFIRI, вместо производного платины включал использование иринотекана (IRI), также приводящего к двуцепочечным разрывам в ДНК [41]. Данные препараты, будучи клеточными ядами, неизбирательно поражали как опухолевые, так и нормальные клетки организма, что приводило к серьезным побочным эффектам. К тому же у некоторых пациентов со временем развивалась невосприимчивость к химиотерапии. Опухоли вырабатывали разнообразные механизмы устойчивости, в результате чего эффективность лечения заметно снижалась [42].
С развитием технологий промышленного производства терапевтических моноклональных антител (о том, как они помогают лечить рак и другие болезни, читайте в статье «Терапевтические моноклональные антитела» [43]) на рынке начали появляться целые группы новых препаратов с принципиально иными механизмами действия. Они относились к таргетной терапии, так как блокировали определенные мишени, присутствующие в клетках опухоли, — рецепторы факторов роста или звенья сигнальных путей, имеющих важное значение в прогрессии рака .
На самом деле, данное деление в онкологии является несколько условным, потому что стандартные химиотерапевтические агенты тоже могут иметь конкретные «таргеты» — мишени в клетках опухоли, например, 5-фторурацил блокирует тимидилат синтазу, синтезирующую необходимый для репликации тимин, а иринотекан — топоизомеразу I, предотвращающую суперспирализацию ДНК. Поэтому во избежание путаницы к таргетным противоопухолевым препаратам стоит относить ингибиторы белков, входящих в молекулярные каскады опухоли.
В 2004 году Food & Drug Administration (FDA) одобрила для применения при метастатическом колоректальном раке сразу два новых препарата: бевацизумаб, анти-VEGF (vascular endothelial growth factor — фактор роста эндотелия сосудов) антитело, и цетуксимаб, антитело против рецептора эпидермального фактора роста (epidermal growth factor receptor, EGFR).
Последний играет важную роль как в жизненном цикле нормальных клеток, так и в патогенезе многих опухолевых заболеваний, в частности и колоректального рака. Активация данного рецептора запускает сразу несколько сигнальных путей внутри опухолевой клетки (Ras/Raf/MEK/ERK, JAK/STAT3, PI3K/AKT/mTOR, NFκB), что приводит к экспрессии генов, участвующих в процессах клеточного роста и пролиферации, в подавлении программы апоптоза, в синтезе провоспалительных цитокинов, в формировании устойчивости к цитостатикам, в инвазии и метастазировании (рис. 6) [44–47].

Рисунок 6. Активация рецептора EGFR запускает внутриклеточную передачу сигнала по путям Ras/Raf/MEK/ERK, JAK/STAT3, PI3K/AKT/mTOR, NF-κB и многим другим. Это приводит к экспрессии различных транскрипционных факторов и протоонкогенов, опосредующих прогрессию опухолевого заболевания, инициирующих пролиферацию и рост, воспаление в ткани, уклонение от апоптоза, формирование лекарственной устойчивости, метастазирование и другие отличительные черты рака. Стимуляция рецепторов VEGFR1/2, в числе прочего, активирует киназу mTORC1, которая, в свою очередь, активирует белок HIF-1α (hypoxia-inducible factor 1α), важный переключатель клеточного метаболизма в условиях гипоксии и один из транскрипционных факторов, инициирующих экспрессию гена VEGFA. В результате опухолевая клетка самостоятельно синтезирует фактор роста эндотелия сосудов, осуществляя аутокринную стимуляцию собственных рецепторов VEGFR1/2.
ЭМП — эпителиально-мезенхимальный переход.
рисунок автора статьи с использованием Biorender
Фактор роста эндотелия сосудов также инициирует внутриклеточную передачу сигнала по нескольким путям, способствующим опухолевой прогрессии, но, как следует из названия, VEGF главным образом запускает ангиогенез — образование новых кровеносных сосудов в опухоли (рис. 6) [48–50]. Способность организовывать собственную сосудистую сеть очень полезна для развития рака, поскольку позволяет опухоли эффективнее получать кислород и необходимые для роста питательные вещества, облегчает инвазию злокачественных клеток в кровоток, внося вклад в формирование отдаленных метастазов [16], [51].
К 2005 году уже имелись работы, в которых была отдельно продемонстрирована эффективность каждого моноклонального антитела в сочетании с химиотерапией, однако не проводилось прямого сравнения двух таргетных препаратов [52], [53]. Тогда группа врачей под руководством онколога Алана Венука из Калифорнийского университета в Сан-Франциско (UCSF) инициировала исследование CALGB/SWOG 80405 [54]. Исходной целью было сравнение показателей общей выживаемости пациентов, страдающих распространенным или метастатическим колоректальным раком и не получавших лечения ранее, при добавлении цетуксимаба, бевацизумаба или обоих препаратов сразу к стандартным схемам лекарственной терапии данного заболевания (FOLFOX либо FOLFIRI). Прямое сравнение помогло бы понять, какое лечение лучше назначать таким пациентам. Исследование неоднократно претерпевало ряд важных изменений и поправок. Так, в 2008 году к критериям включения пациентов в протокол добавился дикий тип гена KRAS. Было показано, что мутация KRAS является фактором отрицательного ответа опухоли на анти-EGFR терапию (цетуксимаб) и фактором неблагоприятного прогноза таких пациентов [55]. При этом поломка данного гена случается довольно часто, примерно в трети всех случаев колоректального рака [56]. Механизм, лежащий в основе устойчивости таких опухолей к цетуксимабу, заключается в том, что мутация белка KRAS приводит к его постоянной активации и передаче сигнала по Ras/Raf/MEK/ERK пути вне зависимости от лиганд-опосредованной активации молекулярного каскада через EGFR (рис. 7). В результате терапевтические попытки заблокировать рецептор, запускающий передачу сигнала, утрачивают всякий смысл — путь активирован уровнем ниже, а опухоль получает карт-бланш на пролиферацию, неконтролируемый рост и избегание апоптоза. На основании этих данных пациенты с обнаруженной в опухоли мутацией гена KRAS были исключены из исследования — анти-EGFR антитела являются априори малоэффективными для них.
Впоследствии также был прерван рукав двойной таргетной терапии (комбинация цетуксимаба и бевацизумаба) — появившиеся данные свидетельствовали о том, что сочетание двух моноклональных антител (анти-EGFR и анти-VEGF) не приводит к улучшению результатов выживаемости пациентов, повышая при этом токсичность такого лечения [57], [58].

Рисунок 7. Слева — передача сигнала по Ras/Raf/MEK/ERK пути в нормальной клетке. Стимуляция рецептора EGFR приводит к переключению белка KRAS дикого типа в активное состояние (ON), что позволяет ему активировать другие молекулы. Справа — передача сигнала в опухолевой клетке с мутацией белка KRAS. Измененный белок остается активным вне зависимости от поступающего стимула от рецептора EGFR. В результате по пути Ras/Raf/MEK/ERK осуществляется непрерывный сигналинг.
адаптировано из NEJM Illustrated glossary
В марте 2012 года завершился набор пациентов для участия в исследовании, 1137 человек были рандомизированы для получения различного лечения в соотношении 1:1 — половине пациентов назначалась схема химиотерапии с цетуксимабом, другой половине — с бевацизумабом. Спустя 24 месяца наблюдения была проведена промежуточная оценка результатов лечения, в ходе которой не удалось выявить значимых различий общей выживаемости между двумя исследуемыми группами пациентов [59]. Отсутствие разницы в исходах лечения подтвердилось и в течение более длительного интервала наблюдения (рис. 8) [54].
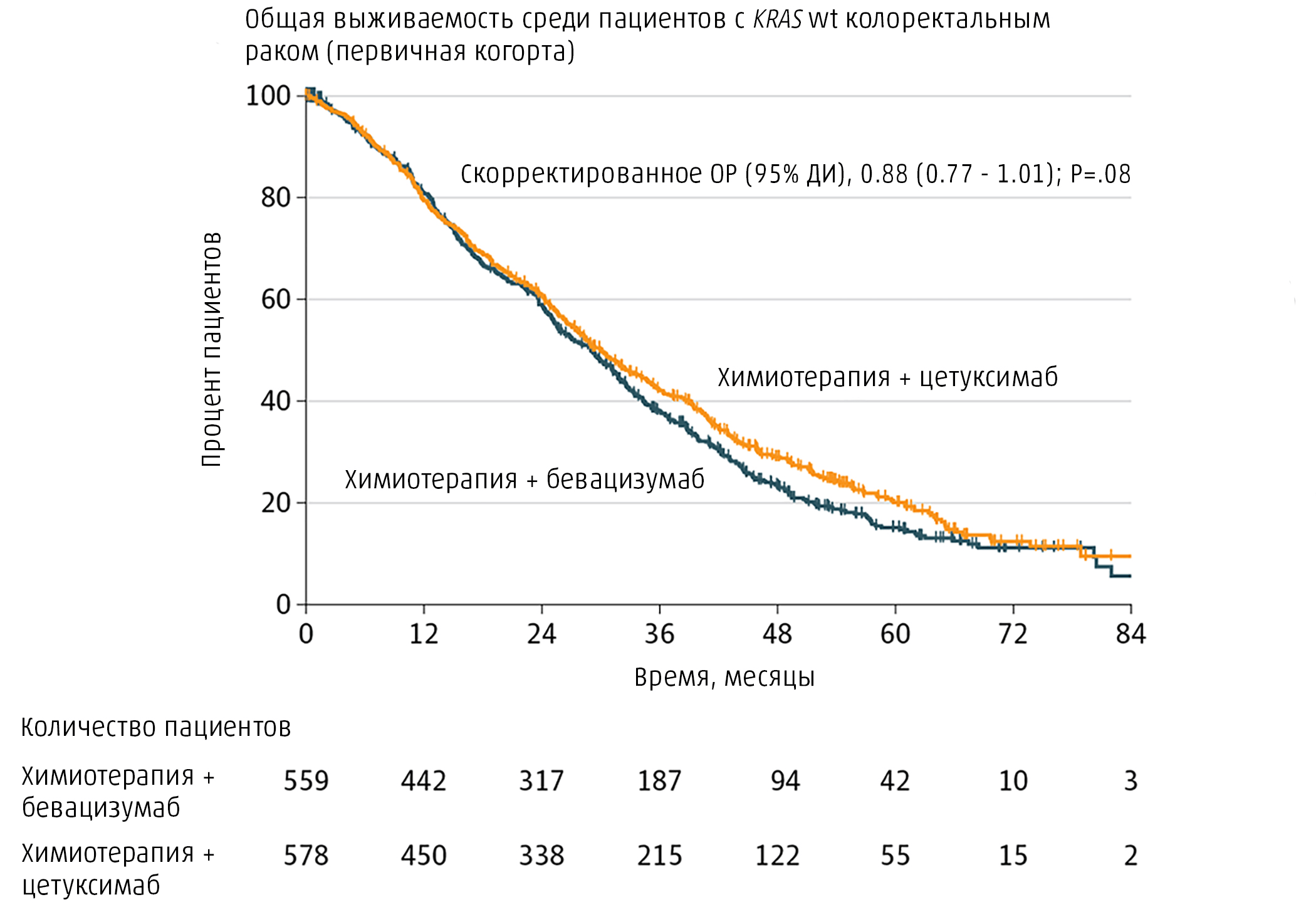
Рисунок 8. Анализ выживаемости групп, получавших различное лечение в исследовании CALGB/SWOG 80405. Несмотря на расхождение кривых, различия в выживаемости между группами не являются статистически значимыми (P = 0,08).
адаптировано из [54]
Полученные результаты нуждались в объяснении. К тому времени уже было установлено, что на клинические исходы болезни влияет и локализация — левостороннее расположение опухоли толстой кишки (после селезеночного изгиба) является фактором лучшего прогноза и ответа на терапию цетуксимабом [60], [61]. Имеющиеся данные подтолкнули Венука с коллегами на проведение подгруппового анализа. Пациенты были ретроспективно разделены в зависимости от расположения опухоли — слева либо справа (до печеночного изгиба) [62]. И вот тут результаты удивили самих исследователей — кривые значимо разошлись (как говорят в таких случаях — «разлетелись»), согласуясь с немногочисленными наблюдениями других авторов (рис. 9). Медиана общей выживаемости (мОВ) при левосторонней локализации опухоли составила 33,3 месяца, а более эффективным для таких пациентов оказался цетуксимаб. В то же время, при расположении опухоли справа прогноз в целом был хуже (мОВ 19,4 месяца), а большее увеличение общей выживаемости достигалось при назначении бевацизумаба. Но почему опухоли, возникшие в одном и том же органе, только в различных его сегментах, так по-разному отвечали на терапию и так сильно отличались по своему прогнозу?

Рисунок 9. Ретроспективный анализ выживаемости групп, получавших различное лечение (Бев – бевацизумаб, Цет – цетуксимаб), в исследовании CALGB/SWOG 80405 в зависимости от локализации первичной опухоли.
адаптировано из Analysis of CALGB/SWOG 80405
«Долгие годы люди думали, что толстая кишка — это всего лишь трубка, которая перемещает каловые массы к прямой кишке...», — говорит Алан Венук. Однако к моменту публикации результатов CALGB/SWOG 80405 было выявлено множество различий между двумя частями толстой кишки — правой и левой, условно разделенными по селезеночному изгибу. Было давно известно, что правые отделы развиваются из среднекишечного сегмента эмбриона (midgut), в то время как левые происходят из заднекишечного (hindgut) [63]. Молекулярный анализ в начале 2000-х с помощью ДНК-микрочипов обнаружил 165 генов, демонстрирующих двукратное, и 49 генов, демонстрирующих трехкратное изменение экспрессии между двумя разными отделами кишечной трубки [64]. Другие работы показали различия в особенностях морфологии, в скорости протекания биохимических реакций и даже в концентрации канцерогенных факторов [65–67]. Эти и многие другие параметры, отличающие правый отдел толстой кишки от левого, могли обуславливать развитие возникающих в них опухолей по различным путям. Так в действительности и оказалось — было установлено, что опухоли двух отделов толстой кишки имеют разные частоты встречаемости среди возрастов и полов, отличаются молекулярно-генетически, гистологически и иммунологически, для них характерно различное клиническое течение, прогноз и ответ на терапию [60], [62], [68–79]. Для простоты восприятия эти различия суммированы на рисунке 10.
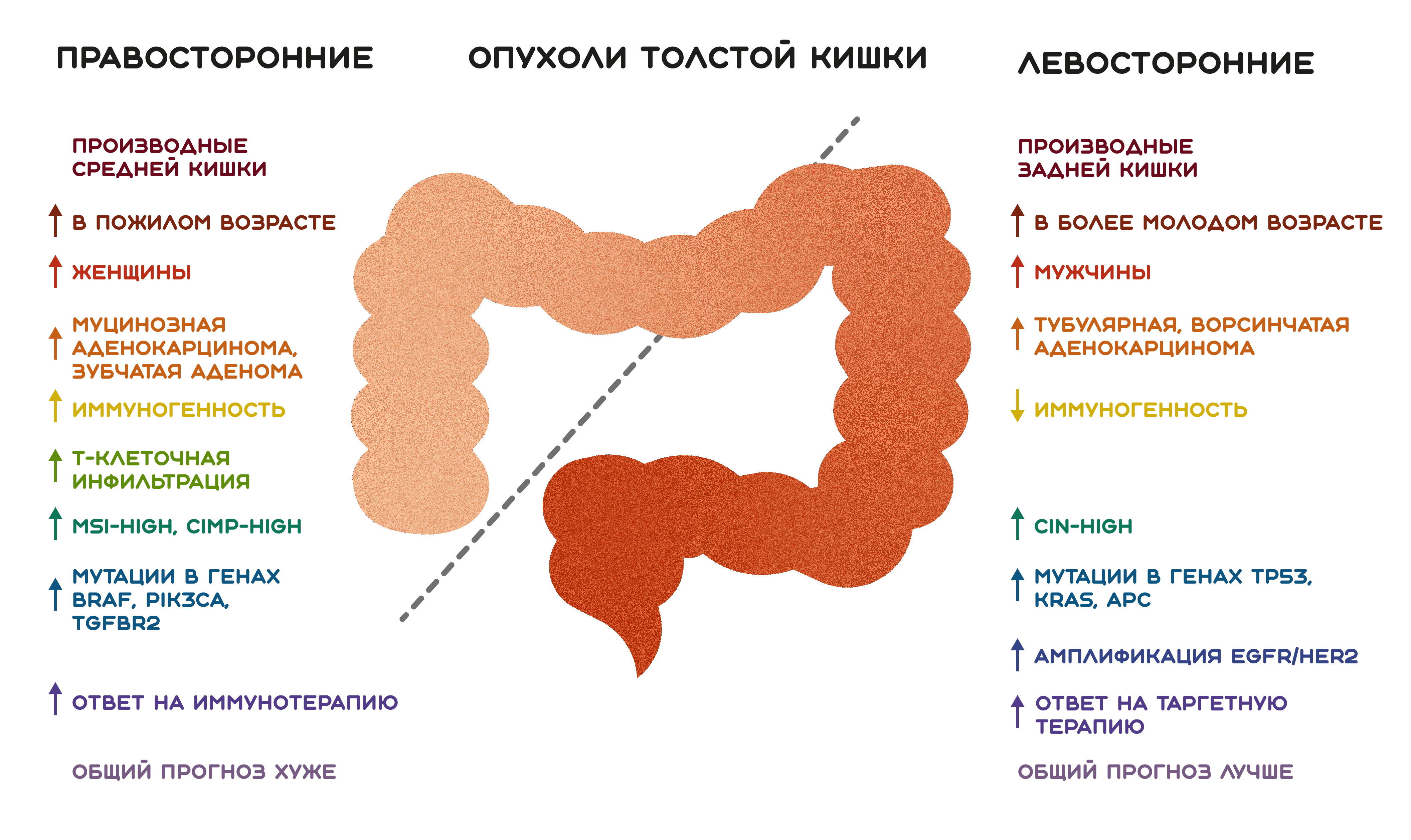
Рисунок 10. Сравнительная характеристика опухолей толстой кишки, локализованных справа и слева. MSI — microsatellite instability, микросателлитная нестабильность; CIMP — CpG island methylator phenotype, фенотип метилирования CpG островков; CIN — chromosomal instability, хромосомная нестабильность.
рисунок Полины Дементьевой
Результаты, полученные Венуком и коллегами, на большой выборке пациентов обосновали клиническую значимость изучения колоректального рака как двух отдельных заболеваний — правостороннего и левостороннего. Исследование CALGB/SWOG 80405 позволило взглянуть на локализацию опухоли как на косвенное отражение ее биологических свойств, скрытых от глаз врача до проведения молекулярного анализа. В дальнейшем классификация колоректального рака стала еще более подробной, включив 4 консенсусных молекулярных подтипа (consensus molecular subtype, CMS) опухолей в зависимости от их молекулярно-генетических свойств [80], [81]. Однако подробный разговор об этом может стать темой для отдельной статьи.
Заключение
Знание биологии новообразования — это ключ в успешной борьбе с опухолевым заболеванием. Исследование CALGB/SWOG 80405 и другие, последовавшие за ним, подтверждали концепции, предложенные еще в 1970-х годах докторами Фишером и Фидлером. Биология опухоли является основным фактором при принятии клинического решения в отношении конкретного пациента. Борясь с опухолью, мы боремся со стремительно эволюционирующим биологическим объектом [82]. С течением времени этот объект может приобретать новые свойства, позволяющие ему эффективнее захватывать экологическую нишу в организме хозяина, а внутренняя молекулярная гетерогенность опухолей, даже происходящих из одного органа, может обуславливать полный провал терапии у одного пациента и успех у другого. Любому доктору, любому медицинскому специалисту важно помнить об этом и рассматривать рак как системный биологический процесс, и тогда из клинических исследований врачи смогут продолжать извлекать ценные фундаментальные знания, а пациенты получат шансы на улучшение результатов лечения или даже на выздоровление.
Литература
- Stewart Anderson. (2022). A Short History of Bernard Fisher’s Contributions to Randomized Clinical Trials. Clinical Trials. 19, 127-136;
- WILLIAM S. HALSTED. (1894). THE RESULTS OF OPERATIONS FOR THE CURE OF CANCER OF THE BREAST PERFORMED AT THE JOHNS HOPKINS HOSPITAL FROM JUNE, 1889, TO JANUARY, 1894. Annals of Surgery. 20, 497-555;
- WILLIAM STEWART HALSTED. (1907). THE RESULTS OF RADICAL OPERATIONS FOR THE CURE OF CARCINOMA OF THE BREAST.*. Annals of Surgery. 46, 1-19;
- M Hassan Murad, Noor Asi, Mouaz Alsawas, Fares Alahdab. (2016). New evidence pyramid. Evid Based Med. 21, 125-127;
- Urban J.A., Baker H.W. (1952). Radical mastectomy in continuity with en bloc resection of the internal mammary lymph-node chain; a new procedure for primary operable cancer of the breast. Cancer. 5, 992–1008;
- Stein J.J. (1958). The management of cancer of the breast. Calif Med. 88, 202–205;
- Hugh Auchincloss. (1958). The nature of local recurrence following radical mastectomy. Cancer. 11, 611-619;
- Fisher B. (1970). The surgical dilemma in the primary therapy of invasive breast cancer: a critical appraisal. Curr Probl Surg. 1, 1–53;
- Fisher B. (1973). One giant leap for mankind. JAMA. 225, 1246–1247;
- C. David Naylor. (2020). The Evolution of Schools of Thought in Medicine. JAMA. 323, 1035;
- Fisher B., Montague E., Redmond C. (1977). Comparison of radical mastectomy with alternative treatments for primary breast cancer. A first report of results from a prospective randomized clinical trial. Cancer. 39, 2827–2839;
- Karunanidhi G., Chandramouli R., Dharanipragada K., Penumadu P., Das J. (2021). Assessment of cosmesis and quality of life and their correlation using novel, validated methods in breast cancer patients who had undergone breast conservation therapy. Gulf J Oncolog. 36, 21–29;
- Julio A. Aguirre-Ghiso. (2007). Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846;
- Tri Giang Phan, Peter I. Croucher. (2020). The dormant cancer cell life cycle. Nat Rev Cancer. 20, 398-411;
- Daniela F Quail, Johanna A Joyce. (2013). Microenvironmental regulation of tumor progression and metastasis. Nat Med. 19, 1423-1437;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Zheng Hu, Christina Curtis. (2020). Looking backward in time to define the chronology of metastasis. Nat Commun. 11;
- Bernard Fisher. (1979). Breast-Cancer Management. N Engl J Med. 301, 326-328;
- Elizabeth A. Mittendorf, Mariana Chavez-MacGregor, Jose Vila, Min Yi, Daphne Y. Lichtensztajn, et. al.. (2017). Bioscore: A Staging System for Breast Cancer Patients that Reflects the Prognostic Significance of Underlying Tumor Biology. Ann Surg Oncol. 24, 3502-3509;
- Li Yin, Jiang-Jie Duan, Xiu-Wu Bian, Shi-cang Yu. (2020). Triple-negative breast cancer molecular subtyping and treatment progress. Breast Cancer Res. 22;
- Shuai Jiang, George J. Zanazzi, Saeed Hassanpour. (2021). Predicting prognosis and IDH mutation status for patients with lower-grade gliomas using whole slide images. Sci Rep. 11;
- Биологическая машина репарации ДНК;
- I. P. M. Tomlinson, M. R. Novelli, W. F. Bodmer. (1996). The mutation rate and cancer. Proc. Natl. Acad. Sci. U.S.A.. 93, 14800-14803;
- Ivana Bozic, Tibor Antal, Hisashi Ohtsuki, Hannah Carter, Dewey Kim, et. al.. (2010). Accumulation of driver and passenger mutations during tumor progression. Proc. Natl. Acad. Sci. U.S.A.. 107, 18545-18550;
- Lucy R. Yates, Peter J. Campbell. (2012). Evolution of the cancer genome. Nat Rev Genet. 13, 795-806;
- C. Tomasetti, B. Vogelstein. (2015). Variation in cancer risk among tissues can be explained by the number of stem cell divisions. Science. 347, 78-81;
- Иммунные войны: космическая онкологическая сага;
- Alberts B., Johnson A., Lewis J. Molecular Biology of the Cell. 4th edition. New York: Garland Science, 2002;
- Isaiah J. Fidler, Margaret L. Kripke. (1977). Metastasis Results from Preexisting Variant Cells Within a Malignant Tumor. Science. 197, 893-895;
- George Poste, Isaiah J. Fidler. (1980). The pathogenesis of cancer metastasis. Nature. 283, 139-146;
- Arthur W. Lambert, Diwakar R. Pattabiraman, Robert A. Weinberg. (2017). Emerging Biological Principles of Metastasis. Cell. 168, 670-691;
- Jawad Fares, Mohamad Y. Fares, Hussein H. Khachfe, Hamza A. Salhab, Youssef Fares. (2020). Molecular principles of metastasis: a hallmark of cancer revisited. Sig Transduct Target Ther. 5;
- Mario J. Acquarelli, Ronald S. Matsunaga, Kenneth Cruze. (1961). Metastatic carcinoma of the neck of unknown primary origin. The Laryngoscope. 71, 962-974;
- Frederick F. Holmes, Terry L. Fouts. (1970). Metastatic cancer of unknown primary site. Cancer. 26, 816-820;
- M. Merson, S. Andreola, V. Galimberti, R. Bufalino, S. Marchini, U. Veroizesi. (1992). Breast carcinoma presenting as axillary metastases without evidence of a primary tumor. Cancer. 70, 504-508;
- Shumei Kato, Ahmed Alsafar, Vighnesh Walavalkar, John Hainsworth, Razelle Kurzrock. (2021). Cancer of Unknown Primary in the Molecular Era. Trends in Cancer. 7, 465-477;
- Morikawa K., Walker S.M., Jessup J.M., Fidler I.J. (1988). In vivo selection of highly metastatic cells from surgical specimens of different primary human colon carcinomas implanted into nude mice. Cancer Res. 48, 1943–1948;
- Erin F. Cobain, Yi-Mi Wu, Pankaj Vats, Rashmi Chugh, Francis Worden, et. al.. (2021). Assessment of Clinical Benefit of Integrative Genomic Profiling in Advanced Solid Tumors. JAMA Oncol;
- Shumei Kato, Ahmed Alsafar, Vighnesh Walavalkar, John Hainsworth, Razelle Kurzrock. (2021). Cancer of Unknown Primary in the Molecular Era. Trends in Cancer. 7, 465-477;
- A. de Gramont, A. Figer, M. Seymour, M. Homerin, A. Hmissi, et. al.. (2000). Leucovorin and Fluorouracil With or Without Oxaliplatin as First-Line Treatment in Advanced Colorectal Cancer. JCO. 18, 2938-2947;
- JY Douillard, D Cunningham, AD Roth, M Navarro, RD James, et. al.. (2000). Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. The Lancet. 355, 1041-1047;
- William A. Hammond, Abhisek Swaika, Kabir Mody. (2016). Pharmacologic resistance in colorectal cancer: a review. Ther Adv Med Oncol. 8, 57-84;
- Терапевтические моноклональные антитела;
- Mary Luz Uribe, Ilaria Marrocco, Yosef Yarden. (2021). EGFR in Cancer: Signaling Mechanisms, Drugs, and Acquired Resistance. Cancers. 13, 2748;
- Sarah Q. To, Rhynelle S. Dmello, Anna K. Richards, Matthias Ernst, Ashwini L. Chand. (2022). STAT3 Signaling in Breast Cancer: Multicellular Actions and Therapeutic Potential. Cancers. 14, 429;
- Rui Liu, Youwen Chen, Guangzhi Liu, Chenxi Li, Yurong Song, et. al.. (2020). PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers. Cell Death Dis. 11;
- Koji Taniguchi, Michael Karin. (2018). NF-κB, inflammation, immunity and cancer: coming of age. Nat Rev Immunol. 18, 309-324;
- Daniel J. Hicklin, Lee M. Ellis. (2005). Role of the Vascular Endothelial Growth Factor Pathway in Tumor Growth and Angiogenesis. JCO. 23, 1011-1027;
- Gregg L. Semenza. (2003). Targeting HIF-1 for cancer therapy. Nat Rev Cancer. 3, 721-732;
- Beate M. Lichtenberger, Poi Kiang Tan, Heide Niederleithner, Napoleone Ferrara, Peter Petzelbauer, Maria Sibilia. (2010). Autocrine VEGF Signaling Synergizes with EGFR in Tumor Cells to Promote Epithelial Cancer Development. Cell. 140, 268-279;
- Roberta Lugano, Mohanraj Ramachandran, Anna Dimberg. (2020). Tumor angiogenesis: causes, consequences, challenges and opportunities. Cell. Mol. Life Sci.. 77, 1745-1770;
- David Cunningham, Yves Humblet, Salvatore Siena, David Khayat, Harry Bleiberg, et. al.. (2004). Cetuximab Monotherapy and Cetuximab plus Irinotecan in Irinotecan-Refractory Metastatic Colorectal Cancer. N Engl J Med. 351, 337-345;
- Herbert Hurwitz, Louis Fehrenbacher, William Novotny, Thomas Cartwright, John Hainsworth, et. al.. (2004). Bevacizumab plus Irinotecan, Fluorouracil, and Leucovorin for Metastatic Colorectal Cancer. N Engl J Med. 350, 2335-2342;
- Alan P. Venook, Donna Niedzwiecki, Heinz-Josef Lenz, Federico Innocenti, Briant Fruth, et. al.. (2017). Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer. JAMA. 317, 2392;
- Astrid Lièvre, Jean-Baptiste Bachet, Valérie Boige, Anne Cayre, Delphine Le Corre, et. al.. (2008). KRAS Mutations As an Independent Prognostic Factor in Patients With Advanced Colorectal Cancer Treated With Cetuximab. JCO. 26, 374-379;
- Ian A. Prior, Fiona E. Hood, James L. Hartley. (2020). The Frequency of Ras Mutations in Cancer. Cancer Research. 80, 2969-2974;
- Jolien Tol, Miriam Koopman, Annemieke Cats, Cees J. Rodenburg, Geert J.M. Creemers, et. al.. (2009). Chemotherapy, Bevacizumab, and Cetuximab in Metastatic Colorectal Cancer. N Engl J Med. 360, 563-572;
- J. Randolph Hecht, Edith Mitchell, Tarek Chidiac, Carroll Scroggin, Christopher Hagenstad, et. al.. (2009). A Randomized Phase IIIB Trial of Chemotherapy, Bevacizumab, and Panitumumab Compared With Chemotherapy and Bevacizumab Alone for Metastatic Colorectal Cancer. JCO. 27, 672-680;
- Alan P. Venook, Donna Niedzwiecki, Heinz-Josef Lenz, Federico Innocenti, Michelle R. Mahoney, et. al.. (2014). CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC).. JCO. 32, LBA3-LBA3;
- Fotios Loupakis, Dongyun Yang, Linda Yau, Shibao Feng, Chiara Cremolini, et. al.. (2015). Primary Tumor Location as a Prognostic Factor in Metastatic Colorectal Cancer. JNCI: Journal of the National Cancer Institute. 107;
- S.Y. Brulé, D.J. Jonker, C.S. Karapetis, C.J. O’Callaghan, M.J. Moore, et. al.. (2015). Location of colon cancer (right-sided versus left-sided) as a prognostic factor and a predictor of benefit from cetuximab in NCIC CO.17. European Journal of Cancer. 51, 1405-1414;
- Alan P. Venook, Donna Niedzwiecki, Federico Innocenti, Briant Fruth, Claire Greene, et. al.. (2016). Impact of primary (1º) tumor location on overall survival (OS) and progression-free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405 (Alliance).. JCO. 34, 3504-3504;
- Sadler T. W. Langman's medical embryology







