
Структуры рецепторов GPCR «в копилку»
12 декабря 2010
Структуры рецепторов GPCR «в копилку»
- 3423
- 4
- 5
Обобщение строения рецепторов из семейства GPCR и единая теория их активации и передачи сигнала — дело будущего
art. lebedev (картинка копилки)
-
Автор
-
Редакторы
«Биомолекула» не раз уже писала о структурной биологии и, в частности, о строении рецепторов, действующих через активацию G-белка. Осень 2010 года принесла ещё две структуры этих излюбленных фармакологами мембранных белков — дофаминового и хемокинового рецепторов. Однако структурщики и научная общественность пока пребывают в замешательстве: при чрезвычайно высокой общей «похожести», различия между отдельными представителями семейства пока не позволяют воссоздать общую молекулярную картину их действия. «Копилка» продолжает наполняться.
В биологии очень многое решает форма, — в том числе, «форма» (точнее, структура) биологических молекул. «Биомолекула» уже не раз обращалась к вопросам структурной биологии, — в том числе, полуиндустриальной инициативе под названием структурная геномика [1], [2]; не в первый раз речь зайдет и о структуре рецепторов, действующих через активацию G-белка (от англ. G-protein coupled receptors, GPCR). Об их универсальности в качестве сенсоров разнообразных сигналов и о многообразии выполняемых ими функций мы несколько раз говорили весьма подробно: это и зрение (см. «Зрительный родопсин — рецептор, реагирующий на свет» [3]), и обоняние, и вкус (с весьма неожиданной ролью рецепторов горького вкуса в лёгких [4]), и биохимическая рецепция [5], и многое, многое другое.
Десять лет назад (в 2000 г.) была расшифрована первая пространственная структура GPCR-рецептора — родопсина сетчатки глаза [3]. Несмотря на постоянно возрастающие усилия экспериментаторов, следующие структуры оказались более «крепким орешком» и появились лишь семь лет спустя, — ими стали β2- и β1-адренорецепторы [5]. Высокая сложность экспериментального изучения мембранных белков вообще и рецепторов этого семейства в частности стимулировали развитие методов теоретического компьютерного предсказания структуры [6], однако и экспериментаторы работали, не покладая рук. Наконец, лаборатории американских исследователей Брайана Кобилки (Brian Kobilka) и Рэймонда Стивенса (Raymond Stevens) нащупали путь, достаточно надежно ведущий к получению структур таких рецепторов.
Предложенные исследователями ухищрения направлены на увеличение стабильности рецептора при образовании кристаллов [7] (используется кубическая липидная фаза) и на «наращивание» числа межмолекулярных контактов в кристаллической ячейке, что позволяет добиться качественной дифракционной картины при облучении кристалла синхротронным лучом и, в конечном счете, дает рассчитать координаты всех атомов в молекуле. Основных «ухищрений», касающихся подготовки самого рецептора, три:
- термостабилизирующие точечные мутации, увеличивающие стабильность молекулы рецептора;
- кристаллизация в комплексе с молекулой антагониста, что также несколько «замораживает» рецептор в неактивной форме;
- создание генно-инженерного «химерного» варианта рецептора, когда вместо одной из особо подвижных цитоплазматических петель «вставляют» молекулу лизозима-T4, существенно повышающего вероятность формирования качественного кристалла. (Вариант: кристаллизация в комплексе с молекулой антитела, выполняющей те же функции.)
(Естественно, это далеко не все тонкости, в которых заключается «ноу-хау», но подробнее здесь углубляться нет смысла, да и, наверняка, не все «тайны фирмы» расписаны в разделе «Материалы и методы» — всем хочется снять сливки со своего открытия по полной.)
Уже можно утверждать, что этот метод приобрел черты технологии — вскоре после адренорецепторов появилась структура аденозинового рецептора [8] (в 2008 г.), а совсем недавно — хемокинового (CXCR4) [9] и дофаминового (D3) [10] рецепторов. Все эти три структуры получены с использованием примерно тех же приемов, что и описаны чуть выше. Работа проделана в лаборатории Стивенса (уже без Кобилки), все статьи опубликованы в журнале Science (издания рейтингом ниже для этих исследователей — уже «не тот уровень»), а одним из главных авторов работ выступает наш бывший соотечественник Вадим Черезов [11], заканчивавший московский физтех, ныне — профессор НИИ Скриппса в Калифорнии, руководитель собственной лаборатории.
Планы исследователей, явно оседлавших нужного конька, простираются довольно далеко и от отсутствия амбиций не страдают. «Наша цель — раскрыть молекулярные детали работы рецепторов семейства GPCR, что продвинет вперед биологию в целом, — говорит Стивенс. — В конце концов, благодаря нашим (и других исследователей) работам для каждого крупного подсемейства этих важнейших рецепторов будут известны пространственные структуры, а биохимики обеспечат другую необходимую информацию. В этот момент мы станем как никогда близки к заветной мечте фармакологов — разработке лекарств, прицельно действующих на одни молекулярные пути, оставляя незатронутыми все остальные» [12]. Следующими целями ученых станут, вероятно, опиоидные и серотониновые рецепторы.
Если адреналиновые рецепторы, образно выражаясь, реализуют биологическую программу «бей или беги», то рецепторы дофамина связаны, без преувеличения, с молекулярными основами личности. Уже достаточно надежно установлено, что некоторые из рецепторов дофамина отвечают за работу «системы вознаграждения» мозга и до какой-то степени определяют тягу людей к новым ощущениям и даже пагубным привычкам («секс, драгз и рок-н-ролл») [13]. Кроме того, дофаминовые рецепторы D2 и D3 являются мишенями для лечения психиатрических расстройств — таких, как, например, шизофрения. Но существующие лекарства действуют на оба рецептора сразу, что может «смазывать» эффект за счет побочных влияний. Наличие пространственной структуры рецептора (рис. 1) позволит точнее представить механизм действия и предложить модификации существующих молекул, чтобы придать им способность действовать именно на те мишени, на которые нужно.
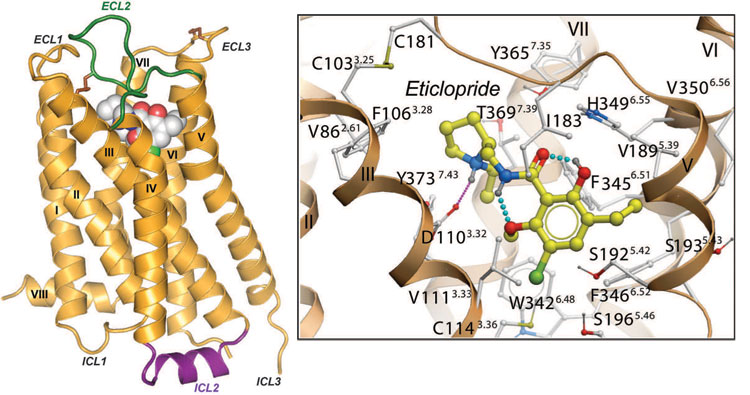
Рисунок 1. Структура дофаминового рецептора (PDB Id: 3PBL). Для получения кристалла дифракционного качества в молекулу внесли термостабилизирующую мутацию L119T, встроили вместо 3-й цитоплазматической петли лизозим-T4 (не показан) и дополнительно «заморозили» рецептор в основном состоянии, добавив D2/D3 антагонист этиклоприд (слева показан сферами, справа — в «скелетном» представлении). Хотя общий тип укладки точно такой же, как и для всех остальных изученных рецепторов GPCR (начиная с родопсина [3]), многочисленные детали (такие как положение дисульфидных связей, конформация внемембранных петель и, главное, положение и устройство сайта связывания) делают «портрет» рецептора сугубо индивидуальным.
В структуре рецептора D3 обнаружили «ионную защелку», которая удерживает вместе цитоплазматические концы трансмембранных спиралей 3 и 6 в неактивной форме рецептора и, разорвавшись, освобождает сайт связывания с G-белком, характеризующий активную форму рецептора. Впервые «защелку» нашли в структуре родопсина [3], и совсем уж было уверились в универсальности этого механизма, когда неожиданно ни в β-адренорецепторах [5], ни в аденозиновом рецепторе [8] ничего похожего не обнаружилось, хотя соответствующие аминокислотные остатки там присутствуют... Так и не понятно: то ли этот механизм остается чисто умозрительным, то ли он работает не у всех рецепторов, то ли в некоторых случаях вставка в структуру рецептора молекулы лизозима деформирует неактивную конформацию рецептора.
«Рецептор D3 был „в пробирке“ самым нестабильным из всех, с которыми нам приходилось работать, — отмечает Стивенс. — Наверное, молекулы липидов или какие-то ещё вещества влияют на его подвижность, но точно мы пока не смогли в этом разобраться» [12].
Хемокиновые рецепторы (CXCR), которых в организме 19 типов, вместе со своими лигандами цитокиновой природы хемокинами играют не менее важную роль: это хемотаксис и миграция клеток, определяющие развитие организма в целом и процессы, возникающие во время нарастания воспаления и развития рака. (Кстати, эти рецепторы участвуют в «жизни» аж 23 форм злокачественных опухолей.) Рецептор CXCR4, кроме того, «славен» тем, что выполняет работу троянского коня для вируса иммунодефицита человека (ВИЧ), который в процессе «вскрывания» мембраны лимфоцита связывается сначала с мембранным рецептором CD4, а после — с CXCR4 (причем оба эти рецептора необходимы для проникновения вируса в клетку). Нормальная функция CXCR4 очерчивается тем наблюдением, что у животных, лишенных этого рецептора или его «родного» лиганда хемокина CXCL12, наблюдаются смертельные дефекты развития сердечно-сосудистой системы и кроветворения.
Структура именного этого рецептора — CXCR4 — и была определена командой Стивенса и Черезова [9]. Точнее, получено целых пять структур рецепторов в различных условиях и в комплексе с двумя антагонистами — низкомолекулярным веществом IT1t (разрешение структуры 2,5 Å) и циклическим пептидным ингибитором CVX15 (2,9 Å). Кроме того, были использованы те же «классические» приемы — термостабилизирующие мутации и встраивание индуцирующего кристаллические контакты лизозима-T4.
Анализ структуры выявил множество, опять же, на первый взгляд, мелких отличий от других изученных GPCR-рецепторов, — например, углы наклона трансмембранных спиралей и их излома на остатках пролина, а также отсутствие короткой α-спирали-VIII, во всех других рецепторах прилегающей к мембране с внутренней стороны (рис. 2). Все эти отличия показывают, что предсказание структуры GPCR [6] по-прежнему остается важной, хотя и весьма сложной задачей, к которой на хромой кобыле не подъедешь трудно подступиться с помощью одного лишь моделирования на основании гомологии.
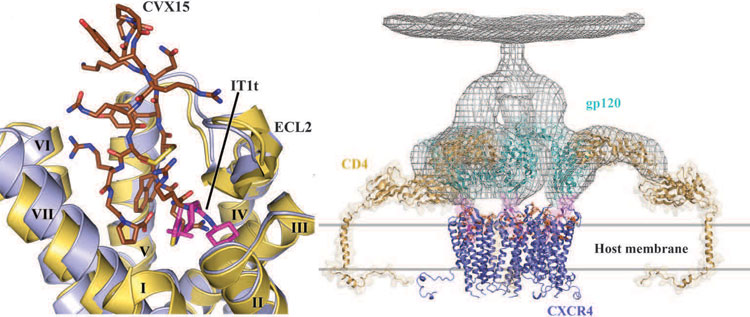
Рисунок 2. Структура хемокинового рецептора CXCR4 и его роль в ВИЧ-инфекции. Слева: совмещенные сайты связывания двух структур рецептора: в комплексе с низкомолекулярным антагонистом IT1t (рецептор окрашен синим; PDB Id: 3OE8) или в комплексе с циклическим пептидным ингибитором CVX15 (рецептор окрашен жёлтым; PDB Id: 3OE0). Такое сравнение позволяет оценить «пластичность» сайта связывания, в CXCR4 более «просторного», нежели в случае других рецепторов. Справа: схематичное изображение ранних стадий проникновения ВИЧа внутрь лейкоцита. Первым делом вирусный белок gp120 взаимодействует с рецептором CD4, вслед за чем, изменив конформацию и выставив на поверхность «тот самый» гипервариабельный участок, из-за которого не удается создать эффективное лекарство от СПИДа (показан розовым), взаимодействует с рецептором CXCR4 (показан в виде димера) и внедряется внутрь атакуемой клетки.
«Технологический tour de force, которым стала задача определения структуры GPCR-рецепторов, поддержанная программами структурной биологии NIH (Национальный институт здравоохранения США) и PSI (одна из программ по структурной биологии [1]), начинает приносить неплохие дивиденды, — говорит Джереми Берг (Jeremy M. Berg), директор Национального института общемедицинских наук США, поддерживающего PSI. — Это яркий пример того, как технический прогресс стимулирует переход на качественно иной уровень фундаментальных работ. Кроме того, это подчеркивает плодотворность сотрудничества структурных биологов со специалистами из других областей для решения важнейших биомедицинских задач» [14]. Кроме поддержки, упомянутой Бергом, исследователи получают финансирование от фармацевтической фирмы Pfizer.
Значение этих исследований для биологии сложно переоценить, однако сейчас, по-видимому, продолжается период накопления информации о структуре и функциях рецепторов GPCR, который должен завершиться обобщением и синтезом этого знания. Не вызывает сомнений, что новые структуры (а также основанные на них компьютерные модели) будут очень востребованы в молекулярной медицине и фармакологии. Однако если говорить о фундаментальном значении этих работ, доступных данных пока явно недостаточно, чтобы собрать из них универсальную и непротиворечивую картину работы рецепторов GPCR, не только давшую бы понимание механизма активации, но и позволившую подступиться к лечению не поддающихся пока заболеваний во всеоружии. Так что пока — плюс два в копилку!
Литература
- Ловля бабочек, или Чем структурная геномика поможет биологии;
- Структурная геномика меняет курс;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Запах горького ветра;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Торжество компьютерных методов: предсказание строения белков;
- Яминский И. (2004). Кристаллы из белка. «Наука и жизнь». 1;
- V.-P. Jaakola, M. T. Griffith, M. A. Hanson, V. Cherezov, E. Y. T. Chien, et. al.. (2008). The 2.6 Angstrom Crystal Structure of a Human A2A Adenosine Receptor Bound to an Antagonist. Science. 322, 1211-1217;
- B. Wu, E. Y. T. Chien, C. D. Mol, G. Fenalti, W. Liu, et. al.. (2010). Structures of the CXCR4 Chemokine GPCR with Small-Molecule and Cyclic Peptide Antagonists. Science. 330, 1066-1071;
- E. Y. T. Chien, W. Liu, Q. Zhao, V. Katritch, G. Won Han, et. al.. (2010). Structure of the Human Dopamine D3 Receptor in Complex with a D2/D3 Selective Antagonist. Science. 330, 1091-1095;
- Рубан О. (2009). Звездам не дают работать. «Эксперт». 44;
- Molecular structure of dopamine receptor discovered. (2010). ScienceDaily;
- Слово о генетике поведения;
- Study details structure of potential target for HIV and cancer drugs. (2010). ScienceDaily.





