
Флуоресцирующая Нобелевская премия по химии
09 октября 2008
Флуоресцирующая Нобелевская премия по химии
- 7051
- 3
- 6
Светящиеся зелёным фосфорическим светом медузы Aequorea victoria — организм, в котором был открыт зелёный флуоресцентный белок, — были описаны в 1761 году шведским зоологом П. Форскалом во время морской научной экспедиции, следовавшей по маршруту Копенгаген-Аравия. Какое-то время медуза даже называлась в его честь: Aequorea forskalea.
-
Авторы
-
Редакторы
Нобелевская Премия по химии в 2008 году присуждена трём учёным из американских институтов — Осамо Шимамуре, Роджеру Тсину и Мартину Шалфи — за открытие и изучение зеленого флуоресцентного белка медузы Aequorea victoria (green fluorescent protein, GFP). Значение их открытия настолько сложно переоценить, что «Биомолекула» решила дать небольшой материал по использованию GFP в современной биотехнологии.
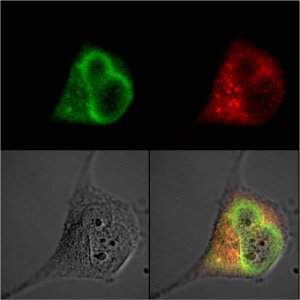
Рисунок 1. Типичный пример использования флуоресцентных белков. Два разных белка метятся зелёным и красным флуоресцентными белкáми (их молекулярный вес около 30 кДа, что позволяет «слить» их с большинством клеточных белков без заметного влияния на функции последних). Клетку фотографируют при облучении ультрафиолетом через зелёный и красный светофильтры, и потом накладывают изображения на изображение клетки в видимом свете (серый). В результате получается довольно точная картина локализации разных белков в клетке и относительно друг друга.
Осамо Шимамура (Osamu Shimomura), первооткрыватель зелёного флуоресцентного белка, начал заниматься биолюминисценцией ещё в студенчестве — в 1955 году в Университете Нагойи, где его первой самостоятельной задачей стало определить, почему разлагающиеся моллюски рода Cypridina светятся в темноте. Шимамуре удалось успешно справиться с этой сложной задачей: он выделил ярко люминесцирующий белок. (В случае люминесценции свечение обусловлено химической реакцией окисления особого субстрата — люциферина; в отличие от флуоресценции, где причиной свечения является предварительное возбуждение светом определенной длины волны.)
Профессура, удивлённая успехами Шимамуры, даже вручила ему степень кандидата наук (PhD) заочно, несмотря на то, что он даже не был аспирантом. После публикации результатов, его пригласили работать в США, где он продолжил изучать светящиеся организмы, — на этот раз медуз Aequorea victoria. Предание гласит, что в течение всего лета 1961 года Шимамура и его научный руководитель собирали на морском берегу и исследовали медуз, и через их руки и аппарат, в котором они их «перерабатывали», проходило по 3000 организмов в день.
Первым светящимся белком, выделенным из медузы, стал экворин, люминесцирующий синим светом при окислительном присоединении молекулы целентеразина в присутствии ионов кальция (которые содержатся в морской воде). (Кстати, экворин-целентеразиновая система с тех пор считается одним из основных биохимических сенсоров Ca2+.) Однако самым интересным было то, что экворин давал синее свечение, а сами медузы светились зелёным! Дело, оказывается, было в том, что медуза содержала ещё один белок — флуоресцентный, «удостоившийся» почти полвека спустя «Нобелевки», — зелёный флуоресцентный белок (GFP).
Первым упоминанием о GFP можно считать статью Шимамуры, вышедшую в 1962 году [1]. В ней было описано, что под действием света раствор этого белкá приобретает слегка зеленоватый цвет, а ультрафиолет вызывает яркое свечение раствора. И — самое важное — для свечения белка необходим только возбуждающий поток света и кислород в обычных концентрациях, и больше ничего (никаких дополнительных кофакторов — в отличие от экворина). Обо всех этих открытиях можно почитать в замечательном «автобиографическом» обзоре Шимамуры [2].
Этот интересный феномен, правда, в те времена было затруднительно использовать — биотехнология тогда делала ещё только самые первые шаги. Настоящая революция началась после встречи Шимамуры с Мартином Шалфи (Martin Chalfie) на одном из семинаров в Университете Колумбии (Нью-Йорк). Последний работал с прозрачным червём-нематодой Caenorhabditis elegans, и предложил попробовать использовать GFP для «картирования» клеток развивающихся зародышей С. elegans, а также для отслеживания определённых белков внутри клетки. Этому способствовала и бурно развивавшаяся научно-техническая база — на дворе был уже конец 80-х. Результат потрясал — внутри живой клетки можно было проследить за перемещением отдельных видов белков в реальном времени, при чем без особых ухищрений — для этого нужен обычный микроскоп с ультрафиолетовой лампой и светофильтром, пропускающим нужную длину волны (рис. 2).
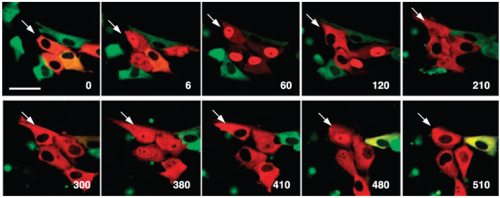
Рисунок 2. Активация клеток TNF-α (tumor necrosis factor alpha) вызывает осцилляцию (циркулярное перемещение цитоплазма-ядро-цитоплазма) транскрипционных факторов (NFkB, зеленый) и их ингибиторов (IkB, красный). Цифры в углу слайдов — время в минутах после стимуляции, стрелка показывает одну и ту же клетку на всех фотографиях.
Кстати следует обратить внимание на красный цвет на рисунке 2! Оказалось, что с помощью направленного мутагенеза можно не только усилить свечение белка, но и поменять его цвет. Так появились варианты GFP, излучающие в желтой, синей и красной областях спектра. С гордостью надо сказать, что одной из ведущих лабораторий по разработке новых «красок» является лаборатория Сергея Лукьянова в московском Институте биоорганической химии.
Лукьянов и его коллеги открыли и описали массу флуоресцирующих и окрашенных белков в морских организмах, которые обычно сами не светятся, но часто флуоресцируют в ультрафиолете, — например в актиниях (Anemonia majano и Ricordia yuma) и кораллах [4]. Что интересно, этих животных учёные брали не из моря, из домашнего аквариума одного из коллег. Кстати «в затылок» русским исследователям дышала группа австралийских учёных, но публикация наших соотечественников, вышедшая в 1999 году [5], прочно закрепила их приоритет в области «цветных» флуоресцентных белков.
Однако третьим Нобелевским лауреатом стал не Лукьянов, а Роджер Тсин (Roger Tsien), объяснивший механизм возникновения флуоресценции в белкé, не содержащем кофакторов и не требующем присутствия ионов металла. Кроме того, он всё-таки первым открыл флуоресцентные белки отличного от зелёного цвета — голубого, синего и жёлтого. В его группе также произвели «переделку» тетрамерного красного белка, открытого Лукьяновым, — с тем, чтобы заставить его работать в качестве мономера и уменьшить молекулярную массу (это необходимо с технологической точки зрения для удобства применения в экспериментах).
Современные светящиеся метки уже далеко превзошли «способности» прадедушки-GFP. Например, на его основе созданы включающиеся-выключающиеся разными длинами света флуоресцентные метки (рис. 3). Для таких белков стало возможным с помощью пучка света включать и выключать свечение молекулы, экономя её «ресурс» (это важно, поскольку флуоресцентные белки «выгорают», и яркость GFP или его аналогов максимальна только в первые минуты, а дальше она постепенно затухает).

Рисунок 3. Схема работы с новым поколением фотоактивируемых флуоресцентных белков. В случае необратимо активируемых белков — PA-GFP, PS-CFP и Kaede — мы можем сначала синей частью светового спектра активировать их для первичной визуализации, а потом направленным пучком лазера активировать отдельную мишень (пул молекул или органеллу). В случае PS-CFP и Kaede УФ-лазер вызывает контрастное свечение молекул на общем фоне. Метод очень удобен для цитологических исследований.
Обратимо активируемые белки — KFP1 и Dropna — являются (по крайней мере для автора данной заметки) полной экзотикой. Кроме свойств, присущих всем фотоактивируемым белкам, они имеют одну дополнительную черту — их свечение можно обратимо потушить излучением с определённой длиной волны. Так мы значительно продляем время жизни метки, не давая ей «выгореть» в промежутках между анализами.
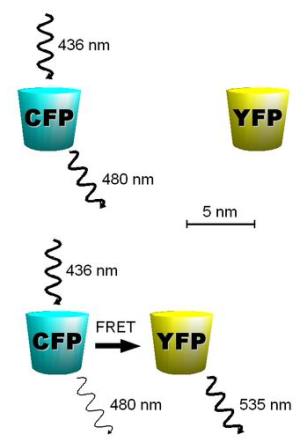
Рисунок 4. Принцип метода FRET. При сближении в пространстве излучение голубого флуоресцентного белка (CFP) «захватывается» жёлтым флуоресцентным белком (YFP). В результате при сближении двух меток наблюдается затухание голубого и возникновение жёлтого свечения. Этот метод используется для детекции взаимодействия меченных молекул или органелл внутри живой клетки в реальном времени.
Создав разноцветные флуоресцентные белки, ученые получили ещё один неожиданный инструмент. Оказалось, что если модифицировать два белкá двумя разноцветными метками, то можно по изменению цвета излучения «видеть» их взаимодействие. Это может происходить, когда длина волны флуоресценции одного белка является возбуждающей для другого (рис. 4). Так, в норме, возбуждая флуоресценцию голубого белка, мы видим синее излучение. Однако при сближении меченного синим белка-хозяина с его партнером — например субстратом, который мы модифицировали меткой другого цвета, — мы будем видеть затухание синего излучения и возникновение желтого! Модифицировав такой парой два белка, мы теперь можем точно регистрировать их взаимодействие in vivo, внутри клетки. Этот способ лёг в основу интересного и точного метода, получившего название FRET (Фёрстеровский резонансный перенос энергии).
Закончить наш обзор хочется красиво. А что может быть красивее, чем прижизненная и абсолютно безвредная визуализация частей тела! На рисунке 5 (слева) в специально выведенную лысую породу мышей введен ген красного флуоресцентного белка. Когда всё тело светится — это красиво. Но намного больше пользы принесут "светлячки«-сигналы болезней (рис. 5 (справа)). Так, первые эксперименты с раковыми опухолями, экспрессирующими флуоресцентные маркеры, показали, что можно визуально пронаблюдать развитие болезни. Возможно, когда-нибудь мы сможем так диагностировать болезни и у себя — на самых ранних этапах, когда любой серьёзный недуг можно сравнительно легко предотвратить. И — кто знает — может быть, предупреждать нас будет все тот же GFP, или его «наследники».
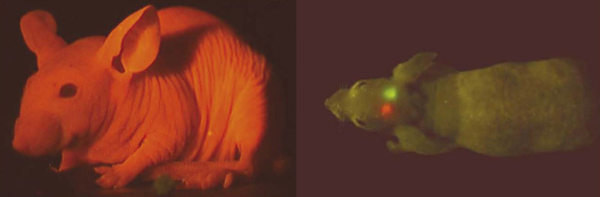
Рисунок 5. Флуоресцентные белки в визуализации заболеваний. Слева: Бесшёрстная мышь (специальная лабораторная порода), экспрессирующая красный флуоресцентный белок — чем не мышь Баскервилля? Справа: Опухоль мозга, экспрессирующая флуоресцентные белки. Этот приём иллюстрирует возможность использования флуоресцентных белков для прижизненной окраски целого организма или его частей. Следует отметить, что такие маркеры в будущем может смогут предупреждать людей о начальных стадиях серьёзных заболеваний.
Литература
- Osamu Shimomura, Frank H. Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239;
- O. SHIMOMURA. (2005). The discovery of aequorin and green fluorescent protein. J Microsc. 217, 3-15;
- D. E. Nelson. (2004). Oscillations in NF- B Signaling Control the Dynamics of Gene Expression. Science. 306, 704-708;
- Лабас Ю.А., Гордеева А.В., Фрадков А.Ф. (2003). Флуоресцирующие и цветные белки. «Природа». 3;
- Mikhail V. Matz, Arkady F. Fradkov, Yulii A. Labas, Aleksandr P. Savitsky, Andrey G. Zaraisky, et. al.. (1999). Erratum: Fluorescent proteins from nonbioluminescent Anthozoa species. Nat Biotechnol. 17, 969-973;
- Konstantin A. Lukyanov, Dmitry M. Chudakov, Sergey Lukyanov, Vladislav V. Verkhusha. (2005). Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6, 885-890;
- Jean Livet, Tamily A. Weissman, Hyuno Kang, Ryan W. Draft, Ju Lu, et. al.. (2007). Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62;
- Сычёв В. (2008). Зелёный белок отмечен Нобелевской премией по химии. Strf.ru;
- Пресс-релиз Нобелевского комитета. (2008). The Nobel Prize.






