
Дом для бактерий, или Что мы знаем о кожной микрофлоре
08 сентября 2008
Дом для бактерий, или Что мы знаем о кожной микрофлоре
- 6007
- 0
- 7
«Планета» бактерий. Для микроорганизмов кожа представляет собой сложную экологическую систему с множеством обособленных экологических ниш. Здесь можно встретить сотни видов бактерий, общая численность которых достигает триллионов. Видовой состав популяций на разных участках кожи может существенно варьировать в зависимости от температуры, влажности, pH, а также множества других факторов, которые на данный момент еще детально не изучены. The Human Factor, автор: Richard Hall
-
Автор
-
Редакторы
Окружающий мир населен огромным количеством микроорганизмов. Невозможно даже представить себе бесконечное разнообразие, которое таит в себе мир микробов: их можно найти практически в любом месте на планете — в почве, воздухе, горячих источниках и водах Мертвого моря, и даже — в Арктических льдах. Однако и человеческий организм подобен обитаемой планете, населённой сотнями видов микроорганизмов. Исследования последних лет дают все основания говорить о том, что кожа человека обладает сложной и многогранной микробной флорой. В процессе длительного взаимодействия между организмом человека и бактериями из окружающей среды некоторые из них стали заселять различные «экологические» ниши на поверхности и в глубинных слоях кожи. Результатом этого процесса стал тонкий баланс в структуре и численности микробных популяций, определяющий нормальные или патологические состояния кожи.
Симбиоз или война?
Люди издавна сталкивались с проявлением жизнедеятельности микробов, отражающимся на состоянии их организма. И наряду с непрекращающейся борьбой с инфекциями, апофеозом которого стало создание многочисленных антибиотиков, они научились пользоваться и полезными свойствами некоторых бактерий. Например, уже в Древней Греции и Риме врачи для улучшения самочувствие заболевших и нормального развития детского организма рекомендовали употреблять кисломолочные продукты. Такой распространённый продукт, как йогурт (от турецкого — yoğurt — «сгущённое молоко»), по легенде был известен еще в Древней Фракии, а в Европу это слово пришло с Балкан в XVI веке. Для получения йогурта основным условием является ферментация молока с помощью специфических штаммов бактерий (Lactobacillus bulgaricus — болгарская палочка и Streptococcus thermophilus — термофильный стрептококк), которые должны сохраняться в живом виде в готовом продукте. Однако в далёком прошлом люди, безусловно, не подозревали, что вкусному и полезному продукту они обязаны крошечным микробам. И только в конце XVIII века итальянский аббат Ладзаро Спалланцани показал, что ферментация различных продуктов происходит вследствие попадания в субстрат микробов из окружающей среды. А в начале XX века Илья Мечников, получивший позднее совместно с Паулем Эрлихом Нобелевскую премию по медицине за «работы по иммунитету», высказал идею о том, что не все бактерии являются вредными для организма. Согласно его мнению, бактерии, живущие в кисломолочных продуктах и попадающие с пищей в кишечник, вырабатывают некие полезные вещества, которые противостоят преждевременному старению и способствуют долголетию. В 1936 Зобелл и Андерсен расширили теорию Мечникова, доказав существование в толстом кишечнике «микробной плёнки». Эти учёные постулировали, что в слизистой кишечника обитают популяции многих видов бактерий — целая экосистема, вовлечённая в процессы метаболизма и пищеварения. Позднее (в 50-х годах) появился термин «пробиотик» (антоним антибиотику) — продукт, стимулирующий развитие здоровой микрофлоры кишечника. А в последующие 20 лет научные исследования помогли установить существование сложного и динамического равновесия между функционированием кишечной микрофлоры и здоровьем организма [1].
В последние годы также стали изменяться представления и о кожной микрофлоре. Обычно бактерии, обитающие на коже, рассматривались лишь как потенциальный источник инфекций. Это сформировало представления о гигиене кожи, одним из основных постулатов которого стало стремление всячески её обеззаразить (вспомнить хотя бы различные антибактериальные мыла). Перед хирургическими операциями вообще рекомендовалось принимать чуть ли не душ из хлоргексидина для предотвращения возможных осложнений, что на самом деле неблагоприятно сказывается на состоянии кожи и практически бесполезно для профилактики [2]. Однако на сегодняшний день концепция существенно усложнилась. Например, появились данные о том, что кожные популяции бактерий контролируются средствами врожденного иммунитета — в частности, конститутивной экспрессией антимикробных пептидов (см. «Антимикробные пептиды — возможная альтернатива традиционным антибиотикам» [3]). Таким образом, модель взаимодействий между кожей и «непрошеными» гостями имеет долгие эволюционные корни и, по-видимому, закодирована в геноме.
Начиная с процесса рождения и последующего постнатального периода, кожа колонизируется огромным количеством микробов, многие из которых являются важными симбионтами человека. Их роль может заключаться в подавлении роста нежелательных патогенных бактерий, а также участии в переработке кожных белков, свободных жирных кислот и кожного сала. При этом кожа состоит из различных «экологических ниш», для которых характерны широкие диапазоны pH, температуры, влажности и уровня секреции сальных желез, что играет непосредственную роль в развитии сложной микробной экосистемы [4]. Кроме того, определённые кожные структуры, такие как волосяные фолликулы и различные железы, могут обладать своей собственной уникальной флорой. Помимо этого важными факторами являются пол, генотип и иммунный статус хозяина, и даже активность, с которой он пользуется различными косметическими средствами [5]. Все это определяет численность и видовой состав микробных популяций. Существует много доказательств в пользу влияния состояния микрофлоры на развитие ряда не инфекционных кожных заболеваний, таких как атопический дерматит, розацея, псориаз и акне [4]. При этом заболевание может являться следствием лишь небольших изменений в «кожной микроэкологии» [5]. Собственная микрофлора также может стать патогенной, снижая защитную функцию кожного барьера. Это, в свою очередь, определяет важность накопления знаний о качественном и количественном составе микрофлоры здоровой кожи, что в будущем обеспечит появление новых и эффективных методов терапии.
Картирование кожи
До недавнего времени знания о кожной микрофлоре могли быть получены только в результате искусственного культивирования микроорганизмов, несмотря на то, что не более 1% таких бактерий вообще поддаются культивированию. Однако применение современных молекулярно-биологических методов существенно расширило возможности исследователей. Гены малой субъединицы рибосомы (16S рРНК) имеются у всех прокариотических клеток, и при этом содержат видоспецифичные вариабельные участки. Использовании техники ПЦР (полимеразой цепной реакции) позволяет амплифицировать такие гены в пробирке и получать информацию о видовом составе исследуемой микробной популяции. Подобная методика недавно позволила получить важную информацию о высокой гетерогенности микрофлоры, собранной из мазков в области запястья [5]. В данном исследовании также было показано, что видовой состав микрофлоры не является постоянным для каждого из волонтеров и может быстро изменяться в течение короткого промежутка времени. Однако используя только образцы с поверхности кожи, невозможно детально изучить распределение микроорганизмов в её более глубоких слоях. Поэтому необходимо применять дополнительные проникающие методики и анализировать соскрёбы и материалы инвазивной биопсии (рис. 1), которая, впрочем, имеет ограничения, поскольку такой метод может оставлять кожные дефекты, и поэтому применим только на малозаметных участках кожи испытуемых добровольцев. В целом, использование подобного комплексного подхода, сочетающего медицинские и молекулярно-биологические подходы, позволяет проводить картирование кожной микрофлоры не только на различных участках поверхности эпидермиса, но и в глубине нижележащих слоев.

Рисунок 1. Многообразие бактерий на разной глубине кожи. Слева: На срезе кожи показаны области, из которых получают образцы микрофлоры для генетического анализа: 1 — мазок с поверхности, 2 — соскрёб верхнего слоя эпидермиса, 3 — инвазивная биопсия. Справа: Диаграмма Венна, иллюстрирующая видовые перекрывания популяций бактерий, полученных из образцов разных типов. Видно, что из 113 видов, общими для всех областей являются 36. Это соответствует 97.2% от всей полученной бактериальной ДНК.
Триллионы соседей
Согласно современным исследованиям, микроорганизмы, обитающие в коже и других тканях тела, превосходят по численности клетки человеческого организма в десятки раз. Они образуют динамически развивающиеся сообщества, которые способны регулировать наше развитие, сопротивление инфекциям и усвоение питательных веществ. По словам исследовательницы многообразия микробной микрофлоры Джулии Сегрэ (Julie Segre) из Национального института геномных исследований в Мэриленде: «Люди представляют из себя амальгаму из человеческого и бактериальных геномов» [6]. Безусловно, необходимо познакомиться со своими соседями поближе. Понимая всю важность этого, Национальный институт здоровья США запустил в прошлом году Проект Человеческого Микробиома (Human Microbiome Project) с объемом финансирования более $100 млн., выделив его в приоритетное направление научных исследований. В рамках этого проекта планируется провести секвенирование геномов более 600 видов бактерий — симбионтов человека. Это будет составлять 99% известных бактерий, не поддающихся культивированию, однако в изобилии населяющих кожу, нос, кишечник, ротовую полость и влагалище. Очевидно, наибольший интерес представляет именно «здоровая» микрофлора.
Картирование микробных популяций внутри и на поверхности кожи, численность которых в норме достигает триллионов, является одной из наиболее важных задач, поскольку до сих пор люди знали об этом крайне мало. Первые шаги в этом направлении позволили получить весьма интересные результаты. Оказывается, бактерии заселяют кожу крайне неоднородно — есть области, которые выглядят настоящими микробными пустынями (между пальцев ног) по сравнению, например, с носовой полостью или пупком [6]. Было обнаружено, что ряд бактерий, для которых обычной средой обитания считалась почва, с удовольствием обитают и в здоровой коже, сосуществуя в гармонии с людьми [4]. В этой работе исследовали участки кожи пяти здоровых добровольцев в области локтевой ямки правой и левой рук. Этот участок кожи был выбран не случайно, как это может показаться сначала: у людей, страдающих экземой, часто именно в этой области развиваются симптомы. Была использована описанная выше комплексная методика, которая позволяет изучать распространение бактерий вдоль всей толщины кожи. Из полученных образцов исследователи выделили более 5300 генов малой субъединицы рибосомы (16S рРНК), относящихся к 113 различным видам бактерий (рис. 1). Годом ранее сходное многообразие было найдено и при исследовании участков запястья [5]. Однако по численности популяции среди 113 лидируют всего десять видов бактерий, на которые приходится 90% полученной генетической информации. Например, более 60% всей выделенной ДНК составляют рибосомальные гены рода Pseudomonas. Это грамотрицательные бактерии, обитающие в почве, воде и разлагающихся органических остатках. Следующими по распространённости (20% генов) являются бактерии из рода Janthinobacterium — представители почвенных и водных грамотрицательных бактерий. Ранее эти микроорганизмы не относили к кожным симбионтам. Несмотря на некоторые индивидуальные отличия, обнаруженные у добровольцев, в целом для их локтевых образцов характерен близкий бактериальный отпечаток. Также интересно, что плотность бактерий во внутренних слоях кожи составила 1 млн. на квадратный сантиметр, по сравнению с 10000 — по данным с соскрёбов. Ранее предполагалось, что внутри кожи бактерий окажется гораздо меньше.
О мышах и людях
Изучение структуры кожной микрофлоры у человека и животных позволяет сделать важное открытие, что симбиоз между организмом и бактериями развивался в течение длительного периода эволюции, и является прямым следствием адаптации к окружающей среде. Так, было показано, что видовой состав бактерий, полученный из кожных образцов мышей в области уха, во многом напоминает кожную микрофлору локтевой ямки человека (рис. 2) [5]. Это говорит в пользу того, что бактерии не случайным образом расселяются на коже, и только определенные их виды смогли выработать «добрососедские» отношения со своими хозяевами, не подвергаясь агрессивному воздействию их иммунной системы. Кроме того, подобное открытие позволяет создать новые стратегии в изучении различных кожных заболеваний человека с использованием мышиных моделей. Например, существует специальная линия мышей (St14hypo/−), у которых отсутствует филаггрин — белок, играющий ключевую роль в формировании корнифицированного эпителия и образовании эпидермального барьера, защищающего организм от действия различных патогенов. Для них было показано, что симптомы, сходные с атопическим дерматитом, могут быть вызваны определёнными изменениями в структуре кожной микрофлоры. Отсутствие филаггрина у человека также часто ведет к развитию умеренной или выраженной формы заболевания [7]. Таким образом, и у мышей, и у человека за развитие кожных патологий могут быть ответственны сходные генетические механизмы в совокупности с влиянием кожной микрофлоры.
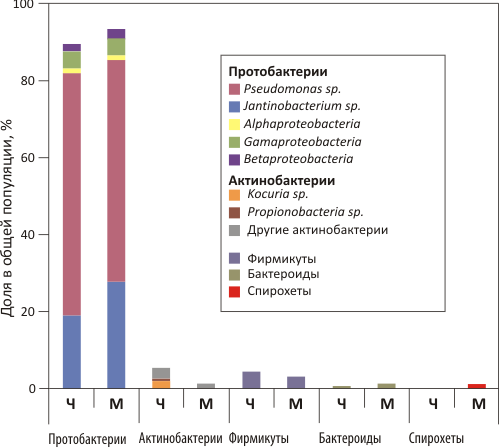
Рисунок 2. Доля разных бактерий в общей популяции, полученной из образцов биопсии человека (Ч, локтевая ямка) и мыши (М, ухо). Выделенные гены 16S рРНК были сгруппированы по таксономическим классам. Доминирующие рода в каждом классе подписаны.
Йогурт для кожи
Новые исследования порождают и массу новых вопросов. Какую физиологическую функцию выполняет кожная микрофлора и как она влияет на функционирование кожи? Закодирована ли структура микробной популяции в геноме хозяина? Каким образом лекарственные препараты, одежда, пол, возраст, окружающая среда, а также бесчисленное множество других факторов влияют на кожную микрофлору? Учёным ещё только предстоит ответить на эти вопросы. Тем не менее, представители косметической индустрии уже увидели для себя новую сферу приложения интересов. Действительно, если нарушен микробный баланс, то почему бы не восстановить его, подселив на кожу «правильные» бактерии? Пробиотики активно применяются для восстановления микрофлоры кишечника и влагалища [8]. Появляются и косметические препараты, в которых эксплуатируется идея пробиотиков, действующих на кожу. Например, капсулы Innéov Solaire (Nestle), которые повышают защиту кожи от солнечных лучей. Однако создание косметических средств, действительно способных влиять на качество кожной микрофлоры — задача, требующая ещё многочисленных исследований. Возможно, их результатом в будущем станет появление новых чудо-йогуртов, которые сделают нашу кожу по-настоящему красивой и здоровой.
Первоначально статья была опубликована в журнале «Косметика и медицина».
Литература
- Giuseppe Caramia, Alessandra Atzei, Vassilios Fanos. (2008). Probiotics and the skin. Clinics in Dermatology. 26, 4-11;
- Joan Webster, Sonya Osborne. (2007) Preoperative bathing or showering with skin antiseptics to prevent surgical site infection;
- Полянский А. (2008). Антимикробные пептиды: альтернатива консервантам и антибиотикам? «Косметика и медицина». 1, 16–21;
- E. A. Grice, H. H. Kong, G. Renaud, A. C. Young, G. G. Bouffard, et. al.. (2008). A diversity profile of the human skin microbiota. Genome Research. 18, 1043-1050;
- Z. Gao, C.-h. Tseng, Z. Pei, M. J. Blaser. (2007). Molecular analysis of human forearm superficial skin bacterial biota. Proceedings of the National Academy of Sciences. 104, 2927-2932;
- C. Ash, J. Foley, E. Pennisi. (2008). Lost in Microbial Space. Science. 320, 1027-1027;
- Aileen Sandilands, Ana Terron-Kwiatkowski, Peter R Hull, Gráinne M O'Regan, Timothy H Clayton, et. al.. (2007). Comprehensive analysis of the gene encoding filaggrin uncovers prevalent and rare mutations in ichthyosis vulgaris and atopic eczema. Nat Genet. 39, 650-654;
- GV Zuccotti, F Meneghin, C Raimondi, D Dilillo, C Agostoni, et. al.. (2008). Probiotics in Clinical Practice: An Overview. J Int Med Res. 36, 1A-53A.






