
Генетика псориаза: иммунитет, барьерная функция кожи и GWAS
22 января 2017
Генетика псориаза: иммунитет, барьерная функция кожи и GWAS
- 17909
- 1
- 10
Нежнее нежного
Лицо твоё,
Белее белого
Твоя рука,
От мира целого
Ты далека,
И все твоё —
От неизбежного.
О. Мандельштам
-
Автор
-
Редакторы
-
Рецензенты
Со времени открытия ДНК редкое описание заболевания обходится без хоть какой-нибудь ссылки на генетику — хотя бы в виде изучения истории заболевания у родственников. Псориаз не стал исключением. В этой части мы познакомимся с фармакогенетикой и сигнальными путями, связанными с развитием псориаза. Кроме того, мы узнаем, сколько подтипов псориаза насчитали ученые, и разберемся, почему исследования по полногеномному поиску ассоциаций рассказывают только полуправду.
Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
В предыдущих статьях цикла мы уже познакомились с тем, что такое псориаз вообще и каков его патогенез. Теперь настало время генетики. Псориаз — это очень гетерогенное заболевание с точки зрения генетика. Оно часто передается по наследству: наследуемость, по данным эпидемиологических исследований, оценивается в 60–90%. Семь из 10 пациентов, у которых псориаз диагностировали в детстве, могут «похвастаться» семейной историей этой болезни. Если один из близнецов болеет псориазом, то для второго риски достигают 73%, если речь идет о монозиготной паре, и 12–20% в случае дизиготной [1], [2].
Распространенность псориаза варьирует в разных популяциях, и ученые выделяют несколько клинических подтипов болезни в зависимости от возраста человека в момент начала ее развития. Все вышеперечисленные особенности псориаза можно разгадать, пристальнее взглянув на ДНК носителя заболевания. Несмотря на то, что нет определенной мутации, которая обязательно «приговорит» человека к появлению псориаза, существует множество вариантов генов, которые увеличивают риски его развития.
Статистическая сила GWAS
Из-за относительно высокой наследуемости псориаза по всему миру было проведено немало генетических исследований, в которых искали гены, влияющие на риск развития заболевания. GWAS помогают внести хоть какую-то ясность в запутанный патогенез псориаза, поскольку их результаты позволяют выявить «основных подозреваемых» — гены, изменения в которых чаще встречаются у больных, а значит, связаны с развитием этой патологии.
В первой статье цикла уже упоминались PSORS (psoriasis susceptibility loci) — участки, ассоциированные с риском развития псориаза [5]. В целом GWAS выявили около 50 участков предрасположенности к псориазу [6]. Хотя каждая такая область охватывает несколько генов, исследователи выделили в пределах каждого локуса и отдельные гены, которые считают наиболее правдоподобными «виновниками» заболевания с биологической точки зрения — с учетом функции кодируемых ими белков [1]. Вклад генов, обнаруженных GWAS, в наследуемость болезни составляет для европейцев менее 25% [7] — правда, это может быть связано с тем, что с помощью GWAS трудно «засечь» редкие варианты генов, ассоциированных с риском псориаза.
Однако генетические факторы риска — это вовсе не приговор. Если у человека есть вариант гена, ассоциированный с риском псориаза, это отнюдь не значит, что заболевание у него разовьется. Например, у большинства носителей аллеля HLA-Cw6 — самого «мощного» фактора предрасположенности — псориаза таки нет [3].
Теперь стόит, наконец, посмотреть, какие же гены влияют на псориаз. За основу псориаза всё чаще принимают нарушение взаимодействия между иммунными клетками и резидентными клетками кожи (рис. 2) [8]. При этом аллели, выявленные как «факторы риска», могут быть активны только в одном типе клеток — например, в клетках кожи или в каком-то типе иммунных клеток, — а могут функционировать и в разных типах клеток. Таким образом, чтобы разобраться в том, что такое псориаз с генетической точки зрения, нужно вместе сложить как минимум три части пазла: врожденный иммунитет, приобретенный иммунитет и барьерную функцию кожи [1]. Иллюстрацией врожденного иммунитета послужит путь сигналинга NF-kB; примером адаптивного станут гены, вовлеченные в процесс презентации антигена; и наконец разговор зайдет о генах, чьи продукты важны для поддержания барьерной функции кожи.
Конечно, «частей пазла» гораздо больше, и GWAS выявил множество локусов предрасположенности к псориазу, связанных с другими молекулярными каскадами. Однако эти три темы — самые главные.
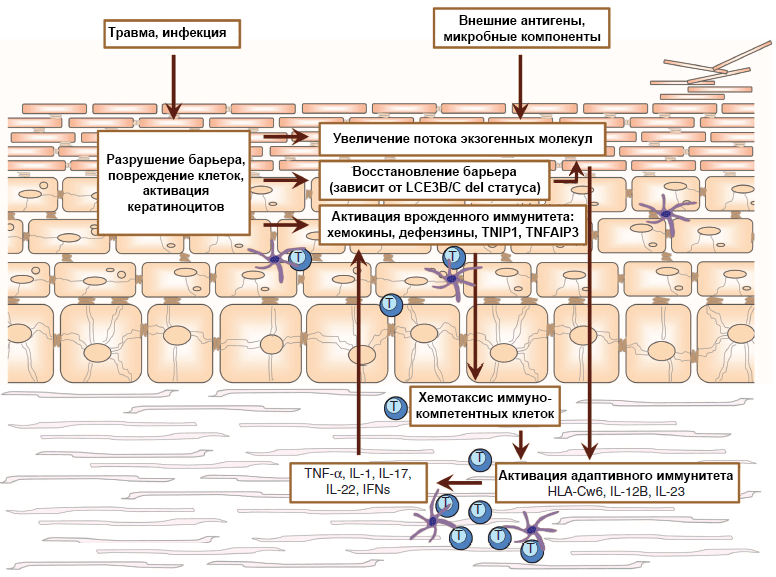
Рисунок 2. Модель псориаза. Полиморфизм генов, вовлеченных в поддержание барьерной функции кожи и иммунной защиты, определяет результат действия окружающей среды. Сколько антигенов проникнет в организм, возникнет ли воспаление вследствие повреждения или активации кератиноцитов и будут ли привлечены в этот участок иммунокомпетентные клетки, часто зависит от генотипа. В итоге под воздействием незнакомых внешних антигенов или аутоантигенов, похожих на чужеродные молекулы, у некоторых людей могут активироваться каскады адаптивного иммунитета. Развивается иммунный ответ, Th1- и Th17-клетки (Т-хелперы) секретируют цитокины, что влечет за собой активацию кератиноцитов. Так процесс зацикливается, и воспаление становится хроническим.
[15], рисунок адаптирован
Врожденный иммунитет: сигнальный путь NF-kВ
В развитии псориаза важную роль играет врожденный иммунитет. Так, с помощью данных GWAS, для европейской популяции были определены гены в сигнальных каскадах врожденного иммунитета, связанные с патогенезом псориаза. Многие из них уже знакомы читателю по статье «Патогенез псориаза: Т-хелперы, цитокины и молекулярные шрамы»: гены каскада NF-kB (например, REL, TNIP1, NFKBIA и CARD14), участники путей регуляции Т-клеток (например, RUNX3, IL13, TAGAP, ETS1 и MBD2) и противовирусного сигналинга (например, IFIH1, DDX58 и RNF114) [9]. Работа этих генов разобрана на картинках ниже.
Как же на развитие этой болезни могут влиять гены, кодирующие различные молекулы из сигнального каскада NF-kВ, который мы выбрали в качестве примера? Путь NF-kB в основном регулирует клеточный ответ на стресс, например, на инфекции [10]. Также он играет важную роль в воспалении и апоптозе. Неоднократно было показано, что этот сигнальный путь активирован в коже, пораженной псориазом. NF-kВ — это ключевой фактор транскрипции в иммунных реакциях (во всех типах клеток, не только в иммунных). Он находится в цитоплазме клетки в комплексе со своим ингибитором IkB. Многие клеточные рецепторы иммунной сигнализации вызывают активацию сигнального каскада NF-kВ. После связывания активирующего лиганда с поверхностным рецептором происходит опосредованная адапторными белками передача активирующего сигнала в клетку, ингибитор IkB фосфорилируется IkB-киназой (IKK) и следует на деградацию, а освобожденный NF-kВ направляется в ядро, где и индуцирует экспрессию генов, связанных с воспалением [6].
Сам по себе NF-kВ — димер, в состав которого могут входить разные субъединицы: p50, p52, RelA(p65), Rel-B, c-Rel. Ген c-Rel находится в локусе предрасположенности к псориазу. Вдобавок c-Rel может непосредственно регулировать рост кератиноцитов и прохождение ими клеточного цикла.
Одним из важных адапторных белков, регулирующих активацию NF-kB, является белок CARD14 из семейства CARD. Исследования показали роль белков этого семейства в развитии псориаза, а также других воспалительных заболеваний. Из всех белков семейства (CARD6,8,9,10,11,14) именно CARD14 наиболее важен для развития псориаза (рис. 3) и, пожалуй, наименее изучен. Ученые обнаружили, что его ген входит в один из локусов предрасположенности к псориазу, PSORS2, а белок синтезируется в кератиноцитах и эндотелиальных клетках. Мутации в CARD14, ведущие к появлению заболевания, активируют сигналинг NF-kB и производство некоторых воспалительных цитокинов и хемокинов в обоих типах клеток [6]. На этом мы не прощаемся с CARD14 — он еще пригодится нам в разговоре про подтипы псориаза.

Рисунок 3. Сигнальный путь с участием CARD14 в некоторых типах псориаза — например, генерализованном постулярном (о нём рассказано ниже, в тексте). Мутации в гене CARD14 приводят к активации сигналинга NF-kB в кератиноцитах, а это индуцирует секрецию хемокинов, в том числе IL-36G, IL-8 и CCL20. В результате к месту воспаления привлекаются воспалительные клетки, и развивается заболевание. Условные обозначения: DC — дендритные клетки, KC — кератиноциты, Neutro — нейтрофилы, Th17 — Т-хелперы 17.
Адаптивный иммунитет: презентация антигена
Хотя нарушения в генах врожденного иммунитета увеличивают риск возникновения псориаза, гены адаптивного иммунитета тоже вносят свою лепту в развитие заболевания. Согласно генетическим исследованиям, локус, играющий самую важную роль в предрасположенности к псориазу у населения Европы и Китая, — это HLA-Cw6. Он входит в PSORS1 и, в зависимости от изучаемой популяции, встречается у каждого пятого, а то и каждого второго пациента с псориазом. HLA-Cw6 — это один из аллелей гена рецептора HLA-C, относящегося к главному комплексу гистосовместимости I (MHCI). Белки MHCI располагаются на ядросодержащих клетках и являются ключевыми молекулами иммунного надзора. Они представляют внутриклеточные пептиды цитотоксическим Т-клеткам иммунной системы (рис. 4). Если антиген оказывается чужеродным, то следует немедленная реакция: иммунные клетки избирательно убивают только эти поврежденные или зараженные клетки.
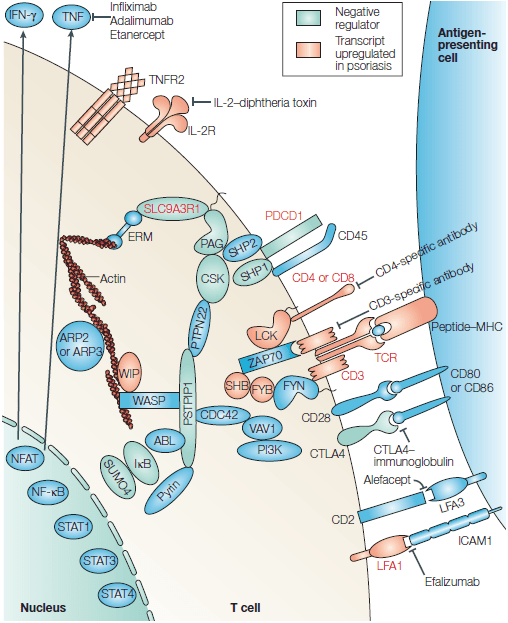
Рисунок 4. Схема взаимодействия Т-клетки с антигенпредставляющей клеткой. Выделены белки, ассоциированные с аутоиммунитетом и псориазом. После формирования иммунологического синапса между Т-клеткой и антигенпредставляющей клеткой происходит активация Т-клетки, которая находится под контролем сложной сети положительных и отрицательных (окрашены зеленым цветом) регуляторов. Красным отмечены белки с повышенной экспрессией в псориатических бляшках. Среди них — Т-клеточный рецептор (TCR), δ-цепь CD3, CD4, CD8, α-цепь рецептора IL-2 (IL-2Rα, CD25), LFA1 (lymphocyte function-associated antigen 1), LCK, SHB (SRC homology 2 (SH2)-domain-containing transforming protein B), FYB (FYN-binding protein) и WIP (Wiskott-Aldrich syndrome (WASP) interacting protein).
Некоторые из отрицательных регуляторов активации Т-клеток связаны с аутоиммунным ответом у человека: CTLA4 (cytotoxic T-lymphocyte antigen 4), PDCD1 (programmed cell death 1), SLC9A3R1 (solute-carrier family 9, isoform 3, regulator 1), PSTPIP1 (proline-serine-threonine phosphatase-interacting protein 1) и SUMO4 (small ubiquitin-like modifier 4 protein).
Кроме того, в животных моделях псориаза и аутоиммунных заболеваний были обнаружены отрицательные регуляторы активации Т-клеток: CTLA4, PDCD1, SHP1 (SH2-domain-containing protein tyrosine phosphatase 1), IkB, PAG (phosphoprotein associated with glycolipid-enriched membrane domains) и CSK (carboxy-terminal SRC kinase). Транскрипционные факторы RUNX1 (runt-related transcription factor 1) и RUNX3 участвуют в регуляции транскрипции нескольких из активируемых белков (TCR, CD3, CD4, CD8 и LFA1) и негативных регуляторов (PDCD1 и SLC9A3R1), что обозначено на рисунке красным текстом.
Другие молекулы, связанные с аутоиммунными или воспалительными заболеваниями у человека, — это ICAM1 (intercellular adhesion molecule 1), CD45, PTPN22 (protein tyrosine phosphatase non-receptor type 22), WASP и пирин (pyrin).
Несколько крайне важных для активации Т-клеток молекул оказались эффективными мишенями для терапии псориаза у человека. ARP (actin-related protein), CDC42 (cell-division cycle 42), ERM (ezrin, radixin и moesin), IFN-γ (интерферон-γ), NFAT (nuclear factor of activated T cells), PI3K (phosphatidylinositol 3-kinase), STAT (signal transducer and activator of transcription), TNF (tumour-necrosis factor), TNFR2 (TNF receptor 2), ZAP70 (ζ-chain-associated protein kinase of 70 kDa).
Ученые связали с предрасположенностью к псориазу и полиморфизмы гена ERAP1 [6]. Он кодирует аминопептидазу 1 эндоплазматического ретикулума, тоже вовлеченную в процесс презентации пептидов на MHCI.
Была выявлена важная роль оси IL23—Th17 в развитии псориаза: в частности, генов TNFAIP3, IL23R, IL12B, TRAF3IP2, IL23A и STAT3 (рис. 5). Как оказалось, Th17 в очаге воспаления выделяют цитокины IL-1, IL-17 и другие молекулы, которые воздействуют на кератиноциты, тем самым активируя их [9], [11]. Эта находка позволила разработать препараты-ингибиторы IL-23 или IL-17, которые с разной долей успеха могут применяться в клинической практике. И об одном таком препарате пойдет речь в главе про фармакогеномику.
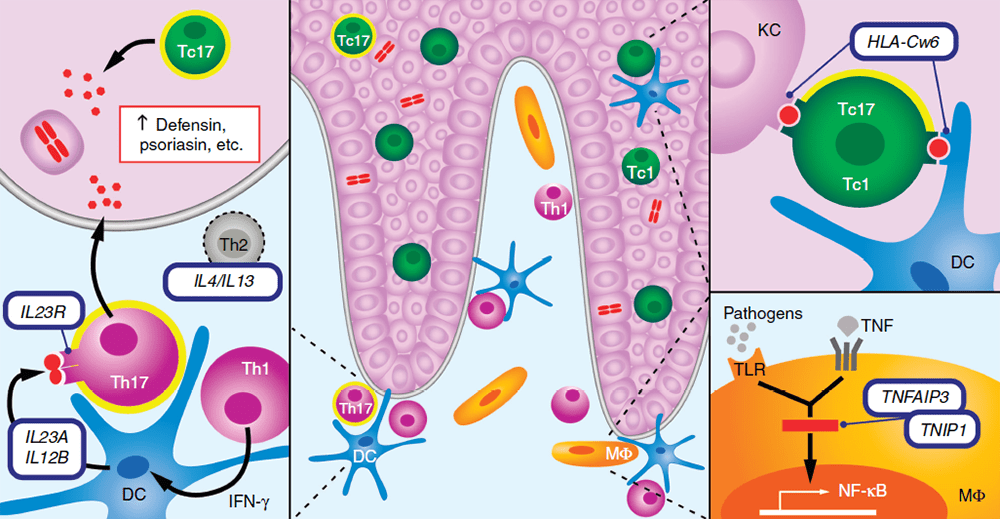
Рисунок 5. На стыке генетики и иммунологии псориаза. Дендритные клетки в дерме выполняют антигенпредставляющую функцию, активируя Т-клетки (основных бойцов адаптивного иммунитета). Производимые Т-клетками цитокины активируют кератиноциты, приводя к выделению различных защитных белков — дефензинов, псориазина и других. Если человек является носителем варианта HLA-Cw6, активация может быть избыточной. Кроме того, если у человека присутствуют варианты генов TNFAIP3, TNIP1 и другие, ассоциированные с псориазом, также может наблюдаться избыточная активация иммунных клеток: контакт с патогенами запускает избыточную работу рецепторов, которые их распознают (TLR) и активируют регуляторный белок NF-kB, что приводит к чрезмерному воспалению.
В центре: Большинство Т-клеток в дерме — хелперные CD4+ (выделены фиолетовым цветом); большинство из них — Т-хелперы 1-го типа (Th1), но некоторые секретируют и IL-17 (Th17, Т-хелперы 17-го типа, желтый ореол вокруг клетки). Большинство эпидермальных Т-клеток — Т-киллеры CD8+ (Tc1, зеленые), секретирующие IL-1, и Tc17, секретирующие IL-17 (выделены желтым ореолом).
Справа вверху: Роль аллеля HLA-Cw6 в увеличении предрасположенности к псориазу связана с процессами антигенпрезентации между дендритными клетками (DC), кератиноцитами (KC) и Т-киллерными клетками 1-го и 17-го типов.
Справа внизу: Макрофаги (МФ, оранжевый цвет) и дендритные клетки экспрессируют рецепторы к TNF и Toll-подобные рецепторы (TLR), которые запускают сигнальные каскады активации NF-kB. Белки, кодируемые генами TNFAIP3 (А20) и TNIP1 (ABIN1), способны блокировать эти сигнальные каскады.
Слева: Клетки Th1 активируют дендритные клетки, продуцируя IFN-γ. Активированные DC производят IL-23A и IL-12B — цитокины, которые связываются с рецептором IL23 (IL23R) на поверхности Th17. Полиморфизмы всех перечисленных генов могут быть связаны с повышенной предрасположенностью к псориазу. IL-17 и IL-22 регулируют врожденные механизмы иммунной защиты кератиноцитов (синтез дефензинов, псориазинов S100A7 и других белков, чья экспрессия повышена в псориатических бляшках). Кроме того, IL-22 может усиливать пролиферацию кератиноцитов и/или изменять их дифференцировку.
Генетика и барьерная функция кожи
Как уже отмечалось в предыдущих статьях, псориатические поражения отличаются от здоровой кожи на клеточном уровне. Они характеризуются измененной дифференцировкой кератиноцитов и неполноценной кератинизацией, в том числе и нарушением образования ороговевшего слоя клеток. Потеря воды через кожу у больных псориазом больше, чем у здоровых. Хотя основной молекулярный механизм этой особенности пока не ясен, считается, что здесь «виноваты» кератиноциты, которые не справляются с возложенной на них задачей по поддержанию барьерной функции.
Сами кератиноциты рогового слоя в здоровой коже погружены в липидный матрикс, который поддерживает барьерные функции кожи. Образно такую структуру сравнивают с кирпичами, скрепленными друг с другом строительным раствором. При развитии же псориаза липидный профиль меняется, количество липидов снижается, и, следовательно, барьерная функция нарушается [12], [13].
При псориазе синтез белков в роговом слое оказывается разбалансированным по сравнению со здоровой кожей. Многие гены, мутации в которых приводят к развитию псориаза, входят в комплекс генов дифференцировки эпидермиса (epidermal differentiation complex) [14]. Например, экспрессия ранних маркеров дифференцировки — инволюкрина, корнеодесмозина (CDSN), цистатина А, малых богатых пролином белков и трансглутаминазы 1 увеличивается, тогда как экспрессия поздних маркеров дифференцировки, таких как лорикрин и филаггрин, уменьшается. Из-за этого внешний ороговевший слой клеток формируется не так, как надо, что может влиять и на барьерную функцию кожи [15].
Бета-дефензины — это пептиды, обладающие широким спектром антимикробной активности и ответственные за поддержание химического барьера кожи. Обнаружено, что относительный риск псориаза увеличивается при наличии в геноме каждой дополнительной копии гена человеческого бета-дефензина 2 (hBD-2) — DEFB4 (свыше первых двух копий). Иными словами, если в геноме присутствует избыточное количество генов бета-дефензинов, вероятность развития псориаза увеличивается.
Как показали исследования геномов европейцев и китайцев, большую роль в развитии псориаза играет и группа LCE-генов (генов «позднего рогового конверта», late cornified envelope) — она тоже входит в комплекс генов дифференцировки эпидермиса (рис. 6). LCE-кластер из 18 генов кодирует белки рогового слоя эпидермиса. Особое внимание в контексте разговора о псориазе нужно обратить на гены LCE3C и LCE3B, входящие в PSORS4 [7]. Предполагается, что делеции этих генов ухудшают восстановление барьерной функции кожи после травмы [9]. Однако, как признают ученые, такие рассуждения сейчас больше похожи на спекуляцию: частота встречаемости делеций в общей популяции тоже очень высока — около 60–70%. Возможно, эти мутации возникли не на пустом месте и даже помогли с эволюционной точки зрения. Так, если после незначительной травмы кожный барьер восстановится не полностью, и через него в организм попадут антигены, они, с одной стороны, не вызовут серьезного заражения, а с другой — подстегнут работу иммунной системы [15].

Рисунок 6. Продукция белков hBD-2 и LCE2 в коже. а — Белок hBD-2 в норме не синтезируется (слева), а при псориазе синтезируется активно (справа). Масштаб — 100 мкм. б — Продукция белка LCE2 в нормальной коже. Стрелочки указывают на антитела к LCE2, меченые золотом, выявляющие ороговевшие оболочки здоровой кожи. Метод — иммуноэлектронная микроскопия, масштаб — 200 нм.
Такой разный псориаз: подтипы болезни
Исследования геномов пациентов с псориазом показали, что, скорее всего, это не одно заболевание, а несколько схожих. Такой вывод не стал большим сюрпризом. Уже давно отмечали, что у пациентов псориаз появляется в разное время: или в молодом возрасте, или после 40 лет. Соответственно, ученые разделили псориаз на подтип 1 и подтип 2, которые оказались различны и генетически. GWAS показали, что предрасположенность к подтипу 1 связана в первую очередь с локусом HLA-C. С риском развития 2-го подтипа сильнее всего коррелирует полиморфизм IL1R1. К сожалению, пока что неясно, как генетические особенности влияют на возраст проявления болезни у пациента. Для ответа на этот вопрос нужны дополнительные исследования [9].
Есть и другое деление псориаза на подтипы. Например, в 1910 году был впервые задокументирован случай генерализованного пустулезного псориаза (generalized pustular psoriasis, GPP), необычного по своим симптомам варианта этой болезни. Его обычно сопровождают системные симптомы вроде лихорадки, и он может даже угрожать жизни пациента. Проявляется GPP в любом возрасте, и спровоцировать его развитие могут инфекции, беременность, гипокальциемия, связанная с гипотиреозом, и медикаменты. Целый век причины болезни оставались неизвестными, поскольку симптомы и триггеры появления бляшек были слишком разнообразными. Только несколько лет назад установили, что все случаи этого подтипа болезни объединяет генетический «фон»: мутации в генах IL36RN и CARD14 [9], [16].
Путь к лекарству: фармакогеномика
У тех, кто впечатлился количеством участков предрасположенности к псориазу, выявленных GWAS, может возникнуть вопрос: а зачем это всё было, помимо любви к науке и воссозданию целостной картины мира (а также некоторой помощи в предсказании проявления и течения заболевания)? Ответом будет особое направление фармакологии — фармакогеномика, изучающая восприимчивость пациента к тем или иным вариантам лечения в зависимости от его генетических особенностей. Результаты генетических исследований вполне можно преобразовать в помощь людям, страдающим от псориаза: создать лекарства, нацеленные на те белки или гены, в которых были обнаружены мутации, и разобраться, почему возникают определенные побочные эффекты в ответ на лечение.
Фармакогеномика псориаза всё еще находится на «младенческой» стадии развития. Однако заявка на движение в сторону введения персонализированной медицины в клинической практике уже была сделана. Цель фармакогеномики — разделить пациентов по результатам геномного теста и подобрать терапию, специфическую для каждой выделенной группы. В идеале лечение для каждого человека с псориазом вообще окажется персонализированным, или стратифицированным. Лекарственная терапия каждому пациенту будет подбираться на основании его уникальных характеристик, а не по среднестатистическим характеристикам всей популяции. Если говорить по-простому, то благодаря такому подходу удастся назначить правильный препарат для «правильного» пациента в правильной дозе и в нужное время [4], [17].
Голубой мечтой пока остается прогностическое использование генетического теста у каждого пациента ab initio. В идеале по его результатам можно было бы предсказать заранее, какой препарат окажется эффективнее и каких потенциальных осложнений от лекарств ожидать. Кроме того, это ускорило бы лечение и снизило бы его стоимость. Именно такую стратегию считают наиболее перспективной сами ученые [18]. Но для ее реализации необходима коммуникация не только внутри научного сообщества. В Великобритании, например, уже 20 лет проходят международные конференции под слоганом «Псориаз: От гена к клинике» (Psoriasis: From Gene to Clinic), где ведущие клиницисты, ученые, представители фармацевтической и биотехнологической промышленностей обсуждают последние генетические новости и их применение во врачебной практике [19].
Хотя до полностью персонализированной медицины еще далеко (как в случае с псориазом, так и относительно других заболеваний), GWAS всё же принеcли свои плоды.
Одно из крупнейших и наиболее полных фармакогенетических исследований в области псориаза посвящено изучению эффективности лечения метотрексатом (methotrexate). Это цитостатический препарат, оказывающий иммуносупрессивное действие на организм. С ответом на метотрексат оказались связаны три SNP в гене ABCC1 и два в гене ABCG2. Однако не было обнаружено строгой взаимосвязи между клиническим исходом лечения и полиморфизмами четырех других генов, которые кодируют ферменты внутриклеточного метаболизма этого препарата. Кроме того, были определены и несколько генов, чьи аллели могут быть ассоциированы с токсичностью препарата или плохим клиническим ответом на него.
Другой препарат, привлекший внимание ученых-генетиков, — ацитретин (acitretin), синтетический ретиноид. У него множество побочных эффектов, в том числе гиперлипидемия и тератогенность, поэтому он используется как препарат второй линии лечения тяжелых форм псориаза. Предсказать ответ пациентов на этот препарат, как оказалось, можно с помощью анализа полиморфизмов генов аполипопротеина Е (APOE) и фактора роста эндотелия сосудов (VEGF).
Еще один интересный препарат — устекинумаб (ustekinumab), моноклональное антитело, нацеленное на общую субъединицу интерлейкинов IL-12 и IL-23 — p40. Установили, что синтез субъединицы р40 увеличивается при развитии псориаза. Препарат ингибирует воспалительные сигнальные пути с участием IL-12/23 (рис. 7) [20], которые играют немаловажную роль в патогенезе хронического воспаления эпителия и о которых «биомолекула» уже рассказывала во второй статье цикла [21]. Роль IL-12 трудно переоценить, ведь с помощью его секреции дендритные клетки могут «направить» наивные Т-клетки на путь Th1. IL-23 в предполагаемых схемах патогенеза псориаза долгое время не фигурировал. До тех пор, пока не обнаружилось, что этот цитокин связан с новым типом Т-клеток — Th17. Сейчас уже ясно, что иммуногенетическая связь IL-23 и развития псориаза довольно сильна, и идентифицированы полиморфизмы, ответственные за это.
Было проведено несколько исследований того, как меняется экспрессия генов после одной инъекции ингибитора IL-12/23, устекинумаба. По экспрессии, как считают ученые, можно предсказать, пройдет ли лечение данного пациента успешно или он не ответит на препарат [7].

Рисунок 7. Ось генов IL-23, связанная с псориазом. IL-12 и IL-23 похожи: у них есть одинаковая субъединица р40 и одинаковая цепь в их гетеродимерном рецепторе IL-12RB1. Оба цитокина передают сигнал через каскад JAK-STAT. На этом их сходства заканчиваются. Помимо множества структурных различий, передача сигнала через каждый из них ведет к активации разных молекул.
На рисунке молекула, выделенная полужирным шрифтом с подчеркиванием, — это белок, чьи гены ассоциированы с псориазом. Псориаз изначально считался Th1-опосредованной болезнью, и поэтому влияние оси IL-12 должно было быть главным. С накоплением новых данных стало ясно, что ось IL-23 и ответ через Th17-клетки важнее. Многие части оси IL-23 генетически ассоциированы с псориазом, в том числе сам IL-23, его рецептор и дальнейший путь передачи сигнала.
Где же истина, или почему результаты разных GWAS часто противоречат друг другу
Окончательные выводы по генетической основе псориаза делать еще рано — несмотря на то, что с помощью GWAS было найдено множество генов, ассоциированных с этой болезнью. На самом деле в результатах многих GWAS есть противоречия и ограничения, наложенные и предметом исследования, и методами исследования.
В первую очередь, псориаз — это очень сложное, комплексное заболевание, характеризующееся значительной фенотипической гетерогенностью. В его развитии принимает участие множество взаимовлияющих генетических и негенетических факторов. Ожидать, что прочтение ДНК сразу покроет все белые пятна в изучении псориаза, было бы неразумно.
Немало вопросов возникает и по отношению к дизайнам самих работ. К примеру, большинство работ ретроспективны, то есть в них анализируются результаты предыдущих исследований и собранный другими авторами исходный материал. Кроме того, количество пациентов-участников во многих публикациях довольно мало. Используются и разные критерии успешности лечения. Наконец, иногда в одном исследовании смешивают представителей разных этнических групп или пациентов, принимавших разные лекарства, — конечно, это тоже влияет на результат генетического анализа [71]. Будем надеяться, что в ближайшее время появятся крупномасштабные исследования, проведенные в однородных популяциях.
Однако есть и еще одно объяснение того, почему анализ первичного генетического материала не дает всех ответов, — это эпигенетика. Именно в ней причина того, что из двух монозиготных близнецов (обладающих одинаковыми генотипами) псориаз иногда возникает только у одного. Из-за внешних воздействий экспрессия генов может меняться, и инструментов такой регуляции множество: метилирование ДНК, химические модификации гистонов, микроРНК... Среди эпигенетических факторов, ответственных за патогенез и/или прогрессирование псориаза, называют условия окружающей среды, воздействие различных инфекционных агентов (особенно стрептококков группы А), психологический стресс, курение, ожирение, чрезмерное употребление алкоголя, применение ряда лекарств, включая нестероидные противовоспалительные средства и иммуномодуляторы, и многое другое [8], [11], [22]. Захватывающие детали влияния эпигенетики на развитие псориаза ждут вас уже в следующей статье цикла!
Литература
- Mahil S.K., Capon F., Barker J.N. (2015). Genetics of psoriasis. Dermatol. Clin. 33, 1–11;
- Villarreal-Martínez A., Gallardo-Blanco H., Cerda-Flores R., Torres-Muñoz I., Gómez-Flores M., Salas-Alanís J. et al. (2016). Candidate gene polymorphisms and risk of psoriasis: A pilot study. Exp. Ther. Med. 11, 1217–1222;
- Elder J.T., Bruce A.T., Gudjonsson J.E., Johnston A., Stuart P.E., Tejasvi T. et al. (2010). Molecular dissection of psoriasis: integrating genetics and biology. J. Invest. Dermatol. 130, 1213–1226;
- Foulkes A.C. and Warren R.B. (2015). Pharmacogenomics and the resulting impact on psoriasis therapies. Dermatol. Clin. 33, 149–160;
- Псориаз: на войне с собственной кожей;
- Harden J.L., Krueger J.G., Bowcock A.M. (2015). The immunogenetics of psoriasis: a comprehensive review. J. Autoimmun. 64, 66–73;
- O’Rielly D.D. and Rahman P. (2015). Genetic, epigenetic and pharmacogenetic aspects of psoriasis and psoriatic arthritis. Rheum. Dis. Clin. North. Am. 41, 623–642;
- Pivarcsi A., Ståhle M., Sonkoly E. (2014). Genetic polymorphisms altering microRNA activity in psoriasis—a key to solve the puzzle of missing heritability? Exp. Dermatol. 23, 620–624;
- Ray-Jones H., Eyre S., Barton A., Warren R.B. (2016). One SNP at a time: moving beyond GWAS in psoriasis. J. Invest. Dermatol. 136, 567–573;
- Eder L., Chandran V., Gladman D.D. (2015). What have we learned about genetic susceptibility in psoriasis and psoriatic arthritis? Curr. Opin. Rheumatol. 27, 91–98;
- Chandra A., Ray A., Senapati S., Chatterjee R. (2015). Genetic and epigenetic basis of psoriasis pathogenesis. Mol. Immunol. 64, 313–323;
- van Smeden J., Janssens M., Gooris G.S., Bouwstra J.A. (2014). The important role of stratum corneum lipids for the cutaneous barrier function. Biochim. Biophys. Acta. 1841, 295–313;
- Sahle F.F., Gebre-Mariam T., Dobner B., Wohlrab J., Neubert R.H. (2015). Skin diseases associated with the depletion of stratum corneum lipids and stratum corneum lipid substitution therapy. Skin Pharmacol. Physiol. 28, 42–55;
- Kypriotou M., Huber M., Hohl D. (2012). The human epidermal differentiation complex: cornified envelope precursors, S100 proteins and the ’fused genes’ family. Exp. Dermatol. 21, 643–649;
- Bergboer J.G., Zeeuwen P.L., Schalkwijk J. (2012). Genetics of psoriasis: evidence for epistatic interaction between skin barrier abnormalities and immune deviation. J. Invest. Dermatol. 132, 2320–2331;
- Sugiura K. (2014). The genetic background of generalized pustular psoriasis: IL36RN mutations and CARD14 gain-of-function variants. J. Dermatol. Sci. 74, 187–192;
- Sutherland A., Power R.J., Rahman P., O’Rielly D.D. (2016). Pharmacogenetics and pharmacogenomics in psoriasis treatment: current challenges and future prospects. Expert. Opin. Drug Metab. Toxicol. 12, 923–935;
- Menter M.A. and Griffiths C.E. (2015). Psoriasis: the future. Dermatol. Clin. 33, 161–166;
- Psoriasis: from gene to clinic congress report. (2015). J. Clin. Aesthet. Dermatol. Supplement 1. 7, 17–25;
- Teng M.W., Bowman E.P., McElwee J.J., Smyth M.J., Casanova J.L., Cooper A.M., Cua D.J. (2015). IL-12 and IL-23 cytokines: from discovery to targeted therapies for immune-mediated inflammatory diseases. Nat. Med. 21, 719–729;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Hawkes J.E., Nguyen G.H., Fujita M., Florell S.R., Callis Duffin K., Krueger G.G., O’Connell R.M. (2016). microRNAs in psoriasis. J. Invest. Dermatol. 136, 365–371;
- Bowcock A.M. and Krueger J.G. (2005). Getting under the skin: the immunogenetics of psoriasis. Nat. Rev. Immunol. 5, 699–711.







