
Мутагенная цепная реакция: редактирование геномов на грани фантастики
24 апреля 2015
Мутагенная цепная реакция: редактирование геномов на грани фантастики
- 6388
- 0
- 9
-
Автор
-
Редактор
Надежда на успешное применение системы CRISPR/Cas9 для решения проблем точного редактирования генома оказалась небезосновательной. Найденные у бактерий и архей в 1987 году непонятно для чего предназначенные кластеры повторов (CRISPR) недаром привлекли внимание исследователей: через 20 лет, изучая бактериальные штаммы для изготовления разного рода заквасок, ученые показали, что система CRISPR/Cas9 защищает бактерий от вирусов. И стали успешно применять ее для своих целей — редактирования геномов всех типов живых организмов. Эта штука была так удобна, проста в применении и эффективна, что не переставала радовать исследователей. И вот опять.
На этот раз всё очень серьезно. Искусственно созданную систему, которая может прицельно вносить изменения в участки генома, научили размножаться. Теперь из гетерозиготных мутантов могут получаться гомозиготные, то есть содержащие эту мутацию в обеих аллелях данного гена. Но самое главное — потомство таких организмов будет почти со 100-процентной вероятностью содержать такую же мутацию. Получается, что исследователи научились вносить изменения в геномы целых популяций! Как же это произошло и как работает?
У бактерий между повторами в CRISPR-кассетах содержатся спейсеры — уникальные участки ДНК, вырезанные когда-то из вторгнувшихся в клетку бактериофагов или плазмид и служащие одновременно «фотороботами» и проводниками CRISPR-ассоциированных (Cas-) белков для оперативного обезвреживания идентичных взломщиков*. При вторжении CRISPR-кассета экспрессируется, длинный транскрипт нарезается на короткие фрагменты (crРНК). Комплементарные соответствующим фрагментам нуклеиновых кислот преступника (протоспейсерам) crРНК «указывают» своим Cas-нуклеазам, кого надо резать. В одной из бактериальных CRISPR/Cas-систем уничтожителем чужеродной ДНК служит белок Cas9 [1].
* — Работа CRISPR/Cas-систем, рекрутированных биологами в качестве инструментов геномной инженерии, напоминает эукариотическую РНК-интерференцию и обеспечивает прокариотам этакий приобретенный иммунитет, о чём подробно рассказано в обзоре «CRISPR-системы: иммунизация прокариот» [2]. — Ред.
Удобство использования стрептококковой системы CRISPR/Cas9 в эукариотических организмах заключается в том, что нужно всего два компонента: «указывающая путь» молекула РНК — РНК-гид (guideRNA, gRNA), комплементарная целевому гену, и фермент Cas9, который расщепляет этот ген (рис. 1). Гены этих двух компонентов помещаются в плазмиду и доставляются в клетку, где должны экспрессироваться. Более того, методика позволяет доставить в клетку сразу несколько РНК-гидов, комплементарных разным генам-мишеням, и фермент Cas9 разрежет их все. Как правило, для инактивации того или иного гена достаточно внесения двунитевого разрыва. Дальше клеточные ферменты сшивают два конца ДНК, однако такая «починка» (репарация) оказывается неточной. Между «склеивающимися» концами ДНК могут ошибочно встроиться или удалиться отдельные нуклеотиды. В таком случае нарушается правильность «прочтения» транскрипта этого гена при трансляции — происходит сдвиг рамки считывания, изменяется аминокислотная последовательность, синтез белка обрывается на случайно возникающих стоп-кодонах. Такую «медвежью услугу» оказывает разновидность репарации, называемая негомологичным сшиванием концов ДНК (NHEJ, non-homologous end joining).
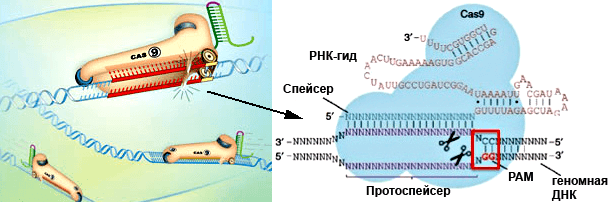
Рисунок 1. Система CRISPR/Cas9 в действии. Фермент Cas9 (изображен в виде конька) разрезает обе цепи геномной ДНК в месте, с которым связывается РНК-гид. РНК-гид (примерно 80 нуклеотидов) состоит из 5’-концевой последовательности (спейсер, 20 нуклеотидов), комплементарной нужному участку ДНК, и «шпильки» (за коньком) для правильной ориентации комплекса. Дизайн РНК-гида должен учитывать один момент, связанный с выбором комплементарной цели. «Целевой» участок геномной ДНК, который будет разрезаться, может быть любым, но за ним должны следовать два цитозиновых нуклеотида, т.к. считается, что РНК-гид лучше связывается с ДНК там, где комплементарная цепь этой ДНК содержит консенсус 5’-NGG-3′ — прилегающий к протоспейсеру мотив, protospacer adjacent motif, PAM. Рисунки из журнала The Scientist и с сайта www.genoway.com.
Система негомологичного сшивания концов ДНК.
С помощью CRISPR/Cas9 можно не только нокаутировать ген, но и вставить любой новый участок ДНК вместо старого (например, заменить мутантный на нормальный). Для этого вместе с плазмидой, кодирующей CRISPR/Cas9, в клетку добавляется еще одна плазмида, содержащая ДНК-матрицу («заплатку»), которая будет вставлена при «починке» ДНК. В этом случае с помощью системы гомологичной рекомбинации происходит как бы «заштопывание по шаблону», и нужный ген или его часть оказываются встроенными в ДНК в нужном месте. Матрица для вставки ограничена (фланкирована) участками, комплементарными геномной ДНК с двух сторон от надреза. За счет рекомбинации комплементарных участков вставка матрицы происходит точно в место разреза (рис. 2).
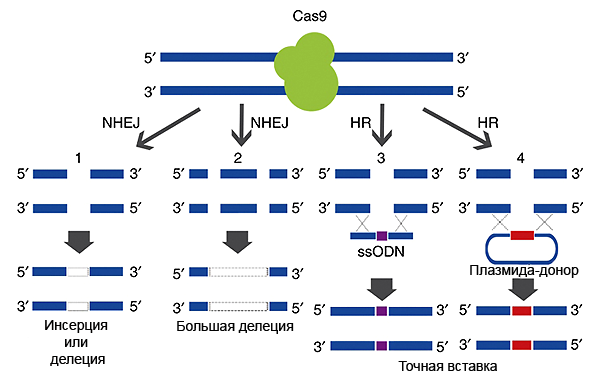
Рисунок 2. Репарация двунитевых разрывов, внесенных комплексом CRISPR/Cas9. Целостность ДНК в районе двунитевых разрывов может восстанавливаться двумя способами. 1) Разорванные концы состыковываются и сшиваются «как получится», при этом могут возникнуть делеции или инсерции (1 и 2). Этот способ называется негомологичным сшиванием концов ДНК (NHEJ). 2) В клетку можно «запустить» еще одну плазмиду или просто одноцепочечную ДНК, содержащую матрицу для репарации — тогда восстановление ДНК будет точным (3 и 4). Такой путь репарации основан на механизме гомологичной рекомбинации (HR), поскольку матрица для репарации — «заплатка» — в плазмиде/одноцепочечном олигонуклеотиде находится между «плечами гомологии» — флангами, комплементарными участкам ДНК с двух сторон от разрыва. Рисунок из [3], адаптирован.
Таким же образом в разрез можно вставить и саму кассету CRISPR/Cas9. Об этом сообщили ученые из Калифорнийского университета — Валентино Ганц (Valentino Gantz) и Этан Бьер (Ethan Bier) [4, 5].
Они «выключали» ген yellow, который отвечает за развитие нормальной окраски туловища — «в темную полосочку» — у Drosophila melanogaster, с помощью системы CRISPR/Cas9. Плазмида, вносящая эту систему в клетку, имела небольшое усовершенствование: кассета CRISPR/Cas9 была фланкирована длинными «плечами гомологии» — последовательностями, комплементарными хромосомной ДНК с двух сторон от предполагаемого разрыва. Такая хитрость позволила ученым не просто внести нокаутирующую мутацию в ген yellow, но и вставить в место разрыва саму кассету CRISPR/Cas9. РНК-гид и фермент Cas9 теперь экспрессировались участками ДНК в составе X-хромосомы и могли разрезáть соседнюю аллель и наследоваться (рис. 3).
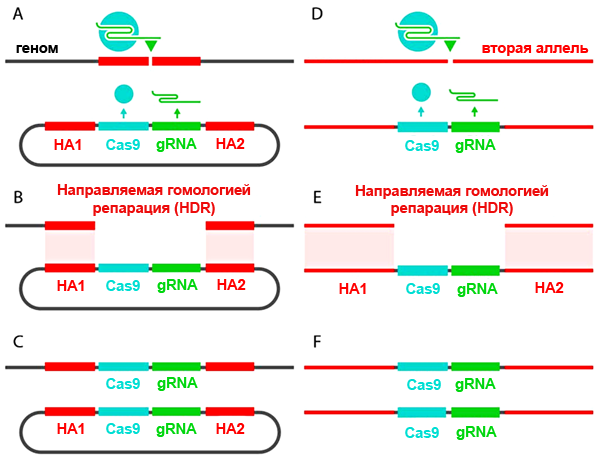
Рисунок 3. «Саморазмножение» кассеты CRISPR/Cas9. А — В плазмиду встроена кассета, содержащая ген нуклеазы Cas9 и матрицу для РНК-гида. Кассета фланкирована участками, гомологичными последовательностям возле места разреза, — плечами гомологии (homology arms, HA1-2). Фермент Cas9 (синий кружок), направляемый РНК-гидом, вносит двунитевой разрыв в геномную ДНК. B-С — Благодаря протяженным (примерно 1000 п.н.) гомологичным участкам происходит рекомбинация, и разрез «застраивается» кассетой CRISPR/Cas9. D-E — Вторая аллель разрезается ферментом Cas9, синтезируемым первой аллелью, и репарируется по тому же принципу. F — Обе аллели изменены: вместо привычной последовательности нуклеотидов встроена кассета CRISPR/Cas9. Ген нокаутирован, инсерция наследуется потомством. Рисунок из статьи [4], адаптирован.
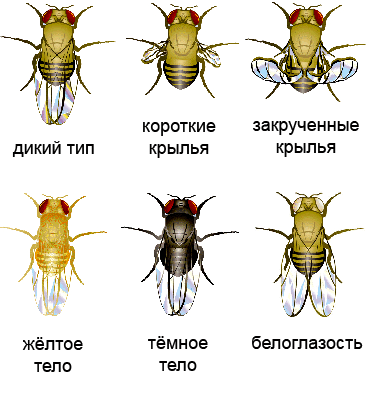
Рисунок 4. Варианты фенотипов при разных мутациях у Drosophila melanogaster. Рисунок с сайта The wonderful fruit fly, адаптирован.
Плазмиду вводили в эмбриональную клетку дрозофилы, из которой затем развивалась обладательница двух измененных аллелей гена yellow — особь с бледно-желтым телом (рис. 4). При скрещивании таких мух женского пола с носителями нормальных генов по менделевским законам наследования (в приложении к рецессивным мутациям в X-хромосоме) только 50% потомства (самцы) должны были родиться бледно-желтыми. Скрещивание самцов-мутантов с нормальными самками вообще не должно было привести к появлению «обесцвеченных» особей (рис. 5, слева). Каково же было удивление ученых, когда в первом случае почти все мухи (97%) были бледно-желтыми, а во втором — почти все самки (рис. 5, справа). Интегрированная кассета CRISPR/Cas9 по типу цепной реакции распространялась по геномам потомства: комплекс ее продуктов — Cas9 с РНК-гидом — упрямо разрезал полученные от другого родителя нормальные аллели гена yellow, и кассета встраивается в разрез путем гомологичной рекомбинации. Потому ученые и назвали разработанный метод мутагенной цепной реакцией, МЦР (рис. 6). Стоит отметить, что во втором поколении мух помимо бледно-желтых особей обнаружили нескольких особей с мозаичной окраской и нескольких — с окраской дикого типа (рис. 7).
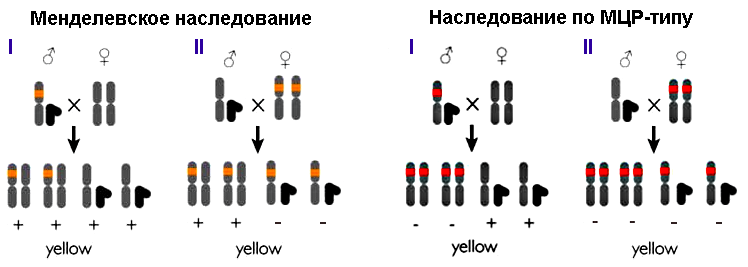
Рисунок 5. Схема распределения аллелей у потомков от скрещивания Drosophila melanogaster дикого типа с особями, несущими рецессивную мутацию в X-хромосоме. Слева — по законам Менделя. Мутация (отмечена оранжевым), возникшая у самца (I), передается только самкам, т.к. потомки-самцы получают нормальную Х-хромосому от матери. Самки-носители одной мутантной хромосомы всё равно будут нормально окрашены (отмечено плюсами): нормальный ген второй хромосомы способен обеспечить особь нужным количеством пигмента. Мутация двух аллелей у самки (II) должна проявиться в фенотипе лишь у 50% потомства (у самцов). Справа — по типу МЦР, мутагенной цепной реакции (при интеграции CRISPR/Cas9). Все мухи женского пола, полученные от самцов-мутантов (I), будут обладать двумя «сломанными» генами yellow (красная метка) и иметь бледно-желтую окраску, т.к. мутация не компенсируется, а наоборот, инсерция CRISPR/Cas9 «саморазмножается», поражая нормальную аллель. Самцы не «бледнеют»: мутантная хромосома им не достается. Мутанты-самки (II) передают по мутантной аллели каждому самцу и каждой самке, у потомков-самцов компенсировать ее нечем, а у самок мутация «перекинется» на нормальную аллель. В итоге всё потомство будет светлым. Рисунок из [4], адаптирован.
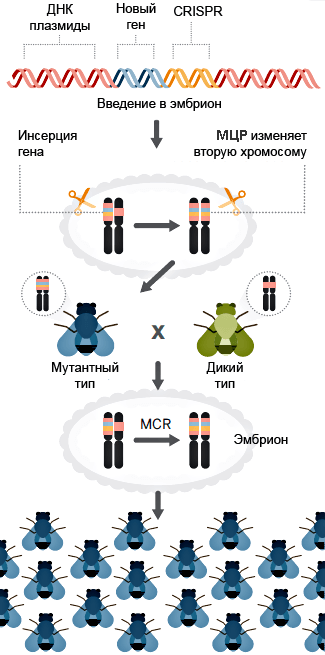
Рисунок 6. Принципиальная схема метода мутагенной цепной реакции (МЦР). В эмбриональную клетку дрозофилы вводится плазмида с кассетой CRISPR/Cas9 и геном устойчивости к какому-либо заболеванию. Этот ген устойчивости вместе с ДНК «мутагенных инструментов» распространяется в клетке на вторую аллель. Взрослеющая особь (синего цвета) становится устойчивой к заболеванию, что само по себе прекрасно. Но, скрещиваясь с обычной дрозофилой, она, вопреки законам наследования, передает ген устойчивости почти всем своим потомкам. Вот так выглядит мечта об оздоровлении целых популяций насекомых. А заодно и нас с вами, если речь идет о болезнях, которые ими переносятся. Рисунок из статьи [5], адаптирован.

Рисунок 7. Варианты фенотипов по результатам эксперимента. 97% потомков второго поколения были бледно-желтыми, но часть дрозофил имела мозаичную окраску или окраску дикого типа (с темными полосами), что свидетельствует о незначительных сбоях в работе системы CRISPR/Cas9, но никак не умаляет ее эффективности. Рисунок из [4].
Использование такого мощного инструмента может привести к изменению целых популяций живых организмов. Некоторые ученые (и, к слову, миллионы жителей тропиков) буквально мечтали об этом открытии, потому что оно позволит создать комаров, неспособных переносить малярию и лихорадку Денге. Другие рады, что теперь можно быстро выводить линии мышей со множественными мутациями для лабораторных исследований и не тратить время на тщательный скрининг [6]. А там недалеко и до генной терапии.
Однако у многих исследователей мутагенная цепная реакция вызывает большие опасения. Мутация, однажды введенная в геном единственного организма, неконтролируемо распространяется в геномах детей, внуков, правнуков и всех последующих поколений этой популяции. Муха с мутацией в гене yellow, случайно вылетевшая из лаборатории, может внести эту мутацию в природные популяции дрозофил — тогда все плодовые мушки на Земле со временем станут бледно-желтыми, а мы навсегда забудем, как выглядели раньше известные нам Drosophila melanogaster.
А если речь пойдет не о мухах, а о внесении мутаций, например, в геном человека?* Или экспериментаторы совершат ошибки, которые приведут к неконтролируемому распространению страшных патогенных организмов? Ученые успокаивают, что судьба нашей планеты не станет похожа на сюжет фантастического фильма. Они держат своих «бледных» дрозофил за семью печатями: посторонние не имеют доступа ни к пробиркам с плазмидами, ни к экспериментальным мухам. Они разделяют всеобщее волнение по поводу своего открытия, однако очень рады, что придумали такой эффективный метод редактирования генома. То ли еще будет!..
Литература
- Hsu P.D., Lander E.S., Zhang F. (2014). Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157, 1262–1278;
- CRISPR-системы: иммунизация прокариот;
- Shao Y., Guan Y., Wang L., Qiu Z., Liu M., Chen Y. et al. (2014). CRISPR/Cas-mediated genome editing in the rat via direct injection of one-cell embryos. Nat. Protoc. 9, 2493–2512;
- Gantz V., Bier E. (2015). The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations. Science. doi: 10.1126/science.aaa5945;
- Bohannon J. (2015). Biologists devise invasion plan for mutations. Science. 347, 1300;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Великий рекомбинатор;
- А не замахнуться ли нам на... изменение генома?;
- Lanphier E., Urnov F., Haecker S.E., Werner M., Smolenski J. (2015). Don’t edit the human germ line. Nature. 519 (7544);
- Baltimore D., Berg P., Botchan M., Carroll D., Charo R.A., Church G. et al. (2015). A prudent path forward for genomic engineering and germline gene modification. Science. 348, 36–38;
- Vogel G. (2015). Embryo engineering alarm. Science. 347, 1301..






