Вирусные геномы в системе эволюции
28 ноября 2014
Вирусные геномы в системе эволюции
- 13473
- 0
- 14
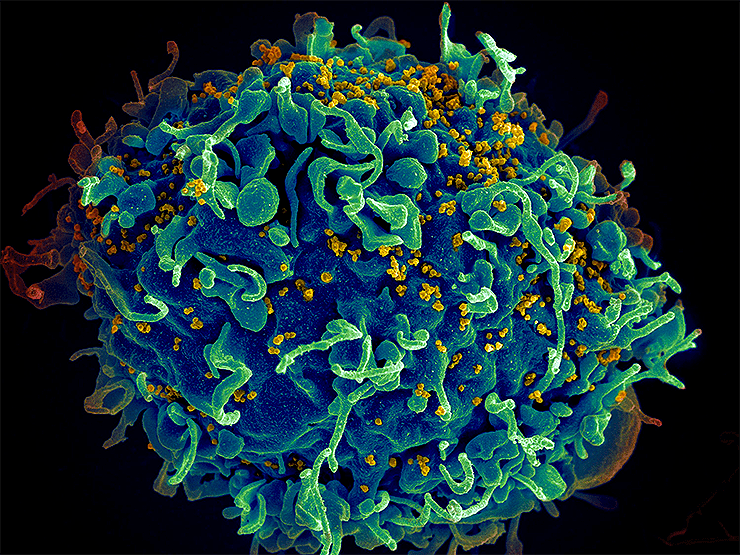
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Изучение виромов (популяций вирусов, объединенных общей средой обитания) практикуется в современной вирусологии всё чаще. Подобный подход приносит неожиданные результаты — концентрация вирусов в природе, оказывается, чрезвычайно высока. Например, в морской среде количество вирусных частиц превосходит количество клеток в разы. При этом вирусные частицы способны к передаче генетической информации. Исследования, опубликованные в 2010 году, показали, что агенты переноса генов (АПГ, особая разновидность вирусоподобных частиц, участвующих в горизонтальном переносе генов) привносят в геном бактерий новые фрагменты значительно чаще, чем считалось ранее. А если вирусные частицы настолько распространены в биосфере, и большая часть из них способна к переносу генов, то важно рассмотреть вирусы в рамках общей модели эволюции.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
- Сценарий «сбежавших генов», приравнивающий вирусы к генам клеточных организмов, которые «выпали» из клеточного генома и переключились на «эгоистичный» режим, — теория клеточного происхождения.
- Дегенерация одноклеточных паразитов до вирусного состояния — регрессивная гипотеза.
- Происхождение вирусов из первичных генетических элементов — гипотеза доклеточного происхождения.
Однако фундаментальные достижения, такие как открытие рибозимов (молекул РНК, обладающих каталитическим действием), разработка гипотезы о «мире РНК» [2], открытие новых форм вирусов и успехи в геномике делают наименее популярную в прошлом гипотезу доклеточного происхождения все более весомой. И то, что некоторые вирусные белки не обнаруживают гомологии с белками бактерий, архей и эукариот [3], свидетельствует о сравнительно давнем обособлении этой группы. В остальном же достоверно объяснить происхождение вирусов на основании трёх закрепившихся классических гипотез пока еще не вполне удаётся.
Возникновение паразитов — неизбежное последствие эволюционного процесса
Если рассматривать эволюцию как единый процесс, становится понятно, что виды никогда не эволюционируют независимо друг от друга. Более того, паразиты появляются и в компьютерных моделях эволюции простых репликаторов (самовоспроизводящихся РНК-подобных систем) [9]. Так исследования, проведенные в 2008 году Набуто Такеучи и Паулин Хогвег, представляют собой расчет такой репликативной системы [12]. Простота системы позволяет явно смоделировать отображение генотип-фенотип взаимодействий отдельных репликаторов. Результаты показали, что популяция репликаторов, первоначально состоящая из одного генотипа, развивается в сложную экосистему до четырех «видов». В этой диверсификации «виды» эволюционируют путем приобретения уникальных генотипов с отличной экологической функциональностью, причем два из четырех «видов» становятся паразитами, неспособными к самостоятельной репликации.
Анализ диверсификации показывает, что паразитарные репликаторы, которые были придуманы, чтобы дестабилизировать разнообразие репликатора, на самом деле способствуют эволюции разнообразия посредством создания новой «ниши» для каталитических репликаторов (самовоспроизводящихся репликаторов). Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов, поскольку в такой системе паразиты имеют преимущество репликации на катализаторах.
Дело в том, что репликация катализаторов требует некоторого периода времени, и паразиты, которые не копируют другие молекулы, могут тратить больше времени на репликацию, чем катализаторы. Таким образом, присутствие катализаторов влечет за собой «нишу» для паразитов. В нынешней системе (рис. 4), C-катализатор (cat-C) создает такую нишу, и это позволяет эволюционировать G-паразиту (par-G). Кроме того, как только создается структура C-катализатор-G-паразит, она создает еще один нишу для фенотипа, который может высвободиться из G-паразита. И если такой фенотип приобретает А-катализатор (cat-A), он тоже эволюционирует. Наконец, создание такого альтернативного катализатора создает нишу для фенотипа, который мог бы паразитировать на этом альтернативном катализаторе (par-U).

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Подобную «гонку вооружений» можно наблюдать, если на молекулярном уровне изучить системы «ионный канал — нейротоксин», которые коэволюционируют, видимо, как раз по этому принципу: «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [13]. — Ред.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Вирус-специфичные гены:
- «Бесхозные» (orphan) гены — гены без выявленных гомологов, кроме как у близкородственных вирусов.
- Вирус-специфические гены, консервативные для относительно широкой группы вирусов, но не имеющие гомологов у клеточных форм жизни.
- Гены — вирусные сигнатуры.
Вирусные сигнатуры — это гены, общие для многих разнообразных групп вирусов, имеющие лишь отдаленные гомологи у клеточных организмов, для которых имеются убедительные свидетельства в пользу монофилии (общего происхождения) всех вирусных членов соответствующих семейств генов [9]. Фактически эти гены являются признаками «вирусного состояния». Гены-сигнатуры предшествуют клеткам и происходят непосредственно из первичного, доклеточного пула генов.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Современные же данные показывают, что ГПГ имеет огромное влияние не только на эволюцию простейших, но и на эволюцию многоклеточных. Молекулярный биолог Петер Гогартен описал горизонтальную генную передачу как «новую парадигму биологии».
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.
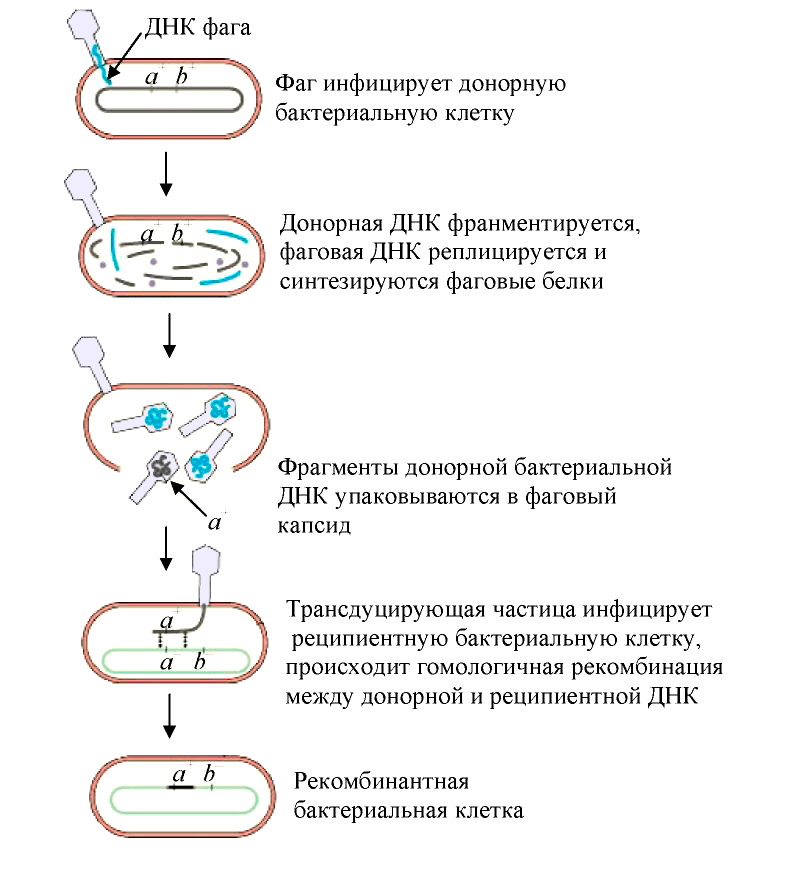
Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Важнейшую роль в эволюции животных играют гены, которые животные заимствуют у вирусов, транспозонов, ретротранспозонов, дельта-ретровирусов (экозогенные и эндогенные вирусы). Фрагменты ДНК вирусов и транспозонов часто «приручаются» высшими организмами и начинают выполнять полезные функции в геноме. Большинство встроенных (ретровирусных, если говорить о высших позвоночных) геномов совершенно бесполезны для хозяина. Фактически идет постоянный процесс превращения так называемой «мусорной» или «эгоистической» ДНК вирусного происхождения в полезные элементы генома. Явление это настолько широко распространено, что для него даже предложен специальный термин — молекулярное одомашнивание [21].
Насколько действительно мусорна мусорная ДНК, обсуждается в статье «Сколько сора в нашей ДНК» [20]. — Ред.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].
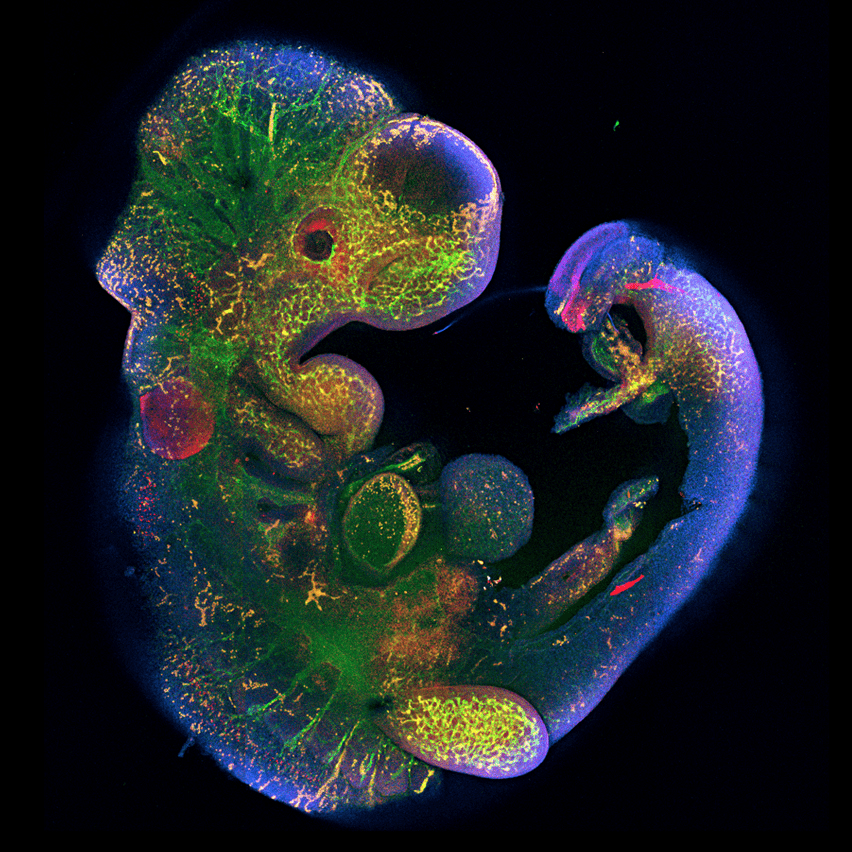
Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Авторы нашли гены ENVV1 и ENVV2 и в геномах других приматов: у человекообразных (шимпанзе, орангутана) и других обезьян Старого Света (макаки-резуса, зеленой мартышки), а также у обезьян Нового Света — мармозетки и беличьей обезьяны. Однако у наших более отдаленных родственников (лемуры) этих генов нет. Сопоставив данные по нуклеотидным последовательностям генов ENVV1 и ENVV2 у разных обезьян, исследователи смогли реконструировать эволюционную историю этих генов. В эволюции приматов имело место приобретение полезных генов «со стороны», а именно от ретровирусов. По своему происхождению они являются генами белков оболочки ретровируса [21]. Исходный ретровирус встроился в геном наших предков и стал эндогенным ретровирусом после того, как разделились линии обезьян и лемуров, но до того, как разошлись обезьяны Старого и Нового света, то есть примерно 43–77 млн. лет назад. Этот ЭРВ вскоре подвергся двум последовательным дупликациям, и в результате получилось три одинаковых ЭРВ, расположенных по соседству на одной хромосоме. Все участки этих ЭРВ, кроме генов белков оболочки, стали постепенно дегенерировать. Ген ENVV2 приобрел в результате мутаций какое-то полезное для хозяина свойство и стал сохраняться отбором. Другие два гена, по-видимому, тоже приобрели полезные функции, но они оказались не столь незаменимыми, как ENVV2. Поэтому в некоторых эволюционных линиях обезьян эти гены были утрачены или выведены мутациями из строя. В частности, общий предок человека и шимпанзе потерял ген ENVV3.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
- Управление слиянием клеток в ходе формирования наружного слоя плаценты (синцитиотрофобласт);
- Защита эмбриона от иммунной системы матери (у обоих белков есть участок, обладающий свойством искусственного угнетения иммунитета, это вполне объясняется тем, что изначально они входили в состав вирусной оболочки);
- Защита эмбриона от «диких» ретровирусов. У ENVV1 и ENVV2 сохранились участки, связывающиеся с теми поверхностными белками клетки, к которым прикрепляются ретровирусы, чтобы проникнуть в клетку. Если к такому поверхностному белку уже прикрепился белок ENVV1 или ENVV2, дикий ретровирус не может использовать его для проникновения в клетку.
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).
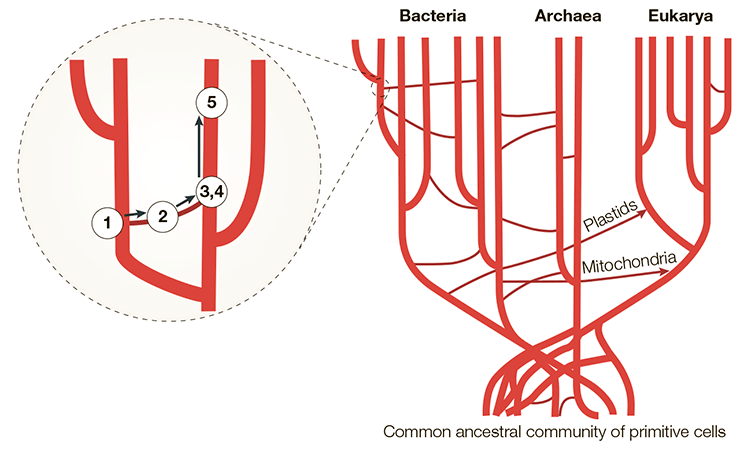
Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Статья написана в соавторстве с Евгенией Щепенок.
Литература
- Barth F. Smets, Tamar Barkay. (2005). Horizontal gene transfer: perspectives at a crossroads of scientific disciplines. Nat Rev Microbiol. 3, 675-678;
- РНК у истоков жизни?;
- Никитин М.А. (2013). Мир вирусов, последний общий предок и происхождение ДНК. «Химия и жизнь». 8;
- Карл Вёзе (1928–2012);
- Гигантские вирусы: 4-й домен жизни?;
- Элементы: «Формальные статистические тесты подтверждают происхождение всех живых организмов от единого предка»;
- Douglas L. Theobald. (2010). A formal test of the theory of universal common ancestry. Nature. 465, 219-222;
- Никитин М.А. (2013). Происхождение мембран и мембранной биоэнергетики. «Химия и жизнь». 9;
- Кунин Е.В. Логика случая. О природе и происхождении биологической эволюции. М.: «Центрполиграф», 2014;
- К вопросу о происхождении жизни;
- Шкроб М.А. (2009). Паразит впереди хозяина. «Химия и жизнь». 8;
- Nobuto Takeuchi, Paulien Hogeweg. (2008). Evolution of complexity in RNA-like replicator systems. Biology Direct. 3, 11;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Агол В.И. (2014). Природа патогенности вирусов. Лекция;
- Агол В.И. (2013). Вирусы: место и роль в природе. Лекция;
- Eugene V Koonin, Tatiana G Senkevich, Valerian V Dolja. (2006). . Biol Direct. 1, 29;
- Maria C. Rivera, James A. Lake. (2004). The ring of life provides evidence for a genome fusion origin of eukaryotes. Nature. 431, 152-155;
- Carl R. Woese. (2004). A New Biology for a New Century. MMBR. 68, 173-186;
- Трансдукция. Неспецифическая трансдукция. Специфическая трансдукция. Абортивная трансдукция. Феномен лизогении. «МедУнивер»;
- Сколько сора в нашей ДНК;
- Марков А.В. (2008). Горизонтальный перенос генов и эволюция. «Проблемы эволюции»;
- Гвоздев В.А. (1998). «Подвижная ДНК эукариот. Часть 1. Структура, механизмы перемещения и роль подвижных элементов в поддержании целостности хромосом. «Соросовский образовательный журнал»;
- Retrotransposon-derived protein PEG10. UniProt;
- Ryuichi Ono, Kenji Nakamura, Kimiko Inoue, Mie Naruse, Takako Usami, et. al.. (2006). Deletion of Peg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality. Nat Genet. 38, 101-106;
- Anders L Kjeldbjerg, Palle Villesen, Lars Aagaard, Finn Skou Pedersen. (2008). Gene conversion and purifying selection of a placenta-specific ERV-V envelope gene during simian evolution. BMC Evol Biol. 8, 266.