
Светлая голова
10 ноября 2014
Светлая голова
- 3010
- 2
- 5
Оптогенентика проливает свет на физиологию поведения и эмоций
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В XXI веке наука о человеке — это прежде всего наука о мозге и его функциях. Современные методы фМРТ и микроэлектродной стимуляции предоставили нам возможность понять устройство этого, пожалуй, самого загадочного из органов и использовать в своем изучении его же язык. Но совсем недавно миру был представлен совершенно иной метод, предлагающий нейронам свой собственный язык — свет. Поговорим об оптогенетике.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Заросший пруд и двигатель прогресса
Гуляя летом по парку, мы часто восхищаемся пестротой и ароматом цветов в красиво расставленных клумбах, украдкой подглядываем за целующимися парочками на скамейках, наслаждаемся птичьим щебетанием. Но вряд ли кто-то из нас любовался заросшим ряской прудом. На лице лишь проступает брезгливая морщинка. А зря. Как ни странно, невзрачные обитатели заболоченных водоемов — хламидомонады — могут дать ключ к понимаю природы человеческого мышления и ответить на вопросы, которые мы так часто себе задаем. Именно эти простейшие стоят у истоков подающего колоссальные надежды метода изучения мозга — оптогенетики.
Еще в 1979 году нобелевский лауреат Фрэнсис Крик озвучил основную проблему в изучении деятельности мозга: влиять на один вид нейронов, не затрагивая при этом другие [1]. Он же, как обладатель прозорливого ума, отвергал в своих лекциях методы электростимуляции и фармакологического влияния как недостаточно точные и предположил, что свет для этой цели подошел бы как нельзя лучше. Но на тот момент науке еще не были известны технологии, заставляющие клетки реагировать на световое излучение.
Шли годы. Развивались биология, физика, генная инженерия, медицина. Уолтер Стокениус (Walther Stoeckenius) и Дитер Остерхельт (Dieter Oesterhelt) из Калифорнийского университета в Сан-Франциско в 1975 году выделили из Chlamydomonas reinhardtii светочувствительный белок бактериородопсин, позволяющий бактериям двигаться в сторону лучей солнца или от них. Генная инженерия тоже не стояла на месте, и, начиная с работ Стенли Коэна и Герберта Бойера (Stanley Cohen и Hebert Boyer) 1973 года, получение рекомбинантных белков с помощью встраивания участков ДНК в геном клетки стало возможным. В начале 2000 Георг Нагель (Georg Nagel) успешно использовал светочувствительный белок каналродопсин, чтобы контролировать деятельность клетки [2].
Науке потребовалось ждать 30 лет для того, чтобы летом 2005 года доктор-психиатр и специалист в области науки о поведении Карл Дайссерот (Karl Deisseroth; рис. 1) и его коллеги по лаборатории представили миру новую технологию изучения функций мозга. Интересно вспомнить, что Дайссерот долгое время возлагал надежды на помещаемые в клетку микроскопические магнитные частицы (magnet beads), с помощью которых активность клетки контролировалась бы магнитным полем. Но, увидев преимущества белков, изучаемых Нагелем, он быстро сменил профиль [3].

Рисунок 1. Карл Дайссерот (Karl Deisseroth) — изобретатель инновационного метода. Профессор биоинженерии и психиатрии в Стэнфордском университете (Калифорния, США).
Азбука оптогенетики
Метод оптогенетики по-научному изящен. Биоинженеры создают участок генной конструкции, состоящий из промотора и гена, кодирующего необходимый опсин (светочувствительный белок), и заключают его в вирусный капсид. После биоинженеров за дело берутся врачи и нейрофизиологи, выбирая зону своего научного интереса в мозге, куда и будет введен вирус (пока все исследования проводились только на животных). Затем происходит процесс трансфекции (что-то вроде вирусной инфекции), и ген попадает в нейрон. Промотор или другие «генетические инструменты» обеспечивают избирательность экспрессии белка только в интересующей нас популяции клеток (например, нейроны, использующие дофамин в качестве медиатора). Нервные клетки, получившие вирус, начинают синтезировать опсин. Этот белок, в свою очередь, встраивается в наружную мембрану нейрона и теперь верой и правдой служит ему как ионный канал, необходимый для создания нервного импульса. После того как нейроны обзавелись светочувствительным белком, на голове животного устанавливается оптоволоконная система доставки пучка света к выбранной области (рис. 2).
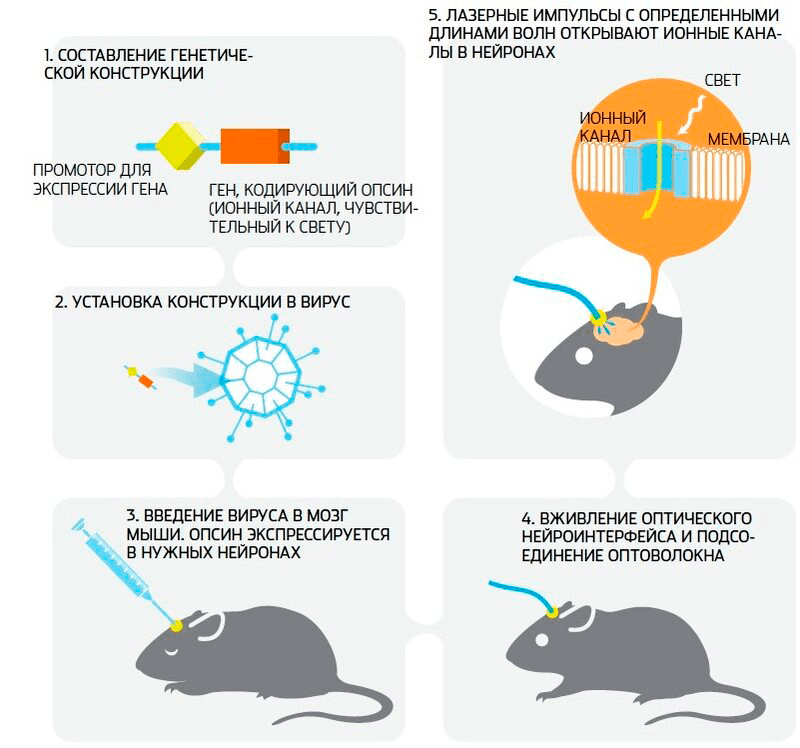
Рисунок 2. Ответ на вопрос «как же устроен мозг?» всего в четырех незамысловатых шагах
При освещении светом определенной длины волны белковые каналы изменяют свою структуру, и, в зависимости от того, какой белок мы заставили синтезировать наши нейроны, они проявляют ту или иную реакцию [1]. На современном этапе этих белков существует довольно много, и каждый из них вызывает специфический ответ нейрона: приводит клетку в возбуждение (каналродопсин — ChR2), тормозит её (галородопсин — NpHR), имитирует физиологические реакции (гибридный опсин в связи с внутриклеточным G-белком) или даже заставляет клетку двигаться (LOV2) [4]. Ответ выбранных нами нейронов на свет может приводить к изменению как отдельных функций организма, так и поведения в целом. А дальше — творческий процесс, море выводов и интерпретаций.
Что наиболее интригует, так это возможность видеть и контролировать определенные цепи нейронов в определенный момент времени с беспрецедентной точностью. А ведь именно эта филигранность и определяет сложность и многообразие всех процессов, протекающих в мозге, да и за его пределами. Приведем пример исследования, проведенного с помощью оптогенетики.
Не верь никому. Даже себе
Ученые из Массачусетского технологического института (MIT) под руководством Сусуму Тонегавы (Susumu Tonegawa) задались вопросом: «Можно ли искусственно управлять воспоминаниями?» [5]. Лабораторным мышам устанавливали оптоволоконную систему, доставляющую свет в зубчатую извилину гиппокампа (gyrus dentatus), нейроны которой были «натренированы» реагировать на свет. Эта весьма скромных размеров область мозга считается ответственной за консолидацию памяти (перехода информации из кратковременной памяти в долговременную), особенно эмоционально окрашенной. Мышь помещали в нейтральную, безопасную среду — коробку с голыми стенками.
Спустя какое-то время, а именно то, которое необходимо для консолидации памяти об этой обстановке, мышь помещали в другую коробку и вырабатывали у нее условный рефлекс. Пойдя чуть дальше лампочки и капающей слюны, группа Тонегавы освещала зубчатую извилину лазером, сразу после чего следовал удар током. При этом активация клеток зубчатой извилины вызывала у мыши воспоминания о первой коробке. «Таким образом, — говорит Ксу Лиу (Xu Liu), один из коллег Тонегавы, — мы хотели искусственно связать вызванные воспоминания о первой коробке с опасностью во второй коробке» (рис. 3). Впоследствии, когда мышь снова поместили в первую коробку, она замирала в ожидании разряда, что говорит об образовании у нее ассоциации первой безопасной коробки со страхом удара тока. Появились ложные воспоминания.
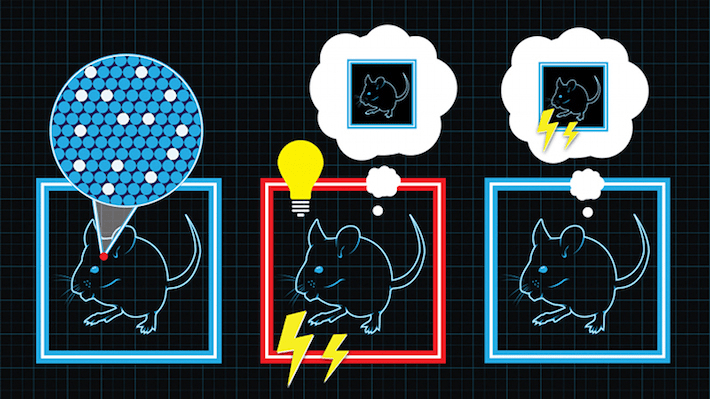
Рисунок 3. Схема эксперимента в лаборатории Тонегавы. Отдельно взятые нейроны гиппокампа мыши возбуждались светом, вследствие чего одни воспоминания заменялись на другие.
В 2012 году статья по этой работе вызвала своего рода сенсацию в околонаучном мире. «Люди думали, что мы способны создавать воспоминания самостоятельно, — улыбается Лиу. — Хотя мы скорее работали с уже готовым материалом, закодированным в гиппокампе». Своими экспериментами ученые из MIT открыли окно для более прицельного изучения механизмов памяти и впустили свежий воздух энтузиазма в умы многих нейрофизиологов. Сами же они не перестают ставить перед собой новые вопросы. Например, их интересует, связаны ли возникающие у людей ложные воспоминания и ассоциации с природой депрессии и различных тревожных расстройств. Оптогенетика находится на расстоянии одной научной революции от ответа на этот и многие другие будоражащие вопросы.
Да прольется свет
Говоря о душевных расстройствах, стоит отметить, что крестный отец оптогенетики Карл Дайссерот, будучи психиатром, возлагает на метод огромные надежды. До настоящего времени психические заболевания лечились, откровенно говоря, эмпирически. Не зная истинной причины заболевания, врач назначал лекарства, которые впоследствии могли оказаться бесполезными или даже опасными для пациента. И правда, научные слабо подтвержденные теории о происхождении психических заболеваний, на которых преимущественно и строилось лечение в психиатрии, можно сравнить с изучением города по виду его разноцветных огней из окна самолета, нежели с наблюдением за перемещениями отдельных людей и машин. Оптогенетика может снять завесу и с этих тайн. С помощью специальных генетических конструкций и нейротропных вирусов (например, вирусов герпеса и бешенства), о которых было рассказано выше, ученые получили возможность отойти от изучения мозга в целом и рассматривать отдельно взятые из триллионов клеток нейроны, функционально связанные между собой.
Таким образом в 2007 году была доказана роль гипокретина, а точнее, группы нейронов, синтезирующих этот белок (гипокретиновые нейроны — нейроны Hcrt), в механизмах сна и пробуждения, а также в развитии таких заболеваний как нарколепсия (неконтролируемые приступы сна) и фатальная семейная бессонница. Исследование этих клеток дало интересные результаты о качестве когнитивных функций мозга в зависимости от количества сна. Крысам стимулировали светом Hcrt-нейроны (при возбуждении они способствуют пробуждению) с различными интервалами, не давая животным спать так, как они привыкли в норме. Количество пройденных фаз сна, которые, как известно, имеют разную глубину, также учитывалось. Выяснилось, что при прерывистом сне память начинает страдать лишь тогда, когда его продолжительность составляет менее 67% от нормы [7], [8].
Методом оптогенетической стимуляции была доказана главенствующая роль располагающихся в лобной коре парвальбуминовых нейронов (ингибирующих нейронов быстрой активности, fast-spiking inhibitory neurons) в образовании искаженного гамма-ритма. Искаженный гамма-ритм преобладает у больных шизофренией и аутизмом и, как показывают эксперименты, способствует большему потоку информации через корковые пути, что в, свою очередь, нарушает анализ происходящих внутри и снаружи процессов, заставляя мозг создавать новые, запутанные и патологические связи между событиями [6], [7], [9]. Крысы, которых пристрастили к лабораторному кокаину, переставали искать его при локальном подавлении активности прилежащего ядра (nucleus accumbens, NAc) с помощью белка галородопсина (см. выше), встроенного в мембрану нейронов, что, несомненно, дает наркологам пищу для размышлений [6].
«Меня как врача, — рассказывает Дайссерот, — очень волнует перспектива использования этого метода, так как неизлечимые психические заболевания с весьма расплывчатыми определениями начинают приобретать осязаемую форму. Оптогенетика позволяет продвинуть психиатрию до уровня науки с системным подходом, где функции мозга, а также эмоции и поведение, которые он порождает, будут рассматриваться как свойства нервной ткани, объяснимые с точки зрения нейрофизиологии...» [1].
Технология глубокой стимуляции мозга (deep brain stimulation, DBS), предложенная калифорнийскими учеными, также может внести существенные коррективы в уже существующий хирургический метод лечения таких расстройств как болезнь Паркинсона и эпилепсия. В случае судорожной активности или двигательных нарушений при паркинсонизме — таких как тремор, ригидность мышц, нарушения позы и походки — микроэлектроды диаметром до 1 мм вводятся глубоко в головной мозг (субталамическое ядро базальных ганглиев). С помощью электростимулятора (устройства, похожего на кардиостимулятор) данная область получает электрический импульс, что несколько изменяет ее активность и устраняет симптомы у пациентов, которым таблетки уже помочь не в силах. Однако электрический ток есть язык всех нейронов, поэтому вместе с нужной областью разряд достается и всем прилежащим к ней нервным клеткам. В результате мы имеем побочные эффекты. Оптогенетика с ее точностью приложения может воздействовать лишь на те несколько десятков клеток, которые стали виновниками заболевания. Это может сослужить добрую службу DBS по увеличению ее точности и, следовательно, эффективности.
В похожем ожидании триумфа оптогенетики находятся и кардиологи. Совсем недавно культуру клеток сердца крысы с помощью луча света заставили ритмично сокращаться с точностью, превышающей электрокардиостимуляцию в десятки раз [10].
Действительно, от наблюдения за ряской в пруду этот метод прошел длинный путь.
Этика vs. Инновации
После того, как журнал Nature в 2010 году признал оптогенетику методом года, его известность и заслуженная популярность стали неуклонно расти. Сейчас в мире насчитывается более 700 лабораторий различных научных направлений, в арсенале которых не последнее место занимает метод оптогенетики. Также метод был предан довольно широкой огласке в СМИ, что послужило поводом запустить поток обсуждений инновации на Всемирном экономическом форуме (World Economic Forum). Как ни странно, дискуссия велась не о технологии метода и о том, что мы можем с ним делать, а скорее о том, должны ли мы это делать. Каково значение оптогенетики для человека? Не опасно ли введение вируса, пускай и безвредного, в мозг? Этично ли вмешиваться в личность и характер человека? Есть ли побочные эффекты со стороны психики у искусственно измененного поведения? Дать сколько-нибудь уверенный ответ на эти вопросы пока нельзя . Все опыты были проведены на лабораторных животных (рис. 4) и, не смотря на подтвержденные результаты, не могут быть однозначно экстраполированы на Homo sapiens.
Тем не менее сейчас уже концептуально подтверждены такие ранее неслыханные вещи, как восстановление зрения при некоторых патологиях сетчатки, основанное именно на принципах оптогенетики: «Оптогенетика + голография = прозрение?» [11]. И то ли еще будет. — Ред.
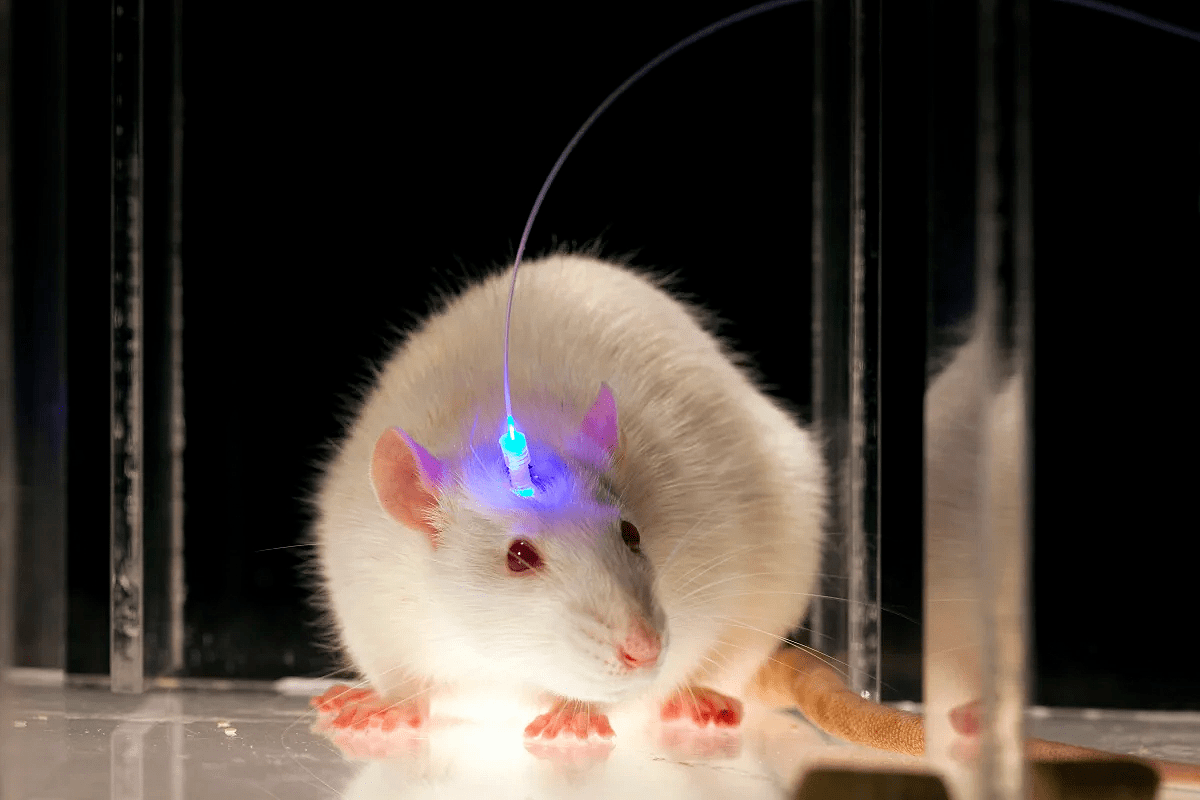
Рисунок 4. Вот как выглядит мышь с оптическим волокном, установленным в мозг
Нельзя быть до конца уверенным и в том, что привнесение в человеческий мозг чужеродной ДНК не повлечет за собой неожиданных последствий. В том числе и отдаленных. Но в одном ученые разобрались наверняка: мы можем изучать отдельно взятые нейроны, и теперь вопрос заключается в том, как адаптировать этот метод для человека.
Еще больше споров на тему этики вызвала программа разработки микроэлектродных оптогенетических мозговых имплантов (рис. 5). Регистрируя с помощью электрода активность нейронов, они способны с максимальной точностью в пространстве и времени модулировать активность этих нейронов, а значит изменить поведенческую реакцию, за которую они отвечают [12]. Это было бы полезно при лечении больных эпилепсией. Патологическая активность небольшого очага подавлялась бы лазером, предотвращая развитие припадка.

Рисунок 5. Протезирование функций мозга с помощью имплантированных прозрачных микроэлектродов. Добро пожаловать в будущее!
Дамы и господа, вашему вниманию предлагается протезирование функций мозга! Этот метод, взятый, несомненно, с самого острия науки, может позволить не только корректировать, но и усиливать существующие функции. Избирательно воздействуя на участки мозга, возможно было бы добиться выдающихся результатов. Хотите музыкальный слух? Пожалуйста. Кому-то требуется запоминать больше слов и цифр? Один момент. Вопрос: надо ли?
Всего одна научная революция
Конечно, все это звучит как строчки из романов Г. Уэллса, но разве не для этого существует наука — удивлять и восхищать людей? Фундаментальная наука всегда была очень уязвима перед критикой, особенно когда речь идет о вложениях в изучение обитателей «цветущих» прудов, но и такие неприглядные элементы живой природы могут предоставить необходимые инструменты для прогресса. Никто не мог и предположить, что наблюдение за водорослями поможет человечеству в изучении, а может и искоренении болезни Паркинсона или шизофрении. Открытие Дайссерота указало на необходимость интеграции различных, на первый взгляд не связанных между собой дисциплин, при решении научных проблем. И в этом его заслугу трудно переоценить. Цитируя гарвардского биохимика Юджина Кеннеди, Дайссерот говорит: «Осознание того, что ты внес сколь угодно малую лепту в понимание устройства мира, в котором мы живем — награда, достойная ежедневного скрупулезного труда».
Видео. Оптогенетика: управление мозгом при помощи света
Тернистый путь оптогенетики только начинается, и пускай она еще не проросла в клиническую дисциплину, открывающую глаза на мистическую связь души и тела и оставила столько же вопросов, сколько и ответов, сама мысль о том, какие возможности для личности и человечества в целом она предоставляет, уже интригует безмерно.
Литература
- Deisseroth K. (2010). Optogenetics: Controlling the Brain with Light. Scientific American;
- Sven Geibel, Thomas Friedrich, Pal Ormos, Phillip G. Wood, Georg Nagel, Ernst Bamberg. (2001). The Voltage-Dependent Proton Pumping in Bacteriorhodopsin Is Characterized by Optoelectric Behavior. Biophysical Journal. 81, 2059-2068;
- Оптогенетика как частный случай. (2012). nature-wonder;
- Erika Pastrana. (2011). Optogenetics: controlling cell function with light. Nat Methods. 8, 24-25;
- Trafton A. (2014). Neuroscientists reverse memories’ emotional association. MIT News;
- Karl Deisseroth. (2014). Circuit dynamics of adaptive and maladaptive behaviour. Nature. 505, 309-317;
- Karl Deisseroth. (2012). Optogenetics and Psychiatry: Applications, Challenges, and Opportunities. Biological Psychiatry. 71, 1030-1032;
- Antoine R. Adamantidis, Feng Zhang, Alexander M. Aravanis, Karl Deisseroth, Luis de Lecea. (2007). Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450, 420-424;
- Ofer Yizhar, Lief E. Fenno, Matthias Prigge, Franziska Schneider, Thomas J. Davidson, et. al.. (2011). Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature. 477, 171-178;
- Björn C Knollmann. (2010). Pacing lightly: optogenetics gets to the heart. Nat Methods. 7, 889-891;
- Оптогенетика + голография = прозрение?;
- Hewitt J. (2014). Transparent optogenetic brain implants: Yet another amazing use for graphene. ExtremeTech.








