Пилюли для эпигенома
24 октября 2013
Пилюли для эпигенома
- 8226
- 2
- 6
Звериный лик эпигенома
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Человечество еще не успело свыкнуться с понятием генной терапии, как ученые подсовывают новые, еще более экстравагантные идеи. Как только стало ясно, что эпигенетические нарушения являются причиной целого спектра заболеваний, светлые умы тут же начали искать «таблетки» для эпигенома. Что же такое epigenetic drugs, и чем их запивать? Давайте разберемся!
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Знакомьтесь — эпигеном!
Эпигеном — это совокупность всех эпигенетических маркеров, определяющих экспрессию генов в клетке. Эпигенетическими называют наследуемые химические модификации хроматина, которые не изменяют последовательности ДНК, но влияют на ее «активность». Для самой молекулы ДНК это метилирование. Для гистонов разнообразие модификаций побольше: это ацетилирование, фосфорилирование, метилирование, гликозилирование, а также менее известные их «коллеги»: убиквитинилирование [1] и сумоилирование [2] (рис. 1). К эпигенетическим механизмам относят также ремоделирование хроматина, разные варианты гистонов и посттранскрипционную регуляцию с помощью микроРНК. Все это, так или иначе, связано с активацией или репрессией генов, хотя механизмы данных процессов довольно сложные и неоднозначные [3]. Но пускай это нас не останавливает. Главное знать, что все эти химические группы цепляются и отцепляются ферментативно, причем для каждой опции существует свой фермент, а то и несколько. А раз так, то эпигенетические модификации обратимы: можно запустить фермент, который поснимает «лишнее» с гистонов или ДНК. Но проще с самого начала инактивировать ферменты, которые занимаются этими модификациями.
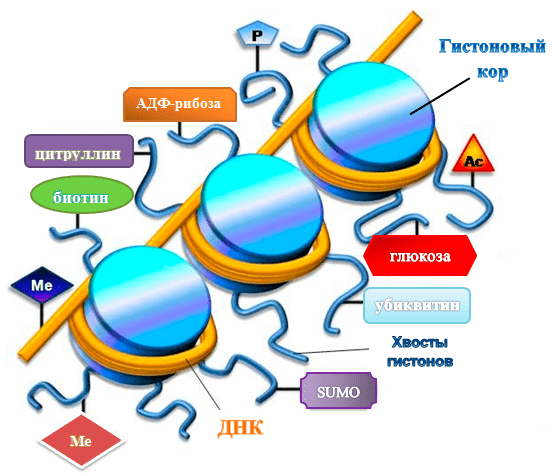
Рисунок 1. Эпигенетические модификаций ДНК и гистонов. Ме — метильная группа, Ас — ацетильная, Р — остаток фосфорной кислоты, SUMO — Small Ubiquitin-like Modifier (убиквитин-подобный модифицирующий белок) [2].
Эпигеномные болезни
Если геном — это текст, то эпигеном — знаки пунктуации, которые указывают, как следует читать ДНК. Помните «убить нельзя помиловать»? Так же и тут: от запятых зависит многое — существует целый ряд заболеваний и синдромов, связанных с нарушениями эпигенетической регуляции (табл. 1).
| Болезнь | Симптомы | Этиология |
|---|---|---|
| Синдром Ангельмана | Неврологические нарушения | Нарушение эпигенетического статуса одного или несколько генов в районе 15q11-13 в хромосоме, полученной от матери |
| Синдром Прадера-Вилли | Ожирение, нарушение интеллекта | Нарушение эпигенетического статуса одного или несколько генов в районе 15q11-13 в хромосоме, полученной от отца |
| Синдром Ретта | Умственная отсталость | Мутации в гене МeCP2, который кодирует метил-СрG-связывающий белок 2 |
| Синдром Коффина-Лоури | Умственная отсталость | Мутации в RSK2, что приводит к нарушению фосфорилирования гистонов |
| α-Талассемия | Анемия | Метилирование СрG-островков гена α2-глобина, делеции HBQ1 и HBA1 |
| Синдром Беквита-Видемана | Быстрый гипертрофический рост, предрасположенность к злокачественным опухолям | Нарушение импринтинга одного или несколько генов в локусе 11р15.5 (напр., IGF2) |
Так уж сложилось, что среди множества болезней наиболее изучена патоэпигенетическая картина рака. Первым выявленным эпигенетическим маркером опухолей было тотальное гипометилирование генома. Это плохой знак, поскольку ведет к активации онкогенов, повышает активность транспозонов и увеличивает хромосомную нестабильность.
В то же время, при раке наблюдается гиперметилирование CpG-островков. Для справки, это CpG-динуклеотиды в области промотора гена, и в норме 85–90% таких островков не метилированы. Их метилирование является вредным, поскольку заставляет «молчать» гены-онкосупреcсоры [5] (табл. 2).
| Рак, локализация | Ген | Эпигенетическая аберрация | Частота |
|---|---|---|---|
| Молочная железа | BRCA1 | Метилирование CpG-островков | 13% |
| WRN | Метилирование CpG-островков | 17% | |
| Яичники | WRN | Метилирование CpG-островков | 36% |
| BRCA1 | Метилирование CpG-островков | 5–30% | |
| FANCF | Метилирование CpG-островков | 21% | |
| RAD51C | Метилирование CpG-островков | 3% | |
| Толстый кишечник | MGMT | Метилирование CpG-островков | 40–90% |
| WRN | Метилирование CpG-островков | 38% | |
| MLH1 | Метилирование CpG-островков | 2–65% | |
| MSH2 | Метилирование CpG-островков | 13% | |
| Голова и шея | MGMT | Метилирование CpG-островков | 35–57% |
| MLH1 | Метилирование CpG-островков | 27–33% | |
| NEIL1 | Метилирование CpG-островков | 62% | |
| FANCB | Метилирование CpG-островков | 46% | |
| MSH4 | Метилирование CpG-островков | 46% | |
| ATM | Метилирование CpG-островков | 25% |
С модификациями гистонов еще сложнее. Более-менее понятно дело обстоит с ацетилированием гистоновых хвостов: такая метка, как и молекула ДНК, несет отрицательный заряд, поэтому эти двое отталкиваются друг от друга — хроматин становится менее компактным, а значит, более доступным для транскрипционной машинерии. А вот метилирование лизина и аргинина в составе гистонов весьма неоднозначно: эффект зависит как от количества метильных групп, присоединенных к аминокислотному остатку, так и от локализации самого остатка. Но установлено, что гистоны некоторых опухолей имеют свой особый паттерн метилирования [6].
Словом, рак — не только генетическое, но и эпигенетическое заболевание. Гипометилирование ДНК и гиперацетилирование гистонов часто являются не только симптомами данного заболевания, но и его причинами. Пожалуй, этой информации нам достаточно, чтобы наконец-то приступить к разработке новых методов лечения.
То, что доктор прописал
Сегодня для лечения эпигенома существует четыре препарата, одобренных FDA (управлением по контролю качества пищевых продуктов и лекарственных препаратов в США). Два из них являются ингибиторами метилирования ДНК, остальные два тормозят деацетилирование гистонов (табл. 3). Наиболее хорошо изученным в клинической практике является 5-азацитидин, который блокирует ДНК-метилтрансферазу (она же ДНК-метилаза, DNMT) и применяется для лечения лейкозов. К сожалению, для лечения других опухолей ни он, ни другой ингибитор ДНК-метилазы — децитабин — не показали утешительных результатов. Апробированные FDA блокаторы деациталаз гистонов (вориностат, ромидепсин) используют только при лимфомах. Существуют перспективные препараты для большего спектра опухолей, но они пока находятся на стадии до- и клинических испытаний [5].
| Компания | Препарат | Мишень | Год одобрения FDA |
|---|---|---|---|
| Merck | Золинза* (вориностат) | Гистондеацетилаза | 2006 |
| Celgene | Истодакс* (ромидепсин) | Гистондеацетилаза | 2009 |
| Celgene | Видаза* (5-азацитидин) | ДНК-метилаза | 2004 |
| Eisai Tokyo | Дакоген* (децитабин) | ДНК-метилаза | 2006 |
| * — Коммерческое название | |||
Ингибиторы ДНК-метилаз
У человека процесс метилирования ДНК контролируют три ДНК-метилтрансферазы (ДНК-метилазы, DNMT): DNMT1, DNMT3a и DNMT3b. Предполагается, что DNMT3a и DNMT3b — это de novo-метилтрансферазы, которые формируют паттерн метилирования ДНК на ранних стадиях развития, а также его изменение в процессе дифференцировки клеток. DNMT1 является ДНК-метилтрансферазой, которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, уже метилирована. Процесс же первичного метилирования более сложен, и допускают, что он связан с интерферирующими РНК [8].
Мишенью нынешних эпигенетических препаратов является DNMT1. Ее ингибиторы — азацитидин (5-азацитидин, коммерческое название — Вайдаза®) и децитабин (5-аза-2′-деоксицитидин, Дакоген®) — впервые были синтезированы в 1964 году, еще до того, как эпигенетика стала мейнстримом (рис. 2). Тогда они рассматривались как антиметаболиты (ингибиторы клеточного роста), и об их способности блокировать метилирование ДНК тогда еще не знали. Эти нуклеозиды являются пиримидиновыми аналогами, что позволяет им встраиваться в ДНК, провоцируя мутагенез, и тем самым убивать клетку. В 1974 выяснилось, что азацитидин влияет на метилирование РНК, а несколько позже установили, что оба препарата инактивируют ДНК-метилазу (рис. 3).
Выводы сделаны на основе хронологии публикаций статей в PubMed
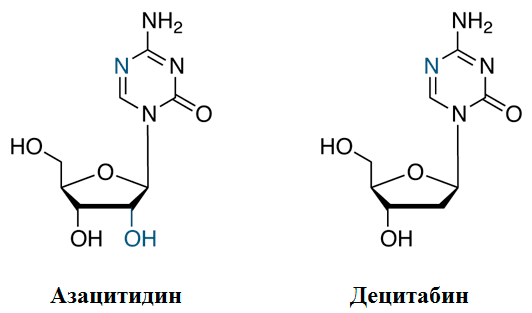
Рисунок 2. Химическое строение азануклеозидов. Децитабин, в отличие от азацитидина, имеет дезоксирибозу, а не рибозу, и этим объясняется его способность лучше встраиваться в ДНК. Основная часть азацитидина, напротив, идет на синтез РНК.
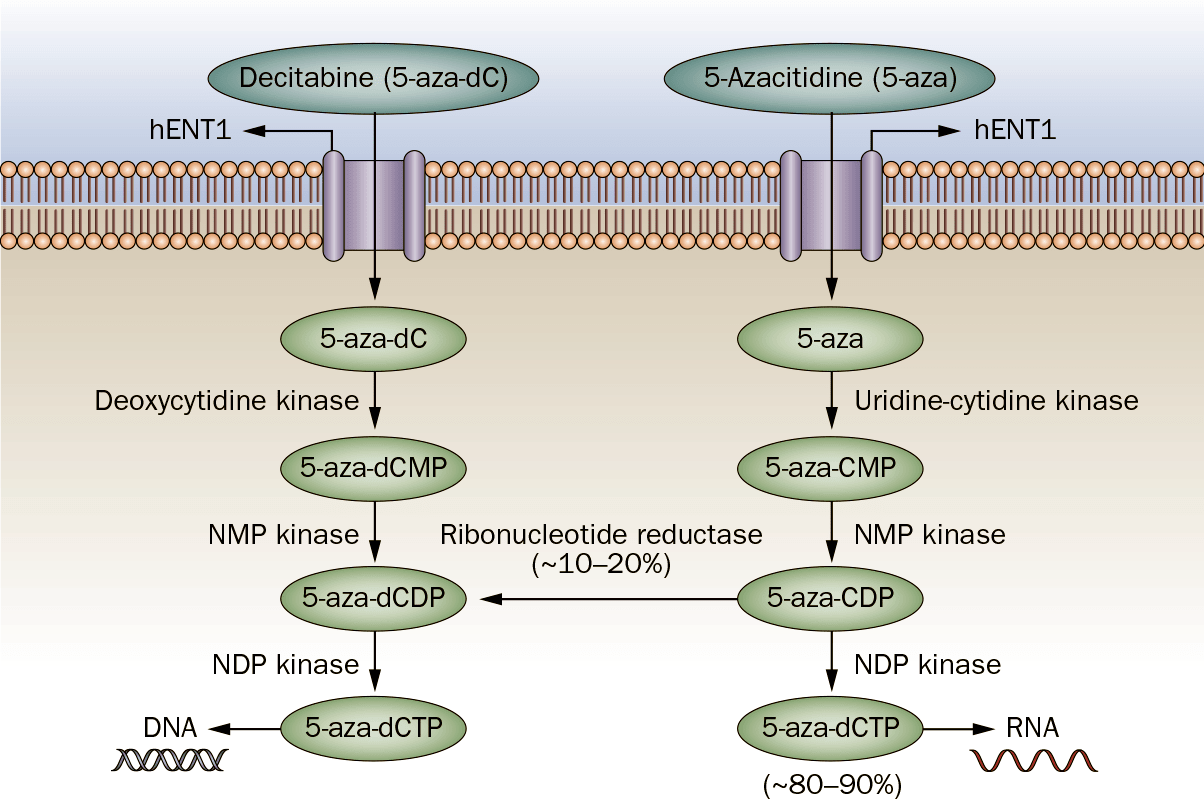
Рисунок 3. Схема метаболизма азануклеозидов. В клетку они попадают с помощью переносчика нуклеозидов hENT1. Далее азацитидин с помощью уридин-цитидинкиназы, а децитабин — дезоксицитидинкиназы фосфорилируются до монофосфатов, а следующая киназа превращает их в нуклеотиддифосфаты. После этого 10–20% азацитидина восстановляется с помощью рибонуклеотидредуктазы в дезоксиформу, фосфорилируются еще раз и участвует в синтезе ДНК. Остальные 80–90%, после превращения в трифосфаты, становятся субстратами для РНК-полимеразы. Поскольку децитабин имеет дезоксирибонуклеотидную природу, после трех фосфорилирований он включается исключительно в ДНК.
Как несложно догадаться, эти соединения в нуклеиновых кислотах замещают цитозин: после превращения в трифосфаты, они встраиваются в молекулу ДНК на его место. Метилтрансфераза, наткнувшись на такой нуклеотид, инактивируется, поэтому новая цепь ДНК при репликации (клеточном делении) будет неметилирована. При следующем делении из двух дочерних клеток одна уже будет полностью деметилирована, и так далее (рис. 4). Правда, деметилирование происходит при низких концентрациях азануклеозидов, при высоких же — блокируется сам синтез ДНК [4].
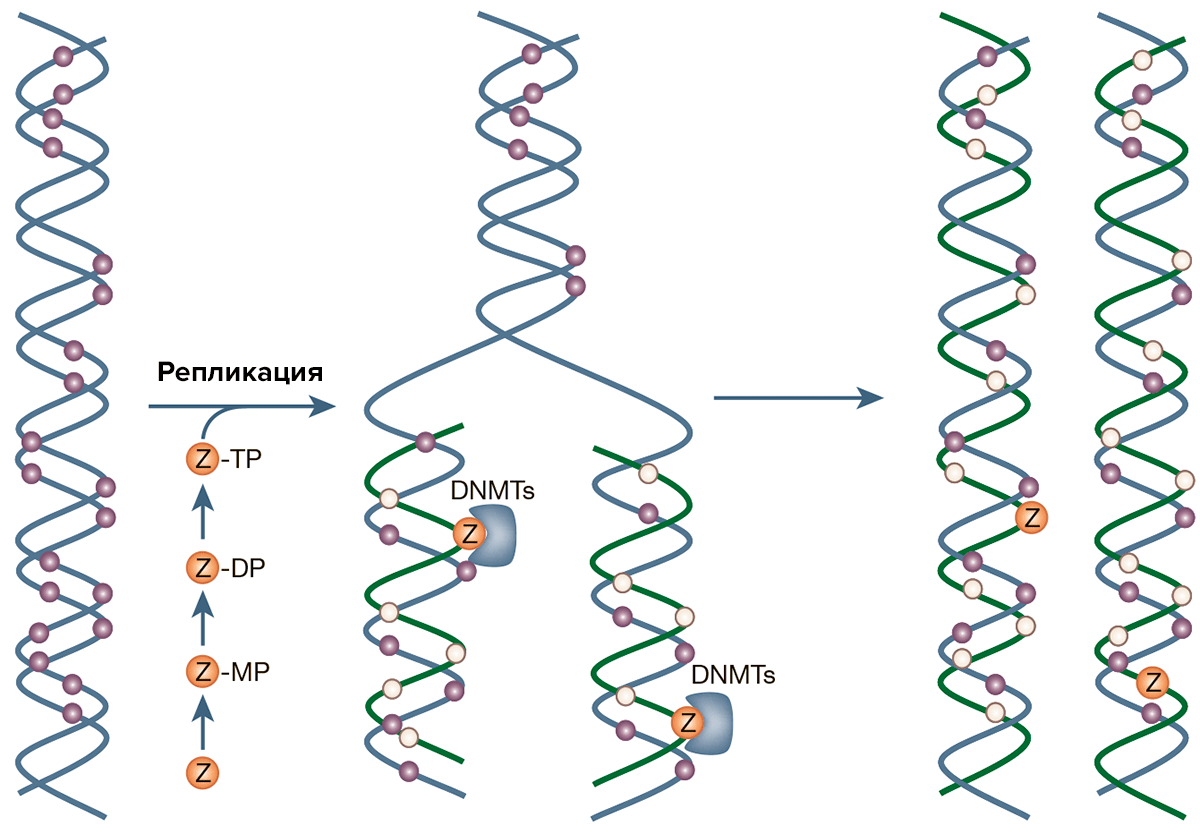
Рисунок 4. Принцип работы азануклеозидов как лекарств. В ходе репликации ДНК-метилаза DNMT1 хочет «скопировать» метильную группу (фиолетовый кружок) на новосинтезированию цепь ДНК. Не замечая подмены, фермент садится на встроенный в цепь ДНК вместо цитозина динуклеотид азацитидин-гуанин (Z) и ковалентно с ним «сшивается». «Загнанный в ловушку» фермент вскоре подвергается деградации. Таким образом, в ДНК будет метилированной только одна из цепочек вместо двух, а значит, новая клетка будет метилирована только наполовину. Дальнейшая репликация приведет к появлению клеток, полностью лишенных метилирования.
Блокаторы деацетилаз гистонов
Ацетилированием гистонов занимаются ацетилтрансферазы (HAT), которые переносят ацетильную группу с ацетилкофермента А на остатки лизина гистонов. Деацетилазы гистонов (HDAC), наоборот, удаляют ацетил, и таким образом восстановляют положительный заряд гистонов, что препятствует транскрипции. Плохо, когда гистоны деацетилированы в районе генов-супрессоров: это заставляет их «молчать», и риск онкотрансформации клетки увеличивается. Существует четыре класса деацетилаз, которые включают 18 разных белков. Деацетилазы первых двух классов называются классическими: это цинк-зависимые ферменты, которые присутствуют во всех типах тканей. Представители первого класса в основном локализованы в ядре, в то время как белки второго класса — в цитоплазме, или же курсируют между ядром и цитоплазмой [11].
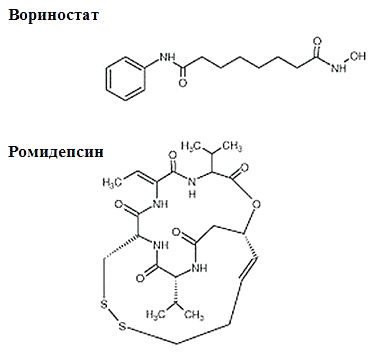
Рисунок 5. Химическое строение ингибиторов деацетилаз гистонов, одобренных FDA. Ромидепсин по своей структуре является депсипептидом (пептид, содержащий в молекуле наряду с пептидными одну или несколько сложноэфирных групп). Вориностат — это производное гидроксамовой кислоты.
Обратимое ацетилирование гистонов было открыто в 1964 году. Тогда же было сделано предположение, что это должно влиять на активность хроматина. А вот первая деацетилаза гистонов была обнаружена 30 лет назад. Сегодня существует целый ряд ингибиторов деацетилаз гистонов, начиная со сложных соединений, выделенных из бактерий и грибов (ТСА, тапоксин), и заканчивая относительно простыми молекулами (бутират) [12]. Но, как уже было сказано, в качества лекарственных препаратов против рака используют пока два. Первый — вориностат (субероиланилид гидроксамовой кислоты (SAHA), Золинза®) — был одобрен FDA в 2006 году; а второй — ромидепсин (депсипептид, Истодакс®) — в 2009 году (рис. 5). Оба препарата являются ингибиторами классических деацетилаз и функционируют путем вытеснения иона цинка из активного центра фермента [13].
Еще один ингибитор гистоновых деацетилаз — вальпроевая кислота — уже много лет используется в нейрологии и психиатрии как противосудорожный препарат. Список возможных применений блокаторов деацетилаз гистонов с каждым годом все длиннее, а по сему, давайте двигаться дальше.
Таблетки с грядки
Ученые только начинают воевать с эпигеномными нарушениями, тогда как растения уже миллионы лет синтезируют аналогичное оружие (рис. 6). Многолетние наблюдения показали, что наш рацион влияет на смертность от опухолей. Сегодня стало очевидно, что это влияние распространяется и на эпигенетическом уровне. В 2003 г. была опубликована статья, авторы которой показали, что флавоноид зеленного чая эпигаллокатехин-3-галлат (EGCG) является эффективным ингибитором фермента ДНК-метилтрансферазы. Двумя годами позже другие авторы описали молекулярный механизм этого процесса. Оказалось, что данный катехин блокирует активный центр ДНК-метилтрансферазы.
Зеленый чай — не единственный продукт, который влияет на эпигеном. Генистеин сои имеет множество биологических эффектов, среди которых и ингибирование метилирования цитозина. На клеточных линиях рака молочной железы показано, что ликопин томатов может «включать» заметилированый ген-онкосупрессор GSTP1. А вот сульфорафан, содержащийся в брокколи, органическая сера и органический селен из чеснока, жирные кислоты с короткой цепью, полученные в результате ферментации пищевого волокна (бутирата) в ЖКТ, ингибируют активность деацетилаз гистонов. Куркумин же — распространенный краситель в пищевой промышленности — наоборот, является блокатором ацетилазы гистонов.
Можно ли зеленым чаем вылечить рак? Многие исследования (проведенные в основном на клеточных линиях) показывают, что растительные метаболиты способны уменьшать риск онкообразования и даже подавлять развитие некоторых опухолей [17]. Тем не менее, ответ скорее нет. И дело не только в низких концентрациях активных веществ в самом растении. Сложность в том, что одно растение — это сотни, а то тысячи разных соединений. И, заваривая чай, вы имеете в одной чашке и ингибиторы деацетилаз, и их активаторы, и еще много всего другого. Возможно, в будущем будут созданы калькуляторы, которые будут рассчитывать максимально полезный для вашего эпигенома рацион. Представьте: каждое утро вы «читаете» свой геном на домашнем секвенаторе, и, исходя с этого, составляете меню к завтраку. Фантастика ? Судя по тому, какой высокий интерес к исследованиям данного рода — все может быть.
На самом деле скорее всего да. Маловероятно, чтобы читать свой геном пришлось каждый день, да еще до завтрака. — Ред.

Рисунок 6. Влияние растений на эпигенетические процессы.
Витамины на сдачу
Изучая онкологические процессы, учение выяснили, что дефицит фолиевой кислоты (витамина В9) приводит к гипометилированию ДНК. Это логично, ведь фолаты обеспечивают продукцию универсального донора метильных групп — S-аденозинметионина (SAM). Синтез SAM начинается с образования 5-метилтетрагидрофолата: на фолиевую кислоту при участии фермента метионинсинтетазы переносится метильная група с метилкобаламина (производного витамина В12). Внутри клетки 5-метилтетрагидрофолат служит донором метильных групп для превращения гомоцистеина в метионин. После этого метионин соединяется с аденозином, наконец-то образуя S-аденозилметионин. После отдачи метильной группы цитозину SAM распадается на аденозин и гомоцистеин. У гомоцистеина, как у богатыря на распутье, есть три дороги (рис. 7):
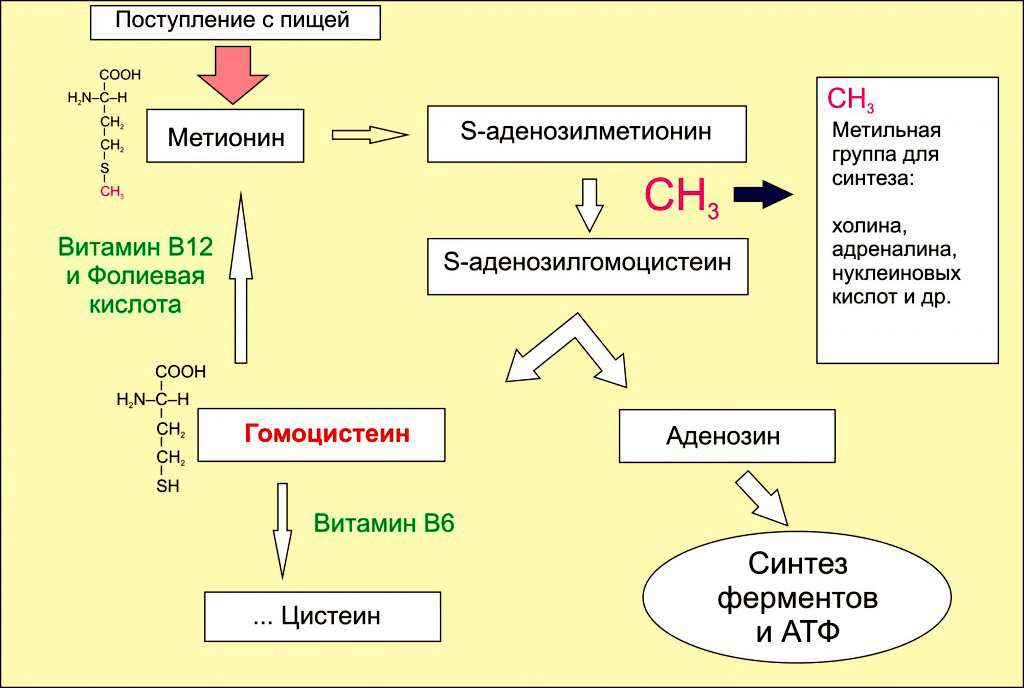
Рисунок 7. Ну очень упрощенная схема метаболизма метионина.
- При достаточном количестве в организме фолиевой кислоты и витамина В12: гомоцистеин превращается обратно в метионин, чтобы предоставить метильную группу для нужд организма.
- При помощи другого витамина группы В — пиридоксина (В6) — будет синтезирован цистеин.
- Самая печальная дорога. При нехватке в организме витаминов В6, В12 и фолиевой кислоты, либо при избытке в пище метионина: гомоцистеину в клетке делать нечего, и он выталкивается кровь. Попав в плазму крови, гомоцистеин повреждает внутреннюю стенку артерий, что имеет весьма печальные последствия для здоровья [18–20].
Как видим, дефицит витаминов накладывает плохой отпечаток и на эпигеном тоже.
Побочные эффекты
Несмотря на многообещающие положительные эффекты регуляторов эпигеномных модификаций, следует внимательно следить и за их побочными эффектами. Огромным поводом для беспокойства служит отсутствие специфичности в действии эпигенетических таблеток. Например, аналоги нуклеозидов являются неспецифическими ингибиторами ДНК-метилтрансфераз и ингибируют метилирование ДНК во всем геноме. Поэтому существует возможность непреднамеренной и непредсказуемой активации вредных генов.
Сладкое послевкусие
Но все же, такие препараты — это сильнейшие оружие против патологий как эпигенома, так и генома. Плохой ген — давайте-ка заметилируем его! Нужно похудеть — деацетилируем хроматин, в том месте, где в нас спрятаны гены, кодирующие ферменты катаболизма жиров. А сколько всего намотано на гистоновые хвосты — вот бы поснимать метки, да посмотреть, что будет ! Словом, мозгу ученого здесь есть где разгуляться. А значит новые, более эффективные пилюли для эпигенома уже не за горами.
Оставим эти мысленные эксперимента на совести автора статьи. — Ред.
Литература
- Вездесущий убиквитин;
- SUMO: японская борьба или уникальная посттрансляционная модификация?;
- Eleftheria Hatzimichael, Tim Crook. (2013). Cancer Epigenetics: New Therapies and New Challenges. Journal of Drug Delivery. 2013, 1-9;
- Simmons D. (2008). Epigenetic influence and disease. Nature Education. 1, 6;
- Hsing-Chen Tsai, Stephen B Baylin. (2011). Cancer epigenetics: linking basic biology to clinical medicine. Cell Res. 21, 502-517;
- Oliver J Rando. (2012). Combinatorial complexity in chromatin structure and function: revisiting the histone code. Current Opinion in Genetics & Development. 22, 148-155;
- Википедия: Epigenetics;
- Bethany A. Buck-Koehntop, Pierre-Antoine Defossez. (2013). On how mammalian transcription factors recognize methylated DNA. Epigenetics. 8, 131-137;
- Alfonso Quintás-Cardama, Fabio P. S. Santos, Guillermo Garcia-Manero. (2010). Therapy with azanucleosides for myelodysplastic syndromes. Nat Rev Clin Oncol. 7, 433-444;
- Gerda Egger, Gangning Liang, Ana Aparicio, Peter A. Jones. (2004). Epigenetics in human disease and prospects for epigenetic therapy. Nature. 429, 457-463;
- Annemieke J.M. de RUIJTER, Albert H. van GENNIP, Huib N. CARON, Stephan KEMP, André B.P. van KUILENBURG. (2003). Histone deacetylases (HDACs): characterization of the classical HDAC family. Biochem. J.. 370, 737-749;
- Thomas A. Miller, David J. Witter, Sandro Belvedere. (2003). Histone Deacetylase Inhibitors. J. Med. Chem.. 46, 5097-5116;
- P.A. Marks, W.-S. Xu. (2009). Histone deacetylase inhibitors: Potential in cancer therapy. J. Cell. Biochem.. 107, 600-608;
- Giuseppe Giannini, Walter Cabri, Caterina Fattorusso, Manuela Rodriquez. (2012). Histone deacetylase inhibitors in the treatment of cancer: overview and perspectives. Future Medicinal Chemistry. 4, 1439-1460;
- Maria M. Mihaylova, Debbie S. Vasquez, Kim Ravnskjaer, Pierre-Damien Denechaud, Ruth T. Yu, et. al.. (2011). Class IIa Histone Deacetylases Are Hormone-Activated Regulators of FOXO and Mammalian Glucose Homeostasis. Cell. 145, 607-621;
- Rudolf Jaenisch, Adrian Bird. (2003). Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat Genet. 33, 245-254;
- Alexander Link, Francesc Balaguer, Ajay Goel. (2010). Cancer chemoprevention by dietary polyphenols: Promising role for epigenetics. Biochemical Pharmacology. 80, 1771-1792;
- Беседа о сосудах. Часть 4. Метионин и гомоцистеин. «НП Курсив»;
- Микитенко Д. А. (2008). Коррекция эпигенетических нарушений ДНК: новая стратегия противоопухолевой терапии. «Сибирский медицинский журнал». 76;
- Холестериновая страшилка, которая правит миром.