Жизнь и путешествия замечательных клеток нервного гребня
23 мая 2023
Жизнь и путешествия замечательных клеток нервного гребня
- 1687
- 2
- 7
Клетка нервного гребня оседлала прообраз коняшки — дерево транскрипционных состояний с мордой ланцетника — и торопится прочитать статью, чтобы узнать свое будущее. Кем же ей стать? Какие приключения ее ждут? А окружена она персонажами, с которыми встретится в рассказанной нами истории.
Рисунок в полном размере.
здесь и далее — иллюстрации Надежды Потаповой
-
Авторы
-
Редакторы
-
Иллюстратор
Клетки нервного гребня — самая загадочная и интересная популяция в эмбрионах позвоночных животных. Благодаря этим клеткам мы становимся красивыми и индивидуальными, а также получаем способность тактильно чувствовать окружающий мир. Именно благодаря клеткам нервного гребня и их эволюции, которая полна тайн, мы можем улыбаться и кусаться, ведь у нас есть лица и челюсти, которые развиваются из нервного гребня и хранят тайны ранних эволюционных преобразований позвоночных животных. Так как большинство самых потрясающих открытий в этой области произошли за последние десять лет, на занятиях по эмбриологии о них почти ничего не рассказывают. Главные из этих открытий касаются понятия мультипотентности, а также способности достигать всех необходимых локаций в развивающихся эмбрионах. Чтобы заполнить этот пробел, мы решили рассказать вам, дорогие читатели (и показать в рисунках!), о новых достижениях науки в области изучения клеток нервного гребня, которые никого не оставят равнодушными.

Игорь Адамейко — полный профессор и руководитель Департамента Нейроиммунологии Медицинского Университета Вены (Австрия) и второй лаборатории в Каролинском Институте (Стокгольм, Швеция). Игорь — автор многих статей в Nature, Cell и Science, а также лауреат различных европейских научных премий. За время существования лаборатории Игоря Адамейко ее сотрудники предложили радикально новую концепцию биологии развития, согласно которой определенные пулы клеток-предшественников, существующие в узкоспециализированной нише, используют нервы в качестве проводников для миграции и дифференцировки посредством временной и пространственной связи между нервными волокнами и ассоциированными клетками. Эта концепция имеет значительный вес, поскольку она также применима к развитию опухолей из нерв-ассоциированных клеток. До этого на протяжении многих десятилетий преобладала концепция, согласно которой единственная функция периферических нервов заключалась в трансмиссии паттернов нейрональной активности. Однако лаборатория Игоря Адамейко продемонстрировала новую неканоническую функцию периферических нервов, а именно — функцию ниши стволовых клеток. За период, охватывающий несколько последних лет, концепция периферических нервов, служащих «нишей» и миграционными «магистралями», перешла в разряд мейнстрима и привела к пересмотру того, как формируются многие ткани и типы клеток из нерв-ассоциированных стволовых элементов.
Сегодня мы расскажем одну из самых интересных и долгих историй в нашей достаточно специализированной науке. Мы (см. врезку) — биологи развития, которые пытаются понять, как из одной клетки образуется несколько сотен специализированных клеточных типов, причем в правильном порядке, положении и количестве. Задача нетривиальная, учитывая множество оригинальных решений, которые использует природа. Более того, модификации планов строения и их тонких деталей в процессе эволюции происходят именно на стадии эмбриона. Так происходит, потому что адаптивным модуляциям подвергаются в значительной степени развитийные механизмы. Таким образом, для понимания механизмов эволюции, как и для лечения врожденных заболеваний, требуется детальное представление о процессах развития эмбрионов разнообразных животных и, в том числе, человека.
Эмбриональное развитие можно метафорически представить ландшафтом Уоддингтона , в котором клеточные линии, подобно шарикам, скатываются по «холмам» и «долинам» пространственно-временных паттернов разных молекул-морфогенов, выбирая траекторию движения (рис. 1). В этом смысле развитие подобно шахматной партии, разворачивающейся из единой диспозиции по строго определенным правилам, где каждая последующая ситуация на доске зависит от предыдущей. В отличие от разнообразия шахматных фигур, которое уменьшается в процессе игры, ассортимент клеточных типов в эмбрионе со временем только растет, образуясь из более однородных и мультипотентных эмбриональных предшественников, таких как эктодермальные, мезодермальные и энтодермальные клетки.
Подробнее об этой основополагающей концепции в биологии развития и эпигенетике мы рассказывали в публикациях «Процессы и эпигеном» [1] и «Эпигенетика: невидимый командир генома» [2].
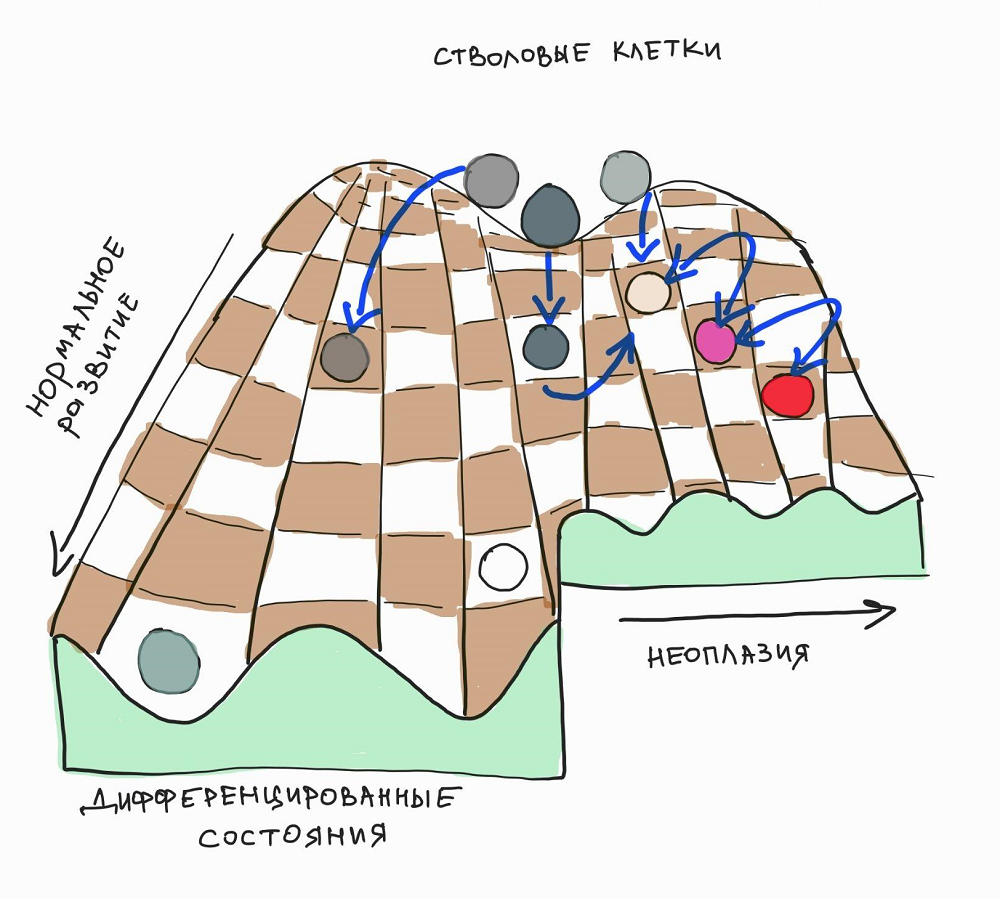
Рисунок 1. Эмбриональное развитие в виде динамической развертки пространственно-временных паттернов, напоминающих Уоддингтоновские ландшафты. Проще говоря, это что-то вроде игры на шахматной доске с набором сложных правил для клеточных линий, развивающихся в динамическом контексте.
иллюстрация Надежды Потаповой
Расшифровкой правил игры «сделай сложный многоклеточный организм, начиная с одной клетки» и занимаются биологи развития (см., например, «Лаборатория молекулярных основ эмбриогенеза: от гена к признаку» [3]). Хотя в нашей области исследований за последние годы произошел невероятный прогресс, мы все еще плохо понимаем многие фундаментальные вопросы, такие как:
- откуда клетки знают, где они точно находятся?
- как клетки-предшественники вычисляют количество необходимых делений для создания органа определенного размера?
- как специальные предшественники попадают в удаленные места эмбриона?
- каким образом закладываются пространственные границы между клеточными типами?
- как кодируются идентичности и функции клеточных типов в процессе развития?
- как формируется многообразие из однообразия?
- что такое клеточный тип в развитии и как его определить?
- и многие другие.
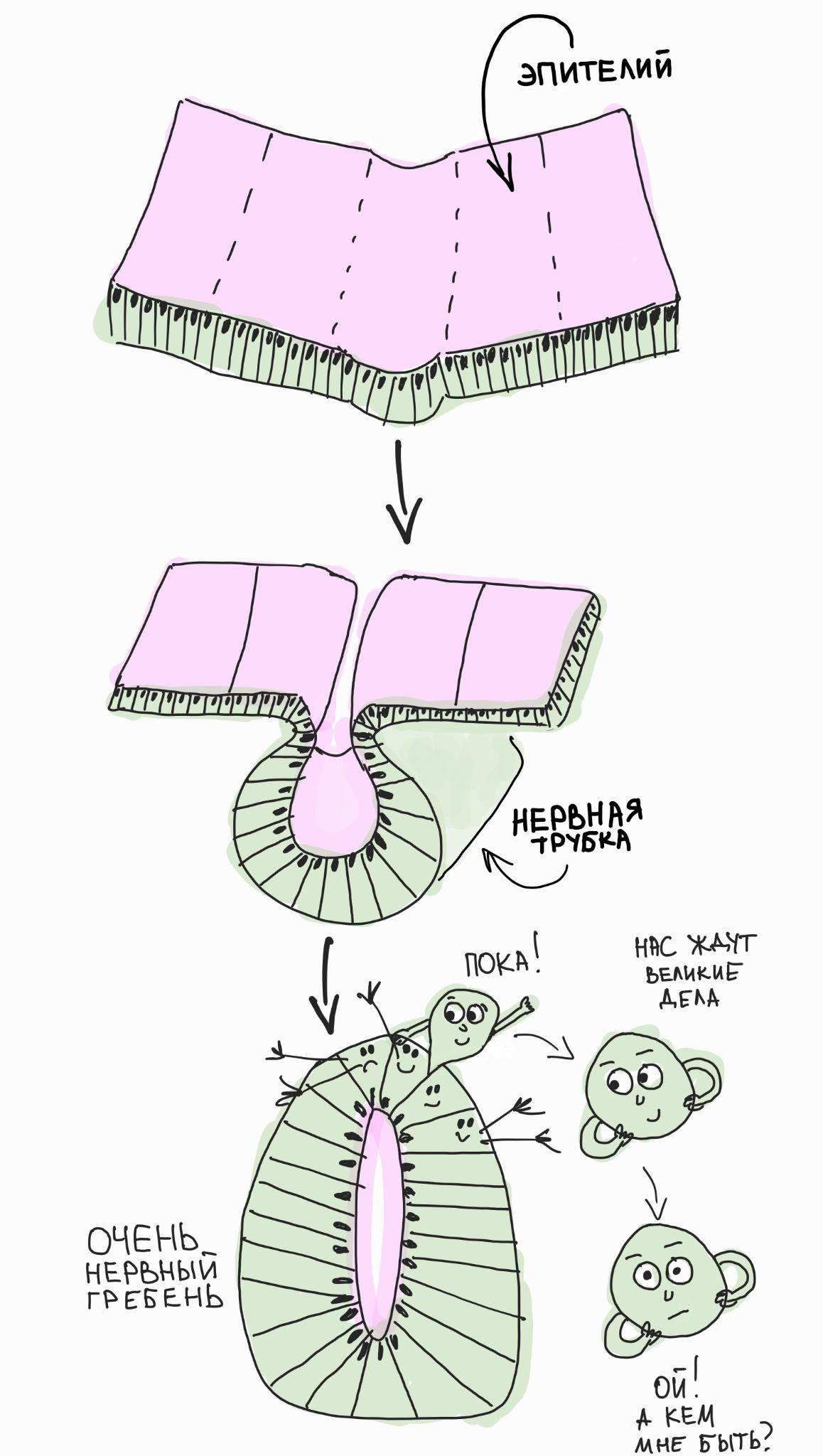
Рисунок 2. Клетки нервного гребня появляются (удивительно!) из нервного гребня и встают перед вопросом — кем же им быть?! Будущий нейроэпителий нервной трубки делает впячивание, чтобы сформировалась полость (выделена розовым цветом). В это время эпителиальные клетки в самом верху впячивания разрывают межклеточные контакты и совершают эпителиально-мезенхимальный переход, после чего отправляются в свободную миграцию. Это, собственно, и есть клетки нервного гребня. В процессе миграции им предстоит выбрать свой собственный путь дифференцировки и дать начало нейронам периферической нервной системы, глиальным клеткам, мезенхимальным скелетогенным предшественникам и многим другим клеточным типам. Как клетки нервного гребня делают такой выбор — большой вопрос и предмет многочисленных исследований.
иллюстрация Надежды Потаповой
Среди множества загадочных клеток-предшественников в эмбрионах позвоночных (в том числе человека) есть особенная группа — клетки нервного гребня, которые образуются на самом верху замыкающейся нервной трубки (рис. 2). Эти клетки имеют нейроэпителиальное происхождение и, в принципе, должны были бы давать начало центральной нервной системе. Однако вместо этого клетки нервного гребня осуществляют эпителиально-мезенхимальный переход и активно выползают из формирующейся нервной трубки. После этого они мигрируют во все возможные места эмбриона и дают начало частям сердца, кишечной (энтеральной) нервной системе, соматосенсорным нейронам в ганглиях дорсального корешка, нейронам автономной нервной системы, периферическим глиальным клеткам, меланоцитам (пигментным клеткам кожи) и даже клеткам будущего лица, включая скелетные ткани, зубы, дермис, периваскулярные клетки, адипоциты и многое другое!
Этот невероятный потенциал клеточных элементов, выползающих из формирующейся центральной нервной системы, ставил в тупик не одно поколение биологов. В какой-то момент клетки нервного гребня предложили считать четвертым зародышевым листком.
Даже такую эволюционную инновацию, как возникновение полноценной головы, челюстей и лицевого отдела у хордовых животных сейчас сводят к возникновению клеток нервного гребня у общего предка всех позвоночных животных! В самом деле, возникновение клеток нервного гребня в процессе эволюции до сих пор покрыто мраком, так как непонятно, каким было то ланцетникоподобное хордовое животное, в котором начался процесс выползания предшественников из развивающейся центральной нервной системы на периферию тела, и что за образ жизни потребовал таких неординарных адаптаций. Поэтому озабоченность ученых проблемой эволюции нервного гребня вполне оправдана. Еще бы, ведь выползание мультипотентных «стволовых» клеток из развивающегося мозга способно поставить в тупик кого угодно.
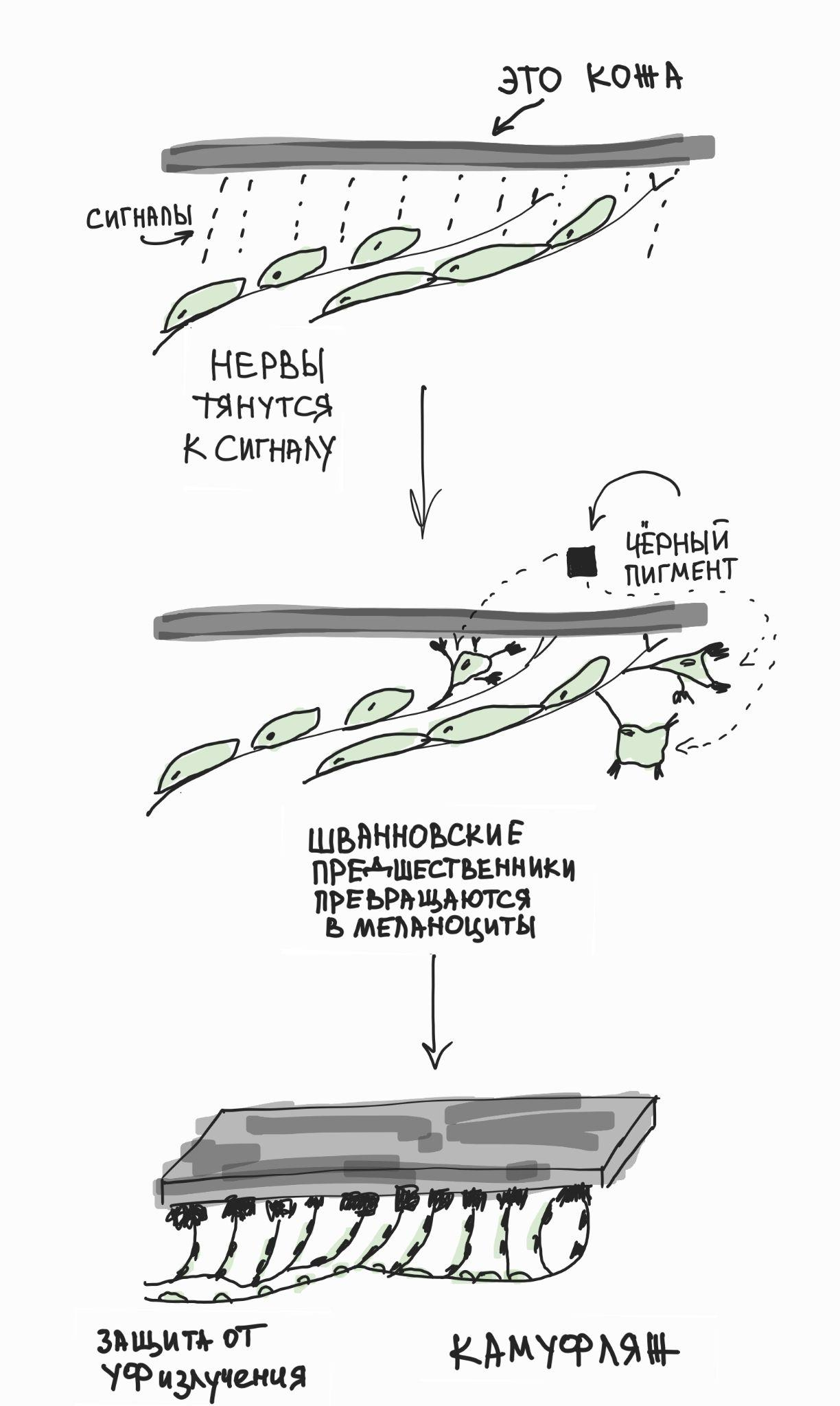
Рисунок 3. Вот как получается, что Шванновские предшественники превращаются в меланоциты. Шванновские прешественники сохраняют часть мультипотентности нервного гребня, отвечая за иннервацию эмбриональной кожи. В определенный момент они отделяются от поверхности нервов и начинают дифференцировку в пигментые клетки (меланоциты), которые защищают от мутагенного УФ-излучения и обеспечивают камуфляж других видов окраски. Задумайтесь о разнообразии пигментации в природе и том, какую роль тут могли бы играть паттерны иннервации кожи!
иллюстрация Надежды Потаповой
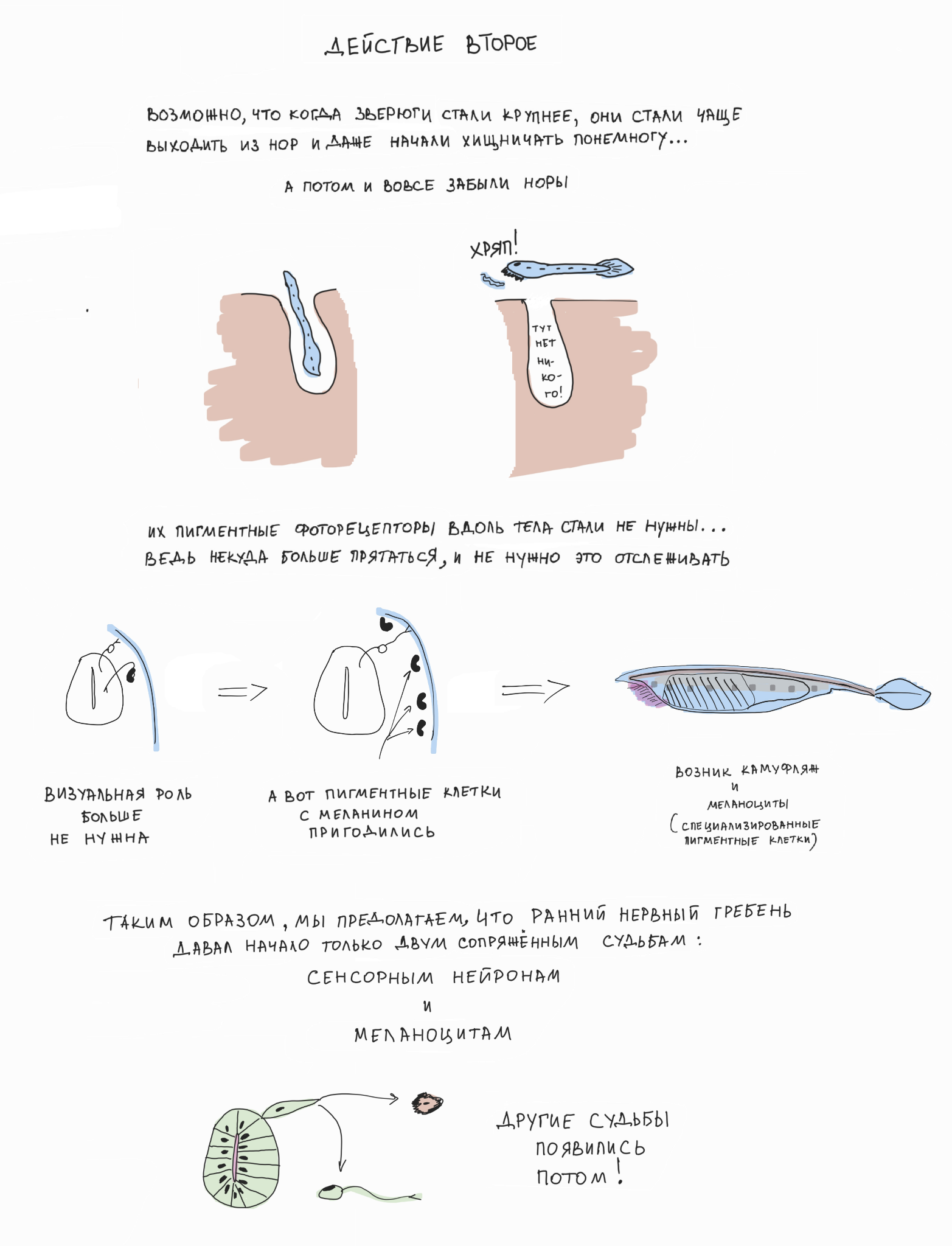
В свое время мы предположили, что эволюционное возникновение нервного гребня было связано с необходимостью развития пигментации и камуфляжа у прозрачных и мелких хордовых животных (похожих на современного ланцетника) при увеличении размера их тела и переходе к активному хищничеству [4]. Так как пигментация у наших хордовых предков встречалась только внутри центральной нервной системы и была ассоциирована с фоторецепторной функцией (надо же делать фоторецепторы направленными!), то выползание предшественников пигментных клеток из развивающейся нервной трубки на периферию тела стало первым шагом к возникновению нервного гребня и его производных — в том числе камуфляжа на поверхности кожи. До сих пор наши пигментные клетки — меланоциты — сохраняют свойства фоторецепторов, экспрессируют меланопсин (один из опсинов — фоторецепторных белков глаза [5]) и отвечают на сильный свет активацией каскада фототрансдукции [4] (рис. 3, рис. 4).
Позднее в эволюции клетки нервного гребня научились кооптировать (или, по-простому, красть) генетические программы развития других клеточных типов — и даже целых клеточных линий, как, например, краниальной мезодермы. Такая кооптация стала возможна за счет прежде недоступной перенастройки эпигенетических состояний генома, которые контролируют возможность активации разных подпрограмм развития (см. спецпроект «Биомолекулы» по эпигенетике). Таким образом, клетки нервного гребня смогли включать нетипичные для них программы мезодермы для более обширной генерации разнообразных клеточных типов. Это расширение репертуара доступных деривативов привело к постепенному возникновению лицевого отдела с собственным скелетом, включая челюсти и зубы — всё из нервного гребня.
В процессе миграции внутри эмбриона клетки нервного гребня должны выбирать свою будущую судьбу из целого спектра возможностей и опций. И загадка тут состоит не столько в том, какие сигналы могут влиять на выбор, сколько какие процессы происходят в клетке в момент самого выбора или непосредственно перед ним. Мы исследовали этот процесс с помощью метода транскриптомики индивидуальных клеток (рис. 5).
И мы обнаружили удивительный феномен: перед тем, как осуществить выбор, клетки нервного гребня активируют противоборствующие генетические программы, каждая из которых подталкивает клетку к одному из двух возможных вариантов выбора. Результат такого противоборства заканчивается победой одной из программ, что ведет к началу дифференцировки клетки по выбранному пути. Совокупность подобных последовательных бинарных выборов обеспечивает весь спектр клеточных судеб в развивающейся и мигрирующей линии клеток нервного гребня [6] (рис. 6).
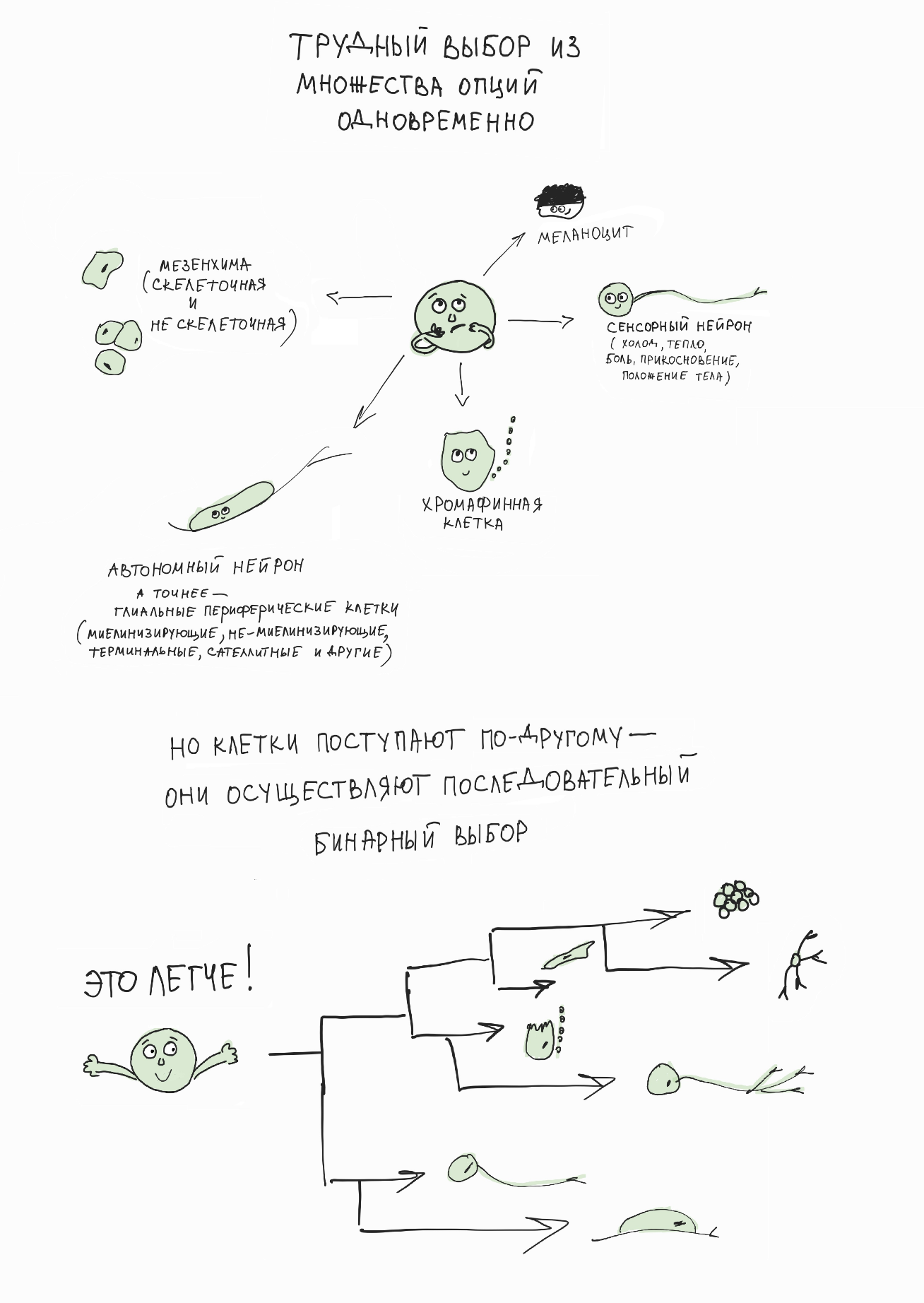
Рисунок 6. Клетка использует бинарный последовательный выбор своей окончательной судьбы и специализации. Это интересно, потому что последовательный и растянутый во времени бинарный выбор лучше защищен от потенциальных ошибок и легче поддается внешнему контролю по сравнению с гипотетическим множественным выбором, который происходил бы одномоментно. Видимо, наибольший процент ситуаций выбора в организме работает именно так (хотя возможны исключения).
иллюстрация Надежды Потаповой
Но давайте вернемся в самое начало истории и расскажем обо всем по порядку! Проследим за тем, как двигались не только клетки нервного гребня (рис. 7), но и наша научная мысль.
Несмотря на невероятную точность и эффективность, миграция клеток нервного гребня имеет ограничения. Проблема в том, что эмбрион растет очень быстро, и расстояния внутри постоянно увеличивающегося тела становятся все длиннее с каждым новым моментом развития. Миграция в эмбрионе, где все динамически меняется, может быть эффективной только на относительно небольших расстояниях и временных диапазонах. Именно поэтому клетки нервного гребня весьма эфемерны: они быстро мигрируют и превращаются в другие клеточные типы в конечных точках миграции, пока эмбрион все еще мал, и расстояния, как и навигационные метки, отмечающие верный путь, еще не успели сильно измениться. Через очень короткое время ситуация в эмбрионе меняется, и, с увеличением общего размера тела, клетки нервного гребня прекращают свое существование, как казалось, навсегда.
Однако такое понимание ситуации долгое время приводило к парадоксам и противоречиям. Ведь даже после того, как клетки нервного гребня исчезают в эмбрионе, различные ткани и органы продолжают развиваться и получать клеточные типы, про которые мы точно знаем, что они возникают из нервного гребня, которого, вроде бы, в эмбрионе на этих стадиях просто нет и быть не может! Откуда же берутся эти загадочные невидимые клетки-предшественники в поздних крупных эмбрионах? Мы взялись ответить на этот вопрос и открыли новый принцип развития мультипотентных клеточных линий.
Мы открыли, что клетки нервного гребня способны превращаться в уникальное промежуточное состояние: многие из них ассоциируются с периферическими нервами и сохраняют мультипотентность под маской эмбриональных глиальных клеток, которые называют предшественниками Шванновских клеток. Размножаясь и путешествуя по нервам, эти мультипотентные клетки достигают даже самых далеких мест в гораздо более крупных поздних эмбрионах позвоночных животных, ведь нервам, как и сосудам, необходимо проникнуть везде, и у них есть для этого свои методы! В местах, где необходимы поздние клеточные типы, которые могли бы возникнуть только из нервного гребня, эти нерв-ассоциированные клетки начинают отсоединяться от локальной иннервации и давать начало другим клеточным типам, в точности повторяя возможности своей материнской популяции — нервного гребня. Таким образом, нервы можно сравнить с рельсами железной дороги, которые строители проводят ко всем местам большой страны и по которым едут поезда (хотя Шванновские предшественники достигают своих мест назначения, просто прикрепившись к растущему нерву, так что аналогия с поездами не совсем верная).
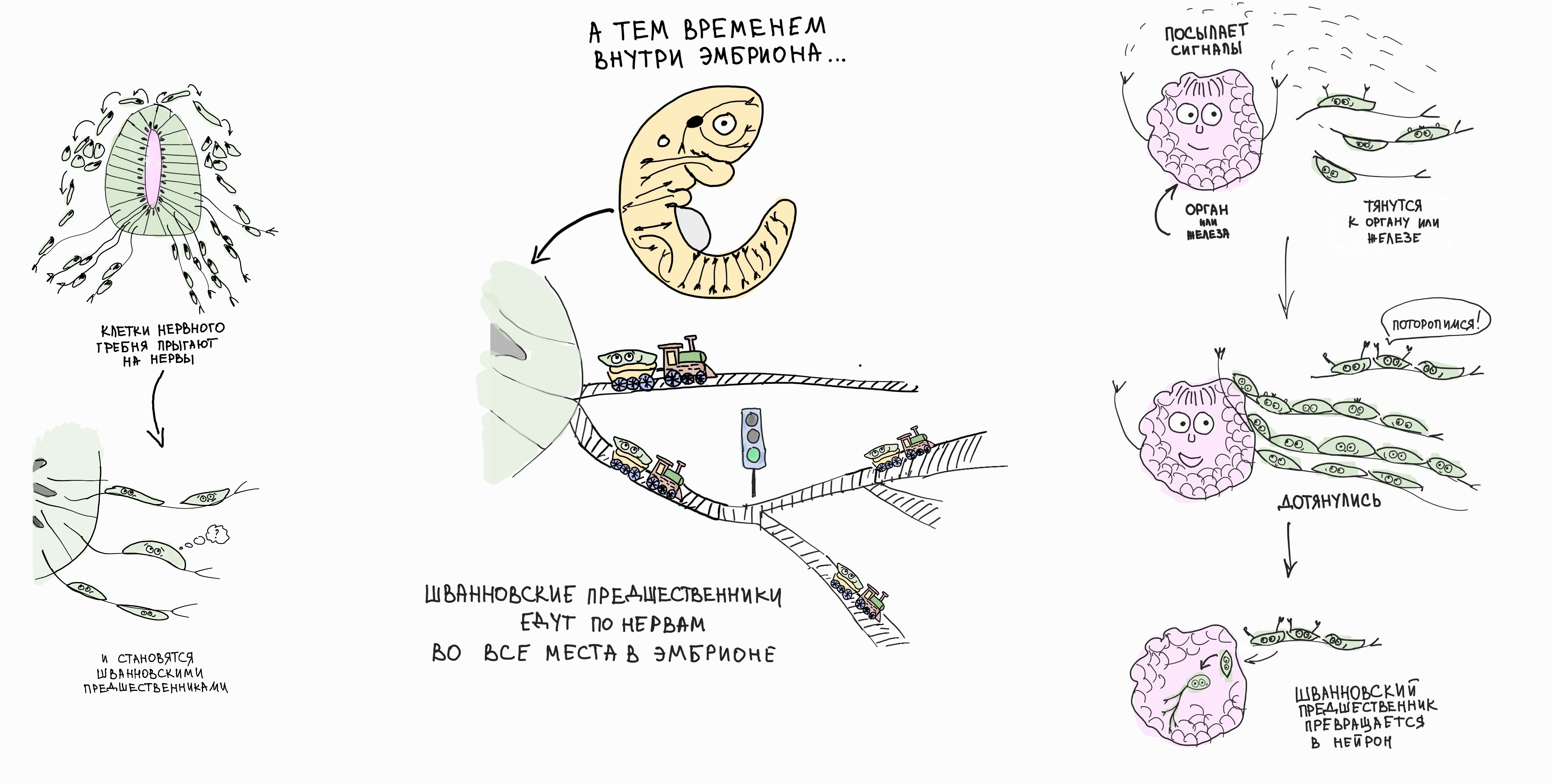
Рисунок 8. Рассказ о том, как Шванновские предшественники последовательно превращаются, например, в парасимпатические нейроны. После фазы миграции большáя доля клеток нервного гребня оседает на прорастающих нервах, превращаясь в Шванновские предшественники. Они все еще мультипотентны, как и их «предки» — клетки нервного гребня. С ростом нервов по всему телу Шванновские предшественники попадают почти во все локации развивающегося эмбриона. В некоторых местах они получают сигналы от развивающихся желез и других органов, и эти сигналы индуцируют интересный переход: Шванновские предшественники отделяются от нервов и дифференцируются в парасимпатические нейроны. Особенно любопытно, что эти новорожденные парасимпатические нейроны тут же иннервируются нервами, которые их туда и «принесли». Этот общий принцип работает не только с нейронами других типов (энтеральными и симпатическими), которые также развиваются из Шванновских предшественников, но и с совсем непохожими клеточными типами (такими как пульпарные клетки зуба и одонтобласты).
иллюстрация Надежды Потаповой
Конечно, процесс исследования нерв-ассоциированных «промежуточных» мультипотентных клеток не был простым. История этого открытия началась в далеком 2007-м году, когда мы исследовали работу молекулярных переключателей, определяющих типы соматосенсорных нейронов, развивающихся из клеток нервного гребня. Это была совершенно другая история с мощным фокусом на выборе сенсорных модальностей у нейронов, ответственных за чувства боли, температуры, прикосновения, положения частей тела в пространстве. Этот проект не был успешным, хотя отнял много сил и времени. Тем не менее, однажды мы заметили, что экспериментальная модуляция активности только одного гена приводит к странному феномену: периферические нервы в эмбрионе избыточно покрываются ползучими клетками, которые отделяются потом от нервов и стремятся непосредственно в кожу эмбриона. Немного подумав, мы протестировали несколько возможных вариантов и определили, что ими оказались меланобласты — пропигментные клетки, которые в будущем созревают и придают цвет нашей коже и волосам, а также помогают слышать звуки и работать нашему сердцу. Почему именно они возникали на поверхности нервов и устремлялись к коже в нашем эксперименте? Как показали более глубокие исследования, это происходило оттого, что экспериментальная модуляция определенного гена повышала чувствительность Шванновских предшественников к специальным эмбриональным сигналам, превращавшим их в пигментные элементы.
Конечно, проведенный эксперимент был искусственным «насилием над природой», а потому было решено проверить, могут ли пропигментные клетки (меланобласты и меланоциты) возникать в нервах, покрытых глиальными клетками, в природных условиях без экспериментального воздействия. К счастью, мы смогли обнаружить это явление и опубликовали первую важную статью на эту тему в журнале Cell в 2009 году [7]. Оказалось, что нормальные меланобласты возникали из небольшой популяции Шванновских предшественников в специальных локациях, которые, в свою очередь, получали специфические молекулярные сигналы из развивающегося эпидермиса. Позднее механизм нерв-зависимой генерации меланобластов и меланоцитов получил широкое признание и стал особенно актуален для понимания возникновения меланомы и эмбриональных патологий пигментации. Вполне возможно, что открытие этого механизма возникновения меланоцитов из периферических нервов в будущем поможет разрешить загадку формирования генетически запрограммированных и видоспецифичных паттернов пигментации — полос и пятен на теле (как у зебр, жирафов и многих других животных).
После такого амбициозного начала истории о происхождении пигментных клеток наша лаборатория смогла поставить более общий вопрос: не может ли механизм возникновения меланоцитов из нерв-ассоциированных предшественников быть на самом деле более общим и работать неким аналогичным образом на более широкий спектр клеточных типов, про которые мы плохо понимаем их происхождение в эмбрионах?
Для того, чтобы генерализовать эту идею, мы проводили много времени за анализом научной литературы и пришли к выводу, что отложенное возникновение в эмбрионе парасимпатических ганглиев и мозгового вещества надпочечников нельзя объяснить в рамках парадигмы свободной и скоротечной миграции клеток нервного гребня на очень ранних стадиях развития. Фактически, клетки нервного гребня не смогли бы доползти до будущих областей автономных парасимпатических ганглиев и надпочечников, так как в этот ранний период соответствующие структуры еще и не начали развиваться.
Мы поняли, что должна быть промежуточная стадия, заполняющая долгий временной пробел между окончанием миграции нервного гребня в эмбрионе и более поздним формированием парасимпатической нервной системы и адренергических популяций надпочечников. К этому моменту мы имели на руках ряд точных технологий, позволяющих детально посмотреть на превращения клеток нервного гребня в любые промежуточные или окончательные клеточные типы. Воспользовавшись инструментами генетического маркирования клеток с помощью Cre-Lox системы (это позволяет избирательно метить клетки-предшественники и их потомство флуоресцентными белками), мы установили, что, действительно, парасимпатические нейроны и хромаффинные клетки надпочечников возникают не из свободных клеток нервного гребня, а из более поздних клеток-предшественников внутри прорастающих нервов, которые приходят из развивающегося спинного мозга. Предшественники Шванновских клеток, населяющие эти спинномозговые нервы, отделяются от нервных волокон и превращаются в нейроны и нейроэндокринные клетки — будущие мишени для моторной иннервации, которая сама их и доставила в правильную локацию внутри эмбриона [8], [9].
Последующий систематический анализ перехода из Шванновских предшественников в другие локальные клеточные типы с помощью транскриптомики индивидуальных клеток показал, что сам этот переход является короткоживущим клеточным типом с индивидуальной быстрой генетической программой, приводящей к возникновению специализированных клеток. Именно транскриптомика индивидуальных клеток и анализ транскрипционных ландшафтов позволяют детально анализировать подобную динамику и возникновение «нестабильностей», необходимых для перехода одного клеточного типа в другой. К счастью, именно система пластичных мультипотентных клеток нервного гребня и Шванновских предшественников стала удобной моделью для анализа способов принятия решений о переходах и будущей дифференцировке [9], [10].
Несмотря на то, что мы выпустили ряд крупных статей в Cell, Nature и Science, детально описав феномен мультипотености Шванновских предшественников, научное сообщество отнеслось к нашим открытиям с большим скепсисом. После публикации очередной статьи в 2014 году мы встретились с самым уважаемым человеком в нашей области исследований и узнали, что многие ученые считают наши результаты несколько странными и невероятными. Мы были несколько расстроены этой ситуацией и даже не смели надеяться, что через два года наши коллеги опубликуют статью в Nature с подтверждением принципа нерв-ассоциированных мультипотеных клеток в эволюционно древней модельной системе круглоротого животного (миноги), где клетки, транспортируемые на поверхности нервов, дают начало всей энтеральной нервной системе кишечника [11]. С этого момента отношение ученого сообщества к нам изменилось, и наша маленькая область стала весьма горячей даже в сравнении с мейнстримными областями биологии развития. Немного позднее многие другие научные группы вовлеклись в работу по мультипотентности нерв-ассоциированных клеток и рассказали свои собственные потрясающие истории про их превращения в эмбрионах [12].
Суммируя открытия последнего времени, можно предположить, что мультипотентные предшественники Шванновских клеток, населяющие эмбриональные нервы, являются эволюционно наиболее древним и, вероятно, архетипичным вариантом клеток нервного гребня. В самом деле, миграция по нервам весьма проста, так как не требует сложных навигационных программ, которые возникали в процессе эволюции постепенно и в течение длительного времени для обеспечения свободной миграции нервного гребня через разнообразные ткани. Вполне возможно, что все древние клетки нервного гребня ползали только по нервам, и лишь позднее освоили тактику свободных путешествий, чтобы не быть привязанными ко времени начала иннервации и иметь возможность давать начало гораздо более ранним эмбриональным зачаткам и клеточным типам [4]. С этой точки зрения предшественники Шванновских клеток и есть самый эволюционно ранний вариант нервного гребня. Подобная логика также позволяет нам рассматривать предшественники Шванновских клеток как нерв-ассоциированный и долгоживущий вариант нервного гребня. Вполне возможно, что Шванновские предшественники сохраняются в нервах взрослых людей и играют важную роль в регенерации поврежденных тканей и органов. Таким образом, гипотетически, нервный гребень никогда не заканчивается, а лишь переходит в разные состояния в зависимости от размера тела, наличия иннервации, общего здоровья, стадии развития и, возможно, даже возраста.
Сейчас, на своем пике популярности, предшественники Шванновских клеток привлекают внимание исследователей и как источник ряда детских опухолей, например, нейробластомы или саркомы Юинга. Кроме того, совсем недавно выяснилось, что механизм развития мозгового вещества надпочечника из Шванновских предшественников имеет уникальные особенности в эмбрионах человека и потому уязвим в плане возникновения нейробластомы из-за необычной топологии переходных состояний, берущих начало из нерв-ассоциированных клеток линии нервного гребня [10].
В заключение стоит сказать, что в настоящее время десятки научных групп по всему миру продолжают исследовать регенеративные и другие свойства нерв-ассоциированных клеток. Мы тоже продолжаем работать в этом и других направлениях биологии нервного гребня. Есть надежда, что новое понимание Шванновских предшественников позволит в будущем лучше лечить определенные виды рака, а также управлять эмбриональным развитием человека, предотвращая негативный исход многих врожденных заболеваний — особенно тех, которые затрагивают развитие лица и периферической нервной системы. На фундаментальном уровне, работа в этом направлении поможет лучше понять раннюю эволюцию хордовых и позвоночных животных, в том числе для того, чтобы ответить на вопросы возникновения четырехкамерного сердца, продвинутой сенсорной нервной системы, пигментации, а также челюстей, зубов и лицевого отдела в целом. Интересно, что именно благодаря клеткам нервного гребня люди имеют индивидуальные лица, с помощью которых способны узнавать друг друга. Очевидно, что клетки нервного гребня и Шванновские предшественники до сих пор хранят секреты нашей внешней индивидуальности и социальных аспектов эволюции человека, связанных с распознаванием лиц.
Литература
- Процессы и эпигеном;
- Эпигенетика: невидимый командир генома;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Evgeniy Ivashkin, Igor Adameyko. (2013). Progenitors of the protochordate ocellus as an evolutionary origin of the neural crest. EvoDevo. 4, 12;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Ruslan Soldatov, Marketa Kaucka, Maria Eleni Kastriti, Julian Petersen, Tatiana Chontorotzea, et. al.. (2019). Spatiotemporal structure of cell fate decisions in murine neural crest. Science. 364;
- Igor Adameyko, Francois Lallemend, Jorge B. Aquino, Jorge A. Pereira, Piotr Topilko, et. al.. (2009). Schwann Cell Precursors from Nerve Innervation Are a Cellular Origin of Melanocytes in Skin. Cell. 139, 366-379;
- Vyacheslav Dyachuk, Alessandro Furlan, Maryam Khatibi Shahidi, Marcela Giovenco, Nina Kaukua, et. al.. (2014). Parasympathetic neurons originate from nerve-associated peripheral glial progenitors. Science. 345, 82-87;
- Alessandro Furlan, Vyacheslav Dyachuk, Maria Eleni Kastriti, Laura Calvo-Enrique, Hind Abdo, et. al.. (2017). Multipotent peripheral glial cells generate neuroendocrine cells of the adrenal medulla. Science. 357;
- Polina Kameneva, Artem V. Artemov, Maria Eleni Kastriti, Louis Faure, Thale K. Olsen, et. al.. (2021). Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nat Genet. 53, 694-706;
- Alexander A. Green, Jongmin Kim, Duo Ma, Pamela A. Silver, James J. Collins, Peng Yin. (2017). Complex cellular logic computation using ribocomputing devices. Nature. 548, 117-121;
- Meng Xie, Dmitrii Kamenev, Marketa Kaucka, Maria Eleni Kastriti, Baoyi Zhou, et. al.. (2019). Schwann cell precursors contribute to skeletal formation during embryonic development in mice and zebrafish. Proc. Natl. Acad. Sci. U.S.A.. 116, 15068-15073.