
Войны клонов. Фаговые камикадзе в борьбе за субстрат
26 июля 2021
Войны клонов. Фаговые камикадзе в борьбе за субстрат
- 755
- 0
- 2
На обложке бактерия оказалась в окружении фаговых частиц, а клон из к/ф «Звездные войны» оказывает ей моральную поддержку
рисунок авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Бактерии используют самые разные стратегии борьбы с конкурентами. Не так давно было найдено новое оружие, которое они могут использовать в войне друг против друга, а именно — умеренные вирусы. О том, как зараженная популяция не погибает сама и каков механизм этого процесса, и пойдет речь в статье.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Однажды на далеком-далеком субстрате
Жизнь бактерий полна опасностей. То субстрат истощится, то ближайший сосед выделит антибиотик для того, чтобы уменьшить конкуренцию, то условия среды изменятся, и придется подстраиваться под них для выживания. Разумеется, бывают моменты, когда питательного субстрата много, а соперников нет, но в целом жизнь бактерий — это постоянная борьба за существование, и, соответственно, эволюционная гонка вооружений.
Чтобы подпортить друг другу жизнь, бактерии используют разнообразные способы, самый известный из которых — выделение антибиотиков (рис. 1). У многих видов микроорганизмов активность синтеза антибиотиков возрастает в присутствии других видов или продуктов их метаболизма [1].
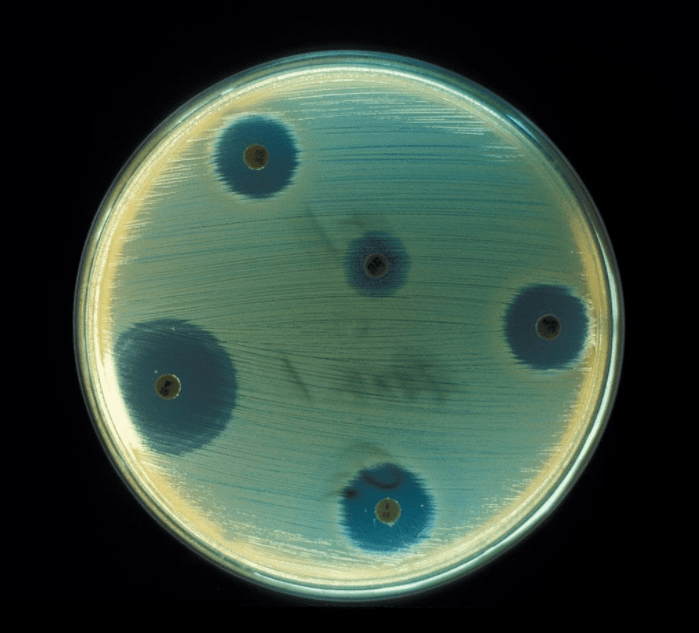
Рисунок 1. Тест на чувствительности бактерий к антибиотикам. На поверхность чашки Петри помещены диски, пропитанные разными антибиотиками. Прозрачная зона вокруг диска — рост бактерий подавлен действием антибиотика.
Именно благодаря способности микробов выделять токсичные для конкурентов вещества и был впервые открыт пенициллин — антибиотик широкого спектра действия, который когда-то помог человечеству справиться со многими тяжелыми заболеваниями.
История этого открытия уже стала хрестоматийной: в 1928 году Александр Флеминг изучал сопротивление организмов стафилококковым инфекциям, но несколько чашек Петри, в которых он выращивал колонии этого микроорганизма, были заражены грибом Penicillium notatum. Плесень нередко вырастает на питательных средах, используемых для культивирования бактерий, мешая исследователям, однако в данном случае именно она позволила совершить грандиозное для человечества открытие. Вокруг пятен плесени Александр Флеминг заметил область, свободную от бактерий, из чего сделал вывод, что этот гриб способен выделять вещество, убивающее их [2].
Позже удалось выделить другие антибиотики из различных природных источников, немалую часть которых составили вещества, выделенные из бактерий (полимиксины из Bacillus polymyxa, бацитрацины и субтилизин из Bacillus subtilis, низин из Streptococcus lactis).
Однако в 2019 году открыли принципиально новый способ бактерий справляться с конкуренцией за субстрат — убивать друг друга при помощи вирусов — бактериофагов .
Бактериофаги — это вирусы прокариот, соответственно, они поражают бактерий и архей, но не эукариот. В данной статье речь пойдет исключительно о фагах бактерий.
Как фаги живут. Жизненные циклы и их регуляция
Попадая в клетку, бактериофаг может направить свою жизнь по лизогенному или литическому пути (рис. 2). В ходе литического цикла фаг внедряется в геном бактерии и заставляет ее синтезировать свои копии, которые постепенно заполняют всю цитоплазму бактериальной клетки и разрывают клеточную стенку, выходя в окружающую среду и заражая новые клетки. Это классическая картина жизненного цикла вируса, которую мы привыкли видеть, однако бактериофаги обладают своей спецификой. У них возможно альтернативное развитие событий — лизогенный цикл — внедрение генома фага в бактериальную ДНК и переход в «спящий режим». При этом новые вирусные частицы не образуются, клетка чувствует себя нормально, неуязвима к повторному заражению и может спокойно делиться. Фаги, развивающиеся путем лизогении, называются умеренными. В дальнейшем такие встроенные в хозяйский геном вирусы могут накапливать мутации, безвозвратно утрачивать активность и даже приносить своему хозяину пользу, но об этом после.
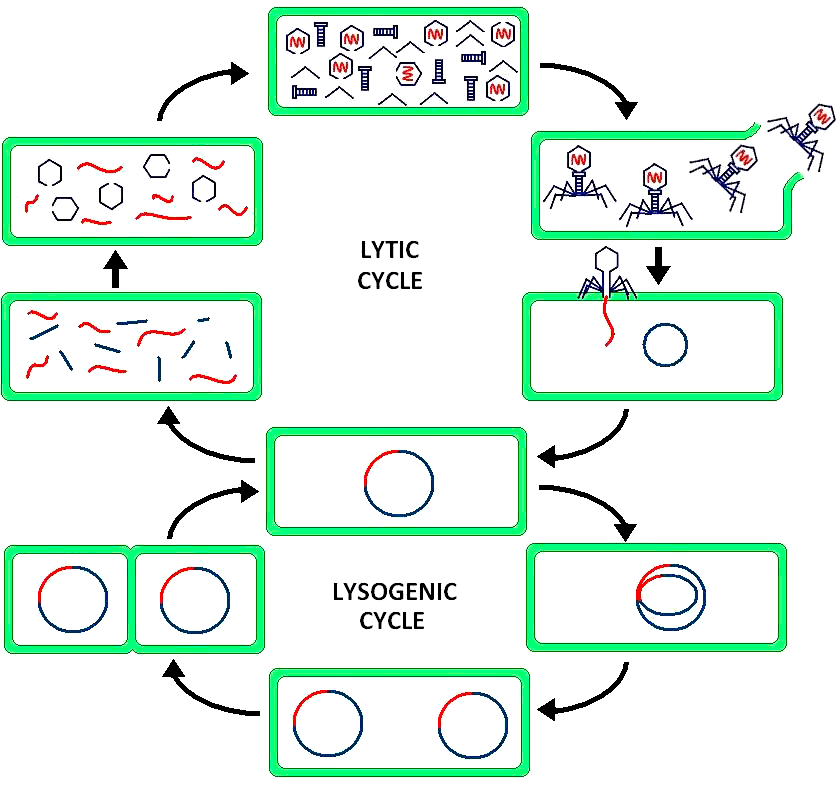
Рисунок 2. Сравнение литического цикла и лизогенного. Литический цикл — это тип размножения вируса, который приводит к разрушению (лизису) инфицированной клетки. В лизогенном же цикле ДНК только удваивается, но не вирусные частицы не собираются и клетка не гибнет.
Но как происходит переключение между этими двумя циклами?
Кворум фагов
С момента открытия бактериофагов в 1917 году ученых мучил вопрос о том, что же заставляет эти вирусы в разных условиях использовать различные стратегии поведения. Ровно спустя столетие — в 2017 году — завеса тайны приоткрылась: исследователи обнаружили белок, участвующий в регуляции жизненного цикла фагов. Группа ученых проанализировала вещества, выделяемые культурой бактерий при заражении вирусом, и обнаружила сигнальный пептид AimP, от которого ферментами отрезалась последовательность из шести аминокислот и секретировалась во внешнюю среду. Этот укороченный пептид, как впоследствии выяснилось, кодировал бактериофаг phi3T, блокируя лизис бактериальных клеток и стимулируя ту самую лизогению — переход в «спящее» состояние (рис. 3). Изначально авторы рассчитывали обнаружить, что бактерии предупреждают друг друга о заражении вирусом, однако оказалось, что это делают сами вирусы. Фаг заставляет клетку синтезировать пептид, который регулирует экспрессию генов в другой клетке, но информация о нем закодирована именно в геноме вируса. Если такого пептида становится много, значит, много и зараженных клеток — следовательно, если вирусы продолжат в том же духе, популяция бактерий вымрет, а вместе с ней и сами вирусы. Этот пептид назвали арбитриумом, именно от его концентрации зависит, умрет бактериальная клетка или вирус позволит ей жить и размножаться , [3–5].
Подробно об «общении» фагов при помощи арбитриума «Биомолекула» уже рассказывала в статье «Бактериофаг-1 Бактериофагу-2, прием!» [5].

Рисунок 3. Фаги используют малые пептиды для коммуникации друг с другом. а — Bacillus subtilis, инфицированные фагом phi3T. Исследователи идентифицировали фаговый белок AimP, который подвергается ферментно-опосредованному расщеплению с образованием пептидного фрагмента, который экспортируется из бактериальной клетки. Этот фрагмент, названный арбитриумом, обеспечивает межклеточную вирусную коммуникацию. б — Арбитриум захватывается соседними клетками через бактериальный белок-переносчик. Если концентрация арбитриума мала, фаг «выбирает» литический путь и уничтожает клетку с выделением во внешнюю среду большого количества вирусов. в — При высокой концентрации арбитриума фаг «решает» подождать более благоприятного момента для начала размножения.
Так концентрация арбитриума позволяет фагам понять, сколько клеток в окружающей среде заражено ими, и перейти в тот или иной цикл, а также отличить зараженную популяцию от незараженной.
Войны клонов. А точнее — штаммов
Долгое время считалось, что бактерии — убежденные индивидуалисты и не способны к сложным скоординированным действиям. Однако с открытием чувства кворума — способности микроорганизмов регулировать поведение популяции за счет выделения определенных веществ (аутоиндукторов) это мнение претерпело значительные изменения. При помощи специальных молекул бактерии могут общаться друг с другом и со своим хозяином, подстраиваясь под изменяющееся окружение [6], [7].
Важную роль здесь играет самоидентификация бактерий-клонов внутри одного штамма — то есть потомков одной клетки, обладающих одинаковым генетическим материалом. Штамм — это субпопуляция, обладающая характерными только для нее свойствами.
В исследовании 2019 года группа ученых заметила, что между двумя штаммами E. coli на питательной среде образуется четкая граница без роста клеток. Эта граница была названа демаркационной линией, как линия, разделяющая две воюющие стороны. Сравнение довольно точное, ведь, по сути, демаркационная линия это место гибели сотен тысяч клеток, место, которое не может пересечь бактериальная колония. Исследователи использовали библиотеку штаммов кишечной палочки, состоящую из более чем 4000 нокаутированных генов и заметили, что демаркационная линия исчезает только в одном случае — если нокаутирован ген, необходимый для размножения некоторых фагов, в частности, фага CPS-53.
Оказалось, что один из штаммов нес в себе генетическую информацию фага CPS-53, перешедшего в лизогенный цикл, и именно он играл роль в распознавании «свой—чужой» между штаммами. Но этот фаг не активен, он просто встроен в ДНК бактерии и не может лизировать клетки, а значит, демаркационная линия образуется под воздействием другого вируса. В дальнейших экспериментах оказалось, что помимо узнавания «своего» штамма CPS-53 способствовал размножению другого фага, выделяя необходимый тому белок YfdM. Этим фагом оказался SW-1 — именно он брал на себя роль «биологического оружия» (рис. 4) [8].

Рисунок 4. Демаркационная линия между двумя штаммами. Слева — штамм, несущий профаг; справа — не несущий. Видно, что в штамме, изображенном справа, при столкновении с активным фагом лизис происходит чаще.
Но почему же тогда от вируса страдал только один штамм из двух? Бактериофаг, конечно, заражал обе популяции, но бактерий из штамма, уже пораженного CPS-53, он реже убивал, то есть — чаще переходил в лизогенный (скрытый) цикл. По-видимому, этот фаг поддерживает постоянную численность в устойчивой популяции и при столкновении с новой начинает активное размножение, полностью уничтожая ее.
Если это предположение верно, то фаг SW-1 переносится с «устойчивого» штамма на конкурента и уничтожает его, позволяя первым спокойно жить дальше и мирно поедать субстрат.
Как так получается? Дело в том, что у двух этих вирусов, по-видимому, одинаковый белок-арбитриум — YfdM. То есть, возвращаясь назад, бактериофаг «чувствует», что популяция уже заражена и нет смысла переходить в активную фазу, убивая ее; он заражает ее клетки, но инфекция не развивается. В результате страдают лишь бактерии, не несущие спящего фага и не выделяющие арбитриум. В статье говорится, что для идентификации «свой—чужой» кишечные палочки могут использовать разные фаги, а значит, этот механизм применим не только для CPS-53 и SW-1.
На данный момент известно как минимум несколько примеров, когда профаг придает лизогенизированным бактериям иммунитет ко второй инфекции [9], [10].
Заключение. Химическая и биологическая война
Бактерии могут использовать фаги и по-другому. Бактериоцины — это специфические белки, подавляющие жизнедеятельность бактериальных клеток. Некоторые бактериоцины имеют фаговое происхождение: умеренные бактериофаги кодируют гены синтеза веществ, убивающих соседние клетки и обеспечивающих хозяевам конкурентное преимущество. Таким образом штамм с помощью фага приобретает новое оружие в борьбе за выживание. В природе между различными бактериями бушует настоящая химическая война [11–13].
Однако, как мы уже знаем, конкуренция может идти и с использованием фагов напрямую, что сравнимо с войной биологической.
К сожалению, пока этот механизм недостаточно изучен. Да, возможно, что бактерии научились использовать запчасти от спящего фага для борьбы с активным, и это позволяет их штамму выигрывать в конкуренции. Но действительно ли такая защита играет существенную роль в конкуренции или выводы исследователей поспешны? Возможно, мы имеем дело со случайным совпадением арбитриумов, и в природе подобных «войн клонов» с использованием фагового оружия не происходит?
По предварительным оценкам, число видов бактериофагов в природе составляет около 1015, а это значительно больше, чем общее число видов бактерий — от 107 до 109. Следовательно, вариантов их взаимоотношений может существовать великое множество [14], [15].
А раз так, возможно ли, что бактерии даже могут пропускать через свои защитные системы некоторые наиболее безобидные фаги? Бактерия, зараженная умеренным фагом, получает значительные преимущества перед остальными, такие как возможность избежать заражения литическим фагом. У бактерий есть множество способов защиты от вирусов и вполне вероятно, что не все механизмы нам известны.
А пока что в руках ученых оказался интересный и функциональный инструмент. Возможно, в будущем удастся подобрать два фага с одинаковым арбитриумом, заразить нужный штамм одним из них и дождаться перехода в лизогенный цикл. После этого останется подселить их в нужное нам место и заразить вторым фагом, тогда нужный нам, «защищенный» штамм сможет победить в конкурентной борьбе с другими представителями своего же вида. Это поможет в медицине при уничтожении патогенных штаммов.
К сожалению, с момента выхода первой статьи исследования по этой теме не продвигались. Возможно, это лишь частный случай, осуществимый только на чашках Петри, а может, этот механизм используют и другие бактерии в своей конкурентной борьбе где-то в далекой-далекой галактике.
Литература
- Организация и технологии промышленного производства препаратов антибиотиков. Сочетание биосинтеза, органического синтеза, химической и биологической трансформации при создании лекарственных средств (на примере антибиотиков). Рязанский государственный медицинский университет;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Zohar Erez, Ida Steinberger-Levy, Maya Shamir, Shany Doron, Avigail Stokar-Avihail, et. al.. (2017). Communication between viruses guides lysis–lysogeny decisions. Nature. 541, 488-493;
- Alan R. Davidson. (2017). Phages make a group decision. Nature. 541, 466-467;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Yung-Hua Li, Xiaolin Tian. (2012). Quorum Sensing and Bacterial Social Interactions in Biofilms. Sensors. 12, 2519-2538;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- Sooyeon Song, Yunxue Guo, Jun-Seob Kim, Xiaoxue Wang, Thomas K. Wood. (2019). Phages Mediate Bacterial Self-Recognition. Cell Reports. 27, 737-749.e4;
- Amos B. Oppenheim, Oren Kobiler, Joel Stavans, Donald L. Court, Sankar Adhya. (2005). Switches in Bacteriophage Lambda Development. Annu. Rev. Genet.. 39, 409-429;
- Stephen T. Abedon. (2015). Bacteriophage secondary infection. Virol. Sin.. 30, 3-10;
- Emma L. Denham, Sjouke Piersma, Marleen Rinket, Ewoud Reilman, Marcus C. de Goffau, Jan Maarten van Dijl. (2019). Differential expression of a prophage-encoded glycocin and its immunity protein suggests a mutualistic strategy of a phage and its host. Sci Rep. 9;
- Dragoš A., Andersen A.J.C., Lozano-Andrade C.N., Kempen P.J., Kovács Á.T., Strube M.L. (2020). Phages weaponize their bacteria with biosynthetic gene clusters. bioRxiv;
- Фаги-оруженосцы на службе у бактерий;
- T. P. Curtis, W. T. Sloan, J. W. Scannell. (2002). Estimating prokaryotic diversity and its limits. Proceedings of the National Academy of Sciences. 99, 10494-10499;
- Мирошников К. (2013). Как действует бактериофаг. «Популярная механика». 10.







