Влияние бактериальных внеклеточных везикул на нейродегенеративные заболевания
06 февраля 2025
Влияние бактериальных внеклеточных везикул на нейродегенеративные заболевания
- 334
- 0
- 5
Бактерии способны влиять на нервную систему человека с помощью внеклеточных везикул.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: На сегодняшний день проблема нейродегенеративных заболеваний очень актуальна. Миллионы человек страдают от болезней из этой группы, а по-настоящему эффективного лечения еще найдено не было. Ученые обнаружили тесную связь между кишечной микробиотой и развитием нейродегенеративных заболеваний. Бактерии выделяют внеклеточные везикулы, которые могут проходить через гематоэнцефалический барьер (ГЭБ) и влиять на нервную систему. Каким же образом это им удается? И можно ли как-то использовать бактериальные везикулы во благо?
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Нейродегенеративные заболевания — ситуация на настоящий момент
Нейродегенеративные заболевания — это группа медленно прогрессирующих наследственных или приобретенных заболеваний нервной системы. Общим признаком для них является гибель нервных клеток, ведущая к различным последствиям разной тяжести. Самое страшное, что каждый год все больше и больше людей подвергается болезням из данной группы, а достаточно эффективного полного лечения для них еще не найдено. На настоящий момент около 15% населения Земли страдает от неврологических заболеваний, причем значительную часть составляют нейродегенеративные заболевания [1].
К данной группе относятся болезнь Альцгеймера, Паркинсона, боковой амиотрофический склероз (БАС) и другие. Нейродегенеративные заболевания, например, болезнь Альцгеймера, могут появиться с возрастом [2]. По статистике, каждый десятый человек старше 65 лет подвержен болезни Альцгеймера [3]. Нарушение работы митохондрий, неправильное сворачивание белков, нейровоспаление — все это признаки нейродегенеративных заболеваний. На настоящий момент не существует по-настоящему эффективного лечения данных заболеваний, поэтому исследования в данной области очень актуальны и важны.
При чем тут кишечная микробиота?
Всем известно, что в организме человека живут бактерии. Их число может достигать 100 триллионов клеток. Они играют огромную роль в жизни человека, участвуя в обмене важных органических соединений, выведении токсинов, синтезе витаминов. Бактерии кишечника защищают организм человека от болезнетворных бактерий и участвуют в формировании иммунитета. Кроме того, микробиота влияет на клетки ЖКТ, обеспечивая их правильное функционирование, и помогает осуществлять коммуникацию между клетками. При нарушении состава микроорганизмов возникает «дисбактериоз», который может привести к развитию многих заболеваний. Каким же образом бактерии могут «общаться» с клетками человека и влиять на них?
Бактерии влияют на клетки человека с помощью бактериальных внеклеточных везикул (БВВ). БВВ обеспечивают «коммуникацию» между бактериальными клетками и клетками человека, а вещества, которые в них находятся, приводят к тем или иным изменениям в клетках. Оказывается, бактерии способны влиять на мозг человека. Такая связь называется осью кишечник—мозг. Изменение в составе кишечной микробиоты может способствовать изменению социального поведения и свойств памяти [4]. Кроме того, это может быть одной из причин возникновения заболеваний нервной системы, например, ряда нейродегенеративных заболеваний (болезни Альцгеймера, Паркинсона), а также депрессии и тревожности [5]. Причем связь кишечник—мозг работает в обе стороны: не только бактерии могут влиять на центральную нервную систему человека, но и она, в свою очередь, может влиять на состав кишечной микробиоты.
Что такое внеклеточные везикулы и их биогенез?
Внеклеточные везикулы характерны для всех доменов жизни: прокариот, эукариот и архей. Например, у млекопитающих представлены следующие типы везикул: экзосомы, апоптотические тельца и микровезикулы. Они различаются по размеру и по происхождению. Бактериальные везикулы схожи с эукариотическими по следующим признакам: по сферической форме, размеру — 10-400 нм, физико-химическим свойствам, способностью переносить генетический материал. Однако в данной статье мы детально рассмотрим именно бактериальные внеклеточные везикулы. Бактериальные внеклеточные везикулы (БВВ) — это окруженные мембраной маленькие частицы, которые выделяют бактерии (рис. 1) [6]. Они содержат различные биоактивные вещества, например, белки, липиды и нуклеиновые кислоты. Содержимое везикул может меняться в зависимости от цели, до которой они доставляют свой «груз». А мембрана защищает его от агрессивной среды. Интересно, что бактериальные везикулы могут проходить через гематоэнцефалический барьер (ГЭБ). Далеко не все молекулы могут преодолеть данный барьер, но везикулы могут им в этом помочь. Причем это могут быть как полезные вещества, например, какие-нибудь лекарственные соединения, так и вредные, приводящие к развитию того или иного заболевания.
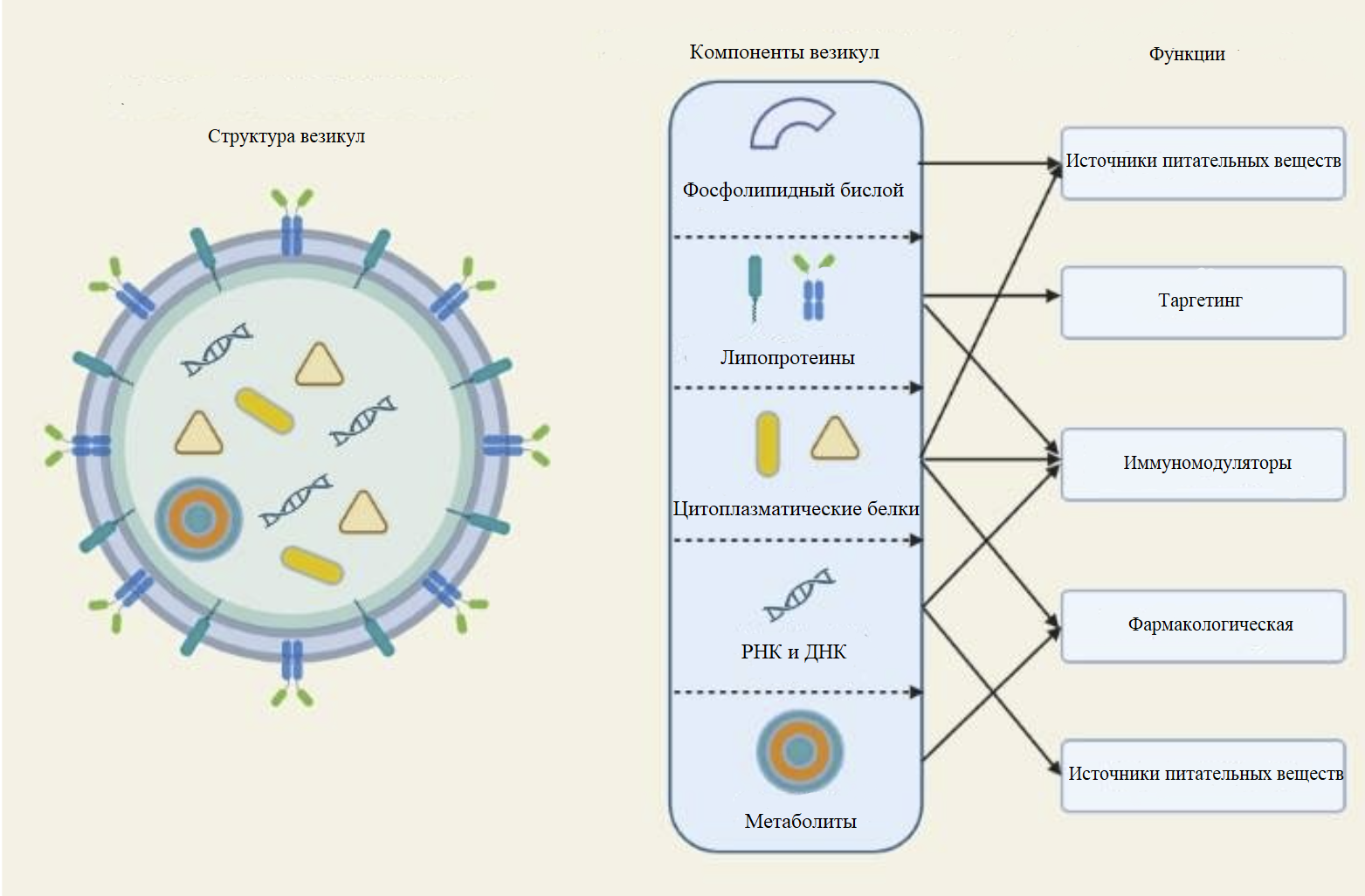
Рисунок 1. Структура бактериальных внеклеточных везикул (БВВ). Бактериальные везикулы могут переносить различные белки, нуклеиновые кислоты, липиды и другие биоактивные вещества.
Впервые внеклеточные бактериальные везикулы были открыты у E. coli в 1960 году. Ученые обнаружили, что бактерии выделяют маленькие пузырьки, в состав которых входит липополисахарид — компонент клеточной стенки грамотрицательных бактерий [7]. В связи с этим открытием предполагали, что продуцировать такие везикулы могут исключительно грамотрицательные бактерии. Процесс их образования называется блеббинг, в результате которого происходит выпячивание внешней мембраны [6]. Однако вскоре выяснилось, что и грамположительные бактерии способны к формированию везикул. Однако, в отличие от грамотрицательных, у грамположительных бактерий есть толстый слой пептидогликана. На настоящий момент механизм образования у них везикул описан не до конца. Но предполагается, что везикулы проходят через поры в клеточной стенке благодаря тургорному давлению, а специальные белки-эндолизины участвуют в разрушении пептидогликана. Причем этот процесс может происходить с полным разрушением пептидогликанового слоя и лизиса клетки (рис. 2) [8], [9]. Клетка при этом умирает. Данную гипотезу подтверждают белки, найденные у Staphylococcus aureus. Или же возможен вариант, в котором разрушается только часть слоя, а клетка остается живой [9].
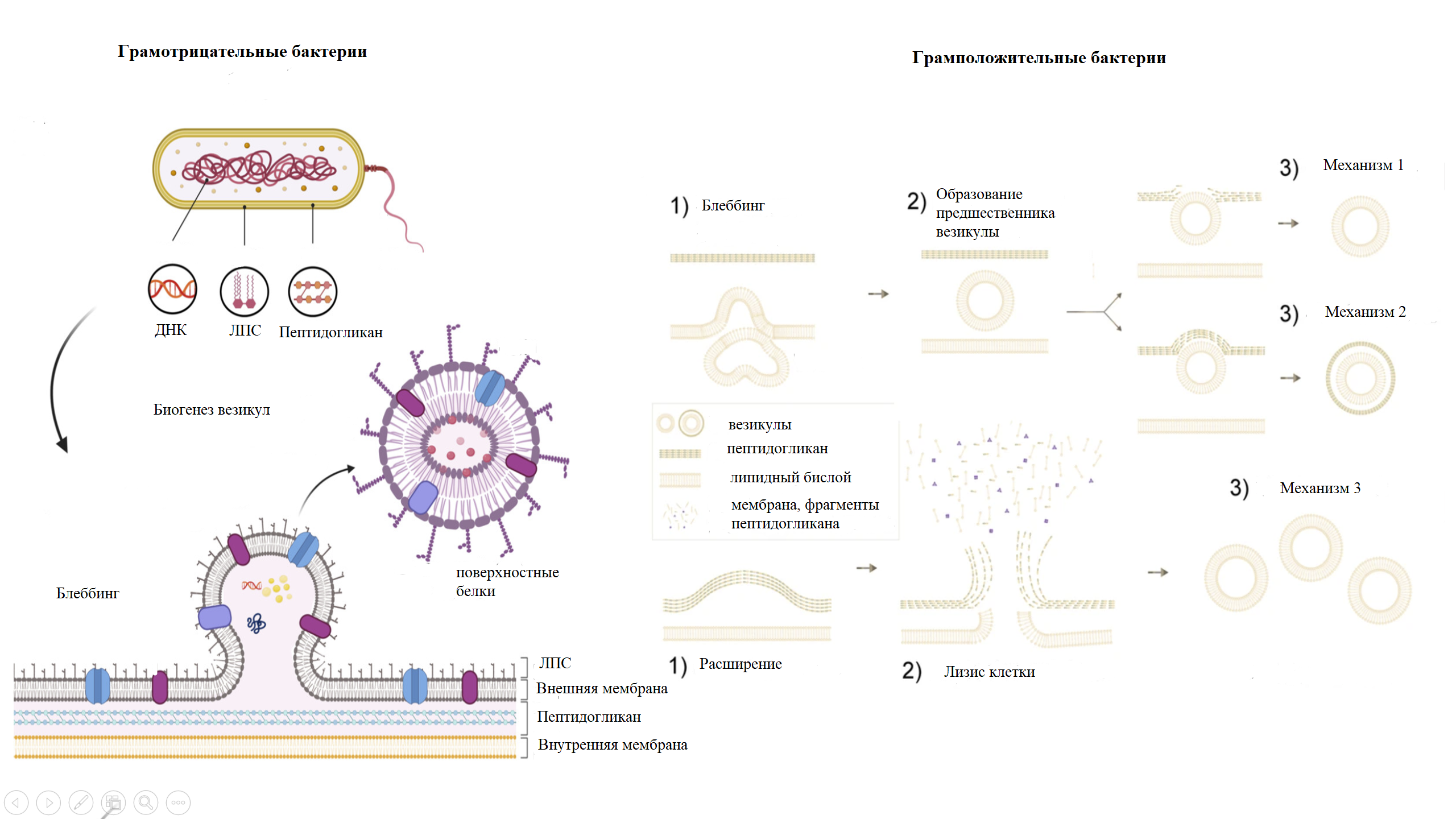
Рисунок 2. Формирование везикул у грамотрицательных (слева) и грамположительных бактерий (справа). Везикулы у грамотрицательных бактерий происходят с помощью «выпячивания» внешней мембраны. У грамположительных бактерий, в отличие от грамотрицательных есть толстый слой пептидогликана. Образования везикул происходит либо с частичным разрушением этого слоя, либо с полным разрушением и лизисом клетки.
Было обнаружено, что бактериальные внеклеточные везикулы могут участвовать как в развитии нейродегенеративных заболеваний, так и быть использованы в терапии против этих заболеваний. Свойства везикул зависит от того «груза», который они переносят. Так что же могут содержать бактериальные везикулы?
Состав бактериальных везикул
Бактериальные везикулы могут переносить различные белки, нуклеиновые кислоты, липиды и другие биоактивные вещества. Белки принимают участие в развитии бактерий и их защите. Так, у патогенных бактерий специфические белки являются мишенью иммунного ответа организма-хозяина. Кроме того, было доказано, что везикулы с помощью своего белкового компонента участвуют в регуляции развития дендритных клеток и образовании цитокинов, что может повлиять на иммунный ответ. Следующая составляющая везикул — нуклеиновые кислоты. Внеклеточная РНК, так же, как и белки, может оказывать влияние на продукцию цитокинов. Кроме того, в составе везикул выделяют липидный компонент. Липиды выполняют структурную функцию, поддерживая форму везикул. В качестве примера можно назвать глицерофосфолипиды, фосфатидилглицерол, фосфатидилэтаноламин и кардиолипин. И, наконец, в везикулах еще могут присутствовать малые молекулы, такие как короткоцепочечные жирные кислоты, нейромедиаторы и различные метаболиты.
Участие бактериальных везикул в развитии нейродегенеративных заболеваний
Для всех нейродегенеративных заболеваний характерно нейровоспаление. Этот процесс может быть спровоцирован многими факторами: различными травмами, инфекциями или некоторыми органическими соединениями, вырабатываемыми внутри организма. Эти соединения приводят к образованию большого количества провоспалительных цитокинов, что, в свою очередь, — к началу воспаления.
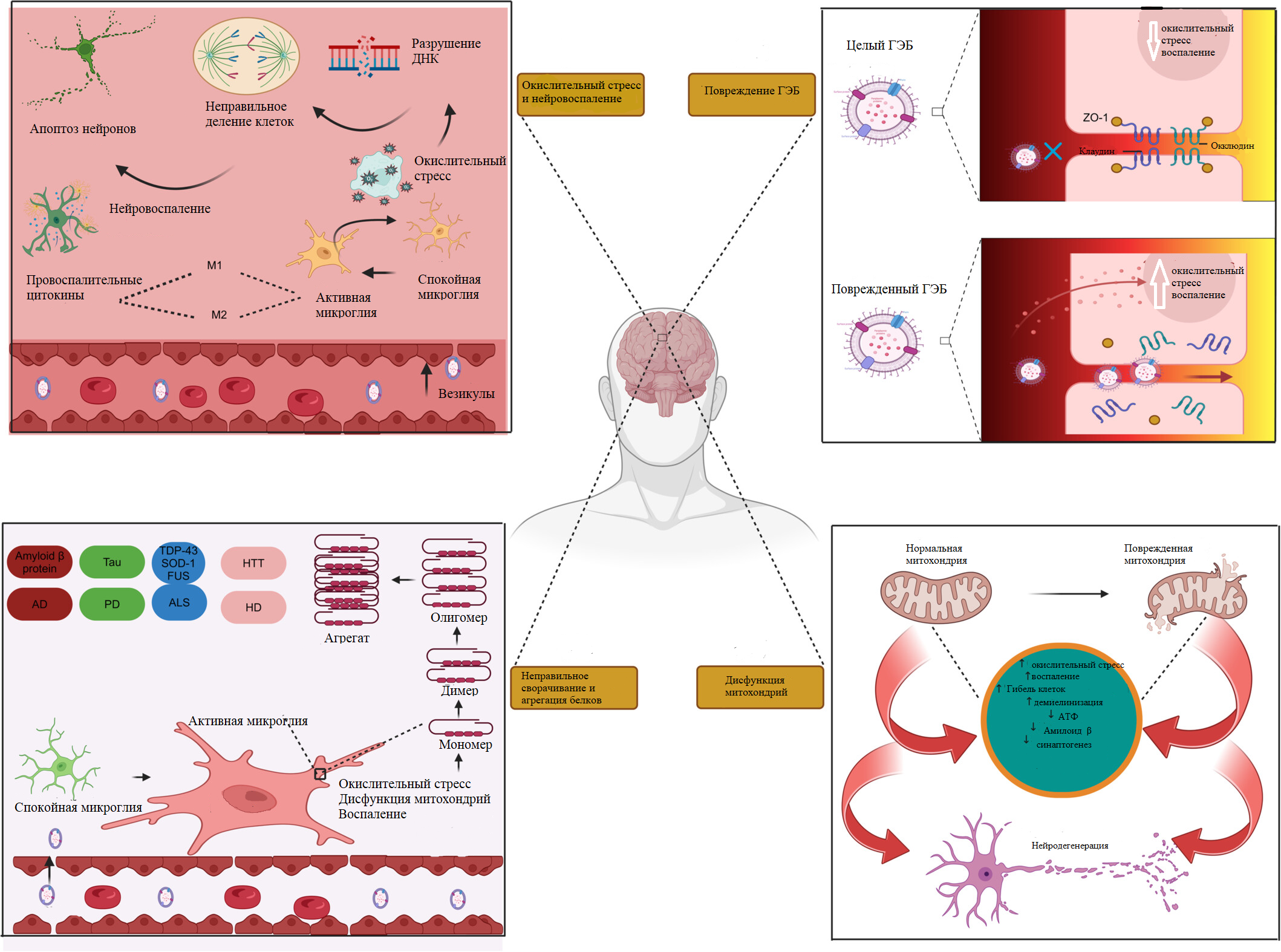
Рисунок 3. Бактериальные везикулы и процессы, влияющие на возникновение нейродегенеративных заболеваний. Бактериальные везикулы участвуют в развитии нейродегенеративных заболеваний следующим образом. Они содержат некоторые биоактивные вещества, которые могут способствовать возникновению нейровоспаления и окислительного стресса, повышению проницаемости ГЭБ, нарушению функционирования и гибели митохондрий, неправильному сворачиванию белков.
Бактериальные везикулы как раз несут в себе компоненты (липополисахариды, РНК, белки), способные вызвать иммунный ответ у организма-хозяина. Как было описано выше, они хорошо проходят через ГЭБ. Некоторые могут влиять на проницаемость барьера, что приводит к проникновению большего количества токсичных веществ (рис. 3). Итак, когда везикулы достигают микроглии и астроцитов, происходит узнавание содержащегося в них липополисахарида (характерного для грамотрицательных бактерий) Toll-подобными рецепторами (TLR). Это провоцирует изменение их морфологии и образованию таких провоспалительных цитокинов, как, например, TNF-α, IL-1-β и IL-6. Эти активные вещества привлекают клетки иммунной системы, которые находятся за пределами ЦНС, что приводит к распространению воспаления внутри мозга (рис. 3). Кроме того, сигналом к началу воспаления может быть действие малых интерферирующих РНК (миРНК) в составе везикул. Достигая микроглии, они способны менять экспрессию определенных генов и вмешиваться в различные пути передачи сигнала.
Митохондрии играют важную роль в клетках мозга человека. А при нейродегенеративных заболеваниях их правильное функционирование нарушается. На это влияют белки и миРНК в составе везикул. Механизм действия миРНК заключается в их «нацеливании» на митохондриальные гены, что приводит к плачевным последствиям для этой органеллы (рис. 3). Было проведено исследование, где показано, что везикулы E. coli способны вызывать нарушение функций митохондрий и впоследствии приводить к их гибели при болезни Паркинсона.
Еще одной причиной нейродегенеративных заболеваний является окислительный стресс (рис. 3). Он возникает в результате нарушения работы системы, которая регулирует удаление активных форм кислорода. Активные формы кислорода — чрезвычайно токсичные молекулы, которые приводят к окислению белков, разрушению ДНК, деградации липидов. Активные формы кислорода могут переноситься по организму человека как раз с помощью бактериальных везикул. Везикулы активируют инфламосомы через различные пути сигналлинга, что приводит к возникновению болезней [10].
Болезнь Альцгеймера и болезнь Паркинсона
Теперь рассмотрим такое явление, как неправильное сворачивание белков на примере болезни Альцгеймера и болезни Паркинсона (рис. 3).
При болезни Паркинсона происходит накопление неправильного свернутого белка α-синуклина. В нормальном состоянии этот белок выполняет ряд важных функций. Это пресинаптический белок, который участвует в высвобождении нейромедиаторов. Он способствует нейропластичности, обучению и памяти [11]. При неправильном его фолдинге меняется растворимость, он становится менее растворимым. Такая конформация не только влияет на транспорт нейромедиатора дофамина, но и приводит к гибели дофаминергических нейронов. Таким образом, в неправильном виде данный белок теряет все свои полезные свойства, становится очень токсичным и приносит лишь вред. Его накопление приводит к образованию так называемых белковых телец Леви. Но при чем тут бактерии? Оказывается, кишечная микробиота напрямую влияет на образование агрегатов данного белка. Не до конца исследовано, какие именно бактериальные метаболиты в этом участвуют. Но данную гипотезу подтверждает тот факт, что α-синуклин обнаруживается не только в мозге, но и в кишечнике при болезни Паркинсона. [12]. В случае же болезни Альцгеймера происходит образование агрегатов β-амилоида и нейрофибриллярных клубков, состоящих из гиперфосфорилированного тау-белка. Как и при болезни Паркинсона, бактерии выделяют некоторые метаболиты, а именно короткоцепочечные жирные кислоты, влияющие на образование вышеперечисленных соединений, однако точные вещества еще не известны. Ученые смогли определить положительное действие валериановой, изовалериановой, изомасляной, масляной, пропионовой, уксусной и муравьиной кислот: они способствуют уменьшению воспаления. При болезни Альцгеймера меняется состав кишечной микробиоты, «вредные» микроорганизмы образуют какие-то другие метаболиты, несущие лишь негативный эффект. Кроме того, некоторые бактерии способны образовывать амилоидные пептиды, что также способствует возникновению агрегатов. Все описанные соединения могут транспортироваться в мозг с помощью везикул [13].
За удаление неправильно свернутых белков отвечают аутолизосомные пути, в которых нежелательные для клетки элементы заключаются в везикулы и впоследствии удаляются (рис. 4). При каких-либо нарушениях в этих путях клетка перестает избавляться от токсичных для нее веществ, что приводит к их накоплению, и, соответственно, заболеванию. Ученые выяснили, что бактериальные везикулы способны вмешиваться в этот процесс. Они могут не только препятствовать удалению токсичных веществ из клетки, но и способствовать образованию из них агрегатов. Приведем в пример бактерию Polymorphus gingivalis, которую часто связывают с развитием болезни Альцгеймера. Ее везикулы предотвращают слияние аутофагосомы с лизосомой, тем самым разрывая весь путь [6].
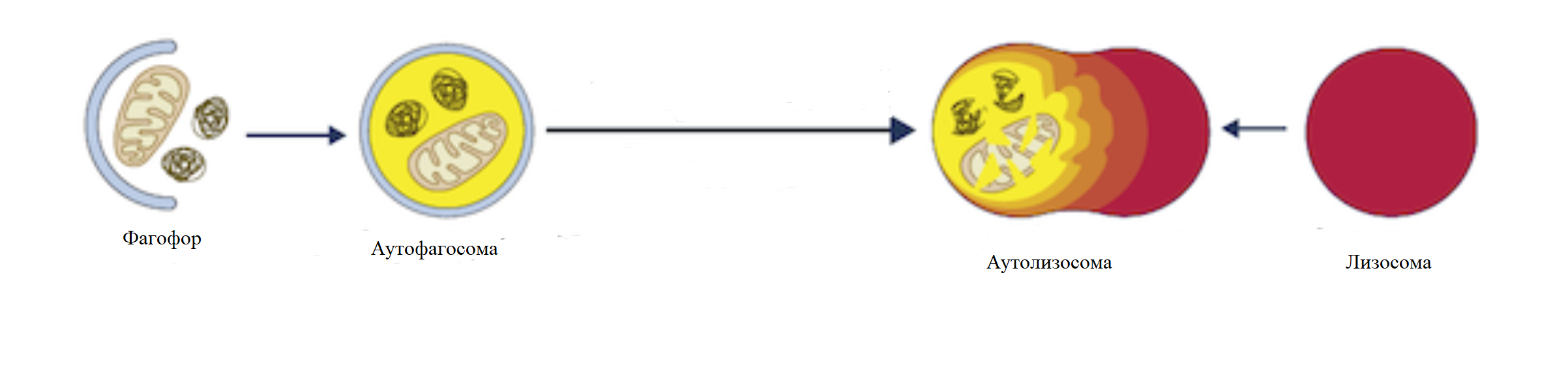
Рисунок 4. Вариант аутолизосомного пути. Неправильно свернутые белки и другие токсичные для клетки вещества удаляются с помощью разных вариантов аутолизосомного пути.
Бактериальные везикулы в терапии
При чтении этой статьи у вас, скорее всего, возникло впечатление, что бактериальные везикулы — вредоносные частицы, которые участвуют в развитии страшных заболеваний. Однако могут ли они принести человеку какую-то пользу? Как выяснилось — да, бактериальные везикулы обладают рядом свойств, которые могут быть применены в терапии нейродегенеративных заболеваний. Возникает вопрос, как какая-то частица может одновременно участвовать в развитии и лечении одной болезни? Ответ на этот вопрос достаточно прост. Бактериальные везикулы значительно отличаются друг от друга по составу, компонентам, которые они в себе несут. Соответственно, у «полезных» бактерий для человека везикулы «полезные», а у «вредных» — «вредные». Рассмотрим подробнее вышеупомянутые свойства.
«Полезные» микроорганизмы называют пробиотиками. Их везикулы так же, как и везикулы «вредных» бактерий способны влиять на микроглию, изменяя ее функции, только в другом направлении. В качестве примера рассмотрим бактерию Lactobacillus plantarum (рис. 5). Ее везикулы могут препятствовать возникновению нейровоспаления следующим образом: они стимулируют переход макрофагов из провоспалительного состояния M1 в противовоспалительное состояние M2 [14]. Кроме того, везикулы способствуют увеличению количества нейротрофического фактора (BDNF) в мозгу [5]. Этот фактор относится к нейротрофинам и играет важную роль в развитии нейронов. Его наличие важно для нормального нервного развития и долговременной памяти. Было проведено интересное исследование, в котором мышей подвергали некоторым воздействиям, приводящим к стресс-индуцированной депрессии, а после этого вводили везикулы данной бактерии. Оказалось, что они действуют как антидепрессанты и значительно улучшают состояние подопытных [15]. На этом удивительные свойства данных везикул не заканчиваются. Благодаря следующим свойствам они значительно улучшают состояние при болезни Паркинсона: везикулы снижают нейровоспаление, ослабляют окислительный стресс и снижают гибель дофаминергических нейронов, которую вызывает нейротоксин МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин). Это приводит к уменьшению двигательных нарушений. Кроме того, везикулы подавляют вызванное этим нейротоксином развитие вредных энтеробактерий в ЖКТ человека.
Рисунок 5. Lactobacillus plantarum.
Как мы уже знаем, бактериальные везикулы представляют собой частицы, несущие в себе какой-то «груз». Они могут свободно перемещаться по организму человека, а самое главное — проходить через ГЭБ. Это свойство может быть очень полезным в таргетной доставке лекарств в мозг, так как немногие вещества способны его преодолевать. Еще одна особенность в том, что везикулы могут доставить свой груз к конкретным клеткам. Это означает, что таким образом можно влиять на определенные зоны мозга, избегая при этом побочного действия на другие. А если вместе с лекарством в везикуле находится еще и ассоциированный с этим веществом фермент, то это значительно улучшит его действие. Конструирование бактериальных штаммов, образующих везикулы с нужными свойствами, возможно с помощью методов биоинженерии. К сожалению, на данный момент в сфере лечения нейродегенеративных заболеваний эта технология еще не применяется. Однако есть исследования, показывающие возможность использования бактериальных везикул в терапии рака. Ученые разработали вектор на основе везикул штамма E. coli, который включается в себя малые интерферирующие РНК (миРНК), нацеленные на белок KSP (kinesin spindle protein) в опухолевых клетках. Этот белок участвует в образовании веретена деления в клетках в митозе. Таким образом, с помощью везикул можно остановить деление опухолевых клеток [16]. Этот пример показывает возможность таргетного действия бактериальных везикул на определенные клетки и их компоненты.
Заключение
Бактериальные внеклеточные везикулы осуществляют «коммуникацию» между кишечной микробиотой и мозгом. Они могут быть причиной серьезных нейродегенеративных заболеваний или же играть значимую роль в их терапии. К сожалению, на настоящий момент терапия с помощью данных везикул еще не применяется, однако эта тема активно изучается, и в будущем ее ждут большие перспективы.
Литература
- Jeroen Van Schependom, Miguel D’haeseleer. (2023). Advances in Neurodegenerative Diseases. JCM. 12, 1709;
- Christiane Reitz, Richard Mayeux. (2014). Alzheimer disease: Epidemiology, diagnostic criteria, risk factors and biomarkers. Biochemical Pharmacology. 88, 640-651;
- Yujun Hou, Xiuli Dan, Mansi Babbar, Yong Wei, Steen G. Hasselbalch, et. al.. (2019). Ageing as a risk factor for neurodegenerative disease. Nat Rev Neurol. 15, 565-581;
- Бабочки в животе: как микробиота влияет на социальное поведение мышей;
- Nicholas H. Pirolli, William E. Bentley, Steven M. Jay. (2021). Bacterial Extracellular Vesicles and the Gut‐Microbiota Brain Axis: Emerging Roles in Communication and Potential as Therapeutics. Advanced Biology. 5;
- Ashok Iyaswamy, Kejia Lu, Xinjie Guan, Kan Yuxuan, Chengfu Su, et. al. Impact and Advances in the Role of Bacterial Extracellular Vesicles in Neurodegenerative Disease and its Therapeutics — MDPI AG;
- Elizabeth Work, K. W. Knox, Maret Vesk. (1966). THE CHEMISTRY AND ELECTRON MICROSCOPY OF AN EXTRACELLULAR LIPOPOLYSACCHARIDE FROM ESCHERICHIA COLI. Annals of the New York Academy of Sciences. 133, 438-449;
- Adil Hassan, Yin Huang, Mahjabina, Otmilda Hapsari Sudiro, Xiangxiu Wang, et. al.. (2024). Emerging role of gut microbiota extracellular vesicle in neurodegenerative disorders and insights on their therapeutic management. iMetaOmics. 1;
- Dokyung Jeong, Min Jeong Kim, Yejin Park, Jinkyoung Chung, Hee-Seok Kweon, et. al.. (2022). Visualizing extracellular vesicle biogenesis in gram-positive bacteria using super-resolution microscopy. BMC Biol. 20;
- Adil Hassan, Yin Huang, Mahjabina, Otmilda Hapsari Sudiro, Xiangxiu Wang, et. al.. (2024). Emerging role of gut microbiota extracellular vesicle in neurodegenerative disorders and insights on their therapeutic management. iMetaOmics. 1;
- David Sulzer, Robert H. Edwards. (2019). The physiological role of α‐synuclein and its relationship to Parkinson’s Disease. Journal of Neurochemistry. 150, 475-486;
- Emily Fitzgerald, Sarah Murphy, Holly A. Martinson. (2019). Alpha-Synuclein Pathology and the Role of the Microbiota in Parkinson’s Disease. Front. Neurosci.. 13;
- M. Bostanciklioğlu. (2019). The role of gut microbiota in pathogenesis of Alzheimer's disease. Journal of Applied Microbiology. 127, 954-967;
- Tingting Xia, Shengping Fu, Ruilin Yang, Kang Yang, Wei Lei, et. al.. (2023). Advances in the study of macrophage polarization in inflammatory immune skin diseases. J Inflamm. 20;
- Juli Choi, Yoon-Keun Kim, Pyung-Lim Han. (2019). Extracellular Vesicles Derived from Lactobacillus plantarum Increase BDNF Expression in Cultured Hippocampal Neurons and Produce Antidepressant-like Effects in Mice. Exp Neurobiol. 28, 158-171;
- Vipul Gujrati, Sunghyun Kim, Sang-Hyun Kim, Jung Joon Min, Hyon E Choy, et. al.. (2014). Bioengineered Bacterial Outer Membrane Vesicles as Cell-Specific Drug-Delivery Vehicles for Cancer Therapy. ACS Nano. 8, 1525-1537.