Вдвоем на страже чистоты. О связи протеасомной системы и аутофагии
29 января 2025
Вдвоем на страже чистоты. О связи протеасомной системы и аутофагии
- 319
- 0
- 4
Рисунок в полном размере.
коллаж автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В процессе жизнедеятельности клетки находящиеся в ней макромолекулы и органеллы постоянно повреждаются и выходят из строя. Их необходимо утилизировать и заменять новыми, чтобы их функции всегда выполнялись с достаточной эффективностью. Утилизация отслуживших свой срок компонентов клетки осуществляется двумя путями: с помощью протеасомной системы и с помощью аутофагии. С возрастом эффективность работы обеих систем уменьшается, из-за чего в клетке постепенно накапливаются повреждения. Это является причиной многих болезней пожилого возраста и старения вообще. Поэтому изучение протеасомной системы и аутофагии имеет большое значение для повышения продолжительности и качества жизни. Особый интерес вызывают пути взаимодействия этих двух систем. Появляется всё больше данных о том, что они тесно связаны между собой и не могут нормально работать друг без друга. Это совершенно логично, ведь они выполняют общую задачу — поддержание чистоты в клетках. О том, как связаны между собой аутофагия и протеасомная система, и пойдет речь в данной статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: зачем поддерживать чистоту
Для нормального функционирования клетки необходимо, чтобы ее компоненты постоянно обновлялись. Все старое и плохо работающее должно расщепляться, чтобы из его составляющих можно было заново что-нибудь синтезировать. Утилизация ненужных компонентов клетки возможна двумя путями: с помощью протеасомной системы и в процессе аутофагии. Принцип их работы показан на рисунке 1. Обе эти системы крайне важны для клетки. Нарушения в их работе могут являться причинами самых разных заболеваний, многие из которых связаны со старением. Среди них: нейродегенеративные заболевания, включая болезнь Альцгеймера [1], [2] и болезнь Паркинсона [2], [3], рак [4], ишемическая болезнь сердца [5], [6] и заболевания, связанные с воспалением, такие как атеросклероз [7].
Помимо того, что протеасомы и аутофагия связаны с заболеваниями, характерными для пожилых людей, они играют важную роль в старении как таковом. С возрастом активность протеасом и аутофагии уменьшается, что приводит к накоплению в клетке неправильно свернутых белков и поврежденных органелл. Это приводит к нарушению функционирования клетки и организма вообще. Поэтому изучение двух систем утилизации имеет большое значение для борьбы со старением [8], [9].
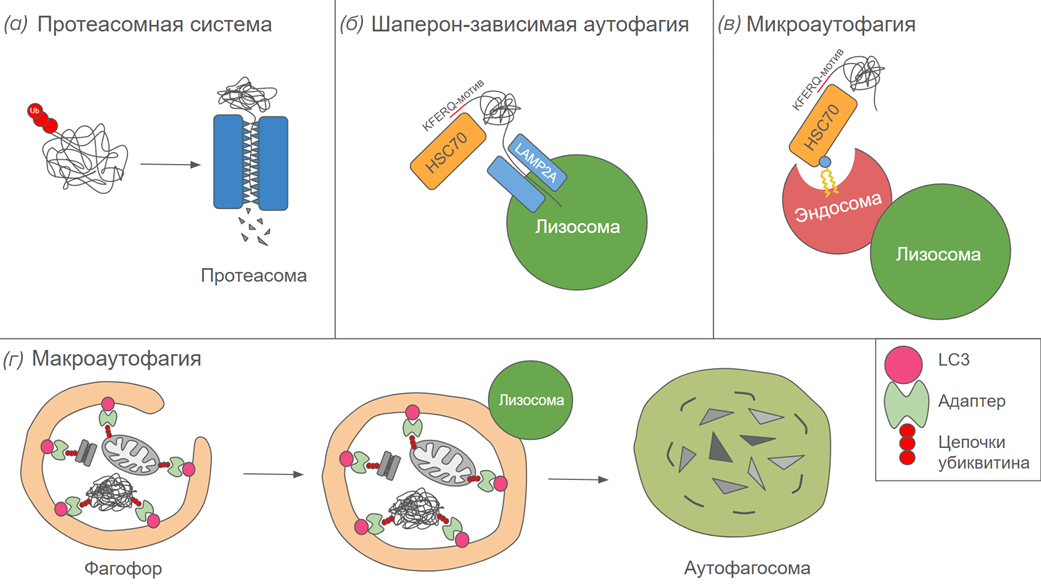
Рисунок 1. Разные виды аутофагии и протеасомная система.
рисунок автора
Протеасомная система
Протеасомы (рис. 1а) — это органеллы, осуществляющие специфическое расщепление белков. Их жертвами в основном становятся неправильно свернувшиеся и поврежденные белки, а также нормальные белки, которым просто пришло время умирать. Протеасомная деградация используется в регуляции многих клеточных процессов, включая экспрессию генов. К примеру, протеасома может расщепить ингибитор какого-нибудь транскрипционного фактора и тем самым запустить транскрипцию определенных генов [10]. Кроме того, белки сами по себе имеют определенный срок жизни. Старые белки расщепляются, и аминокислоты, входящие в их состав, используются для синтеза новых. Время жизни, а точнее, период полудеградации белка подчиняется правилу N-конца. Это правило гласит, что белки с разной скоростью распознаются протеасомной системой в зависимости от того, какая аминокислота находится на их N-конце. Есть аминокислоты, стабилизирующие белок, а есть такие, которые распознаются очень быстро. Среди последних, например, аргинин и фенилаланин. Если на N-конце белка находится такая аминокислота, он сможет продержаться в цитоплазме совсем недолго [11].
К белкам, приговоренным к расщеплению в протеасомах, пришиваются специальные метки — цепочки из маленького белка убиквитина. Чаще всего убиквитин присоединяется к своей мишени следующим образом: его С-конец образует изопептидную связь с лизином в белке-мишени. В самом убиквитине тоже есть несколько остатков лизина, поэтому к нему могут присоединяться другие убиквитины, образуя цепочку [12].
Протеасома — это крупный белковый комплекс, состоящий из большого числа субъединиц. Она включает в себя коровую частицу 20S и одну или две регуляторные частицы 19S. Коровая частица представляет собой полый цилиндр, внутрь которого обращены активные центры множества протеаз. Внутри этого цилиндра и происходит расщепление белков. Регуляторные частицы располагаются на одном или обоих отверстиях цилиндра, как затычки. Они распознают полиубиквитиновые метки на белках и отсоединяют их для повторного использования, после чего за счет энергии АТФ расплетают белки и просовывают их в полость коровой субъединицы [13].
Аутофагия
Протеасомная система может утилизировать только белки, но в клетках есть более универсальный процесс, позволяющий переваривать самые разные субстраты, в том числе целые органеллы. Этот процесс называется аутофагией. Она бывает трех типов: макроаутофагия, микроаутофагия и шаперон-зависимая аутофагия. Эти варианты аутофагии очень сильно различаются по своим механизмам, но их объединяет то, что во всех случаях главную роль играют лизосомы — вакуоли, содержащие большое количество гидролитических ферментов [14].
Шаперон-зависимая аутофагия (рис. 1б) — это еще один механизм поддержания белкового гомеостаза. Ей подвергаются белки, содержащие сигнальный мотив KFERQ. Эту последовательность распознает шаперон HSC70. Он связывается с белком-мишенью, расплетает его и пропихивает в лизосому через рецептор LAMP2A. Активность шаперон-зависимой аутофагии повышается во время голода, когда приходится использовать некоторые белки в качестве источника энергии, а также тогда, когда в клетке накапливается большое количество поврежденных белков, например, при окислительном стрессе. Тем не менее, шаперон-зависимая аутофагия происходит постоянно и в нормальных условиях. По последним данным, KFERQ-подобный мотив содержат 45-47% белков человека [15].
Шаперон-зависимая аутофагия не только утилизирует поврежденные белки, но и выполняет регуляторную функцию. Она может влиять на многие клеточные процессы через утилизацию участвующих в них ферментов. Например, она участвует в регуляции метаболизма липидов и углеводов [16], а также в регуляции иммунной системы [14].
Неправильная работа шаперон-зависимой аутофагии может приводить к развитию ряда заболеваний. Ее недостаточная активность может приводить к накоплению в клетке белков, которые в норме должны утилизироваться. Среди ее субстратов есть белки, связанные с болезнью Паркинсона: α-synuclein, DJ-1, LRRK2, и с другими нейродегенеративными заболеваниями. Избыточная активность тоже может иметь негативные последствия. В раковых клетках она может обеспечивать деградацию проапоптотических белков, опухолевых супрессоров и белков, препятствующих пролиферации, тем самым способствуя росту и метастазированию опухоли. В связи с этим, шаперон-зависимая аутофагия — потенциальная мишень для противоопухолевой терапии [14].
Микроаутофагия (рис. 1в) — это процесс, в ходе которого лизосома напрямую поглощает субстрат. Микроаутофагия участвует в переработке питательных веществ, поддержании размера органелл и постоянства состава мембран. Она может происходить тремя возможными способами: путем оборачивания субстрата лизосомальной мембраны, путем инвагинации (прогибания) лизосомальной мембраны и путем сливания с эндосомой, содержащей субстрат. Микроаутофагия может быть как селективной, так и неселективной, когда лизосома или эндосома заглатывает немного цитоплазмы вместе со всем, что случайно оказалось поблизости. В специфичной эндосомальной микроаутофагии важную роль играет шаперон HSC70. Он, как и в случае с шаперон-зависимой аутофагией, связывается с KFERQ-подобным мотивом в белке-мишени. Потом HSC70 со своим грузом присоединяется к фосфатидилсерину в составе мембраны эндосомы, после чего мембрана прогибается, и оба белка оказываются внутри. Окружающий их фрагмент мембраны разрушается, и они оказываются в полости эндосомы [14].
Многие белки могут утилизироваться как в ходе шаперон-зависимой аутофагии, так и в ходе микроаутофагии, ведь для обоих процессов требуется один и тот же сигнал в белках. Способ, каким будет уничтожен белок, может зависеть от его свойств, таких как наличие посттрансляционных модификаций, и от состояния клетки. Кроме того, утилизация некоторых мишеней возможна только через микроаутофагию. Это белковые комплексы и агрегаты, а также белки, которые по какой-то причине не могут развернуться [17].
Микроаутофагия на данный момент изучена достаточно плохо, но ясно, что она играет важную роль в поддержании нормальной работы клеток. Например, было показано, что ее нарушение у дрозофил приводит к замедлению передачи нервных сигналов из-за нарушения селективной утилизации синаптических белков [18]. Кроме того, было показано, что в эндосомах старых животных накапливаются окисленные белки, многие из которых содержат KFERQ-подобные мотивы. Это говорит о том, что с возрастом работа микроаутофагии нарушается [19].
Макроаутофагия (рис. 1г) — самая масштабная разновидность аутофагии. С ее помощью утилизируются крупные субстраты, в том числе целые неисправные органеллы. Из всех видов аутофагии она наиболее изучена. Очень часто при упоминании аутофагии имеется в виду именно макроаутофагия. Этот процесс отличается от других видов аутофагии тем, что в нем, помимо лизосомы, участвует еще одна органелла — фагофор.
Фагофор представляет собой большой мембранный мешок. Как правило, он образуется путем выпячивания эндоплазматического ретикулума, но донорами мембраны для него могут выступать также плазмолемма и внешняя мембрана митохондрий. Фагофор окружает свою жертву и смыкается, в результате чего образуется двумембранная органелла аутофагосома. С аутофагосомой затем сливается лизосома, и все ее содержимое, включая внутреннюю мембрану, расщепляется [14].
В формировании аутофагосомы участвует большое количество белков. Всего известно около 30 генов ATG (autophagy-related genes, генов, связанных с аутофагией). Важную роль играет белок LC3 (Atg8), сидящий на мембране фагофора. Он связывается с мишенью и стимулирует смыкание фагофора вокруг нее. В качестве мишеней могут выступать различные белки, например, встроенные в мембрану органелл или слипшиеся в агрегаты. Некоторые белки-жертвы могут быть распознаны LC3 просто так, но часто им для этого нужна специальная метка. В качестве такой метки, как и в протеасомной системе, служат цепочки убиквитина [20]. Эти цепочки распознаются белками-адаптерами, такими как p62 и NBR, а их, в свою очередь, узнает LC3 [21].
В среднем, протеасомная система утилизирует короткоживущие белки, а аутофагия — белки с большим сроком жизни. Неправильно сложенными и поврежденными белками занимаются обе системы [21]. Как же протеасомы и аутофагосомы разбираются, где чей субстрат? Дело в том, что убиквитин может образовывать цепочки по-разному, так как в нем есть несколько остатков лизина. Цепочки, где убиквитины связаны через Lys48, распознаются протеосомами, а связь через Lys63 является сигналом к аутофагии. Эти типы связывания используются наиболее часто, хотя есть и другие варианты [22]. Более того, эти сигналы не являются однозначными. Один и тот же белок может подвергнуться как протеасомной деградации, так и аутофагии. Дело в том, что белки-адаптеры p62 и NBR имеют большее сродство к цепочкам убиквитина, соединенных через Lys63, но цепочки со связями через Lys48 они тоже узнают. Обычно им просто не достается белков с такими метками, потому что они гораздо быстрее попадают в протеасомы. Однако если с протеасомой что-то случается или в клетке накапливается так много поврежденных белков, что протеасомы с ними не справляются, белки, меченные полиубиквитинами с Lys48, утилизируются в процессе аутофагии. Таким образом, аутофагия может компенсировать недостаточную активность протеасом [21].
Регуляция аутофагии
Теперь посмотрим, как в клетке происходит регуляция аутофагии. Ее активность в первую очередь зависит от текущих потребностей клетки в питательных веществах. Если клетка голодает, уровень аутофагии повышается, так как приходится использовать в качестве источника энергии те клеточные компоненты, какими можно пожертвовать. Кроме того, активность аутофагии повышается в случае гипоксии, т. к. в этом случае образуется много активных форм кислорода, повреждающих компоненты клеток.
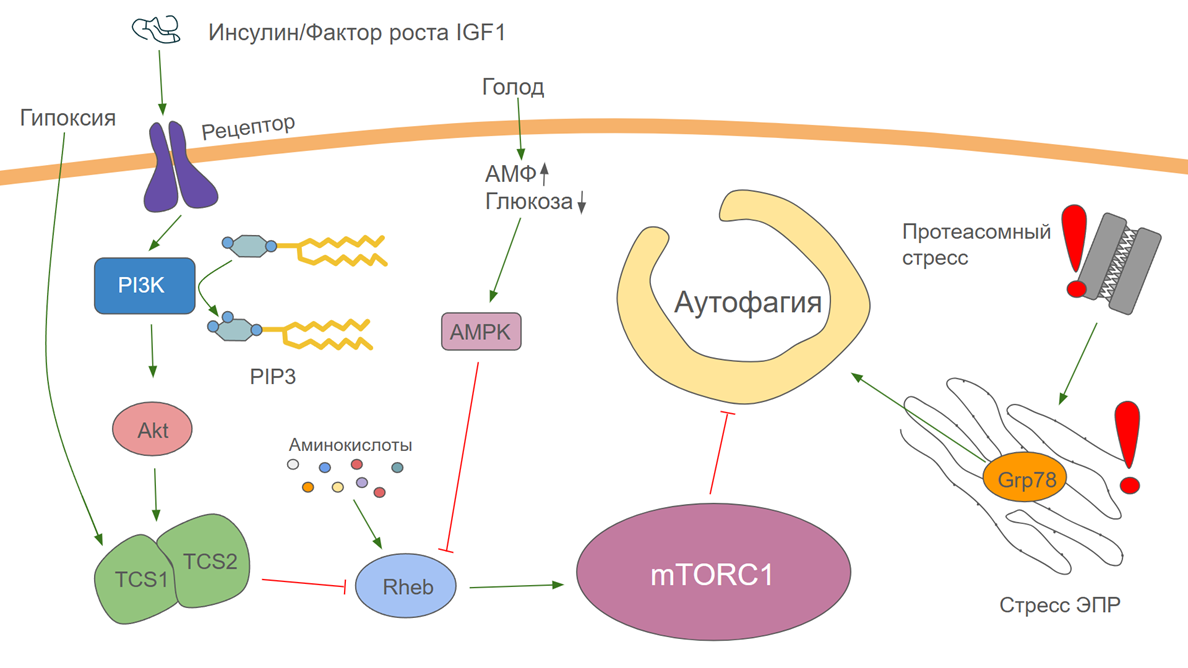
Рисунок 2. Регуляция аутофагии. Контроль количества аминокислот осуществляется белком Rheb. Когда их много, он связывается с mTORC1 и активирует его. У белка Rheb есть негативный регулятор — комплекс TS1/TS2. Ингибируя Rheb, он тем самым подавляет активность mTORC1. На активность комплекса TS1/TS2 влияют разные факторы. Она увеличивается в случае гипоксии и подавляется при действии инсулина и IGF1.
Инсулин и фактор роста IGF1 действуют на mTORC1 через фосфатидилинозитоловую систему. Связывание их со своими рецепторами приводит к активации фосфоинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитол. В результате образуется фосфатидилинозитол-3-фосфат (PIP3), который активирует киназу Akt. Эта киназа ингибирует комплекс TS1/TS2, тем самым активируя mTORC1.
рисунок автора
Важнейшую роль в контроле аутофагии играет mTORC1 (mammalian target of rapamycin complex 1, рапамицин-чувствительный комплекс млекопитающих 1). Он является ее ингибитором: воздействует на некоторые из Atg белков, препятствуя формированию аутофагосомы.
На активность mTORC1 влияют многие факторы. Она увеличивается при наличии большого количества аминокислот и при действии инсулина или фактора роста IGF1 (insulin like growth factor 1, инсулиноподобный фактор роста 1). Недостаток глюкозы и наличие АМР, основного показателя голодания в клетке, а также гипоксия подавляют активность mTORC1 и стимулируют аутофагию.
Помимо пути mTORC1, в клетках есть множество сигнальных путей, обеспечивающих регуляцию аутофагии. В том числе есть механизм активации аутофагии в ответ на недостаточную активность протеасом. Он осуществляется через эндоплазматический ретикулум (ЭПР). Дело в том, что в ЭПР недостаток протеасомной активности становится ощутимым в первую очередь, так как именно там происходит синтез и созревание многих белков. Из-за избытка неправильно свернутых белков в ЭПР его работа нарушается. Это состояние называется стрессом ЭПР, и оно крайне опасно для клетки. Для борьбы с ним активизируются все доступные пути защиты, в том числе активация аутофагии. Она осуществляется шапероном Grp78, который в ответ на избыток неправильно свернутых белков стимулирует образование аутофагосом [21]. Факторы, влияющие на активность аутофагии, изображены на рисунке 2.
Утилизация поврежденных органелл на примере митофагии
Еще одна очень важная задача аутофагии — утилизация поврежденных органелл. Ее лучше всего рассмотреть на примере митохондрий, так как их утилизация изучена наиболее хорошо. У нее даже есть отдельное название — митофагия. Митохондрии выполняют много функций, но главная из них, конечно, — получение энергии в процессе дыхания. С другой стороны, именно митохондрии наиболее часто повреждаются, так как в ходе их работы часто образуются активные формы кислорода. Поэтому митофагия имеет такое большое значение. Ее нарушение приводит к ряду заболеваний, многие из которых связаны со старением [7].
Говоря о митофагии, стоит отметить, что митохондрии в нормальных условиях выглядят совсем не так, как их обычно представляют. На картинках их обычно изображают в виде овалов, но в реальности они имеют форму длинных червячков, которые постоянно перемещаются по клетке, сливаются друг с другом и делятся. Митохондрии образуют сложную динамическую структуру, называемую митохондриальной сетью. Откуда тогда взялись картинки с овальными митохондриями? Дело в том, что так они выглядят на микрофотографиях, полученных с помощью трансмиссионного электронного микроскопа. Этот вид микроскопии подразумевает изготовление очень тонких срезов. Вероятность того, что срез пройдет вдоль длинной структуры, очень мала. Скорее он пройдет под углом, и получится знакомый нам овал. Зато с помощью других методов микроскопии митохондриальную сеть можно увидеть во всей красе (рис. 3).
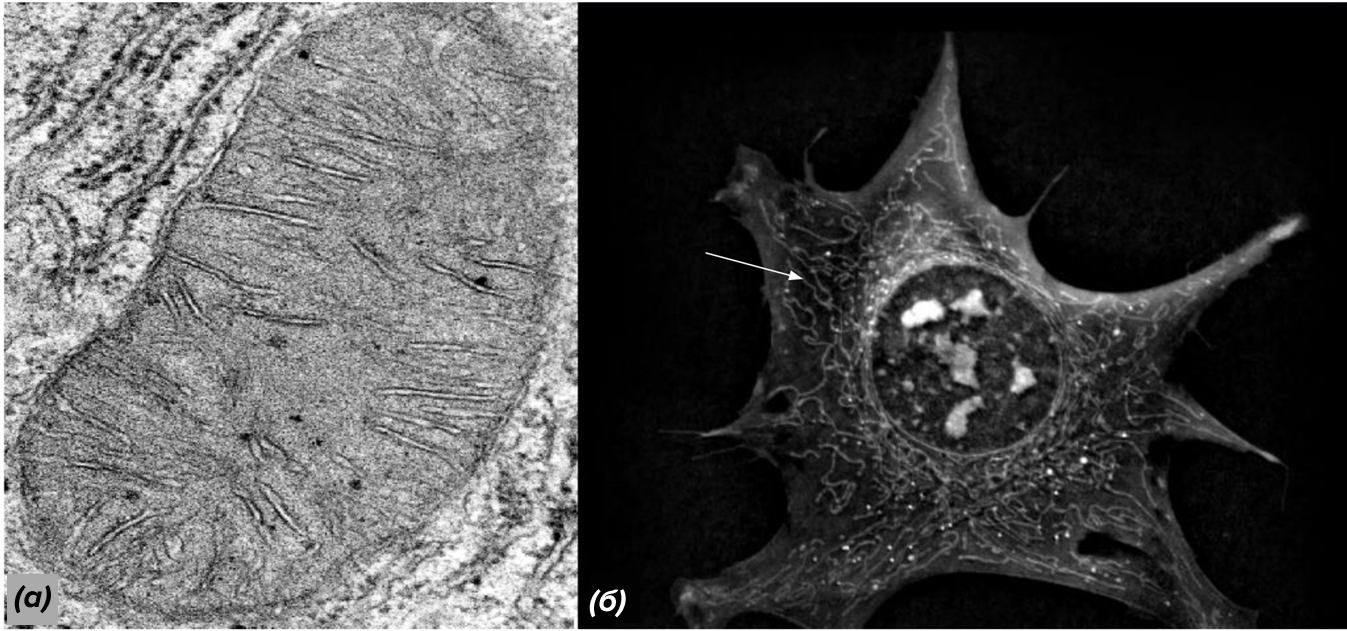
Рисунок 3. (а) — привычное изображение митохондрии, полученное с помощью трансмиссионного электронного микроскопа; (б) — микрофотография живой клетки, где видно, что митохондрии имеют форму червячков, слившихся в сложную сеть (одна из митохондрий обозначена стрелочкой).
Понятно, что никакая аутофагосома просто так не сможет окружить такую большую структуру, как митохондриальная сеть. Поэтому при повреждении митохондрий они сначала фрагментируются и становятся овальными, какими мы их привыкли видеть (рис. 4). Тогда уже наиболее пострадавшие из образовавшихся маленьких митохондрий утилизируются в ходе митофагии, а оставшиеся потом заново сливаются в митохондриальную сеть. Регуляция митофагии и фрагментации митохондрий очень тесно связаны. Так, экспрессию генов белков DRP1 и FIS1, которые обеспечивают фрагментацию, и генов белков, участвующих в митофагии, контролирует один и тот же фактор транскрипции — FOXO3 [23].
Слияние и фрагментация митохондрий контролируется протеасомной системой за счет селективного расщепления белков DRP1, FIS1 и митофузина, который обеспечивает слияние митохондрий. Таким образом, получается, что митофагия косвенно регулируется протеасомной системой [2].
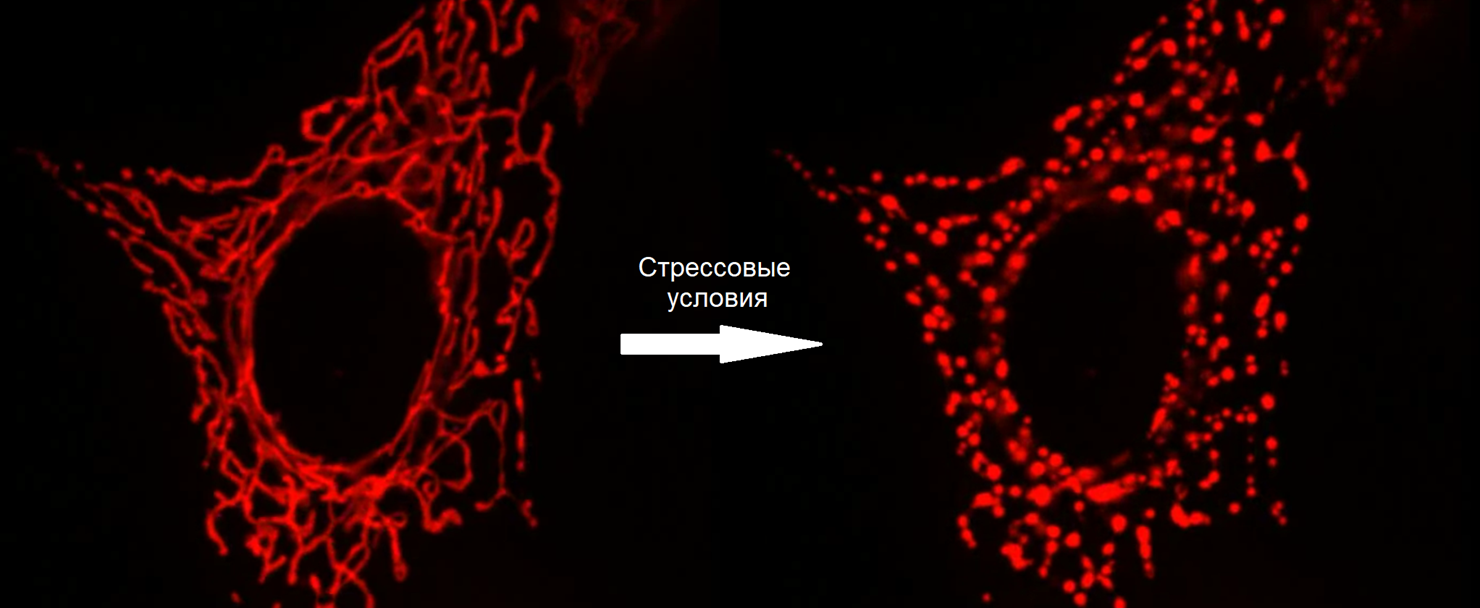
Рисунок 4. Фрагментация митохондрий под действием митохондриального токсина.
В регуляции митофагии участвует очень много сигнальных путей. Большинство из них опосредовано каким-нибудь белком на внешней митохондриальной мембране, который может напрямую связываться с белком LC3, запуская аутофагию. Однако наиболее изученный и один из самых важных путей — PINK1/Parkin-зависимое убиквитинилирование. Этот путь интересен еще и тем, что PINK1 участвует не только в активации митофагии, но и в регуляции ответа на протеасомный стресс.
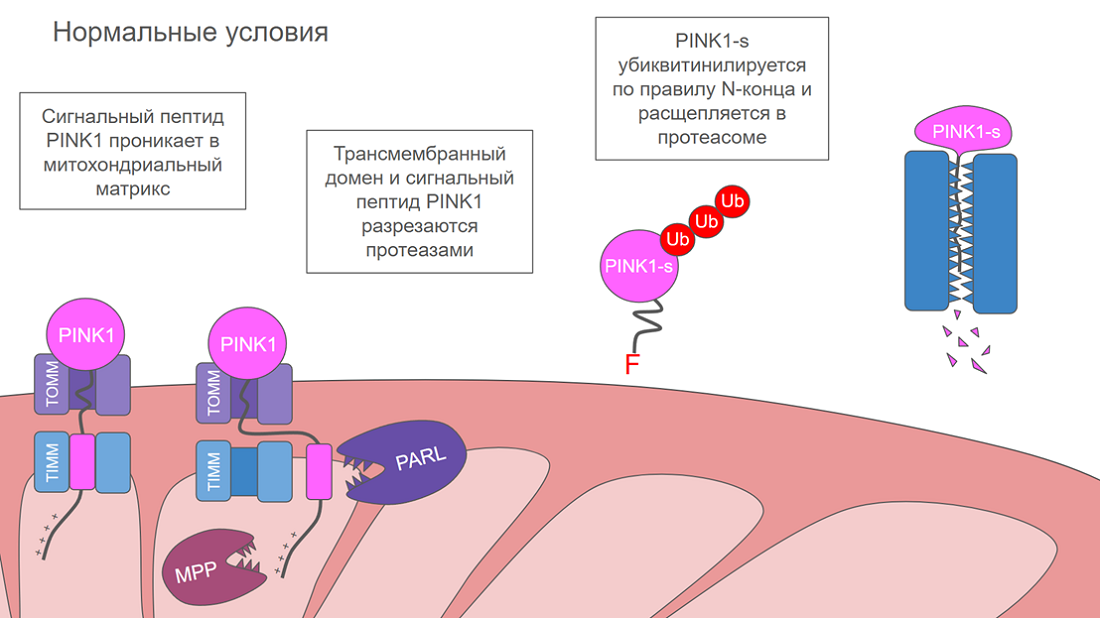
PINK1 состоит из трех частей: киназного домена, который выполняет главную функцию — фосфорилирование, трансмембранного домена и сигнального пептида на N-конце, обеспечивающего его транспортацию к митохондриям. Этот сигнальный пептид заряжен положительно, т. к. в нем много основных аминокислот: аргинина и лизина. Матрикс здоровых митохондрий заряжен отрицательно, потому что протоны для производства АТФ выкачиваются в межмембранное пространство. Благодаря этому N-конец PINK1 легко проходит в матрикс через белковые комплексы TOMM на внешней мембране и TIMM — на внутренней. Однако весь белок за ним последовать не может: киназный домен застревает перед входом в TOMM, а трансмембранный домен встраивается во внутреннюю мембрану митохондрии. Там его подстерегает протеаза PARL. Она разрезает трансмембранный домен, а сигнальный пептид в матриксе добивает протеаза MPP. В итоге от PINK1 остается только киназный домен, который носит название PINK1-s. Он отваливается от TOMM и возвращается в цитоплазму. Там его страдания еще не заканчиваются, потому что на его N-конце после протеолиза обнажается нестабильная аминокислота фенилаланин, которая, по правилу N-конца, распознается как сигнал к убиквитинилированию, и PINK1-s расщепляется протеосомой. Судьба PINK1 в нормальных условия схематично изображена на рисунке 5А.
Получается, что когда в клетке все в порядке, PINK1 синтезируется только для того, чтобы быть подвергнутым изощренной казни. Но когда что-то идет не так, у него появляется возможность себя проявить.
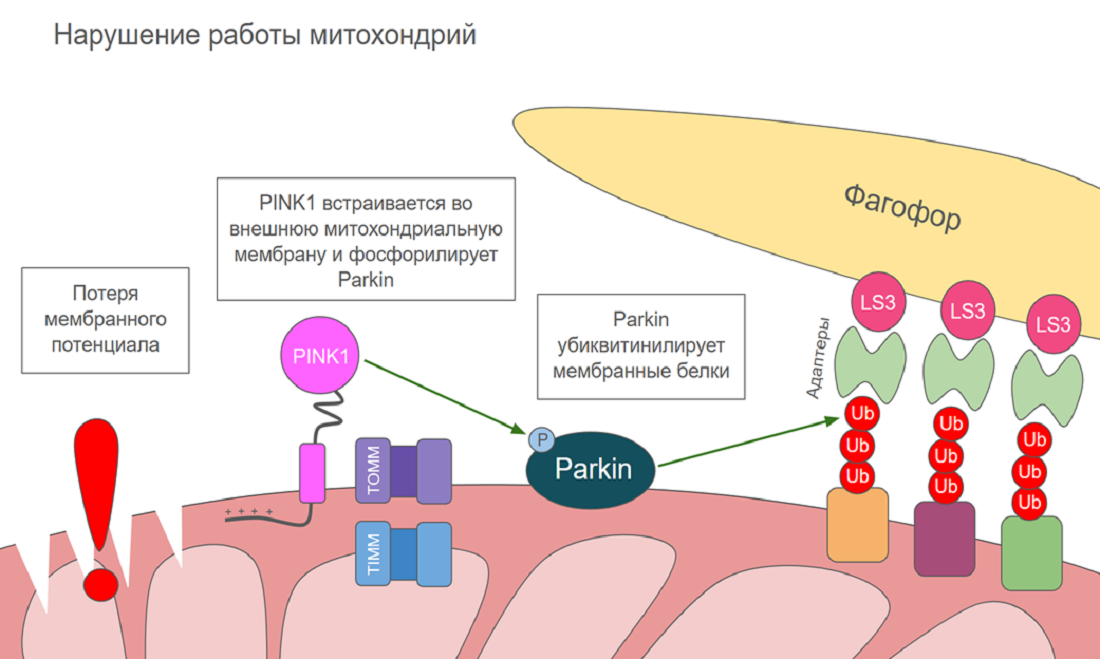
Нарушение работы митохондрии очень часто сопровождается потерей потенциала на внутренней мембране. Матрикс перестает быть заряженным отрицательно, из-за чего сигнальный пептид на N-конце PINK1 на проникает в него. Трансмембранный домен в этом случае встраивается не во внутреннюю, а во внешнюю мембрану митохондрии. Там его никто не расщепляет, поэтому PINK1 остается на поверхности митохондрии и запускает сигнальный каскад, активирующий митофагию — частный случай аутофагии, в ходе которого поглощаются митохондрии. PINK1 активируется за счет автофосфорилирования, после чего фосфорилирует убиквитин-лигазу PARKIN, которая затем убиквитинилирует белки на поверхности митохондрии, в том числе TOMM и митофузины. Полиубиквитиновые метки распознаются белками-адаптерами, которые связываются с LC3, стимулируя замыкание аутофагосомы вокруг митохондрии [24]. Активация митофагии PINK1 изображена на рисунке 5Б.
Нарушение работы митохондрии очень часто сопровождается потерей потенциала на внутренней мембране. Матрикс перестает быть заряженным отрицательно, из-за чего сигнальный пептид на N-конце PINK1 на проникает в него. Трансмембранный домен в этом случае встраивается не во внутреннюю, а во внешнюю мембрану митохондрии. Там его никто не расщепляет, поэтому PINK1 остается на поверхности митохондрии и запускает сигнальный каскад, активирующий митофагию — частный случай аутофагии, в ходе которого поглощаются митохондрии. PINK1 активируется за счет автофосфорилирования, после чего фосфорилирует убиквитин-лигазу PARKIN, которая затем убиквитинилирует белки на поверхности митохондрии, в том числе TOMM и митофузины. Полиубиквитиновые метки распознаются белками-адаптерами, которые связываются с LC3, стимулируя замыкание аутофагосомы вокруг митохондрии [24]. Активация митофагии PINK1 изображена на рисунке 5Б.
Таким образом, PINK1 мониторит потенциал внутренней митохондриальной мембраны и в случае необходимости запускает митофагию. Но и у его покалеченной формы — PINK1-s, которая попадает в цитоплазму после ее отщепления протеазой PARL, — есть не менее важная задача.
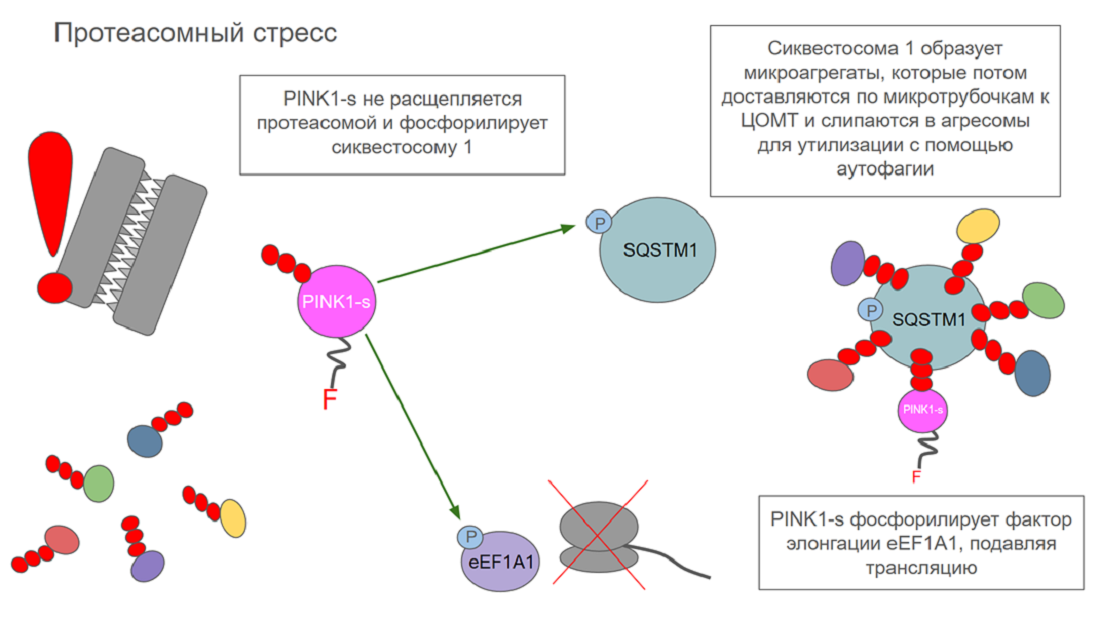
В норме PINK1-s быстро расщепляется протеасомой. Но иногда случается так, что протеасомы по какой-то причине не работают, то есть клетка находится в состоянии протеасомного стресса. Тогда PINK1-s накапливается в цитоплазме и запускает системы борьбы со стрессом, что позволяет избежать гибели клетки.
Если протеасомы не работают, единственный способ избавиться от ненужных белков — утилизировать их с помощью аутофагии. В активации этого процесса и участвует PINK1. Он фосфорилирует SQSTM1 (сиквестосому 1), тем самым активируя еt и запуская агрегацию полиубиквитинилированных белков. Сиквестосома 1 — это белок, участвующий в регуляции ряда клеточных процессов. Он может запускать разные сигнальные пути, но в условиях протеасомного стресса главной его задачей становится связывание полиубиквитинилированных белков. Для этого у него есть специальный домен UBA. Слипшиеся с сиквестосомой белки образуют микроагрегаты, которые затем распознает HDAC6 (деацетилаза гистонов 6). Она загружает их на динеины, которые транспортируют их по микротрубочкам к центру организации микротрубочек. Там они слипаются в более крупные агрегаты — агресомы. В таком состоянии неправильно сложенные белки могут храниться достаточно долго, пока, наконец, не утилизируются в процессе аутофагии [25].
На этом роль PINK1-s в активации ответа на протеасомный стресс не заканчивается. Помимо SQSTM1, он еще фосфорилирует фактор элонгации трансляции eEF1A1, что приводит к подавлению белкового синтеза. Это имеет важное значение для выживания клетки: для того, чтобы решить проблему накопления дефектных белков, нужно первым делом прекратить их появление [26]. Механизм действия PINK1 в условиях протеасомного стресса показан на рисунке 5В.
Иногда клетке так и не удается справиться с протеасомным стрессом, и тогда клубок белковых агрегатов — агресома — разрастается до огромных размеров. Это уже свидетельствует о серьезной патологии. Такая ситуация наблюдается, например, при α-синуклеинопатиях: болезни Паркинсона, деменцией с тельцами Леви и мультисистемной атрофии. Характерным признаком этих заболеваний является образование в нейронах телец Леви — больших скоплений неправильно сложенных белков возле ядра. Тельца Леви в основном состоят из белка α-синуклеина, однако в них присутствуют и другие белки, в том числе связанные с агресомой, такие как HDAC6 [27]. И, конечно, в них также присутствует PINK1 [28].
Никуда друг без друга
Получается, что аутофагия может частично компенсировать недостаточную активность протеасом, а в обратную сторону, по-видимому, не работает. Кроме того, аутофагия может напрямую контролировать протеасомную систему, утилизируя протеасомы, если их слишком много или они повреждены. Однако это вовсе не значит, что протеасомы менее важны, чем аутофагия, и присутствуют у нас только как напоминание о наших прокариотических предках. Появляются данные о том, что протеасомы необходимы для нормального функционирования аутофагии. Недавно было показано, что при активации митофагии образуется комплекс, состоящий из активаторов митофагии PINK1 и Parkin, активатора аутофагии Atg5 и белков PSMA7 и PSMB5, которые входят в состав протеасом. Этот комплекс необходим для доставки паркина к митохондриям. Нокдаун PSMA7 приводит к значительным нарушениям митофагии. Это еще раз говорит о том, что убиквитин-протеасомная система и аутофагия тесно связаны между собой [2].
Подводя итоги
Мы рассмотрели основные механизмы регуляции протеасомной системы и аутофагии. Теперь обобщим все вышесказанное о путях взаимодействия этих двух систем между собой.
- Мишени протеасом и аутофагосом имеют похожие метки: в обоих случаях используется полиубиквитинилирование. Протеасомному расщеплению в основном подвергаются белки, меченные цепочками, в которых убиквитины соединяются через Lys48, а аутофагии — Lys63. Полиубиквитины с Lys48 могут подвергаться и аутофагии, но с меньшей эффективностью. Это начинает происходить, когда протеасомы не справляются со всеми неправильно свернутыми белками.
- Активность аутофагии повышается при нарушении работы протеасом. Этот эффект обеспечивается шаперонами эндоплазматического ретикулума.
- В активации митофагии и ответе на протеасомный стресс участвует один и тот же белок — PINK1. При нарушении потенциала митохондрий он фосфорилирует убиквитин-лигазу Parkin, запуская аутофагию. В случае протеасомного стресса он фосфорилирует сиквестосому 1, стимулируя агрегацию неправильно свернутых белков для последующей утилизации с помощью аутофагии. Кроме того, он фосфорилирует фактор элонгации трансляции eEF1A1, что приводит к подавлению белкового синтеза.
- Митофагия косвенно регулируется протеасомной системой через протеолиз белков, обеспечивающих слияние и фрагментацию митохондрий.
- Аутофагия контролирует протеасомную систему, утилизируя протеасомы.
- Для активации митофагии необходимы белки, входящие в состав протеасом.
Две системы, обеспечивающие чистоту в клетках, имеют огромное значение для их нормального функционирования. Нарушения работы любой из систем способствует развитию ряда заболеваний, большинство из которых связано со старением. Сейчас механизмы регуляции протеасомной деградации и аутофагии активно исследуются, и появляется все больше данных, говорящих о том, что эти системы нельзя рассматривать в отрыве друг от друга. Исследования, посвященные изучению протеасомной системы, аутофагии и механизмам их взаимодействия, несомненно, внесут значимый вклад в борьбу со старением.
Литература
- Yanuar Alan Sulistio, Klaus Heese. (2016). The Ubiquitin-Proteasome System and Molecular Chaperone Deregulation in Alzheimer’s Disease. Mol Neurobiol. 53, 905-931;
- Nur Mehpare Kocaturk, Nesibe Peker, Karin Eberhart, Yunus Akkoc, Gamze Deveci, et. al.. (2022). Novel protein complexes containing autophagy and UPS components regulate proteasome-dependent PARK2 recruitment onto mitochondria and PARK2-PARK6 activity during mitophagy. Cell Death Dis. 13;
- Kenny K.K Chung, Valina L Dawson, Ted M Dawson. (2001). The role of the ubiquitin-proteasomal pathway in Parkinson's disease and other neurodegenerative disorders. Trends in Neurosciences. 24, S7-S14;
- Yihui Wu, Yifei Chen, Xianyan Tian, Genbao Shao, Qiong Lin, Aiqin Sun. (2024). Ubiquitination regulates autophagy in cancer: simple modifications, promising targets. J Transl Med. 22;
- Du Wu, Kangfeng Zhang, Pengfei Hu. (2019). The Role of Autophagy in Acute Myocardial Infarction. Front. Pharmacol.. 10;
- Oliver Drews, Heinrich Taegtmeyer. (2014). Targeting the Ubiquitin-Proteasome System in Heart Disease: The Basis for New Therapeutic Strategies. Antioxidants & Redox Signaling. 21, 2322-2343;
- Liang Kong, Shuhao Li, Yu Fu, Qinyun Cai, Xinyun Du, et. al.. (2024). Mitophagy in relation to chronic inflammation/ROS in aging. Mol Cell Biochem;
- Ashok N. Hegde, Lindsey M. Duke, Logan E. Timm, Hannah Nobles. (2023). The Proteasome and Ageing. Subcellular Biochemistry. 99-112;
- Yahyah Aman, Tomas Schmauck-Medina, Malene Hansen, Richard I. Morimoto, Anna Katharina Simon, et. al.. (2021). Autophagy in healthy aging and disease. Nat Aging. 1, 634-650;
- Kathryn L. Auld, Pamela A. Silver. (2006). Transcriptional Regulation by the Proteasome as a Mechanism for Cellular Protein. Cell Cycle. 5, 1503-1505;
- Takafumi Tasaki, Shashikanth M. Sriram, Kyong Soo Park, Yong Tae Kwon. (2012). The N-End Rule Pathway. Annu. Rev. Biochem.. 81, 261-289;
- Yong Tae Kwon, Aaron Ciechanover. (2017). The Ubiquitin Code in the Ubiquitin-Proteasome System and Autophagy. Trends in Biochemical Sciences. 42, 873-886;
- Keiji TANAKA. (2009). The proteasome: Overview of structure and functions. Proceedings of the Japan Academy. Ser. B: Physical and Biological Sciences. 85, 12-36;
- Yoshihisa Watanabe, Katsutoshi Taguchi, Masaki Tanaka. (2023). Roles of Stress Response in Autophagy Processes and Aging-Related Diseases. IJMS. 24, 13804;
- Philipp Kirchner, Mathieu Bourdenx, Julio Madrigal-Matute, Simoni Tiano, Antonio Diaz, et. al.. (2019). Proteome-wide analysis of chaperone-mediated autophagy targeting motifs. PLoS Biol. 17, e3000301;
- Jaime L. Schneider, Yousin Suh, Ana Maria Cuervo. (2014). Deficient Chaperone-Mediated Autophagy in Liver Leads to Metabolic Dysregulation. Cell Metabolism. 20, 417-432;
- Kumsal Tekirdag, Ana Maria Cuervo. (2018). Chaperone-mediated autophagy and endosomal microautophagy: Jointed by a chaperone. Journal of Biological Chemistry. 293, 5414-5424;
- Valerie Uytterhoeven, Elsa Lauwers, Ine Maes, Katarzyna Miskiewicz, Manuel N. Melo, et. al.. (2015). Hsc70-4 Deforms Membranes to Promote Synaptic Protein Turnover by Endosomal Microautophagy. Neuron. 88, 735-748;
- Elvira S. Cannizzo, Cristina C. Clement, Kateryna Morozova, Rut Valdor, Susmita Kaushik, et. al.. (2012). Age-Related Oxidative Stress Compromises Endosomal Proteostasis. Cell Reports. 2, 136-149;
- Yuchen Feng, Ding He, Zhiyuan Yao, Daniel J Klionsky. (2014). The machinery of macroautophagy. Cell Res. 24, 24-41;
- Benbrook D. M., Long A. (2012). Integration of autography, proteasomal degradation, unfolded protein responce and apoptosis. Experimental oncology. 34, 286–297;
- Chang Hoon Ji, Yong Tae Kwon. (2017). Crosstalk and Interplay between the Ubiquitin-Proteasome System and Autophagy. Molecules and Cells. 40, 441-449;
- Hao Meng, Wan-Yu Yan, Yu-Hong Lei, Zheng Wan, Ye-Ye Hou, et. al.. (2019). SIRT3 Regulation of Mitochondrial Quality Control in Neurodegenerative Diseases. Front. Aging Neurosci.. 11;
- Koji Yamano, Richard J Youle. (2013). PINK1 is degraded through the N-end rule pathway. Autophagy. 9, 1758-1769;
- Ju Gao, Mengen Li, Siyue Qin, Ting Zhang, Sicong Jiang, et. al.. (2016). Cytosolic PINK1 promotes the targeting of ubiquitinated proteins to the aggresome-autophagy pathway during proteasomal stress. Autophagy. 12, 632-647;
- Siyue Qin, Ling Ye, Youshi Zheng, Ju Gao. (2021). Cytosolic PINK1 orchestrates protein translation during proteasomal stress by phosphorylating the translation elongation factor eEF1A1. FEBS Letters. 595, 507-520;
- Miguel Lemos, Nadia Stefanova. (2020). Histone Deacetylase 6 and the Disease Mechanisms of α-Synucleinopathies. Front. Synaptic Neurosci.. 12;
- Miratul M. K. Muqit, Patrick M. Abou‐Sleiman, Adrian T. Saurin, Kirsten Harvey, Sonia Gandhi, et. al.. (2006). Altered cleavage and localization of PINK1 to aggresomes in the presence of proteasomal stress. Journal of Neurochemistry. 98, 156-169.