
Вдарим бицепсом по старению!
03 февраля 2025
Вдарим бицепсом по старению!
- 675
- 0
- 4
Портрет Алоиса Альцгеймера удивлен тому факту, что физическая активность замедляет развитие сенильной деменции.
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Существенную роль в поддержке более «юного» биологического возраста играет физическая активность. Клетки скелетных мышц в ответ на сокращения выделяют большое количество активных молекул, которые влияют на работу других органов. О некоторых механизмах таких биохимических взаимодействий — в этой статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Люди стареют с разной скоростью. В 2010 году в городке Данидин (Новая Зеландия) исследовали 1037 человек в возрасте 38 лет без хронических заболеваний. По 10 биомаркерам рассчитывали их биологический возраст [1]. Разница оказалась поразительной: люди в возрасте 38 лет показали биологическое состояние организма от 28 лет до 61 года (график распределения представлен на рис. 1).
К сожалению, в данном исследовании не изучали причины того, почему кто-то в сорок календарных лет оказался «биохимически» еще тридцатилетним, а кто-то — уже пятидесятилетним. Но на тему долголетия существует масса исследований, и уже сформировано некоторое представление, какие факторы могут ускорить старение или замедлить его. Одним из таких факторов является физическая активность.
Основные оздоровительные эффекты физкультуры все знают: это улучшение липидного профиля, нормализация давления, оптимизация сердечного выброса и объема легких, улучшение кровоснабжения, циркуляции лимфы и т.д. Регулярная физическая активность сокращает смертность на 30–35% в общей популяции населения, что соответствует увеличению продолжительности жизни на 0,4–6,9 года [2]. Но, помимо этого, рационально используемые физические упражнения могут стать настоящей терапией преждевременного старения: оказывается, физическая активность способствует образованию новых нейронов в стареющем мозге, помогает сопротивляться болезни Альцгеймера, в буквальном смысле омолаживает иммунные структуры, играет роль в защите теломер и даже замедляет рост и распространение злокачественных опухолей.
Но как именно это происходит?
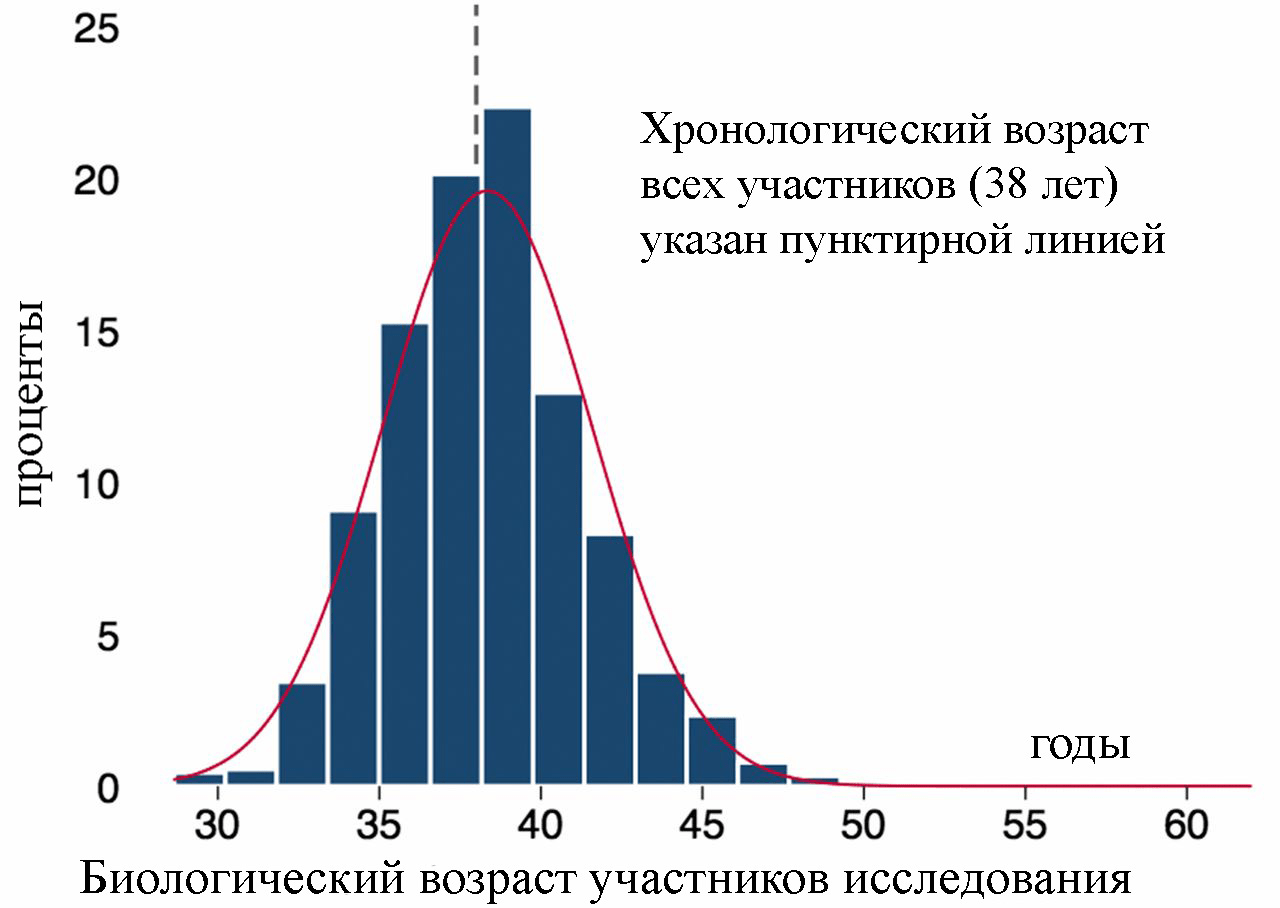
Рисунок 1. Распределение биологического возраста 1037 испытуемых 38 лет [1].
рисунок автора
Вдарим бицепсом по Альцгеймеру
Не найдется в современном обществе человека, который не знал бы о болезни Альцгеймера, которая приводит к потере памяти, а далее — к полному распаду личности. Это заболевание имеет не только наследственный, но и случайный характер: во втором случае оно напрямую связано с процессами старения мозга, и потому каждый, достигающий пожилого возраста, потенциально находится в зоне риска.
Болезнь Альцгеймера пока неизлечима, но есть уже проверенный комплекс мер, которые помогают замедлить ее течение. Двигательные упражнения и физическая активность все чаще предлагаются как часть этой мультимодальной стратегии [3]. Казалось бы: какое отношение физкультура имеет к нейродегенеративному заболеванию? Понятно, что мозг непосредственно влияет на сокращение мышц, а вот сокращение мышц каким образом влияет на мозг? Ранние исследования не могли толком объяснить подобные связи, но буквально недавно вышла интересная работа, в которой удалось наконец проявить цепочку биохимических взаимодействий «между бицепсом и мозгом».
Неклассическая железа
Поиск ресурсов, партнеров, освоение новых территорий, целенаправленный уход из дискомфортных зон — все это требует от живых существ способности активно перемещаться, потому в процессе эволюции движение стало неотъемлемой частью самого феномена жизни. Человек не является исключением: локомоция была крайне необходима для выживания и эволюции Homo sapiens, и на протяжении всей истории развития нашего вида происходил отбор генов и признаков, способствующих физической активности. А так как в организме все взаимосвязано, физическая активность оказывает колоссальное влияние на другие органы.
На протяжении большей части прошлого столетия исследователи искали связь между сокращением мышц и последующими метаболическими изменениями в других системах организма. И они выяснили, что мышечные клетки (миоциты) в ответ на сокращение выделяют большое количество разнообразных активных молекул: цитокинов, пептидов и протеогликанов. Эти молекулы действуют как в пределах мышцы, так и на более высоких уровнях: попадая в транспортную систему крови, они становятся посредниками и обеспечивают физиологическое взаимодействие между мышцами и другими органами. Так мышечная ткань «общается» с мозгом, жировой, костной тканью, печенью, кишечником, поджелудочной железой, сосудами, кожей и влияет на их работу.
Активные молекулы, выделяемые миоцитами, назвали миокинами. Миокины позволили причислить мышечную ткань к неклассической железе внутренней секреции (по аналогии с костной и жировой тканью). То есть получается, что мышечная ткань не просто передвигает или фиксирует рычаги скелета: она обладает существенной гормональной активностью. А занятия физкультурой изменяют не только мышечный рельеф и физические показатели [4].
Иризин
В случае с болезнью Альцгеймера ученых заинтересовал один из миокинов — иризин. Почему именно иризин? Ранее было показано, что концентрация иризина повышается в ответ на увеличение физических нагрузок, и этот миокин прямо ассоциирован с повышенной или нарастающей мышечной массой — это раз. Иризин был найден не только в мышцах и в крови, но также в мозге человека и мыши, особенно в гиппокампе: то есть данная белковая молекула, по-видимому, успешно преодолевает гематоэнцефалический барьер мозга, а «разрешение» на прохождение есть далеко не у всех молекул. Это два. А три: уровень иризина был по какой-то причине ниже у пациентов с болезнью Альцгеймера. Весьма подозрительно, не правда ли? Так и попал иризин под пристальное внимание исследователей [5].
На чем изучали?
Исследование проводилось на трехмерных живых моделях клеточных культур, включающих в себя нейроны, астроциты и олигодендроциты: почти что кусочек мозга в чашке Петри. В создании культур использовались нервные стволовые клетки человека, больного наследственными формами болезни Альцгеймера, которые приводят к отложению амилоида-β по всему гиппокампу и коре головного мозга.
Как изучали?
Получившиеся 0,5- или 3,5-недельные клеточные культуры обрабатывали раствором иризина в концентрации 5 и 500 нг/мл в течение 1,5 недель. Исследователи выбрали 5 нг/мл иризина, так как эта концентрация находится в пределах нормального физиологического уровня в плазме человека (тут следует отметить, что 5 нг/мл — это уровень иризина физически активного человека, так как в исследовании, на которое ссылаются сами авторы, указано, что у людей, ведущих малоподвижный образ жизни концентрация данного белка ~3,6 нг/мл). В ходе эксперимента обработка иризином действительно значительно снижала уровни амилоидов-β, которые уже успели отложиться в клеточных культурах. Мало того, высокая концентрация иризина в 500 нг/мл не оказалась токсичной для клеток.
Далее учеными был выяснен сам механизм воздействия. Оказалось, что иризин уменьшает количество накопленных амилоидов в культурах не сам по себе. Он связывается с определенным рецептором (интегрином αV/β5) на поверхности астроцитов (помощников нейронов) и запускает в них процесс повышения секреции другого белка, неприлизина (NEP). Неприлизин — это фермент, который относится к семейству протеиназ. Протеиназы расщепляют связи в цепочках самых разнообразных белковых молекул, способствуя их распаду и последующей безопасной переработке. То, что протеиназа неприлизин способна расщеплять амилоиды было уже известно ранее. Например, в 2005 году проводилось исследование воздействия на трансгенных мышей «обогащенной среды». И еще тогда было показано, что активность фермента неприлизина повышается в мозге мышей, обитающих в «обогащенных» условиях по сравнению с животными «стандартного содержания». У хвостатых, которые проживали в более просторных клетках с лабиринтами, беговыми колесами и другими развлечениями, стимулирующими активность, амилоидная нагрузка была достоверно ниже [6].
Что в итоге получается: человек работает мускулатурой — мышечные клетки выделяют разнообразные миокины, в том числе иризин. Иризин выходит в кровоток, преодолевает гематоэнцефалический барьер и попадает в мозг. Там он связывается с рецептором на клетках и переключает помощники нейронов — астроциты — на активное производство фермента, расщепляющего амилоиды. Когнитивные функции у пациента, больного Альцгеймером, улучшаются.
Патологические скопления амилоида-β не являются первопричиной болезни Альцгеймера (первопричины по сей день не выявлены), потому говорить о выздоровлении тут, конечно, не приходится. Также пока не ясно, удастся ли разработать лекарство на основе иризина. Но пока неустанные ученые будут заниматься этими вопросами, мы можем в качестве профилактики активно работать мышцами, стимулируя астроциты к более тщательной «уборке» в мозге.
Укатим от старости на велике
Одну из главных ролей в старении играет ослабление и разбалансировка иммунной системы. Это делает организм более восприимчивым к инфекциям, повышает риск возникновения злокачественных новообразований, аутоиммунных процессов. И тут нам больше всего не повезло с тимусом — железой, которая является эдаким ВУЗом для определенного типа иммунных клеток — Т-лимфоцитов. Т-лимфоциты это выходцы из костного мозга, но они становятся способными защищать организм только после сложного «обучения» в тимусе. Лишь там они обретают умение вычислять чужеродные белки и выполнять функции ключевого звена приобретенного иммунитета. Защита от постоянно мутирующих вирусов и перерожденных клеток собственного организма — основная зона ответственности выпускников тимуса, а без обучения Т-лимфоцит останется бесполезным болваном (от слова болванка) и не сможет отличить своего от чужого. Подробнее о процессе «обучения» Т-лимфоцитов на сайте «Биомолекулы» в статье «Тимоцитов ведут в зоопарк. Что такое эктопическая экспрессия и как она защищает нас от аутоиммунитета» [7].
Тимус начинает функционировать у шестинедельного эмбриона человека, к рождению его масса достигает 10–15 г, к началу полового созревания — 30–40 г. А далее… Далее начинается постепенная инволюция тимуса с утратой от 3% до 5% активной ткани ежегодно. Продолжается это безобразие до среднего возраста и после инволюция органа замедляется до 1% в год [8]. Такие особенности делают тимус самым быстро стареющим органом — «седая борода» у него начинает расти уже после пубертата. Ну, а если серьезно, последствия инволюции этой важной железы во многом определяют продолжительность жизни организма.
Исследуя тимус, ученые обратили внимание, что у человека (а также у лабораторных животных) происходит еще более ускоренное сокращение активных тканей тимуса по сравнению с животными, обитающими в природной среде [9]. Чем же таким отличается природная среда от вышеуказанной не природной? Может, уровнем двигательной активности? Надо бы разобраться.
Омолаживающий гормон
Было выяснено, что «омолаживающим» действием на тимус обладает соматотропин — гормон роста. Название связанное с ростом этот гормон получил за то, что у детей он вызывает удлинение трубчатых костей конечностей, собственно — рост тела. Но выделяется соматотропин не только в детстве, но и у взрослых, хоть и в меньших количествах. Введение соматотропина в качестве иммуностимулятора способствовало увеличению тимуса и росту количества так называемых недавних тимусных эмигрантов — «юных» обученных Т-клеток, недавних «выпускников ВУЗа» [10]. А инъекции гормона роста ВИЧ-инфицированным взрослым увеличивали массу тимуса и повышали количество CD4+ Т-лимфоцитов в крови по сравнению с больными, получающими только антиретровирусную терапию [11].
Но гормон роста не является миокином, он выделяется не мышцами, а в мозге, если точнее — в гипофизе. Ложный след? Нет, из физиологических факторов, которые стимулируют секрецию гормона роста гипофизом, можно выделить сон, стрессы, гипогликемию, белковую пищу и… физические нагрузки.
Молодые пожилые велосипедисты
Физические упражнения действительно повышают концентрацию гормона роста: это подтверждено многочисленными исследованиями [12]. Есть также работы, которые проясняют, что влияние физических нагрузок на стимуляцию соматотропина осуществляется через повышение в крови лактата. Лактат — продукт анаэробного гликолиза, бескислородного расщепления глюкозы. Анаэробный гликолиз активизируется в мышечных клетках, когда для обычного энергообеспечения им не хватает кислорода. В покое до физической нагрузки концентрация лактата в крови составляет 1–2 ммоль/л. После физической нагрузки субмаксимальной мощности концентрация лактата в крови резко возрастает и может достигать 18–20 ммоль/л. Это меняет кислотно-щелочной баланс в организме в кислую сторону и положительно влияет на выработку соматотропина гипофизом [13].
В физической активности исследователи даже выделяют три фактора, которые оказывают наибольшее стимулирующее действие на соматотропин у мужчин и женщин [12]:
-
сочетание большого объема выполненной работы;
-
короткая продолжительность интервалов для отдыха (1 минута);
-
использование средней величины отягощений.
Возможно, повышающийся в ответ на лактат соматотропин благотворно влияет на тимус? А недостаток физической активности все-таки может быть одной из причин ускоренной инволюции органа в искусственной среде? Чтобы выяснить, есть ли зависимость уровня физической активности и «возраста» тимуса, сравнили иммунные профили 125 пожилых велосипедистов, которые поддерживали высокий уровень физической активности на протяжении большей части своей взрослой жизни, 75 пожилых людей того же возраста с низкой физической активностью и 55 молодых людей, не занимающихся регулярными физическими упражнениями. По результатам количество юных обученных Т-клеток у пожилых велосипедистов было выше, чем у пожилых неактивных людей — на уровне молодых участников исследования (третья группа). Похоже, что регулярные тренировки действительно «омолаживают» тимус посредством повышения уровня соматотропина и помогают сохранить сбалансированную иммунную систему долгие годы [14].

Рисунок 2. Бабушка на велике.
рисунок автора
Станцуем с морскими коньками
В мозге есть отдел, который называется морской конек, или гиппокамп. Структура эта парная, то есть по одному «коньку» в каждом полушарии. Гиппокамп мал, да удал. Он отвечает за пространственную ориентацию: нейроны гиппокампа создают трехмерную карту местности и сигнализируют о расположении тела в ней. Все процессы, связанные с балансом и навигацией, происходят благодаря этой маленькой структуре головного мозга. Также гиппокамп участвует в переносе информации из кратковременной в долговременную память — похоже что без него нам ничего не получится запомнить [15].
К несчастью, гиппокамп подвержен болезням Альцгеймера и Паркинсона. Но и нормальный процесс старения приводит к расстройству памяти, обучения и проблемам с пространственной навигацией: магнитно-резонансные исследования выявили, что скорость атрофии гиппокампа и парагиппокампальной извилины составляет 2–3% за десятилетие и ускоряется у людей старше 70 лет (до +1% за год) [15]. С возрастом морские коньки «усыхают». Но не спешим расстраиваться: гиппокамп относится к тем немногим областям мозга, которые способны генерировать новые нейроны на протяжении всей жизни! Исследования показали, что нужно всего лишь приложить некоторые усилия, и даже в возрасте после 60 лет, за полтора года регулярных тренировок объем гиппокампа увеличивается [16].
Между движением и нейрогенезом
Но каковы же возможные молекулярные механизмы влияния физических нагрузок на нейрональную пластичность в гиппокампе?
-
Увеличение концентрации продуктов гликолиза. При физических нагрузках, как было уже сказано выше, возрастает концентрация лактата. Лактат, предположительно, может служить источником энергии для нейронов в случае нехватки глюкозы. Возможно, во время физических нагрузок лактат транспортируется непосредственно через клетки эндотелия сосудов в астроциты и затем в нейроны, улучшая их энергетическое питание [17].
-
Усиление кровоснабжения зубчатой извилины за счет прорастания новых сосудов. Бег в колесе, а также подкожные инъекции L-лактата, имитирующие метаболические изменения при физических нагрузках, способствуют повышению экспрессии рецептора лактата HCAR1 в фибробластах, входящих в состав сосудов мозга. Активация рецептора HCAR1, в свою очередь, приводит к увеличению уровня васкулярного фактора роста (VEGF-A). VEGF-A — это основной индуктор роста кровеносных сосудов. Прорастание новых сосудов из уже существующих формирует более разветвленную капиллярную сеть и способствует лучшему кровоснабжению нервной ткани [17].
-
Стимуляция синтеза нейротрофических факторов. Такие миокины, как инсулиноподобный фактор роста-1 (IGF-1) и знакомый нам иризин стимулируют деление клеток в гиппокампе, уменьшают процессы нейровоспаления, а также — и это, наверное, самое важное — способствуют увеличению уровня нейротрофического фактора BDNF [17], [18]. Белковая молекула BDNF принимает важнейшее участие в развитии и выживании нейронов и необходима для синаптической пластичности (особенно в гиппокампе и неокортексе). Без BDNF нейроны вянут, как цветы без полива, и с большим трудом образуют между собой синаптические связи [19]. На «Биомолекуле» об этом можно прочитать в статье «BDNF: почему спорт — это жизнь?» [20].
Получается, человек занимается физкультурой, а новые сосуды прорастают не только в активно работающих мышцах (что логично), но и в определенных структурах мозга. Мало того, физическая активность стимулирует появление новых нейронов. Чудеса да и только. И, что интересно, наибольший нейрогенез в морских коньках показали… танцы! [15]
Исследовали четырнадцать участников танцевальной группы (67,21 ± 3,78 года, семь женщин) и 12 участников фитнес-группы (68,67 ± 2,57 года, пять женщин) после 18 месяцев активных тренировок. В обеих группах было выявлено увеличение объема гиппокампа (преимущественно в левом ГК). У танцоров наблюдалось дополнительное увеличение левой зубчатой извилины ГК и правого субикулюма [15].
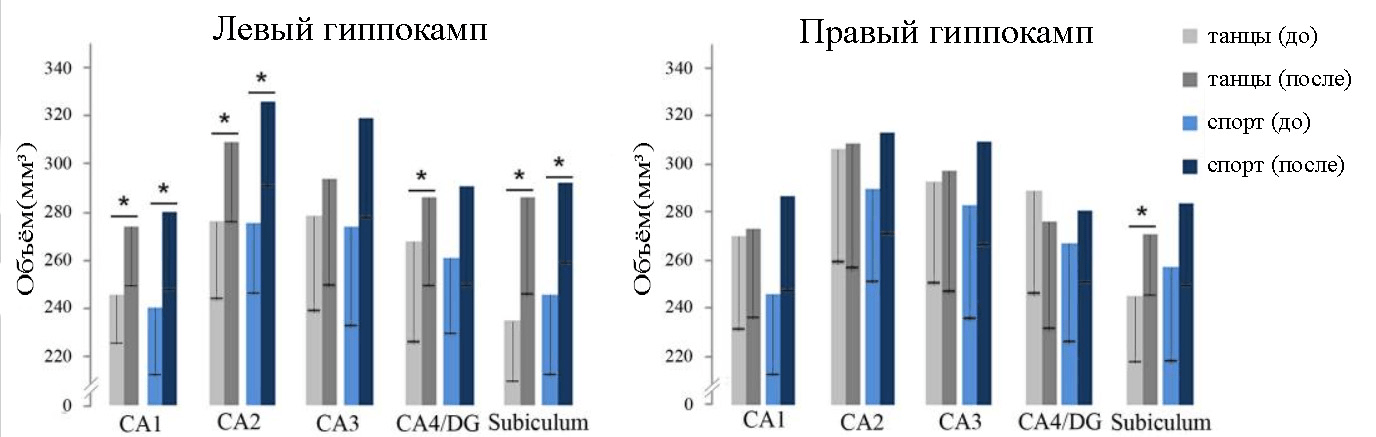
Рисунок 3. Объемы подполей гиппокампа в группе танцев и спорта на исходном уровне и через 18 месяцев вмешательства, включая стандартное отклонение. CA1, CA2, CA3 и CA4 — зоны гиппокампа, DG — зубчатая извилина гиппокампа, субикулюм [15].
Следовательно, танцы — многообещающий кандидат в противодействии возрастному снижению физических и умственных способностей. Верно же кто-то подметил, что перестают танцевать не потому что стареют — стареют потому, что перестают танцевать.
Опухоль — на голодную диету!
Накопление мутаций происходит в клетках всю жизнь. Но далеко не каждая мутация приближает клетку к предательству и бессовестному эгоистичному существованию: безобидные мутации, которые не ведут к злокачественным перерождениям, называют «пассажиры», а которые участвуют в канцерогенезе получили прозвище «водители» [21]. «Водителями» становятся мутации в определенных участках генома: например, в генах, ответственных за ремонт ДНК, в генах регуляторов клеточного деления (белок р53) и т.д. По современным представлениям, таких «пьяных водителей» в геноме клетки должно собраться от трех до семи (за редким исключением меньше). Потому не удивительно, что, чем старше становится человек, тем выше шанс появления злокачественной мутантной клетки, которая решит построить свое собственное «государство» в организме. Ускоряют процесс образования мутаций:
-
наследственность;
-
канцерогенные вещества (табак, алкоголь, загрязненный воздух и др.);
-
радиационное облучение (в частности воздействие ультрафиолета);
-
ожирение и связанный с ним метаболический синдром.
Основной удар онкологических заболеваний приходится на людей в возрасте 60+. В этой группе диагностируется 72,1 % случаев заболевания у мужчин и 65,8 % у женщин, а максимальный уровень онкологической заболеваемости отмечается в группе 70–74 года (1406,6 случаев на 100 тыс. населения). Данные статистики остаются в этих пределах уже не один десяток лет, в том числе остается неизменной статистика «возраста рака» (По данным НМИЦ онкологии им. Н.Н. Петрова).
Физические нагрузки действуют позитивно на общую сопротивляемость организма мутантным клеткам. Но не только потому, что помогают сохранить тимус, как освещалось выше. Оказывается, активно работающие миоциты вступают с мутантными клетками в конкурентную борьбу за ресурсы.
Немного про энергетику
Основным путем добычи энергии у клеток эукариот обычно является окисление глюкозы с помощью кислорода — аэробный распад. Происходит этот процесс в митохондриях (энергетических органеллах), при этом из одной молекулы глюкозы в сумме получается 36 молекул АТФ (универсальных энергетических единиц). Это очень эффективный и прогрессивный способ добыть энергию. А самым древним способом выудить из глюкозы АТФ является анаэробный (бескислородный) гликолиз, который происходит с помощью ферментов в цитозоле клетки. При гликолизе на выходе получается всего две молекулы АТФ, но зато он не зависит от наличия кислорода. В клетках высших животных используются оба варианта, причем гликолиз у большинства соматических клеток обычно является запасным: его активность подавляет присутствие кислорода и «включается» он в состоянии кислородного дефицита. Например, в мышцах во время самого начала интенсивной работы (пока организм не успел перестроить режим сердца и легких) или во время продолжительных высоких физических нагрузок (как дополнительный источник энергии).
Эффект Варбурга и последствия неэффективного энергообеспечения
Лауреат нобелевской премии Отто Генрих Варбург почти 100 лет назад обнаружил, что большинство опухолевых клеток (не все) отличаются от нормальных клеток странным метаболизмом: основным источником энергии у них является не аэробный распад глюкозы, а гликолиз. При этом происходит он в присутствии кислорода, что не согласуется с эффектом Пастера, при котором скорость гликолиза в присутствии кислорода должна резко снижаться. Этот процесс получил название эффект Варбурга. Нормальные соматические клетки обычно используют аэробное окисление для получения до 90% всей АТФ, анаэробный гликолиз — для получения 10% АТФ. Опухолевые клетки, проявляющие эффект Варбурга, используют гликолиз для получения до 50–60% АТФ [22].
Получается, в таких перерожденных клетках скорость гликолиза обычно во много раз выше, чем в нормальных. Тогда снижение интенсивности гликолиза может привести к тому, что опухоль лишится основного питания? Действительно, ингибиторы гликолиза подавляют рост некоторых типов опухолей и могут быть успешно использованы в комплексной терапии онкологических заболеваний [22].
А причем тут физкультура?
Анализ 20-летних данных наблюдения за группой людей (n = 2734; 1302 женщины) показал, что высокоинтенсивные упражнения значительно снижают риск метастазирования некоторых опухолей. А в трех моделях меланомы у мышей физические нагрузки перед инъекцией рака также значительно защищали зверей от метастазов в отдельных органах [23]. Чем же опухолевые клетки невзлюбили физкультуру?
Злокачественные клетки обычно отличаются очень активным метаболизмом, который позволяет им быстро делиться. Но если они при этом проявляют эффект Варбурга (сидят на неэффективном энергообеспечении) — тогда глюкозы им для такой бурной жизнедеятельности нужен вагон и маленькая тележка. И тут на сцену выходят активно работающие мускулы, которые, как полагают исследователи, вступают в конкурентное противоборство за глюкозу с клетками-отступниками. Иными словами, активные миоциты «объедают» опухолевые клетки. От самой опухоли это, конечно, не избавляет, но на голодной диете не сильно-то разгонишься расти и метастазировать. Кроме того, как считают исследователи, мышечная активность перепрограммирует метаболизм некоторых органов, делая их среду некомфортной для развития перерожденных клеток [23] (рис. 4).
Рисунок 4. Клетки организма после физкультуры и опухолевая клетка.
рисунок автора
Это замечательные новости, которые не только придают еще больше смысла физической активности, но также намечают широкую область для дальнейших исследований.
Сохраним теломеры
Теломеры — концевые участки линейной молекулы ДНК, которые состоят из повторяющейся последовательности нуклеотидов. Это специализированные структуры, которые защищают концы хромосом от потери важной информации. При каждом делении теломеры укорачиваются, и считается, что чем короче теломеры, тем «старше» сама клетка. Некоторые клетки могут удлинять (наращивать) теломеры с помощью фермента теломеразы, которая активна в стволовых и опухолевых клетках, сперматозоидах, яйцеклетках. В обычных клетках теломераза, как правило, не активна. Но при этом теломеры, как оказалось, хоть и не удлиняются, но все равно находятся под защитой.
Не так давно исследователи выяснили, что теломеры это не просто нуклеотидные повторы на хромосомах, которые не несут никакой информации: с них все же считывается нить РНК. Эту РНК назвали TERRA. Предполагают, что TERRA является важным компонентом и регулятором теломерного хроматина. Она участвует в гетерохроматизации — компактной упаковке теломер, что может быть важно для защиты их целостности. При сниженном уровне TERRA наблюдаются теломерные сшивки, а удаление TERRA из клетки приводит к резкой потере последовательностей теломер и, следовательно, повреждению информационной ДНК [24]. Стало быть, эта TERRA — важная штука.
Велосипедные упражнения на выносливость увеличили уровни TERRA в биопсиях скелетных мышц, полученных от 10 здоровых молодых добровольцев. Стимуляцию подъема уровня TERRA связывают с АМФ-активируемой протеинкиназой, которая включается в работу при значительном потреблении клеткой энергии (например, при физической нагрузке) и нарастании внутриклеточного уровня АМФ (продукта использования АТФ). И, хоть исследований в этой области еще не так много, эти данные подтверждают идею, что физические упражнения могут защищать определенные клетки от порчи теломер и преждевременного старения [25].
Эпилог
Старение организма — многофакторный процесс. По расчетам ВОЗ и Минздрава, долголетие определяется двумя основными факторами: примерно на 20% — генетикой и около 80% — образом жизни. В образ жизни, который замедляет темпы старения организма, входят сбалансированность питания, своевременная профилактика заболеваний, отказ от вредных привычек и физическая активность, сбалансированная периодами отдыха для полноценного восстановления. В настоящее время, по оценке Всемирной организации здравоохранения, физическая активность около 60 % населения Земли не достигает уровня, необходимого для поддержки и сохранения здоровья. Сидячий образ жизни стал настолько распространен, что упражнения называют «полезными», хотя подвижность в принципе является биологически нормальным состоянием [26]. Тем временем исследователи находят все больше связей между мышечной активностью и остальными системами организма, раскрывая важнейшую составляющую формулы здоровья и долголетия. А главное, что «молодильные яблоки» в виде физических упражнений легко доступны практически всем.
Литература
- Daniel W. Belsky, Avshalom Caspi, Renate Houts, Harvey J. Cohen, David L. Corcoran, et. al. (2015). Quantification of biological aging in young adults. Proc. Natl. Acad. Sci. U.S.A. 112;
- Гендлин Г.Е., Учаева Я.И., Мелехов А.В. (2013). Физические нагрузки и продолжительность жизни. Атмосфера. Новости кардиологии. 3, 39–44;
- Anna Rosenberg, Tiia Ngandu, Minna Rusanen, Riitta Antikainen, Lars Bäckman, et. al. (2018). Multidomain lifestyle intervention benefits a large elderly population at risk for cognitive decline and dementia regardless of baseline characteristics: The FINGER trial. Alzheimer's & Dementia. 14, 263-270;
- T. T. Tsoriev, Zh. E. White, L. Ya. Rozhinskaya. (2016). The role of myokines interstitial interaction and regulation of metabolism: a review of literature. Osteopor Bone Dis. 19, 28-34;
- Eunhee Kim, Hyeonwoo Kim, Mark P. Jedrychowski, Grisilda Bakiasi, Joseph Park, et. al. (2023). Irisin reduces amyloid-β by inducing the release of neprilysin from astrocytes following downregulation of ERK-STAT3 signaling. Neuron. 111, 3619-3633.e8;
- Orly Lazarov, John Robinson, Ya-Ping Tang, Ilana S. Hairston, Zeljka Korade-Mirnics, et. al. (2005). Environmental Enrichment Reduces Aβ Levels and Amyloid Deposition in Transgenic Mice. Cell. 120, 701-713;
- Тимоцитов ведут в зоопарк. Что такое эктопическая экспрессия и как она защищает нас от аутоиммунитета;
- Демьяненко С.В., Чистяков В.А., Водопьянов А.С., Брень А.Б. (2012). Возрастные изменения тимусзависимого звена иммунной системы. Журнал фундаментальной медицины и биологии. 1, 17–29;
- Юрчинский В.Я., Ерофеева Л.М. (2020). Сравнительная характеристика возрастных изменений лимфоидного и волокнистого соединительнотканного компонентов тимуса позвоночных животных. Журнал общей биологии. 81, 20–30;
- Ярилин А.А. и Донецкова А.Д. (2012). Т-клетки — недавние эмигранты из тимуса. Иммунология. 33, 326–334;
- Безвершенко И.А., Гойдаш М.М. (1993). Действие соматотропина и непептидного митогенного фактора на пролиферативную активность тимоцитов. Проблемы эндокринологии. 39;
- L.A. Botvineva, Yu.V. Koryagina. (2022). Physical activity and somatotropic hormone. Russian Journal of Sports Science: Medicine, Physiology, Training. 1;
- S. E. Gordon, W. J. Kraemer, N. H. Vos, J. M. Lynch, H. G. Knuttgen. (1994). Effect of acid-base balance on the growth hormone response to acute high-intensity cycle exercise. Journal of Applied Physiology. 76, 821-829;
- Niharika Arora Duggal, Ross D. Pollock, Norman R. Lazarus, Stephen Harridge, Janet M. Lord. (2018). Major features of immunesenescence, including reduced thymic output, are ameliorated by high levels of physical activity in adulthood. Aging Cell. 17;
- Kathrin Rehfeld, Patrick Müller, Norman Aye, Marlen Schmicker, Milos Dordevic, et. al. (2017). Dancing or Fitness Sport? The Effects of Two Training Programs on Hippocampal Plasticity and Balance Abilities in Healthy Seniors. Front. Hum. Neurosci. 11;
- Gerd Kempermann, Hongjun Song, Fred H. Gage. (2015). Neurogenesis in the Adult Hippocampus. Cold Spring Harb Perspect Biol. 7, a018812;
- Anna Vyacheslavovna Vinogradova, Polina Andreevna Smirnova, Zlata Yuryevna Yakovchuk, Oksana Pavlovna Tuchina. (2022). Ihe role of physical activity in the processes of neurogenesis in the hippocampus. Molekulyarnaya Meditsina (Molecular medicine). 20, 22-27;
- Q. Ding, S. Vaynman, M. Akhavan, Z. Ying, F. Gomez-Pinilla. (2006). Insulin-like growth factor I interfaces with brain-derived neurotrophic factor-mediated synaptic plasticity to modulate aspects of exercise-induced cognitive function. Neuroscience. 140, 823-833;
- Devin K. Binder, Helen E. Scharfman. (2004). Brain-derived neurotrophic factor. Growth Factors. 22, 123-131;
- BDNF: почему спорт — это жизнь?;
- Рыженкова О.Н. (2005). Мутации -"водители" и "пассажиры". Биомедицинская химия. 53, 260–265;
- Менчиков Л.Г., Шестов А.А., Попов А.В. (2023). Новый взгляд на эффект Варбурга: слияние классической биохимии и органической химии. Современное состояние и перспективы. Успехи биологической химии. 63;
- Danna Sheinboim, Shivang Parikh, Paulee Manich, Irit Markus, Sapir Dahan, et. al. (2022). An Exercise-Induced Metabolic Shield in Distant Organs Blocks Cancer Progression and Metastatic Dissemination. Cancer Research. 82, 4164-4178;
- Juan José Montero, Isabel López de Silanes, Osvaldo Graña, Maria A. Blasco. (2016). Telomeric RNAs are essential to maintain telomeres. Nat Commun. 7;
- Aurélie Diman, Joanna Boros, Florian Poulain, Julie Rodriguez, Marin Purnelle, et. al. (2016). Nuclear respiratory factor 1 and endurance exercise promote human telomere transcription. Sci. Adv. 2;
- John A. Hawley, Mark Hargreaves, Michael J. Joyner, Juleen R. Zierath. (2014). Integrative Biology of Exercise. Cell. 159, 738-749.







