
В ооцитах мышей с ожирением нарушается работа митохондрий
05 марта 2015
В ооцитах мышей с ожирением нарушается работа митохондрий
- 483
- 2
- 6
Кому нужны эти митохондрии, когда тут столько еды?
Рисунок в полном размере.
-
Автор
-
Редактор
Избыточный вес самок мышей плохо сказывается на качестве их половых клеток — ооциты становятся менее жизнеспособными, а полученные из них зародыши развиваются медленнее и с большей частотой нарушений. Кроме того, и в ооцитах, и в развивающихся из них зародышах снижается мембранный потенциал митохондрий и уменьшается количество митохондриальной ДНК. Состояние ооцитов позволило предположить, что они страдают от липотоксичности — «симптомокомплекса» повышенного содержания жиров. Негативные эффекты липотоксичности удалось сгладить благодаря применению активаторов стрессового ответа эндоплазматической сети.
Ожирение — нездоровое состояние, которое влияет на многие аспекты жизни. Однако не так широко известно, что у самок животных вместе с ожирением возникают проблемы и в репродуктивной сфере. В экспериментах на грызунах показано, что ожирение матери негативно влияет на предимплантационное развитие эмбрионов. Что касается человека, то женщинам с избыточным весом часто приходится прибегать к вспомогательным репродуктивным технологиям, но успешность применения этих методов у них ниже, чем у женщин с нормальным весом, из-за худшего качества ооцитов. Однако до сих пор было неизвестно, как избыточный вес матери влияет на свойства ооцитов и способность эмбрионов к развитию.
Чем может быть вредно избыточное количество жиров в организме? На клеточном уровне оно вызывает комплекс негативных последствий, который можно назвать липотоксичностью . Чрезмерное накопление жиров нарушает структуру мембранных органелл клетки — эндоплазматической сети (ЭПС) и митохондрий. Эти органеллы выполняют очень важные функции: в эндоплазматической сети происходят правильное сворачивание (фолдинг) и модификации белков, а в митохондриях — «сжигание» органических молекул, благодаря которому клетка запасает энергию. Помимо непосредственного вреда митохондриям от избыточных липидов, их мембранный потенциал также падает под воздействием ионов кальция, которые начинают «вытекать» из поврежденной липидами ЭПС. В результате в митохондриях усиливается образование активных форм кислорода, вызывая окислительный стресс у клеток. Если с ситуацией не удается справиться с помощью запуска специальных реакций на стресс, клетка погибает.
В то же время жировые клетки (адипоциты) в разумном количестве могут защищать организм от развития некоторых инфекций: «Полюби свои жировые клетки!» [1]. — Ред.
Рисунок 1. Мышь, склонная к перееданию, по сравнению с нормальной. Уже к четырнадцатинедельному возрасту такие мыши весили в полтора раза больше, чем нормальные особи.
Ученые из университета Аделаиды (Австралия) предположили, что избыточное количество липидов может влиять и на качество ооцитов самок животных с ожирением [2]. В качестве материала для исследования выбрали ооциты особой линии мышей (Blobby), склонных к перееданию (рис. 1). Эти мыши набирают вес постепенно — масса тела пятинедельных особей почти не отличается от массы обычных мышей, зато к четырнадцатинедельному возрасту они уже превосходят нормальных особей по массе в полтора раза. Такая особенность позволила сравнить качество ооцитов мышей Blobby при близком к норме весе и в состоянии ожирения.
Оказалось, что у мышей с ожирением проблемы начинались еще на стадии овуляции: из фолликулов выходило меньше ооцитов, чем у нормальных мышей. В ооцитах мышей Blobby было видно больше жировых капель, а также была повышена активность генов стрессового ответа эндоплазматической сети. Кроме того, такие ооциты выделяли меньше белка PTX3 (пентраксина-3), важного для оплодотворения, что косвенно подтверждает нарушение работы ЭПС в ооцитах (поскольку именно эта органелла отвечает за фолдинг белков). Разумеется, в ооцитах мышей с ожирением была нарушена и функция митохондрий: снизился мембранный потенциал, несколько уменьшилось содержание митохондриальной ДНК (мтДНК). Кроме того, чаще наблюдались аномалии веретена деления. По-видимому, ооциты мышей Blobby действительно страдали от токсического действия липидов.
После оплодотворения ооциты ожиревших мышей также испытывали определенные трудности. Во-первых, они часто подвергались фрагментации и теряли жизнеспособность на ранних стадиях. Во-вторых, развитие оставшихся протекало медленнее и прекращалось еще до стадии бластоцисты у большего числа зародышей. Кроме того, в ходе развития эмбриона количество митохондриальной ДНК в нем оставалось пониженным.
После имплантации выживших эмбрионов суррогатным матерям оказалось, что плоды из ооцитов мышей с ожирением имели бóльшую массу, чем плоды из ооцитов нормальных мышей. В тканях таких плодов содержание мтДНК оставалось пониженным. Кроме того, митохондриальная ДНК потомков мышей Blobby несла больше мутаций, чем мтДНК потомков нормальных мышей.
Получается, что липотоксичность может влиять на состояние ооцитов и их дальнейшее развитие после оплодотворения. Её влияние проявляется даже в тканях потомков мышей с ожирением, поскольку митохондрии каждое животное получает только от матери .
Однако сейчас появилась возможность разжиться «здоровыми» митохондриями от третьего родителя: «Трое в лодке: о легализации замены митохондрий» [3]. — Ред.
Хорошая новость заключается в том, что ученые нашли способ подавлять или смягчать обнаруженные негативные эффекты липотоксичности на развитие ооцитов и эмбрионов. Они использовали два соединения для активации стрессового ответа эндоплазматической сети:
- салубринал, который делает ответ ЭПС на стресс более продолжительным;
- BGP-15, который, повышая активность эндоплазматической кальций-зависимой АТФазы, избавляет цитоплазму клетки от лишнего кальция, а также активирует один из белков-шаперонов, помогающий клетке преодолеть последствия нарушения работы ЭПС.
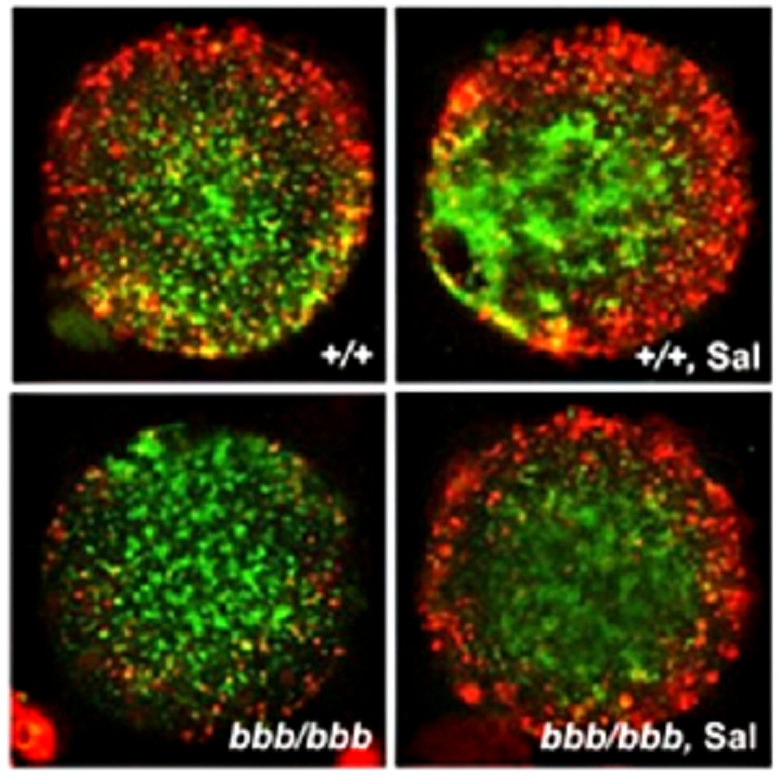
Рисунок 2. Мембранный потенциал митохондрий ооцитов. Красный цвет соответствует высокому потенциалу, а зеленый — низкому. +/+ — Мыши с нормальным весом, bbb/bbb — мыши с ожирением (Blobby). Пометка Sal означает, что мышам перед овуляцией в течение нескольких дней давали салубринал. Видно, что это вещество помогало увеличить мембранный потенциал митохондрий в ооцитах мышей с ожирением.
Оба вещества улучшали состояние ооцитов и полученных из них эмбрионов, если их давали мышам за несколько дней до овуляции.
Такое лечение увеличивало количество овулировавших ооцитов и выделяемого белка PTX3, уменьшало частоту нарушений структуры веретена деления, увеличивало мембранный потенциал митохондрий (рис. 2) и интенсифицировало репликацию мтДНК. В итоге лекарства увеличили жизнеспособность ооцитов и нормализовали скорость развития эмбрионов. Они повлияли и на вес плодов мышей Blobby — он больше не увеличивался чрезмерно. Кроме того, содержание митохондриальной ДНК в тканях потомков ожиревших мышей тоже было нормальным, а частота мутаций в мтДНК снизилась, хотя и не до нормального уровня. В целом, однако, липотоксичность по отношению к репродуктивным способностям мышей с ожирением удалось практически полностью сгладить благодаря стимуляторам стрессового ответа эндоплазматической сети. BGP-15 сейчас проходит клинические испытания в качестве лекарства от диабета II-го типа, но, возможно, это вещество можно будет использовать и для улучшения репродуктивных способностей людей с ожирением.
Литература
- Полюби свои жировые клетки!;
- Linda L. Wu, Darryl L. Russell, Siew L. Wong, Miaoxin Chen, Te-Sha Tsai, et. al.. (2015). Mitochondrial dysfunction in oocytes of obese mothers: transmission to offspring and reversal by pharmacological endoplasmic reticulum stress inhibitors. Development. 142, 681-691;
- Трое в лодке: о легализации замены митохондрий.






