
В Японии разработаны синтетические аналоги гормона растений CLAVATA
31 октября 2011
В Японии разработаны синтетические аналоги гормона растений CLAVATA
- 668
- 1
- 0
Маленькое растение — Резуховидка Таля, — которое привело к очередному открытию — на этот раз в Нагое (Япония).
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Растительная пептидомика — сравнительно молодая наука, но, тем не менее, уже довольно много известно о коротких сигнальных пептидах, являющихся регуляторами в растительных организмах. Особое внимание уделяется пептидам, регулирующим рост растений, — таким как CLAVATA. До недавнего времени не существовало синтетических аналогов (агонистов и антагонистов) таких пептидов, которые могли бы активно использоваться в сельском хозяйстве. Работа японских учёных — первый шаг к таким молекулам.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшее новостное сообщение».
Новая разработка
Исследователи из Университета Нагои разработали синтетические аналоги пептидного гормона растений CLAVATA3. Известно, что короткие пептиды регулируют специфические функции в растительных организмах. Рассматриваемый здесь пептид CLAVATA3 играет особую роль в формировании меристемы арабидопсиса. Мутации в генах, кодирующих CLAVATA3 (CLV3) либо его рецептор CLAVATA1 (CLV1), приводят к фасциации: стебель становится плоским и расположение листьев нарушается.
Сначала учёными был выделен пептид MCLV3. Это самый маленький функционально-активный пептид, образующийся из CLV3 как предшественника. MCLV3 может ингибировать рост первичного корня, а в больших концентрациях он приводит к нарушению куполообразной структуры апикальной меристемы.
Особенности MCLV3
Последовательность MCLV3 (рис. 1) содержит три консервативных остатка пролина (Pro4, Pro7 и Pro9). Пролин играет важную роль в формировании конформации пептида, однако, видимо, у этих остатков есть и другая функция. Замена Pro9→Ala приводит к потере активности MCLV3; в естественном пептиде MCLV3 остатки Pro4 и 7 гидроксилированы. Модификации этих остатков могут привести к получению новых агонистов и антагонистов рецепторов CLV1.
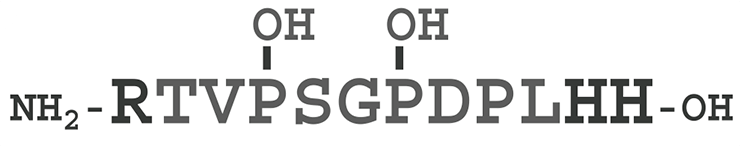
Рисунок 1. MCLV3 — короткий пептид, который образуется из большого CLV3 как предшественника
На чём строить синтетические пептиды?
Авторы разработали несколько синтетических пептидов на базе MCLV3, заменяя один или несколько остатков пролина на пептоид или модифицированные остатки пролина. В качестве индикатора биологической активности использовали способность этих пептидов ингибировать рост корней, а также сродство синтетических молекул-аналогов к рецептору CLV1. Комбинация этих двух методов позволила выявить агонисты и антагонисты, способные конкурировать с CLV3 и другими родственными гормонами.
В предшествующих исследованиях было показано, что наибольшую активность MCLV3 проявляет, когда все остатки пролина негидроксилированы. Чтобы исследовать эффекты модификаций пролина, использовали аналоги с пришитыми гидрокси- и метокси-группами. Синтетические молекулы не влияли на ингибирование активности роста корней, за исключением гидроксилированных по Pro7 и 9, активность которых уменьшилась на десятую часть. Эти данные показывают, что гидроксилирование пролина, увеличивающее его гидрофильность, не является существенным для активности MCLV3.
Ещё одним важным аспектом исследования было определение свойств пролиновых остатков, необходимых для биоактивности. Пролиновый остаток имеет характерное пятичленное кольцо и цис/транс изомерию, играющую существенную роль при укладке белковых молекул. Учитывая потенциальный вклад пролина в функциональную активность MCLV3, было важно выявить, какие свойства пролиновых остатков имеют значение при определении биоактивности.
И что в итоге получилось?
Для того чтобы показать эту специфику, авторы синтезировали простейшую иминокислоту — N-метилглицин (саркозин, Sar), которой заменили пролиновые остатки. Оценивая результаты работы синтетического пептида с помощью дисперсионного анализа (ANOVA) и также с помощью теста Тьюки, японские исследователи показали, что активность пептида, содержащего саркозин в 4-м положении, была существенно ниже, чем у естественного MCLV3, содержащего пролин.
С другой стороны, P9→Sar-замещённый аналог показал себе столь же (или даже более) активным, что и MCLV3. Используя выделенные CLV1-рецепторы, исследователи выяснили, что P9Sar прочно связывается с рецептором (в концентрациях меньших, чем MCLV3). Это указывает на то, что именно иминокилотные свойства пролина, а не его пятичленное кольцо, важны для проявления биоактивности.
Далее исследователи вводили вместо Pro9 в пептид MCLV3 различные N-замещённые производные глицина (пептоиды), используя коммерчески доступные первичные амины (рис. 2). Образцы (1–5) показали активность одинаковую с MCLV3, образцы (6–9) были в 10 раз слабее. Молекулы (10–13) показали ещё более низкую активность. При этом важно отметить, что у «слабых» аналогов замещающие группы были довольно громоздкими.
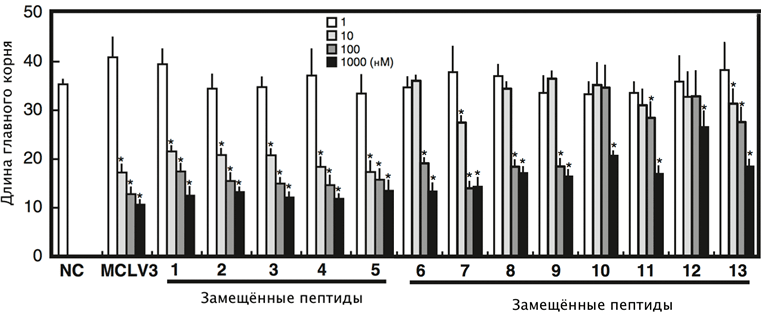
Рисунок 2. Биологическая активность аналогов MCLV3. Аналоги 1–5 показали активность, примерно одинаковую с естественным пептидом. Молекулы 6–13 с более объемными заместителями в модифицированном остатке Pro9 были существенно менее активными. Измерялось ингибирование роста корня пептидами-аналогами, в которых остатки Pro-9 заменяли на пептоиды с различными боковыми группами: (1) — н-бутиламин; (2) — н-гексиламин; (3) — циклопропанметиламин; (4) — триптамин; (5) — 2-фенилэтиламин; (6) — изопропил; (7) — циклогексил; (8) — циклогексанметил; (9) — бензил; (10, 11) — (R)/(S)-1-циклогексилэтил; (12, 13) — (R)/(S)-1-фенилэтил. Тестировали четыре концентрации каждого вещества (показано столбиками разных цветов).
Далее, авторы исследовали связывание с рецептором образца (12), который показал самую низкую активность. Несмотря, на то, что этот аналог был слабым, он с достаточно хорошим сродством связывался с рецептором, что говорит о том, что путем таких химических модификаций можно создавать молекулы-антагонисты.
И что из этого всего следует?
Результаты японских исследователей указывают на то, что синтетические аналоги можно получать, заменяя Pro9 определёнными громоздкими пептоидами, — таким образом можно получать антагонисты CLV3.
Пролин содержит пятичленное кольцо, в силу чего он придает пептиду большую жесткость, нежели соединения-аналоги на основе пептоидов. Однако чёткой корреляции между гибкостью структур и уровнем активности аналога показано не было. Пептоиды могут имитировать пролиновые остатки в определённых случаях белок-белковых взаимодействий. А некоторые пептоиды могут даже увеличить уровень взаимодействия.
Таким образом, в будущем мы будем обладать набором разнообразных синтетических аналогов растительных пептидов, что, вероятно, даст принципиально новый способ управления ростом растений.
Литература
- T. Kondo, K. Yokomine, A. Nakagawa, Y. Sakagami. (2011). Analogs of the CLV3 Peptide: Synthesis and Structure-Activity Relationships Focused on Proline Residues. Plant and Cell Physiology. 52, 30-36;
- Shinichiro Sawa, Atsuko Kinoshita, Shigeyuki Betsuyaku, Hiroo Fukuda. (2008). A large family of genes that share homology with CLE domain in Arabidopsis and rice. Plant Signaling & Behavior. 3, 337-339.







