
Таблетка от несуществующей болезни
12 ноября 2018
Таблетка от несуществующей болезни
- 2802
- 1
- 5
Нет сомнений, что в будущем арсенал медицины пополниться надёжными и эффективными препаратами для «лечения» старения
-
Автор
-
Редактор
Темы
Статья на конкурс «био/мол/текст»: Современной науке известно несколько десятков различных «теорий» старения, однако его биологическая природа остается до конца не изученной. Интерес к этой области постоянно растет. В попытке разработать универсальный протокол увеличения продолжительности жизни ученые продолжают исследовать биохимические и генетические основы долголетия. Полученные результаты ложатся в основу тестирования новых фармагентов, обладающих геропротекторными свойствами. И кто знает, возможно, через несколько лет принять «таблетку от старости» будет так же просто, как сделать прививку?
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Известная поговорка гласит, что с возрастом приходит мудрость. Однако, оглядываясь вокруг, понимаешь, что зачастую возраст приходит совсем в другой компании: его сопровождают болезни различной этиологии, медленно прогрессирующие с течением жизни человека. Заболевания сердечно-сосудистой системы, диабет и деменция входят в первую пятерку причин смертности в мире, и индустрия здравоохранения вкладывает огромные средства для предотвращения их прогрессирования. Но если эти заболевания в подавляющем большинстве случаев ассоциированы с возрастом человека, с его старением, не стоит ли массированно сконцентрировать часть этих ресурсов на изучении старения как биологического феномена и молекулярных механизмов, лежащих в его основе? Не стоит ли в глобальном масштабе заняться поиском «таблеток и вакцин от старости»? Ниже мы поговорим о стратегии их поиска, а также о веществах, отчасти претендующих на роль этой «таблетки». В заключении коснемся того, какие подводные камни и выгоды таит отнесение такого естественного процесса как старение к патологическим состояниям, болезням.
Неумолимая статистика
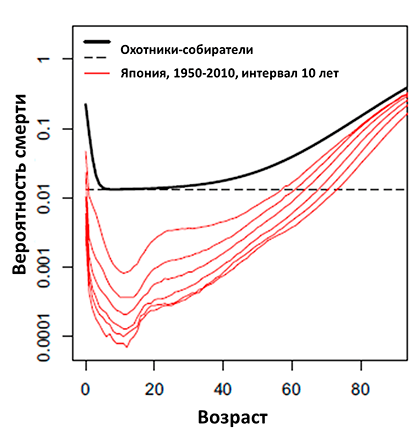
Рисунок 1. Ежегодная вероятность смерти среди охотников-собирателей по сравнению с жителями Японии (красные кривые представлены с интервалом 10 лет, начиная с 1950 г.) Во всех случаях смертность относится к общей численности населения, по обоим полам. Пунктирная линия отражает предел, ниже которого не опускается вероятность смерти среди охотников-собирателей.
В процессе старения биологических объектов происходит нарастающее нарушение функционирования отдельных частей организма, которое приводит к снижению его общей приспособленности и, в конце концов, к смерти. Другими словами, существует положительная корреляция между возрастом индивида и вероятностью его смерти в заданный промежуток времени. Развитие естественных наук вкупе с развитием медицины и гигиены привело к значительному увеличению ожидаемой продолжительности жизни людей в развитых странах. Процесс уменьшения смертности в Японии на фоне развития медицины наглядно представлен на рисунке 1, где красные кривые отражают постепенное уменьшение смертности разных возрастных групп в течение 1950–2010 гг., тогда как черная кривая отражает вероятность смерти человека в племенах охотников-собирателей (данные по африканским племенам Хадза и Кунг, южноамериканским племенам Хиви и Аче, и племени Филиппинских островов Аэта). В оригинальной работе авторы приводят сравнения рассчитанных вероятностей смерти, так, например, вероятность 65-летнего охотника-собирателя умереть в течение года составляет около 5,3%, тогда как для современного японца того же возраста эта вероятность составляет ~0,8%. Или же 30-летний охотник-собиратель имеет ту же вероятность умереть в течение года, что и современный японец в возрасте 72 лет [1].
Но в то же время качество этой жизни, в том числе и в Японии, неуклонно падает с возрастом. По данным ВОЗ, среди ведущих причин смерти в мире числятся болезни сердечно-сосудистой системы, хроническая обструктивная болезнь легких, диабет и деменция [2]. Эти заболевания носят хронический характер, «созревают» в течение десятилетий, постепенно снижая качество жизни человека. Например, среди немцев старше 65 лет каждый второй имеет от одного до трех хронических заболеваний, а ~25% имеют четыре и более [3]. Мы видим, что даже в Японии, одной из стран с самой высокой средней продолжительностью жизни, сегодня (рис. 1, нижняя красная кривая) вероятность смерти, тем не менее, экспоненциально растет с возрастом.
Однако в природе есть организмы, вероятность смерти которых не увеличивается с течением времени при сохранном репродуктивном потенциале. В литературе этот фенóмен получил название «пренебрежимое старение» (negligible senescence) , концепцию которого предложил Калеб Финч в монографии Longevity, senescence, and the genome [4]. Среди позвоночных к таким организмам Финч относит некоторых черепах (Emydoidea blandingii и Chrysemys picta), морских окуней (рекордсменом считается алеутский морской окунь, Sebastes aleutianus, проживший 205 лет) и... голого землекопа (Heterocephalus glaber, рис. 2) [5].
Молекулярные механизмы и теории старения, а также пренебрежимо стареющие животные, включая голого землекопа, описаны в предыдущих статьях «Биомолекулы»: «Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить» [6], «Преодолевшие старение. Часть I. Кому выпал эволюционный джекпот?» [7] и «Преодолевшие старение. Часть II. Дети подземелья» [8].

Рисунок 2. Голый землекоп (Heterocephalus glaber)
Об особенностях жизни последнего уже было подробно рассказано [8], но стоит привести недавнее исследование (рис. 3), в котором показано, что в то время как смертность исследуемых млекопитающих (мышь, человек) экспоненциально растет с возрастом индивида, смертность среди голых землекопов остается постоянной с течением времени [9]. Удивительно, но максимально зарегистрированный возраст самца голого землекопа составил 31 год, и это при массе 30–35 г [10]!
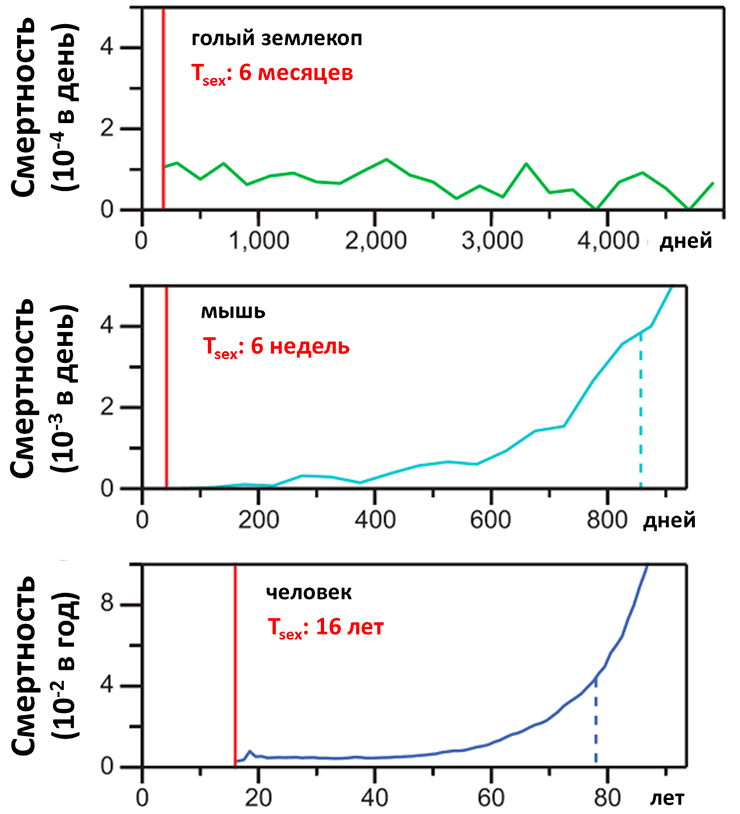
Рисунок 3. Смертность среди голых землекопов, лабораторных мышей и людей разных возрастов. Tsex — возраст наступления половой зрелости. Пунктирные линии обозначают среднюю продолжительность жизни соответствующего вида.
Близкое эволюционное родство с человеком и пренебрежимое старение делает голого землекопа заманчивым кандидатом для исследования генетических механизмов, обеспечивающих экстремальное долгожительство. Однако сейчас отсутствие понимания этих механизмов и несовершенство технологий интервенции в человеческий геном отодвигают перспективы их использования для человека в будущее на неопределенный срок. Ко всему прочему манипуляции с геномом людей в целях продления жизни поднимают ряд острых этических вопросов, требующих широкого обсуждения . В обозримом будущем эффективной альтернативой генетическим интервенциям обещает стать фармакологический подход к «лечению» старения, о котором пойдет речь ниже.
Тема этичности вмешательства в геном человека затронута в статье «12 методов в картинках: генная инженерия. Часть I, историческая» [11].
Как таблетку делать: стратегия эффективного поиска и перспективные кандидаты
Известно, что определенные физиологические состояния приводят к увеличению продолжительности жизни модельных организмов. Одно из таких состояний наступает при ограничении калорийности питания (calorie restriction) . В 1935 году Клайв МакКей в эксперименте на крысах продемонстрировал, что ограничение калорийности питания, начиная с раннего возраста, приводит к увеличению продолжительности жизни самцов [12]. Сегодня этот метод является самой надежной негенетической экспериментальной процедурой увеличения продолжительности жизни среди различных модельных организмов, включая плодовых мушек, дрожжи, нематод, рыб, грызунов и собак [13]. Более того, недавно получили данные в пользу того, что ограничение калорийности питания увеличивает продолжительность жизни и тормозит развитие возрастзависимых заболеваний у нечеловекообразных приматов, макак резусов (Macaca mulatta) и серых мышиных лемуров (Microcebus murinus) [14], [15].
О старении организма в контексте образа жизни, в частности образа питания, подробно рассказано в статьях «Нутригеронтология: питание vs. старение» [16] и «Нутригеномика: питание vs. заболевания» [17].
Необходимо понимать, что физиологическое состояние, наступающее при ограничении калорийности питания, опосредовано изменением уровня экспрессии многих генов и последующим изменением метаболических путей в клетках. Ключевыми регуляторами, известными у млекопитающих, в этом случае выступают инсулин / инсулиноподобный фактор роста 1 (insulin/IGF1) и mTOR (mechanistic target of rapamycin), молекулярные каскады которых сегодня активно изучаются [18]. А если обнаружены и изучены каскады, возможен целенаправленный поиск фармагентов, воздействующих на разных молекулярных участников этих каскадов. Подобная стратегия неоднократно высказывалась в научном сообществе [19–21], и уже выявлен ряд перспективных веществ, влияющих на молекулярные каскады, лежащие в основе ограничения калорийности питания.
Рапамицин
Одно из наиболее известных веществ, продемонстрировавших свою эффективность в продлении жизни модельных организмов — рапамицин. Рапамицин был выделен из бактериальной культуры стрептомицетов (Streptomyces hygroscopicus), обнаруженных в почвенном образце полинезийского острова Рапа Нуи в 1975 году, и проявлял выраженную фунгицидную активность. Позже у рапамицина обнаружили иммуносупрессирующие свойства, а в 1999 году FDA одобрило его к использованию для профилактики отторжения органов у пациентов, перенесших органную трансплантацию [22]. Помимо всего прочего, оказалось, что рапамицин увеличивает продолжительность жизни у целого ряда организмов, среди которых пекарские дрожжи (Saccharomyces cerevisiae) [23], нематоды (Caenorhabditis elegans) [24], плодовые мушки (Drosophila melanogaster) [25] и лабораторные мыши (Mus musculus) [26]. В эксперименте с мышами рапамицин начинали давать животным в зрелом возрасте (600 дней), что, тем не менее, приводило к увеличению средней продолжительности жизни на 9% у самцов и на 13% у самок.
На молекулярном уровне эффекты рапамицина опосредованы его ингибирующим действием на mTOR. mTOR относится к высоко консервативным среди эукариот серин/треониновым протеинкиназам. У млекопитающих mTOR включает два комплекса: mTOR complex 1 (mTORC1) и mTOR complex 2 (mTORC2), которые отличаются взаимодействующими с ними молекулярными партнерами. mTORC1 (непосредственная мишень рапамицина) изучен лучше, известно, что он вовлечен в регуляцию аутофагии [27], трансляции, синтеза липидов и пиримидинов.
На рисунке 4 представлена схема влияния ограничения калорийности питания и рапамицина на старение, опосредуемое mTORC1. Предположительно, ингибирование mTOR-пути увеличивает продолжительность жизни за счет [28]:
- снижения продукции белков в клетке, приводящего к снижению уровня протеолитического и оксидативного стрессов;
- увеличения уровня аутофагии, в том числе аутофагии поврежденных органелл;
- увеличения самообновления популяций гематопоэтических и кишечных стволовых клеток.

Рисунок 4. Влияние ограничения калорийности и рапамицина на старение, опосредуемое активацией mTOR-пути
Метформин
Другим перспективным веществом в контексте увеличения продолжительности жизни является широко известный сахароснижающий препарат, относящийся к бигуанидам, — метформин. Метформин используется в терапии сахарного диабета II типа на протяжении уже более чем 50 лет. Длительный прием метформина увеличивал продолжительность жизни лабораторных мышей [29], [30] и замедлял развитие возрастзависимых заболеваний нематод [31], [32]. Однако на продолжительность жизни плодовых мушек метформин не оказывал влияния [33].
Известно, что метформин ингибирует глюконеогенез — процесс образования глюкозы из неуглеводных соединений (включая аминокислоты, лактат и пируват), происходящий преимущественно в печени [34], [35]. Что, в свою очередь, приводит к системному снижению уровня инсулина и инсулиноподобного фактора роста 1 в крови (рис. 5). Рецептор IGF1 при связывании со своим субстратом активирует по нисходящей фосфатидилинозитол-3-киназу (PI3K, phosphatidylinositol-3-kinase) и киназу Akt, также называемую протеинкиназой Б (PKB, protein kinase B), что в свою, очередь, приводит к активации mTOR-пути. Соответственно, при уменьшении количества субстрата (IGF1) в крови, происходит ингибирование mTOR-пути [36] со всеми вытекающими благоприятными для здоровья эффектами.
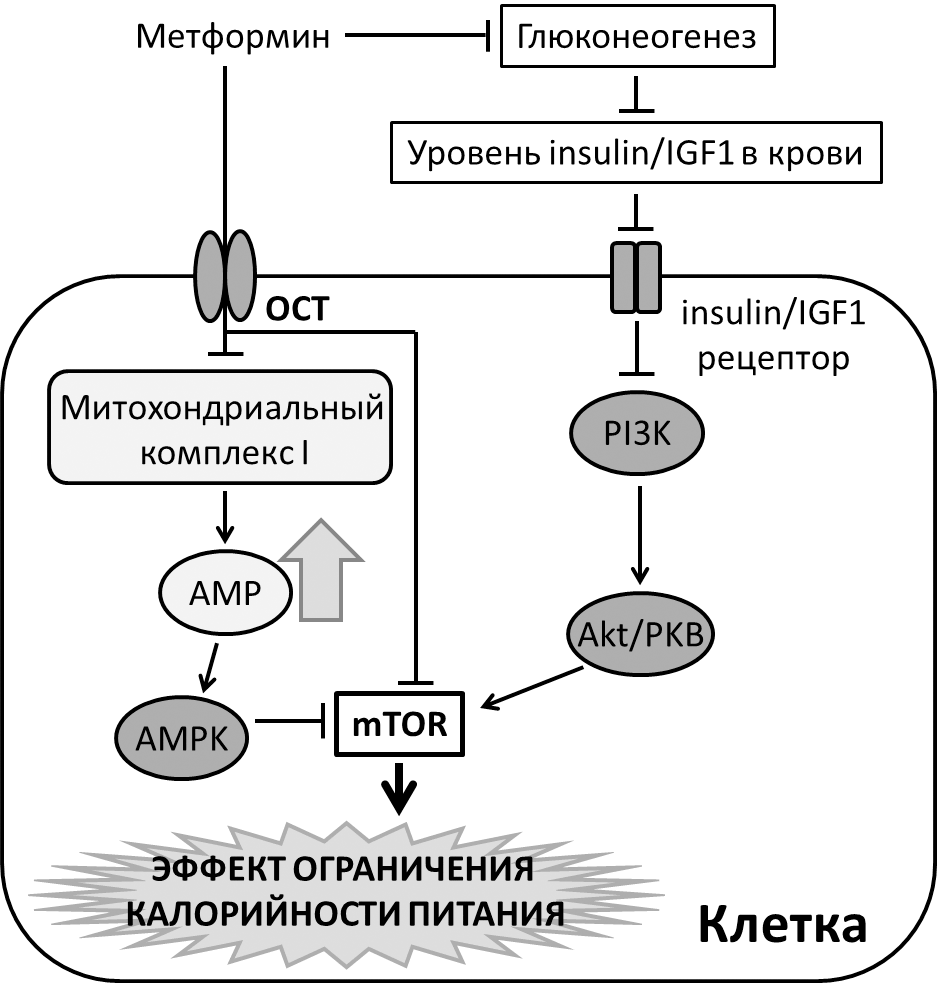
Рисунок 5. Возможные молекулярные механизмы, опосредующие эффекты приема метформина. Объяснения в тексте. Условные обозначения: OCT — транспортёр органических катионов (organic cation transporter). AMP — аденозинмонофосфат (adenosine monophosphate). AMPK — АМФ-активируемая протеинкиназа (AMP activated protein kinase). PI3K — фосфатидилинозитол-3-киназа (phosphatidylinositol-3-kinase). Akt/PKB — киназа Akt/протеинкиназа Б.
С другой стороны, метформин может напрямую влиять на клетки, проникая внутрь путем активного транспорта, опосредованного транспортёрами органических катионов (organic cation transporter, OCT) (рис. 5). В клетке метформин ингибирует митохондриальный коплекс I, приводя к увеличению количества аденозинмонофосфата и активации АМФ-активируемой протеинкиназы (AMPK, AMP-activated protein kinase) [37]. AMPK служит универсальным энергетическим сенсором и, будучи активированной, включает катаболические пути, такие как гликолиз и окисление жирных кислот, для получения бóльшего количества АТФ [38]. В дополнение, показано, что метформин способен ингибировать mTOR-путь по AMPK-независимому механизму [39].
Ресвератрол
Среди веществ, имитирующих благоприятные для здоровья эффекты ограничения калорийности питания, нельзя не отметить активаторы сиртуинов. Сиртуины — семейство NAD+-зависимых белков, обладающих в том числе деацетилазной активностью. SIRT1 — у млекопитающих гомолог гена дрожжей Sir2. Показано, что SIRT1 играет роль в старении, ответе на стресс, клеточной пролиферации и апоптозе, а также опосредует многие эффекты ограничения калорийности питания [40].
Одним из активаторов экспрессии сиртуинов считается ресвератрол — природный полифенол, обладающий противопаразитарной эффективностью, который, в частности, содержится в кожице винограда. На пекарских дрожжах было показано, что ресвератрол активирует экспрессию Sir2, увеличивая стабильность ДНК и продлевая жизнь дрожжевых клеток на 70% [41]. Позднее выявили, что ресвератрол увеличивает продолжительность жизни других модельных организмов, таких как нематоды и плодовые мушки [42].
Однако на позвоночных животных получены противоречивые результаты. С одной стороны, ресвератрол увеличивал как среднюю, так и максимальную продолжительность жизни короткоживущего вида рыб, нотобранхов Фурцера (Nothobranchius furzeri) [43]. С другой, несмотря на то, что ресвератрол, добавляемый в пищу мышам, начиная с 12-месячного возраста, уменьшал воспаление и апоптоз в эндотелии сосудов, увеличивал эластичность аорты, плотность костной ткани и улучшал координацию движений, увеличения продолжительности жизни лабораторных мышей зафиксировано не было [44]. Более того, повторные эксперименты не выявили эффектов ресвератрола на продолжительность жизни плодовых мушек [45]. Также остается открытым вопрос: является ли ресвератрол прямым активатором сиртуинов или его эффекты опосредованы другими механизмами [46], [47]. Несмотря на это, поиск других активаторов сиртуинов, представляется перспективной задачей для современной фармакологии, наряду с модификацией молекулы ресвератрола, направленной на усиление ее действия.
Оксалоацетат и β-гидроксибутират
Не только вещества «постороннего» для организма происхождения, но и участники собственных метаболических путей могут выступать в роли геропротекторов (веществ, увеличивающих продолжительность жизни животных). Так оксалоацетат, или соль щавелевоуксусной кислоты, — промежуточное соединение в цикле Кребса и глюконеогенезе — увеличивал продолжительность жизни нематод посредством активации AMPK-пути [48].
β-гидроксибутират — другое вещество-участник энергетического метаболизма, которое сейчас начинают активно исследовать в контексте увеличения продолжительности жизни. β-гидроксибутират относится к так называемым кетоновым телам, небольшим молекулам, синтезируемым преимущественно в печени при расщеплении жирных кислот в условиях длительных физических нагрузок или продолжительного голодания. Известно, что ключевым регулятором кетогенеза в печени является уже известный нам mTOR-путь [49]. Циркулируя в кровеносной системе, кетоновые тела поглощаются тканями, в которых метаболизируются сначала до ацетил-КоА, а затем до АТФ. Однако накапливающиеся данные говорят в пользу того, что кетоновые тела выступают не только в пассивной роли энергоносителей, но также имеют сигнальные функции, модулирующие профиль экспрессии генов, липидный метаболизм и активность нейронов [50]. Показано, что добавление в культуральную среду β-гидроксибутирата в концентрации 20 мМ увеличивало среднюю продолжительность жизни нематод на 26% [51]. Несмотря на то, что исследования по влиянию β-гидроксибутирата на продолжительность жизни млекопитающих еще не были опубликованы, уже получены результаты по его влиянию на старение сердечно-сосудистой системы. Так β-гидроксибутират предотвращал старение клеток сосудов мышей in vivo, за счет увеличения синтеза фактора транскрипции Oct4 (octamer-binding transcription factor 4), опосредуемого активацией РНК-связывающего белка hnRNP A1 (heterogeneous nuclear ribonucleoprotein A1) (рис. 6). В свою очередь, увеличение продукции Oct4 приводило к увеличению синтеза ламина Б1 (lamin B1) — белка, предотвращающего повреждения ДНК при старении [52].

Рисунок 6. β-гидроксибутират предупреждает старение клеток сосудов. Объяснения в тексте. Условные обозначения: Oct4 — транскипционный фактор, один из факторов Яманаки (octamer-binding transcription factor 4). hnRNP A1 — гетерогенный ядерный рибонуклеопротеин А1 (heterogeneous nuclear ribonucleoprotein A1). β-HB — β-гидроксибутират (β-hydroxybutyrate).
Необходимо отметить, что здесь представлен далеко не исчерпывающий список веществ-кандидатов, имитирующих благоприятные эффекты ограничения калорийности, к которым также можно отнести ингибитор желудочно-кишечных липаз орлистат и ингибитор альфа-глюкозидазы, тормозящий переваривание и всасывание углеводов в тонкой кишке, акарбозу [21]. Нет сомнений, что этот список будет шириться, и в будущем арсенал медицины пополниться надежными и эффективными препаратами для «лечения» старения.
Является ли старение болезнью?
Этому вопросу было посвящено широкое обсуждение в журнале «Успехи геронтологии» за 2017 год [54–58]. Отправной точкой этой дискуссии послужила работа, опубликованная в журнале Frontiers in Genetics в 2015 году, где авторы приводят соображения в пользу того, что старение следует рассматривать как болезнь [53]. Основной аргумент внесения этих изменений в реестр Международной классификации болезней (МКБ), по мнению авторов, заключается в том, что в нынешнем виде система здравоохранения неэффективна и носит реакционный характер. В частности в Соединенных Штатах, по оценке авторов, 32% всех расходов Национальной программы медицинского страхования для лиц от 65 лет и старше (Medicare) идет на последние два года жизни пациентов с хроническими заболеваниями без какого-либо существенного улучшения их качества жизни. Признание старения заболеванием, по мнению авторов, существенно увеличит финансирование со стороны правительственных организаций на поиск и внедрение геропротекторных препаратов [53].
С другой стороны, опытные специалисты из разных областей, от биодемографии до гериатрии, обсуждая вопрос «признать ли старение болезнью?» с позиций разных подходов, склоняются к отрицательному ответу. Ниже перечислен ряд приводимых ими аргументов:
- «...Понятие болезни подразумевает ее причинность, обозначаемую в клинической практике как этиологическое начало, тогда как на сегодня этиология процесса старения неизвестна» [54].
- «Признание самого явления процесса старения не нормой, то есть болезнью, фактически исключает понятие “здоровье” из обихода» [54].
- «...Старение отличается от болезни так же, как причина отличается от следствия. Старение является причиной многих возрастзависимых заболеваний. Соответственно, эти возрастзависимые заболевания являются следствием старения. Объявлять старение болезнью — чрезмерное упрощение (отождествление причины и следствия)» [55].
- «Старение само по себе не ведет к смерти, а “всего лишь” повышает ее вероятность, включая вероятность возникновения болезней, способных привести к смерти. Можно замедлить развитие болезни и отсрочить смерть по болезни. Всякий раз, когда это удается, продолжительность жизни возрастает. Но это не значит, что замедляется старение» [56].
- «...Если считать процесс старения болезнью человека, то на основании данного закона философии [закона единства и борьбы противоположностей] должны быть люди, совершенно не стареющие, то есть не страдающие заболеванием под названием “старение”» [57].
Кроме того, если отнести старение к болезням, то неминуемо возрастет нагрузка на систему здравоохранения. Другими словами, с определенного возраста любой человек будет считаться пожизненно «заболевшим» и, соответственно, он будет вправе рассчитывать на пожизненное, но несуществующее на сегодняшний день лечение. В свете приводимых аргументов включение старения в реестр МКБ сейчас выглядит слишком радикальным шагом. Компромиссным решением в этом направлении послужит расширение списка возрастзависимых заболеваний в МКБ, как это уже предложили некоторые исследователи [50], [51]. Однако если мы признаём старение причиной развития возрастных заболеваний, а сами заболевания — следствиями, то разумным шагом будет сконцентрировать ресурсы на устранении причины, а именно старения, независимо от того, называем мы его болезнью или нет. В противном случае «точечная» борьба с конкретными возрастассоциированными заболеваниями делает сохранение здоровья в пожилом возрасте крайне сложной задачей: «Например, человек, умерший от инсульта, просто не дожил до рака простаты или болезни Альцгеймера. Отсюда следует важный вывод: если не бороться целенаправленно со старением как с причиной этих заболеваний, избавиться от болезней старости невозможно, можно, в лучшем случае, перевести их на некоторое время в хроническую форму. Устранение симптомов одного заболевания лишь дает отсрочку до возникновения других заболеваний» [58].
Завершая, нельзя не отметить, что огромную роль в вопросе «признать ли старение болезнью?» играет социокультурное восприятие фенóмена: мы каждодневно, начиная с самого раннего возраста, сталкиваемся с людьми разных возрастов, включая пожилых людей. В этом контексте старение и сопутствующее ему общее одряхление организма видится процессом абсолютно «нормальным», закономерным итогом долгой жизни. Но необходимо понимать, что на протяжении развития нашей цивилизации менялись и нормы различных ее аспектов. До настоящего времени эти изменения касались в бóльшей степени социокультурной сферы жизни. Сегодня, в связи со стремительным развитием наук о живом, подобные изменения начинают затрагивать и нормы биологии человека. В конечном итоге мы сами определяем необходимую на данном этапе середину и допустимые от нее отклонения. Но нам никак нельзя забывать, что делать это нужно разумно, всегда с оглядкой назад и четким пониманием того, куда мы движемся.
Литература
- O. Burger, A. Baudisch, J. W. Vaupel. (2012). Human mortality improvement in evolutionary context. Proceedings of the National Academy of Sciences. 109, 18210-18214;
- 10 ведущих причин смерти в мире. (2016). ВОЗ;
- Jacob L., Breuer J., Kostev K. (2016). Prevalence of chronic diseases among older patients in German general practices. Ger. Med. Sci. 14, Doc03;
- Finch C.E. Longevity, senescence, and the genome. Chicago: University of Chicago Press, 1990. — 938 p.;
- Caleb E. Finch. (2009). Update on Slow Aging and Negligible Senescence – A Mini-Review. Gerontology. 55, 307-313;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- Преодолевшие старение. Часть I. Кому выпал эволюционный джекпот?;
- Преодолевшие старение. Часть II. Дети подземелья;
- J Graham Ruby, Megan Smith, Rochelle Buffenstein. (2018). Naked mole-rat mortality rates defy Gompertzian laws by not increasing with age. eLife. 7;
- AnAge entry for Heterocephalus glaber. HAGR;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- C. M. McCay, Mary F. Crowell, L. A. Maynard. (1935). The Effect of Retarded Growth Upon the Length of Life Span and Upon the Ultimate Body Size. The Journal of Nutrition. 10, 63-79;
- Edward J. Masoro. (2005). Overview of caloric restriction and ageing. Mechanisms of Ageing and Development. 126, 913-922;
- Julie A. Mattison, Ricki J. Colman, T. Mark Beasley, David B. Allison, Joseph W. Kemnitz, et. al.. (2017). Caloric restriction improves health and survival of rhesus monkeys. Nat Comms. 8, 14063;
- Fabien Pifferi, Jérémy Terrien, Julia Marchal, Alexandre Dal-Pan, Fathia Djelti, et. al.. (2018). Caloric restriction increases lifespan but affects brain integrity in grey mouse lemur primates. Commun Biol. 1;
- Нутригеронтология: питание vs. старение;
- Нутригеномика: питание vs. заболевания;
- David K.G. Ma, Christian Stolte, James R. Krycer, David E. James, Seán I. O’Donoghue. (2015). SnapShot: Insulin/IGF1 Signaling. Cell. 161, 948-948.e1;
- Shin-Hae Lee, Kyung-Jin Min. (2013). Caloric restriction and its mimetics. BMB Reports . 46, 181-187;
- Gabriella Testa, Fiorella Biasi, Giuseppe Poli, Elena Chiarpotto. (2014). Calorie Restriction and Dietary Restriction Mimetics: A Strategy for Improving Healthy Aging and Longevity. CPD. 20, 2950-2977;
- Donald K. Ingram, George S. Roth. (2015). Calorie restriction mimetics: Can you have your cake and eat it, too?. Ageing Research Reviews. 20, 46-62;
- Rapamune. Approval letter. (1999). Center for drug evaluation and research;
- R. W. Powers. (2006). Extension of chronological life span in yeast by decreased TOR pathway signaling. Genes & Development. 20, 174-184;
- Stacey Robida-Stubbs, Kira Glover-Cutter, Dudley W. Lamming, Masaki Mizunuma, Sri Devi Narasimhan, et. al.. (2012). TOR Signaling and Rapamycin Influence Longevity by Regulating SKN-1/Nrf and DAF-16/FoxO. Cell Metabolism. 15, 713-724;
- Ivana Bjedov, Janne M. Toivonen, Fiona Kerr, Cathy Slack, Jake Jacobson, et. al.. (2010). Mechanisms of Life Span Extension by Rapamycin in the Fruit Fly Drosophila melanogaster. Cell Metabolism. 11, 35-46;
- David E. Harrison, Randy Strong, Zelton Dave Sharp, James F. Nelson, Clinton M. Astle, et. al.. (2009). Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. 460, 392-395;
- Аутофагия, протофагия и остальные;
- Robert A. Saxton, David M. Sabatini. (2017). mTOR Signaling in Growth, Metabolism, and Disease. Cell. 168, 960-976;
- Vladimir N. Anisimov, Lev M. Berstein, Peter A. Egormin, Tatiana S. Piskunova, Irina G. Popovich, et. al.. (2008). Metformin slows down aging and extends life span of female SHR mice. Cell Cycle. 7, 2769-2773;
- Alejandro Martin-Montalvo, Evi M. Mercken, Sarah J. Mitchell, Hector H. Palacios, Patricia L. Mote, et. al.. (2013). Metformin improves healthspan and lifespan in mice. Nat Comms. 4;
- Brian Onken, Monica Driscoll. (2010). Metformin Induces a Dietary Restriction–Like State and the Oxidative Stress Response to Extend C. elegans Healthspan via AMPK, LKB1, and SKN-1. PLoS ONE. 5, e8758;
- Lianfeng Wu, Ben Zhou, Noriko Oshiro-Rapley, Man Li, Joao A. Paulo, et. al.. (2016). An Ancient, Unified Mechanism for Metformin Growth Inhibition in C. elegans and Cancer. Cell. 167, 1705-1718.e13;
- Cathy Slack, Andrea Foley, Linda Partridge. (2012). Activation of AMPK by the Putative Dietary Restriction Mimetic Metformin Is Insufficient to Extend Lifespan in Drosophila. PLoS ONE. 7, e47699;
- R. S. Hundal, M. Krssak, S. Dufour, D. Laurent, V. Lebon, et. al.. (2000). Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes. 49, 2063-2069;
- Ling He, Amin Sabet, Stephen Djedjos, Ryan Miller, Xiaojian Sun, et. al.. (2009). Metformin and Insulin Suppress Hepatic Gluconeogenesis through Phosphorylation of CREB Binding Protein. Cell. 137, 635-646;
- Guillermo López-Lluch, Plácido Navas. (2016). Calorie restriction as an intervention in ageing. J Physiol. 594, 2043-2060;
- Marc Foretz, Bruno Guigas, Luc Bertrand, Michael Pollak, Benoit Viollet. (2014). Metformin: From Mechanisms of Action to Therapies. Cell Metabolism. 20, 953-966;
- Kristopher Burkewitz, Yue Zhang, William B. Mair. (2014). AMPK at the Nexus of Energetics and Aging. Cell Metabolism. 20, 10-25;
- Adem Kalender, Anand Selvaraj, So Young Kim, Pawan Gulati, Sophie Brûlé, et. al.. (2010). Metformin, Independent of AMPK, Inhibits mTORC1 in a Rag GTPase-Dependent Manner. Cell Metabolism. 11, 390-401;
- David A. Sinclair, Leonard Guarente. (2014). Small-Molecule Allosteric Activators of Sirtuins. Annu. Rev. Pharmacol. Toxicol.. 54, 363-380;
- Konrad T. Howitz, Kevin J. Bitterman, Haim Y. Cohen, Dudley W. Lamming, Siva Lavu, et. al.. (2003). Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature. 425, 191-196;
- Jason G. Wood, Blanka Rogina, Siva Lavu, Konrad Howitz, Stephen L. Helfand, et. al.. (2004). Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature. 430, 686-689;
- Dario R. Valenzano, Eva Terzibasi, Tyrone Genade, Antonino Cattaneo, Luciano Domenici, Alessandro Cellerino. (2006). Resveratrol Prolongs Lifespan and Retards the Onset of Age-Related Markers in a Short-Lived Vertebrate. Current Biology. 16, 296-300;
- Kevin J. Pearson, Joseph A. Baur, Kaitlyn N. Lewis, Leonid Peshkin, Nathan L. Price, et. al.. (2008). Resveratrol Delays Age-Related Deterioration and Mimics Transcriptional Aspects of Dietary Restriction without Extending Life Span. Cell Metabolism. 8, 157-168;
- Timothy M. Bass, David Weinkove, Koen Houthoofd, David Gems, Linda Partridge. (2007). Effects of resveratrol on lifespan in Drosophila melanogaster and Caenorhabditis elegans. Mechanisms of Ageing and Development. 128, 546-552;
- Michelle Pacholec, John E. Bleasdale, Boris Chrunyk, David Cunningham, Declan Flynn, et. al.. (2010). SRT1720, SRT2183, SRT1460, and Resveratrol Are Not Direct Activators of SIRT1. J. Biol. Chem.. 285, 8340-8351;
- Sung-Jun Park, Faiyaz Ahmad, Andrew Philp, Keith Baar, Tishan Williams, et. al.. (2012). Resveratrol Ameliorates Aging-Related Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases. Cell. 148, 421-433;
- David S. Williams, Alan Cash, Lara Hamadani, Tanja Diemer. (2009). Oxaloacetate supplementation increases lifespan inCaenorhabditis elegansthrough an AMPK/FOXO-dependent pathway. Aging Cell. 8, 765-768;
- Shomit Sengupta, Timothy R. Peterson, Mathieu Laplante, Stephanie Oh, David M. Sabatini. (2010). mTORC1 controls fasting-induced ketogenesis and its modulation by ageing. Nature. 468, 1100-1104;
- John C. Newman, Eric Verdin. (2017). β-Hydroxybutyrate: A Signaling Metabolite. Annu. Rev. Nutr.. 37, 51-76;
- Clare Edwards, John Canfield, Neil Copes, Muhammad Rehan, David Lipps, Patrick C. Bradshaw. (2014). D-beta-hydroxybutyrate extends lifespan in C. elegans. aging. 6, 621-644;
- Young-min Han, Tatiana Bedarida, Ye Ding, Brian K. Somba, Qiulun Lu, et. al.. (2018). β-Hydroxybutyrate Prevents Vascular Senescence through hnRNP A1-Mediated Upregulation of Oct4. Molecular Cell. 71, 1064-1078.e5;
- Sven Bulterijs, Raphaella S. Hull, Victor C. E. Björk, Avi G. Roy. (2015). It is time to classify biological aging as a disease. Front. Genet.. 6;
- Новосёлов В.М. (2017). Является ли старение болезнью? «Успехи геронтологии». 6, 836–840;
- Гаврилов Л.А. и Гаврилова Н.С. (2017). Является ли старение болезнью? Точка зрения биодемографов. «Успехи геронтологии». 6, 841–842;
- Голубев А.Г. (2017). Является ли старение болезнью? Точка зрения биогеронтолога: старость ≠ болезнь. «Успехи геронтологии». 6, 845–847;
- Мякотных В.С. (2017). Является ли старение болезнью? Точка зрения врача-гериатра. «Успехи геронтологии». 6, 848–850;
- Москалёв А.А. (2017). Является ли старение болезнью? Точка зрения генетика. «Успехи геронтологии». 6, 843–844.







