
Свободные от кристы митохондрии — хит сезона
08 апреля 2025
Свободные от кристы митохондрии — хит сезона
- 324
- 0
- 1
Две субпопуляции митохондрий, сосуществующие рядом друг с другом. Недавно открытые митохондрии без крист (содержащие P5CS — выделено синим) рядом с «классическими» митохондриями с кристами (без P5CS — выделено розовым).
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Давайте честно, большинство из нас уже забыли большую часть школьной программы. Но есть фраза, которую, как мне кажется, помнят абсолютно все: «Митохондрии — это энергетические станции клеток». Но это не единственная функция, которой они обладают. Помимо нее, эти удивительные органеллы отвечают за производство энергии и участвуют в биосинтезе строительных блоков клетки. Но вот что интересно, в одном из недавно опубликованных исследований в журнале Nature был открыт захватывающий аспект митохондрий, который может перевернуть наше понимание динамики клеточной энергии.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Общее количество митохондрий в теле взрослого человека оценивается в несколько квадриллионов. Одна только эта цифра показывает, насколько они важны для выживания наших клеток. Взглянув на их структуру, легко понять, что митохондрии созданы для многозадачности (рис. 1). У них есть пористая внешняя мембрана, которая обеспечивает обмен молекулами; внутренняя мембрана, изогнутая в складки, называемые кристами, где и происходят главные энергетические процессы (именно там и происходит магия); межмембранное пространство, где создается протонный градиент во время синтеза АТФ; и, конечно, матрикс, где хранятся митохондриальная ДНК, рибосомы и работают ферменты, участвующие в биосинтетических и метаболических реакциях [2].
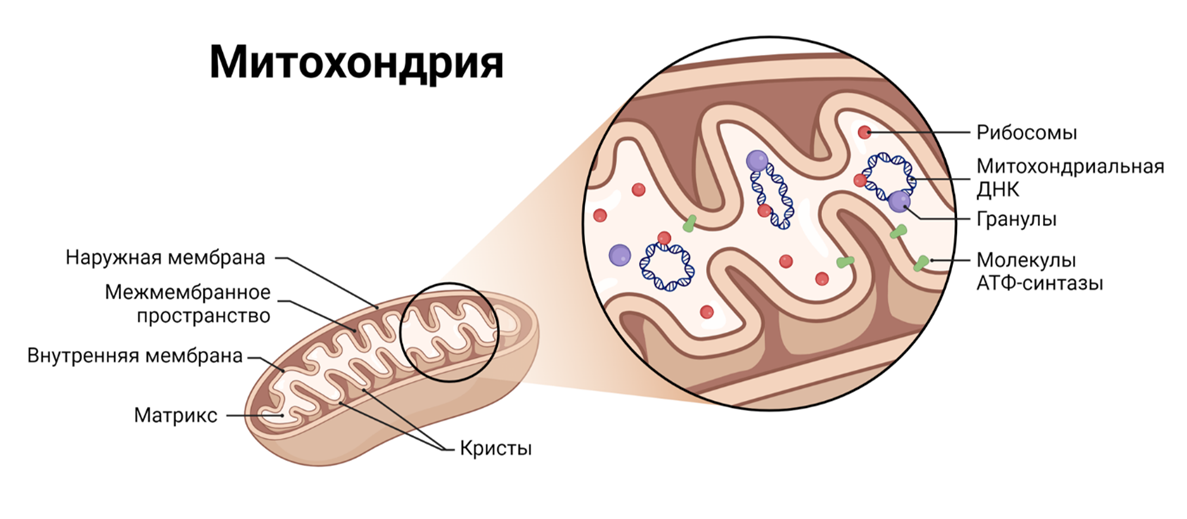
Рисунок 1. Познакомьтесь с митохондриями — энергетическими станциями и мастерами на все руки! Эти органеллы в форме бобов имеют гладкую внешнюю мембрану и внутреннюю оболочку в форме складок — крист. Но это не просто дизайнерское решение! Эти складки увеличивают площадь поверхности, чтобы максимально эффективно производить АТФ — энергию, которая питает всё: от движения до восстановления. Внутри матрикс буквально забит ферментами, ДНК и рибосомами — отсылка к прошлому, когда митохондрии были свободноживущими бактериями. Но энергия — это только начало! Митохондрии еще занимаются хранением кальция, управляют сигнальными процессами клетки, а также ответственны за апоптоз — запрограммированную гибель клеток, которая помогает вашему организму поддерживать баланс. По сути, митохондрии — это швейцарский нож клетки, они многофункциональны, жизненно важны и никогда не отдыхают!
иллюстрация автора статьи, выполненная с помощью онлайн-инструмента Biorender
Митохондрии способны сливаться и делиться — это динамические процессы, которые поддерживают здоровье наших клеточных энергостанций [3]. В условиях стресса они могут сливаться в эффективных гигантов, превращаясь в мощные энергетические центры с обогащенными ресурсами. А вот деление митохондрий — это, скорее, стратегический «разрыв». Этот процесс позволяет изолировать поврежденные митохондрии от здоровых, чтобы направить их на переработку. Кроме того, деление увеличивает количество митохондрий, готовых к производству АТФ, когда клеткам требуется больше энергии — например, во время физических нагрузок.
Динамическая морфология митохондрий напрямую связана с их функциями, а значит, и с физиологией клетки [4]. Если всё это звучит как описание автономной клетки внутри другой клетки, то вы абсолютно правы! И всё благодаря эндосимбиозу. Подробнее об этом можно узнать в статье «Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос»на «Биомолекуле» [5].
50 оттенков митохондриальной функциональности
Заряд энергии. Ключевой функцией митохондрий является процесс окислительного фосфорилирования (OXPHOS), который производит энергию (АТФ) для клетки [6]. Это волшебство происходит на внутренней мембране митохондрий, где электрон-транспортная цепь (ЭTC) передает электроны, полученные из питательных веществ, таких как глюкоза и жирные кислоты. Двигаясь по ЭTC, электроны высвобождают энергию, которая используется для прокачки протонов в межмембранное пространство, создавая градиент. Затем протоны возвращаются в матрикс через АТФ-синтазу, что заставляет ее синтезировать АТФ из АДФ и фосфата. OXPHOS настолько эффективен, что может производить до 34 молекул АТФ из одной молекулы глюкозы!
Строительные блоки. Митохондрии также участвуют в синтезе аминокислот — ключевых элементов для построения белков [7]. Ферменты в матриксе митохондрий превращают различные метаболические промежуточные продукты в аминокислоты, обеспечивая клетку необходимым для роста и восстановления [8]. Но это еще не всё: митохондрии играют важную роль в липидном метаболизме [9]. Они окисляют жирные кислоты до ацетил-КоА, который либо вступает в цикл Кребса для производства энергии, либо используется повторно для биосинтеза липидов, таких как жирные кислоты и холестерин — важнейших компонентов клеточной мембраны. Липидный метаболизм митохондрий тесно связан с другими метаболическими путями, подчеркивая их значение для поддержания липидного баланса клетки [10].
Производство гема. Митохондрии необходимы для синтеза гемовых групп, которые жизненно важны для гемоглобина и других гемсодержащих белков [11]. Этот процесс включает метаболизм сукцинил-КоА (важнейшего промежуточного продукта цикла Кребса) через несколько ферментных стадий в матриксе митохондрий.
Синтез vs. Синтез
Очевидно, что митохондрии играют ключевую роль в выживании, росте и функциях клетки. Но вот что любопытно: многие процессы, происходящие в митохондриях, конкурируют между собой. Например, OXPHOS в основном использует для окисления промежуточных продуктов цикла Кребса, в то время как в восстановительных процессах для синтеза аминокислот требуются эти же продукты (рис. 2). Как именно эти конкурирующие метаболические пути сосуществуют в одной органелле, остается загадкой.
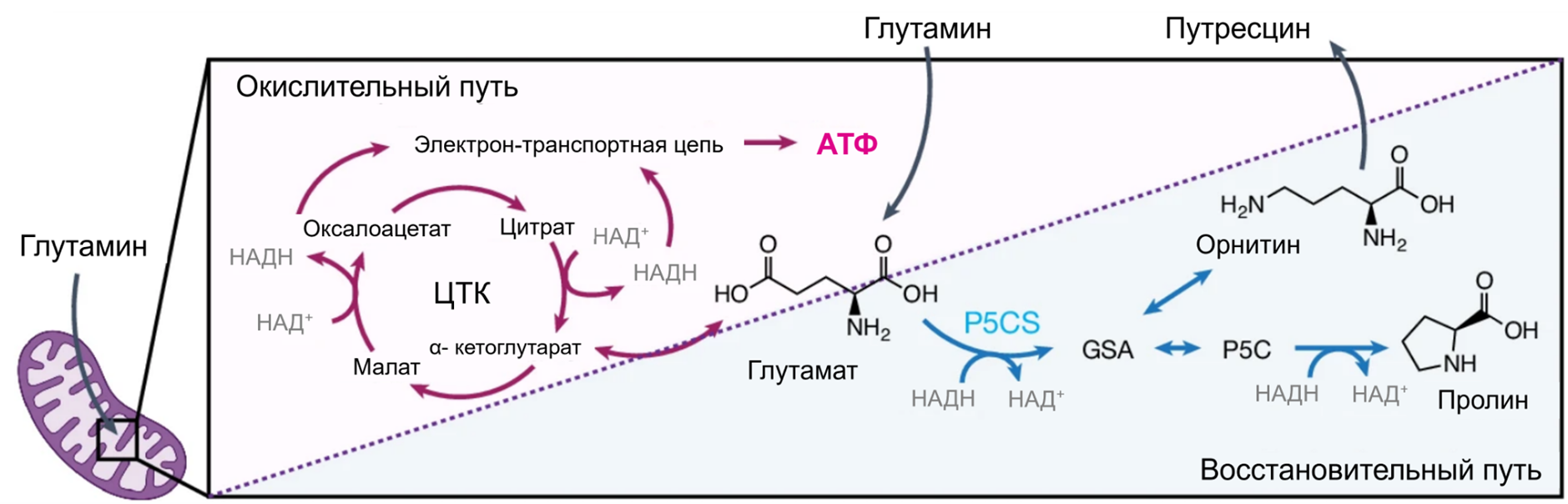
Рисунок 2. В кипящем метаболическом центре важна каждая молекула! На этой схеме показан цикл Кребса — главный энергетический генератор клетки, который перерабатывает питательные вещества, чтобы производить АТФ. Но он работает не в одиночку: параллельно пути, синтезирующие орнитин и пролин, заняты созданием строительных блоков для белков и других важных молекул. И вот в чем интрига: все они претендуют на один и тот же ценный ресурс — глутамат. Это метаболическое «перетягивание каната» между потребностью в энергии и необходимостью в росте и восстановлении — типичный рабочий день митохондрий! Баланс между этими процессами жизненно важен для клетки, и митохондрии удивительным образом справляются с этой задачей, словно дирижируя оркестром метаболизма.
Эти процессы используют одни и те же метаболиты, ставя клетку перед сложным выбором: что важнее — энергия или строительные материалы? Традиционно считалось, что, если клетки делают ставку на синтез АТФ через OXPHOS, ресурсов для синтеза аминокислот или других строительных блоков может не хватить, и наоборот. Логично предположить, что этот компромисс должен приводить к дефициту энергии, материалов или и того, и другого. Значит ли это, что вы должны чувствовать себя ужасно каждый раз после тренировки? Группа ученых под руководством Keun Woo Ryu опровергли эту идею, продемонстрировав, что митохондрии способны адаптироваться под конкретные энергетические потребности клетки [1]. Исследователи впервые описали формирование метаболически различных субпопуляций митохондрий, каждая из которых настроена на локальные потребности в АТФ.
Скрытые популяции
Используя передовые методы визуализации и метаболические анализы, ученые изучили, как клетки реагируют на разные уровни спроса АТФ [1]. Оказалось, что в условиях повышенной потребности в энергии определенные митохондрии усиливают производство АТФ, в то время как другие переключаются на более «спокойное» состояние, ориентированное на синтез строительных блоков (рис. 3). Это динамическое распределение позволяет клеткам максимально эффективно обеспечивать свои энергетические и структурные нужды.
Исследование показало, что когда клетки увеличивают зависимость от OXPHOS, фермент под названием пирролин-5-карбоксилатсинтаза (P5CS), необходимый для синтеза пролина и орнитина, концентрируется в особых митохондриях, лишенных крист и АТФ-синтазы. Это приводит к образованию двух различных субпопуляций митохондрий, каждая из которых отличается морфологией, составом и функциями. Этот процесс регулируется способностью P5CS образовывать нитевидные структуры, а также непрерывным циклом слияния и деления митохондрий. В результате появляются митохондрии, обогащенные либо АТФ-синтазой, либо филаментозным P5CS, эффективно деля обязанности между энергетическим и строительным «цехами».
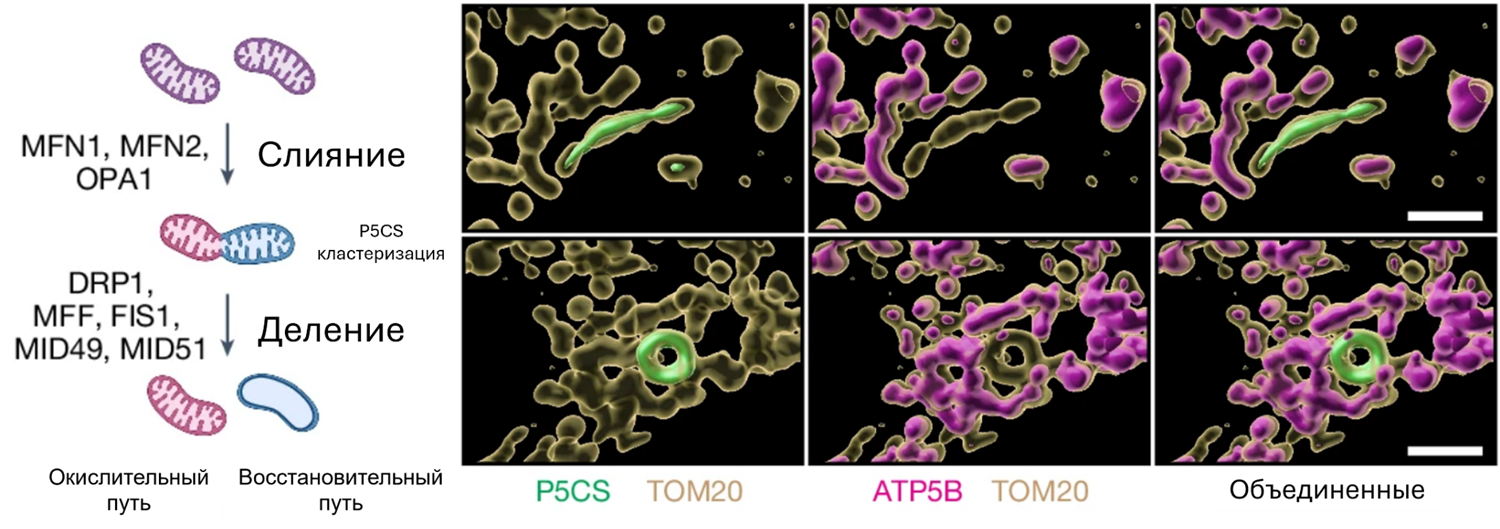
Рисунок 3. Митохондриальные трансформации в действии. Слева представлена схема митохондрий, проходящих через процессы слияния и деления. В этот момент происходит сегрегация P5CS, а также изменения их морфологии. Справа — трехмерная реконструкция изображений из культуры мышиных клеток. Желтым цветом обозначен TOM20 — белок, который служит маркером митохондрий. На изображении видно, что митохондрии явно прошли процесс слияния. Зеленый цвет показывает распределение фермента P5CS, ответственного за синтез пролина и орнитина, а розовый цвет отмечает местоположение АТФ-синтазы, ключевого участника процесса синтеза АТФ. Эти изображения визуализируют, как митохондрии распределяют свои ресурсы: в результате слияния и деления они создают специализированные субпопуляции, каждая из которых оптимизирована для своей функции — будь то производство энергии или синтез строительных блоков.
Когда клеткам требуется много энергии, митохондрии могут сохранять на ожидаемом уровне как уровень АТФ, так и уровень пролина. Однако, если исследователи блокировали процесс слияния, митохондрии переключались исключительно на восстановительные (редукционные) процессы, жертвуя производством энергии. Также при блокировке деления нарушалось и разделение на специализированные субпопуляции. Интересно, что разделение оставалось стабильным даже в условиях высокого спроса на энергию и могло быть отменено, если потребность в энергии снижалась. Ранее было известно, что слияние и деление митохондрий играют важную роль в регулировании производства энергии в стрессовых условиях, но механизмы этих процессов оставались загадкой [11]. Новое исследование проясняет, как митохондриальный слияние и деление помогает балансировать окислительные и восстановительные процессы в ответ на изменения доступности питательных веществ и энергетических потребностей.
Новый взгляд на опухоли и митохондрии?
Эти открытия могут стать ключом к лучшему пониманию злокачественных новообразований, поскольку в исследовании было показано, что опухолевые клетки, по мере роста, могут приобретать специализированные митохондрии, которые помогают им поддерживать свой рост [1]. Однако, чтобы полностью связать это новое поведение митохондрий с процессами появления новообразований, потребуется гораздо больше научных поисков. Команда исследователей уже начала активно заниматься этой задачей!
Литература
- Keun Woo Ryu, Tak Shun Fung, Daphne C. Baker, Michelle Saoi, Jinsung Park, et. al.. (2024). Cellular ATP demand creates metabolically distinct subpopulations of mitochondria. Nature. 635, 746-754;
- Stefan Jakobs, Till Stephan, Peter Ilgen, Christian Brüser. (2020). Light Microscopy of Mitochondria at the Nanoscale. Annu. Rev. Biophys.. 49, 289-308;
- Martin Picard, Orian S. Shirihai, Benoit J. Gentil, Yan Burelle. (2013). Mitochondrial morphology transitions and functions: implications for retrograde signaling?. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 304, R393-R406;
- Timothy Wai. (2024). Is mitochondrial morphology important for cellular physiology?. Trends in Endocrinology & Metabolism. 35, 854-871;
- Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос;
- Fernand Vedel, Éric Lalanne, Mohammed Sabar, Philippe Chétrit, Rosine De Paepe. (1999). The mitochondrial respiratory chain and ATP synthase complexes: Composition, structure and mutational studies. Plant Physiology and Biochemistry. 37, 629-643;
- Catherine Ross-Inta, Chern-Yi Tsai, Cecilia Giulivi. (2008). The mitochondrial pool of free amino acids reflects the composition of mitochondrial DNA-encoded proteins: indication of a post- translational quality control for protein synthesis. Bioscience Reports. 28, 239-249;
- Qiaochu Li, Thorsten Hoppe. (2023). Role of amino acid metabolism in mitochondrial homeostasis. Front. Cell Dev. Biol.. 11;
- Yu Wang, Weixing Yu, Sha Li, Dingyuan Guo, Jie He, Yugang Wang. (2022). Acetyl-CoA Carboxylases and Diseases. Front. Oncol.. 12;
- Yaqing Chen, Jianchang Qian, Qun He, Hui Zhao, Lourdes Toral-Barza, et. al.. (2016). mTOR complex-2 stimulates acetyl-CoA and de novo lipogenesis through ATP citrate lyase in HER2/PIK3CA-hyperactive breast cancer. Oncotarget. 7, 25224-25240;
- Daniel A. Garcia, Andrew F. Powers, Thomas A. Bell, Shuling Guo, Mariam Aghajan. (2022). Antisense Oligonucleotide-Mediated Silencing of Mitochondrial Fusion and Fission Factors Modulates Mitochondrial Dynamics and Rescues Mitochondrial Dysfunction. Nucleic Acid Therapeutics. 32, 51-65.








