
Свечение флуоресцентного белка осветило механизмы эпистаза
12 мая 2016
Свечение флуоресцентного белка осветило механизмы эпистаза
- 1412
- 0
- 2
Исследование ландшафта приспособленности.
рисунок Екатерины Путинцевой
-
Автор
-
Редакторы
Большая интернациональная группа ученых, возглавляемая работающим в Барселоне биоинформатиком Федором Кондрашовым, совершила маленький прорыв в понимании эпистаза - процесса влияния друг на друга различных сайтов генома. Исследовав несколько десятков тысяч мутаций зеленого флуоресцентного белка (GFP), ребята создали экспериментальную модель эпистаза. Это позволит лучше изучить как сам эпистаз (крайне важный и любопытный момент фундаментальной эволюционной геномики), так и связанные с ним практические процессы.
Сложна эволюционная геномика. Ландшафты приспособленности (рис. 1) — воображаемые многомерные поверхности, на которых каждая точка представляет собой определенную комбинацию генотипов (например, комбинацию аллелей различных генов; или сочетание аминокислот в разных позициях белка), а высота этой точки — меру приспособленности соответствующего генотипа. «Биологическими координатами» могут быть также и черты фенотипа: например, два признака слонов из одного стада — высота в холке и длина хобота.
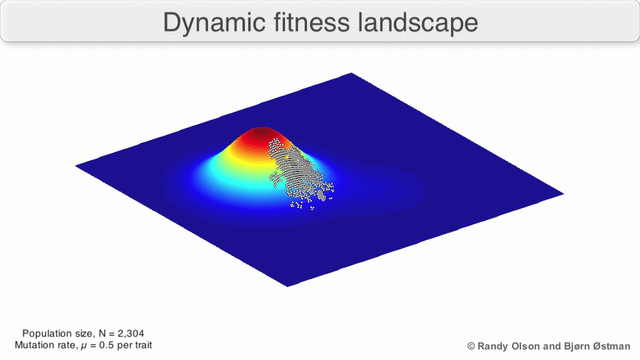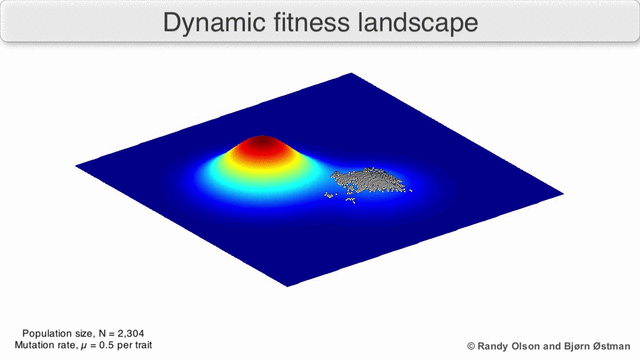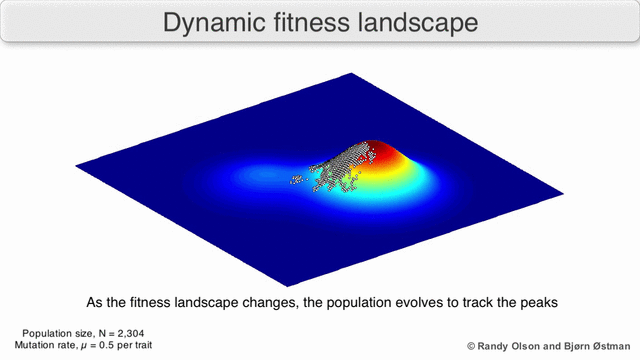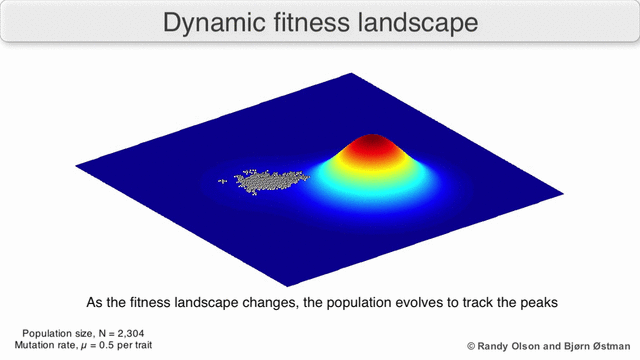
Рисунок 1. Завораживающий пример ландшафта приспособленности: биологические сущности переползают с одного возможного пика на другой и обратно.
При исследовании ландшафтов приспособленности большое значение имеет эпистаз — ситуация, при которой проявление гена зависит от другого гена или генов, неаллельных ему. Иначе говоря, эпистазом называют любое влияние одного гена на другой. Классический и смешной пример эпистаза: допустим, у инопланетян существуют аллельные гены зеленых, синих и фиолетовых волос, а кроме того, ген плешивости (доминантный вариант этого гена делает инопланетянина лысым). В случае, если инопланетянин не является носителем доминантного аллеля гена плешивости, мы сможем любоваться его цветной шевелюрой. Если же инопланетянин — носитель этого аллеля, то ни волос, ни соответственно цвета волос у него не будет. В этом случае говорят, что ген плешивости эпистатичен по отношению к гену цвета волос.
Эпистаз сильно влияет на ландшафт приспособленности, ведь если гены в геноме зависят друг от друга, то одни генотипы будут встречаться заведомо чаще других. На рисунке 2 приведен пример влияния эпистаза на адаптивные ландшафты.
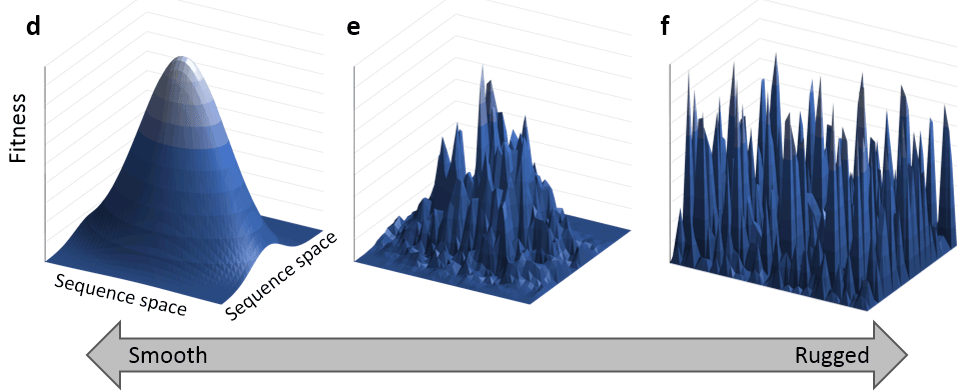
Рисунок 2. Эпистаз и ландшафт приспособленности. При независимости эффектов всех генов друг от друга на ландшафте может существовать единственный пик приспособленности, соответствующий комбинации лучших аллелей каждого гена. При возникновении взаимодействий между генами, на ландшафте появляются локальные максимумы, в которых эволюционирующая популяция может попасть в ловушку. Наличие эпистаза замедляет исследование популяцией ландшафта приспособленности (например, см. заметку на Элементах «Расширение белковой вселенной продолжается»).
С помощью ландшафтов приспособленности легко и удобно представлять эволюционный процесс и, возможно, даже предсказывать его. Однако, к сожалению, до сих пор эти ландшафты были исключительно умозрительной концепцией, поскольку для их экспериментального изучения не хватало данных. Но вот совершился прорыв, и большая интернациональная команда исследователей во главе с биоинформатиком Федором Кондрашовым (работающим в Центре Геномной Регуляции в Барселоне) и за первым авторством Карена Саркисяна и Дмитрия Болотина (из лабораторий биофотоники и геномики адаптивного иммунитета Института биоорганической химии РАН) ухитрилась впервые изучить ландшафт приспособленности для одной конкретной биологической молекулы — зеленого флуоресцентного белка (GFP) [1], [2] — на экспериментальных данных. Статья опубликована в журнале Nature [3] — мечте всех аспирантов-естественников на свете.
GFP в определенных условиях светится зеленым светом и потому горячо любим биологами: им можно «раскрашивать» различные интересные части клетки, а потом легко за ними следить [4]. По структуре молекула GFP является β-бочонком, внутри которого находится хромофор (несколько химически замкнутых друг на друга аминокислотных остатков), способный поглощать и испускать видимый свет.
В данном случае, светимость GFP была использована очень остроумным образом. Как известно, свойства белка определяются его структурой, а структура — последовательностью аминокислот. Исследователей интересовало, как влияют точечные мутации на функциональность белка — то есть, его способность светиться.
Для того, чтобы это исследовать, они создали более пятидесяти тысяч мутантных вариантов гена GFP, несущих от одной до пятнадцати точечных мутаций каждый, и экспрессировали каждый вариант в клетках бактерий. Полученные бактерии рассортировали по уровню светимости с помощью специального автоматического прибора — клеточного сортера — на восемь групп.
— Нас интересовал вопрос, как накапливающиеся в белке мутации взаимодействуют между собой, и как часто это может происходить в белковой эволюции, — говорит Карен Саркисян в своем комментарии для пресс-релиза ИБХ [5]. — Мы придумали способ одновременно измерить функциональность десятков тысяч мутантов одного белка и воспользовались им, чтобы определить, как влияние мутаций на яркость зеленого флуоресцентного белка зависит от присутствия в гене других мутаций.
Теперь можно было увидеть главное: как связаны мутации в белке и сочетания этих мутаций с его свойствами. Возможны были два варианта: либо разные мутации в одном белке не влияют друг на друга и просто суммируются, если им суждено встретиться, либо влияют, и тогда итоговое свечение белка не будет являться суммой эффектов всех мутаций по-отдельности. Второй случай — это и есть эпистаз, но не для генов, а для отдельных мутаций в одном гене.
Результат эксперимента был однозначен: некоторые мутации влияют друг на друга, эпистаз в белке существует. Две относительно безобидные поодиночке мутации вместе могут совсем «загасить» белок — загасить гораздо сильнее, чем если бы их эффекты просто сложились. А вот примеров положительного эпистаза, когда мутации вместе компенсируют эффекты друг друга, исследователи почти на обнаружили. Эпистаз сильнее связан с теми мутациями, которые находятся в функционально значимых участках белка, но непосредственная пространственная близость аминокислот в белке не связана или почти не связана с эпистазом. Общее влияние данных аминокислотных остатков на светимость показано в видео 1.
Видео 1. Пространственная структура GFP (тот самый «бочонок») с результатами мутагенеза отдельного β-листа: чем фиолетовей остаток, тем сильней мутация в нем гасит белок. В самом центре «бочонка» располагается хромофор — светящаяся группировка GFP.
Если вдуматься, эпистатические эффекты интуитивно понятны: сворачивание белка происходит в зависимости от последовательности аминокислот в нем; подмена сразу нескольких аминокислот взаимно влияет друг на друга: в некоторых случаях это влияние компенсирует неполадки в белке (представьте две доминошки, которые упали друг на друга и теперь друг друга поддерживают), в некоторых — усиливает неполадки (две свалившиеся доминошки обрушили еще несколько остальных).
На основе полученных данных исследователи выстроили адаптивный ландшафт для мутаций в GFP и представили его в виде брутального видео 2. Ну а подробности изображены на рисунке 3.
Видео 2. Трехмерная визуализация изученного на примере GFP ландшафта приспособленности.
Эта работа действительно неординарна: в ней впервые не умозрительно, а с данными в руках говорится о форме пресловутого «ландшафта приспособленности». И только самые современные методы исследований позволили получить и обработать такой огромный массив данных. Разумеется, это заняло много времени и сил — не только у самих исследователей, но и у рецензентов, которые следили за тем, чтобы в новой работе было все честь по чести. «Более 4 лет работы, 1 год на рецензии с участием 5 рефери, и вот, пожалуйста: вот первое серьезное сотрудничество нашей лаборатории с несколькими другими научными группами в четырех странах на трех континентах», — написал об этом в фейсбуке Кондрашов.
И правда, данные уже какое-то время представляются публике: еще в феврале 2016 года эти результаты Федор представил в докладе на тему «Исследования ландшафта приспособленности: от моделей до данных» на Зимней школе Современная биология и Биотехнологии будущего — 2016.
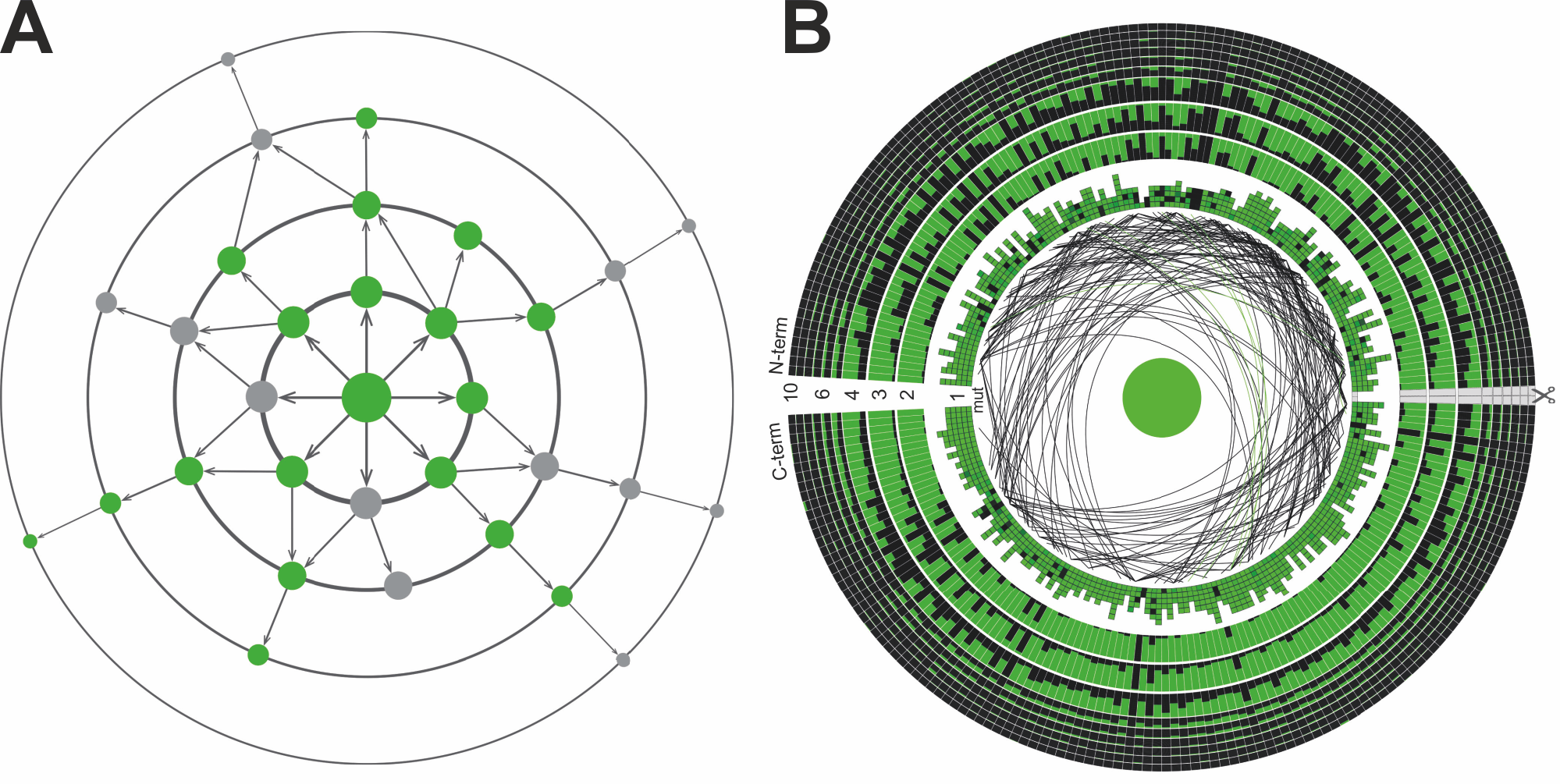
Рисунок 3. A. Иллюстрация концепции ландшафта приспособленности зеленого флуоресцентного белка. Зеленая точка в центре — немутированный белок, точки на окружностях — мутантные варианты с одной, двумя и тремя отличающимися аминокислотами. Цвет отражает фенотип (индивидуальные свойства) мутанта: зеленый — мутант ярко светится, серый — мутант не светится. Стрелки отражают возможные маршруты движения по ландшафту приспособленности. B. Визуализация всех полученных в работе данных на одной картинке. Последовательность зеленого флуоресцентного белка изображена в виде окружности: каждый маленький сектор обозначает одну аминокислотную позицию. Чем дальше круг находится от центра, тем больше мутаций содержит белок. Доля зеленого в каждом секторе отражает долю функциональных мутантов.
Помимо чисто научной ценности, работа может иметь и прикладное значение. С использованием алгоритмов машинного обучения исследователи смогли с неплохой точностью предсказывать эпистатические эффекты. Возможно, это исследование сможет принести и практическую пользу. Сейчас мы только подбираемся к пониманию генетической подоплеки полигенных заболеваний — то есть таких, которые вызываются не поломкой в одном гене, а фатальным сочетанием нескольких разных генов, самих по себе относительно безобидных. Очевидно, что в таких случаях не обходится без эпистаза, а предложенная в данной работе модель эпистаза на основе белка GFP может и в прямом, и в переносном смысле пролить свет на процессы взаимодействия генов между собой.
Литература
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Sarkisyan K.S., Bolotin D.A., Meer M.V., Usmanova D.R., Mishin A.S., Sharonov G.V. et al. (2016). Local fitness landscape of the green fluorescent protein. Nature. 533, 397–401;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Ген из медузы позволил прояснить механизмы белковой эволюции. (2016). Сайт ИБХ.






